抗菌肽LL37活性中心衍生肽二倍体抗菌肽LG及其制备方法和应用
抗菌肽ll37活性中心衍生肽二倍体抗菌肽lg及其制备方法和应用
技术领域
1.本发明属于生物技术领域,具体涉及一种抗菌肽ll37活性中心衍生肽二倍体抗菌肽lg及其制备方法和应用。
背景技术:
2.近年来,动物产品中抗生素的严重残留已给人类健康带来不利影响。欧盟自2006年率先禁止饲料中添加抗生素以来,许多国家都已出台了相关政策,这也标志着抗生素黄金时代的终结。
3.抗菌肽(antimicrobial peptides,amps)作为一种新型饲料添加剂,其开发前景优良,不具有传统抗生素在畜牧业中的应用所产生的负面影响,且抗菌肽具有分子量小、热稳定性高、广谱抗菌、作用机制独特等特点。ll37是人类cathelicidin家族的唯一成员,由白血球(主要是嗜中性粒细胞)和各种上皮细胞产生并广泛存在于各种人体组织和体液中。由于其具有参与免疫调节,引起免疫细胞趋化和促进伤口愈合的突出优势,近年来学者们对ll37保持着较高的研究兴趣。此外,它还对多种类型的病原体具有防御作用,包括细菌,真菌,病毒,寄生虫乃至癌细胞。系列研究表明,ll37的17
‑
29氨基酸残基(fd)是其活性中心。然而fd对革兰氏阴性菌和革兰氏阳性菌的抗菌活性不高,并且存在盐离子的环境下导致抗菌活性有较大降低的问题。其衍生肽fr分子量小(3.82kda),极易被微生物蛋白酶降解。
技术实现要素:
4.基于以上不足之处,本发明的目的在于提供一种抗菌肽ll37活性中心衍生肽二倍体抗菌肽lg,以解决fd抗菌活性不高,并且存在盐离子的环境下导致抗菌活性有较大降低的问题,从而提高了抗菌活性及盐离子的稳定性。
5.本发明通过如下技术实现:一种抗菌肽ll37活性中心衍生肽二倍体抗菌肽lg,其序列如序列表seq id no.1所示。
6.本发明的另一目的在于公开如上所述的一种抗菌肽ll37活性中心衍生肽二倍体抗菌肽lg的制备方法,步骤如下:
7.(1)选取抗菌肽ll37的活性中心fd,将抗菌肽fd中的天冬氨酸d替换为精氨酸r,从而获得衍生肽fr;
8.(2)通过直接连接、刚性连接肽aeaaaka连接和柔性连接肽ggggs连接的设计,获得三种二倍体(fr)2、lg和la,并以“选择指数”作为评价指标进行筛选;
9.(3)将“选择指数”最高的二倍体lg通过多肽合成仪,采用固相化学合成法进行合成,即完成抗菌肽lg的制备。
10.本发明的另一目的在于公开一种抗菌肽ll37活性中心衍生肽二倍体抗菌肽lg在制备治疗革兰氏阳性菌或革兰氏阴性菌引发的感染性疾病药物中的应用。
11.本发明的有益效果及优点:本发明的二倍体抗菌肽lg与原活性中心片段fd相比,抗菌活性提升了近20倍;抗菌肽lg与衍生肽fr相比,抑菌活性提升了约3倍,具有更好的盐离子稳定性,具有开发成新型抗菌药物的潜力。
附图说明
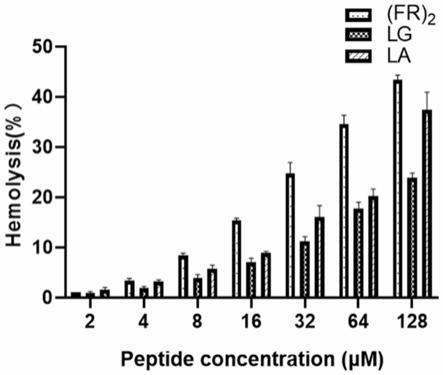
12.图1是(fr)2、lg、la的溶血活性图。
13.图2是6
×
his
‑
sumo
‑
lg重组表达载体构建图。
14.图3为毕赤酵母阳性转化子pcr验证情况图,
15.其中,1为marker,2为ppiczαa空质粒的pcr产物,3
‑
7为重组酵母x33/6
×
his
‑
sumo
‑
lg的pcr产物。
16.图4是融合蛋白tricine
‑
sds
‑
page检测结果图,
17.其中,1为空载体对照,2为超低分子量预染蛋白marker,3
‑
6为融合蛋白6
×
his
‑
sumo
‑
lg的表达产物。
18.图5是6
×
his
‑
sumo
‑
lg被sumo蛋白酶切割的tricine
‑
sds
‑
page分析,
19.其中,1为marker;2为纯化后的6
×
his
‑
sumo
‑
lg;3为被sumo蛋白酶切割后6
×
his
‑
sumo标签和rlg。
20.图6是重组lg(rlg)的纯化及鉴定图,
21.(a)rlg的tricine
‑
sds
‑
page分析。其中,1为marker;2为纯化后的rlg。
22.(b)纯化的rlg的maldi
‑
tof质谱。
具体实施方式
23.实施例1抗菌肽的设计合成
24.衍生肽fr分子量小(3.82kda),极易被微生物蛋白酶降解,使其在微生物表达系统中的重组表达更具挑战性。amps的融合或串联表达为该问题提供了解决方案。除此之外,连接肽串联表达策略还具有提高生物学活性、扩大表达产量等优势。因此,合理的设计连接肽至关重要。通常,连接肽分为两类,柔性连接肽和刚性连接肽。本实施例通过精氨酸(r)替换抗菌肽ll37活性中心中的天冬氨酸(d),得到具有高活性的衍生肽fr。
25.fd:人源抗菌肽ll37的第17
‑
29个氨基酸序列,此片段为富含阳离子的两亲性螺旋结构的肽链,是ll37发挥抗微生物,抗癌和抗病毒活性的结构区域。
26.fr:将抗菌肽fd中的天冬氨酸(d)替换为精氨酸(r),从而获得衍生肽fr。
27.(fr)2:将衍生肽fr直接串联在一起,从而得到二倍体(fr)2。
28.lg:将衍生肽fr通过连接体ggggs串联在一起,从而得到二倍体lg,
29.la:将衍生肽fr通过连接体aeaaaka串联在一起,从而得到二倍体la。
30.使用多肽合成仪,利用固相合成法合成上述抗菌肽。肽的氨基酸序列和理化参数如表1所示。
31.表1 fd、fr、(fr)2、lg、la的氨基酸序列和理化参数
[0032][0033]
注:
a
由质谱仪检测的分子质量
[0034]
b
疏水性通过在线工具计算http://heliquest.ipmc.cnrs.fr/cgi
‑
bin/computparams.py
[0035]
实施例2抗菌肽的抑菌活性
[0036]
将肽配置成为1.28mm/l储存液备用。利用微量肉汤稀释法测定几种抗菌肽的最小抑菌浓度。将细菌在37℃下mueller
‑
hilton肉汤(mhb)中孵育过夜,直到达到对数生长期。然后将细菌稀释至105cfu/ml。将5μl最高浓度肽与95μl的0.01%(v/v)乙酸和0.2%(w/v)的牛血清白蛋白混合,混合均匀后二倍连续稀释,并每个孔加入50μl菌液。分别设置阳性对照(含有菌液而不含有抗菌肽)和阴性对照(不含菌液也不含肽)。将混合物在37℃下孵育24小时。以未见孔底部有混浊现象为最小抑菌浓度。结果如表2所示。
[0037]
表2 fd、fr、(fr)2、lg、la的最小抑菌浓度
[0038][0039][0040]
注:1最低抑制浓度是抗菌肽可以抑制细菌生长的最低浓度。测试至少进行三次重复。数据表示为平均值
±
标准差。
[0041]
实施例3溶血活性
[0042]
将收集的人类健康血液以1000
×
g离心5分钟以收集红细胞。然后洗涤红细胞,并重悬于10mm pbs(ph 7.4)中。将50μl红细胞稀释液和等体积的肽溶液(2
‑
128μm)在96孔板中于37℃孵育1小时。用0.1%的triton x
‑
100处理的红细胞悬液用作阳性对照(100%溶血),未处理的血细胞悬液用作阴性对照。将96孔板在4℃下以1000
×
g离心5分钟,然后将上清液转移至新的96孔板中。用酶标仪在od570下测量吸光度。(fr)2、lg、la的溶血活性如图1所示。
[0043]
实施例4选择指数
[0044]
为进一步评估肽的细胞选择性,用“选择指数(si)”(mhc/gm)的高低来筛选目标肽。结果如表3所示。
[0045]
表3(fr)2、lg、la的最小抑菌浓度、溶血活性和选择指数
[0046][0047]
注:
a
mhc是引起20%溶血的最小抗菌肽浓度;
[0048]
b
gm是肽对细菌的mic的几何平均数,当在32μm处未观察到可检测的抗菌活性时,将64μm的值用于计算gm;
[0049]
c
si为mhc/gm,数值越大表示细胞选择性越高。
[0050]
实施例5盐离子耐受性
[0051]
将盐离子添加到bsa溶液中,并配置为不同最终浓度的盐离子溶液(150mm nacl,4.5mm kcl,6μm nh4cl,8μm zncl2,1mm mgcl2,2mm cacl2,and 4μm fecl3)。参考例2中的方法确定在不同浓度盐离子存在下lg对大肠杆菌25922的mic值。
[0052]
表4肽在生理盐存在下对大肠杆菌atcc 25922的mic值(μm)
[0053][0054]
生理浓度na
+
、mg
2+
、ca
2+
离子的存在对单体肽fr抗菌活性有较大影响,na
+
、ca
2+
甚至直接导致fr失去活性,mg
2+
使fr的mic值提高了4倍。而ggggs存在下的二倍体lg在na
+
、mg
2+
离子溶液中依旧能够保持几乎不变的抗菌活性。盐离子的存在导致fr的mic值提高2.44倍,而lg的mic值仅提高了1.81倍。
[0055]
实施例6构建重组表达载体
[0056]
为将其应用于畜牧生产中,本实施例通过巴斯德毕赤酵母表达系统成功获得具有生物学活性的重组二倍体抗菌肽lg。
[0057]
根据酵母的密码子偏爱性人工设计编码lg的基因片段,在lg序列的n端添加6
×
his
‑
sumo融合标签,并在其n端加上ecor i酶切位点,在c端加上taa终止密码子和kpn i酶切位点,目的片段与表达载体ppiczαa连接,构建重组表达载体ppiczαa
‑6×
his
‑
sumo
‑
lg。6
×
his
‑
sumo
‑
lg重组表达载体构建图如图2所示。
[0058]
将重组表达载体质粒用sac i进行线性化后电转入毕赤酵母x33中。经zeocin
tm
筛选和pcr鉴定,表明目的基因成功转化到毕赤酵母x33中。pcr鉴定结果如图3所示。
[0059]
实施例7融合蛋白的表达
[0060]
筛选的阳性克隆接种到bmgy和bmmy培养基中进行摇瓶表达,将p.pastoris x33/6
×
his
‑
sumo
‑
lg以及p.pastoris x33/ppiczαa发酵上清液进行tca浓缩,tricine
‑
sds
‑
page电泳结果显示目的基因成功表达,结果如图4所示。
[0061]
实施例8融合标签的去除以及重组lg(rlg)的纯化
[0062]
融合蛋白6
×
his
‑
sumo
‑
lg通过镍柱纯化并与sumo蛋白酶和酶切缓冲液混合并在4℃下孵育16小时。混合体系再次通过镍柱,结果如图5所示。收集穿流物,采用1kda mwco透析管透析后冻干。最后,通过tricine
‑
sds
‑
page验证纯化的重组lg(rlg)。通过基质辅助的激光解吸/电离飞行时间质谱(maldi
‑
tof ms)进一步测定肽的分子量,结果如图6所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1