一种人参特有化合物精氨酸糖苷AF的分离纯化新方法
一种人参特有化合物精氨酸糖苷af的分离纯化新方法
技术领域
1.本发明涉及一种从人参相关加工品中提取化合物的方法,具体说是一种从红参中高效提取精氨酸单糖苷af的方法及应用。
背景技术:
2.人参为传统名贵药材,在《神农本草经》中被列为上品。af是鲜人参在加工蒸制成为红参的过程中,发生的梅拉德反应产物,郑毅男首次发现并鉴定了其结构,研究发现在人参加工成生晒参、红参时af含量较高,可达2.51%
[1,2]
。鲜人参在加工为红参过程中,葡萄糖与精氨酸发生羰醛缩和反应,经amadori重排而生成af。人参精氨酸单糖苷(af)含量在红参中最高可达2.51%以上,并且在人参根、西洋参根及其非药用部位(如:茎叶、果实),以及相关加工品中均有所发现
[3,4]
。其后实验研究表明,af具有增强免疫、抑制脂质过氧化,对于预防动脉粥样硬化有一定的调节作用。kyoung
‑
soo
[5]
和lee kh等
[6]
研究af对sd大鼠饮食摄食蔗糖/淀粉后血糖的影响,发现af能够明显降低小鼠饮食蔗糖/淀粉后血糖的水平,同时,af
[7]
对2型糖尿病大鼠具有很好的降血糖活性。这一研究大大提高了人参非皂苷类物质得的地位。
[0003]
目前,af主要提取方法为红参粉末用高浓度乙醇萃取,去上清,沉淀水提醇沉,然后过阳离子树脂柱分离得。但此方法杂质偏多,且后续过阳离子树脂需要用到氨水溶液洗脱,氨水溶液味道较为刺激,对人体和环境有一定得危害。
[0004]
而本发明使用水饱和正丁醇作为萃取液不仅能把皂苷除去,还能除糖除色素等各种杂质弥补了现有分离方法的不足,且后续用醋酸水溶液混合一定量的三氯化铁代替乙醇溶液制备af简化了步骤并提高了提取率,同时抑制了af的分解,安全环保,无刺激气味,通过多次试验结果表明以此方法提取af纯度增加,其操作简单,且节约成本,安全环保。
[0005]
本
技术实现要素:
[0006]
本发明公开一种从红参中高效提取af的方法,为一种新的提取方法:红参粉末用水饱和正丁醇萃取除去杂质,沉淀用有机酸(醋酸)水溶液混合一定量的三氯化铁超声提取,滤液醇沉过硅胶和聚丙烯酰胺凝胶柱得af,具有操作简易,安全环保,提取率高,产物刺激性小和稳定性高等特点。
[0007]
本发明通过以下技术方案来实现:
[0008]
一种高效提取精氨酸单糖苷(af)的方法,具体包括如下步骤:人参相关加工品粉末用水饱和正丁醇萃取,得沉淀,再用含有一定量的三氯化铁的ph为4.5~5的醋酸水溶液去超声提取,过滤,从滤液中获得精氨酸单糖苷。
[0009]
作为本发明的一种优选技术方案:所述人参相关加工品包括但不限于红参,人参根、西洋参根及其非药用部位(如:茎叶、果实),优选红参。
[0010]
作为本发明的一种优选技术方案:人参相关加工品粉末重量与醋酸水溶液体积的比,按g/ml为1:10。
[0011]
作为本发明的一种优选技术方案:人参相关加工品粉末重量与三氯化铁质量的
比,按照g/g为1:0.3。
[0012]
作为本发明的一种优选技术方案:前述方法进一步包括:滤液用无水乙醇沉淀,抽滤去除上清液,沉淀过硅胶柱,用70%乙醇水溶液洗脱,收集各部分洗脱液,合并富含af成分的洗脱液,浓缩后继续过聚丙烯酰胺凝胶柱,用0.2%醋酸水溶液洗脱,收集富含af的洗脱液,浓缩冷冻干燥即得af。
[0013]
作为本发明的一种优选技术方案:人参相关加工品粉末用水饱和正丁醇萃取包括:人参相关加工品粉末过80目筛,粉末加入到水饱和正丁醇中,萃取3次,离心,过滤,去除上清液,人参相关加工品粉末重量与水饱和正丁醇体积的比,按g/ml为1:100。
[0014]
通过大量的实验研究发现,af在酸性条件下比较稳定,优选ph值为4.0
‑
6.0的酸性水溶液,酸浓度太高或太低均会影响红参中af的提取与分离,优选醋酸的酸性溶液。更为重要的是,与一定量的三氯化铁组合能提高af的提取率并增加物质的稳定性,可使af的提取率提高20
‑
40%。
[0015]
本发明提取物通过hplc分析法测试计算出af的纯度可达98%以上,从红参中提取af的得率可达1.2%
‑
2.1%。
[0016]
作为本发明的一种优选技术方案:本发明精氨酸单糖苷的提取方法,包括以下步骤:
[0017]
将人参相关加工品粉末(80目)用水饱和正丁醇搅拌过夜,离心,过滤,去除上清液,得沉淀,再用ph为4.5的醋酸水溶液混合一定量的三氯化铁去超声提取,过滤,去除不溶部分,滤液用无水乙醇沉淀,抽滤去除上清液,沉淀过200
‑
300硅胶柱,用70%乙醇水溶液洗脱,收集各部分洗脱液,合并富含af成分的洗脱液,浓缩后继续过聚丙烯酰胺凝胶柱,用0.2%醋酸水溶液洗脱,收集富含af的洗脱液,浓缩冷冻干燥即得af。
[0018]
作为本发明的一种优选技术方案:1g红参粉末,置入100ml的水饱和正丁醇萃取三次,沉淀置于10ml的ph为4.5的醋酸水溶液混合0.3g的三氯化铁中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af。作为其优选技术方案:提取液用无水乙醇沉淀,抽滤去除上清液,沉淀过硅胶柱,用70%乙醇水溶液洗脱,收集各部分洗脱液,合并富含af成分的洗脱液,浓缩后继续过聚丙烯酰胺凝胶柱,用0.2%醋酸水溶液洗脱,收集富含af的洗脱液,浓缩冷冻干燥即得af。
[0019]
本发明相对于现有技术的积极效果在于:
[0020]
本发明中,首次使用水饱和正丁醇作为萃取媒介,醋酸水溶液混合一定量的三氯化铁作为提取溶剂提取af,提取率可以达到1.9%以上,同时降低了提取成本,且安全环保,提取率高。
[0021]
以水饱和正丁醇为萃取媒介,沉淀中皂苷、多糖和色素残留量少,易于后续分离提纯;以ph为4.5的醋酸水溶液混合一定量的三氯化铁提取af,抑制了af的水解,提高了af提取率,简化了提取步骤,节约了成本。
[0022]
最为重要的是,醋酸作为易挥发的成分,不会对后续分离纯化产生影响,且对人体无伤害,三氯化铁也易过滤除去,增加了af的稳定性,使提取率得以增加。
附图说明:
[0023]
附图1:最终产物中af含量测定示意图。
[0024]
参考文献
[0025]
[1]ha ks,jo sh,kang bh,apostolidis e,lee ms,jang hd,et al.in vitro and in vivo antihyperglycemic effect of 2 amadori rearrangement compounds,arginyl
‑
fructose and arginyl
‑
fructosyl
‑
glucose.j food sci.2011;76:188
–
93.doi:10.1111/j.1750
‑
3841.2011.02361.x.
[0026]
[2]joo km,park cw,jeong hj,lee sj,chang is.simultaneous determination of two amadori compounds in korean red ginseng(panax ginseng)extracts and rat plasma by high
‑
performance anion
‑
exchange chromatography with pulsed amperometric detection.j chromatography b.2008;865:159
–
66.doi:10.1016/j.jchromb.2008.02.012.
[0027]
[3]郑毅男,孟祥颖,张晶,韩立坤,奥田拓道,高久武司,龟田健治.红参中新化合物精氨酸苷的生成机理及生成条件的研究[j].中国药物化学杂志,1997(03):64+66
‑
67.
[0028]
[4]刘丽敏.西洋参中l
‑
精氨酸及其衍生物的研究[d].吉林农业大学,2008.
[0029]
[5]minseok seo,hyunjin kim,jin hyup lee,jeen
‑
woo park.pelargonidin ameliorates acetaminophen
‑
induced hepatotoxicity in mice by inhibiting the ros
‑
induced inflammatory apoptotic response[j].biochimie,2020,168.
[0030]
[6]lee kwang
‑
hyoung,ha kyoung
‑
soo,jo sung
‑
hoon,lee chong m,kim young
‑
cheul,chung kwang
‑
hoe,kwon young
‑
in.effect of long
‑
term dietary arginyl
‑
fructose(af)on hyperglycemia and hba1c in diabetic db/db mice.[j].international journal of molecular sciences,2014,15(5).
[0031]
[7]su eun park,ok
‑
hwan kim,jung hyun kwak,kwang
‑
hyoung lee,young
‑
in kwon,kwang hoe chung,jong ho lee.antihyperglycemic effect of short
‑
term arginyl
‑
fructose supplementation in subjects with prediabetes and newly diagnosed type 2diabetes:randomized,double
‑
blinded,placebo
‑
controlled trial[j].su eun park;ok
‑
hwan kim;jung hyun kwak;kwang
‑
hyoung lee;young
‑
in kwon;kwang hoe chung;jong ho lee,2015,16(1).
具体实施方式
[0032]
以下结合实施例对本发明作进一步详细的举例描述,但发明的实施方式不限于此。
[0033]
除另有说明外:
[0034]
本实施例硅胶和聚丙烯酰胺凝胶柱洗脱条件为:沉淀过200
‑
300硅胶柱,用70%乙醇水溶液洗脱,收集各部分洗脱液,合并富含af成分的洗脱液,浓缩后继续过聚丙烯酰胺凝胶柱,用0.2%醋酸水溶液洗脱,收集富含af的洗脱液,浓缩冷冻干燥即得af。
[0035]
本发明实验用红参粉末(af含量约为2.5%),生晒参粉末(af含量约为1.6%),人参果粉末(af含量约为0.23%),西洋参粉末(af含量约为0.76%)。
[0036]
所述过硅胶和聚丙烯酰胺凝胶柱是指:沉淀过200
‑
300硅胶柱,用70%乙醇水溶液洗脱,收集各部分洗脱液,合并富含af成分的洗脱液,浓缩后继续过聚丙烯酰胺凝胶柱,用0.2%醋酸水溶液洗脱,收集富含af的洗脱液,浓缩冷冻干燥即得af。
[0037]
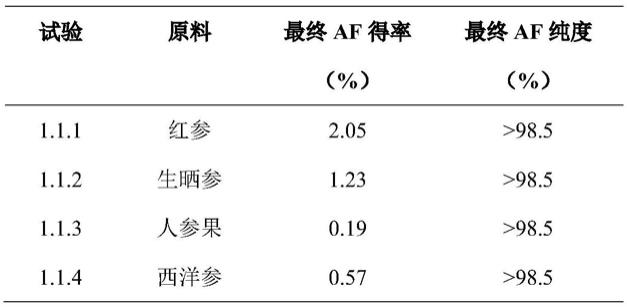
实验例一 不同原料提取af
[0038]
1.1按人参相关加工品粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置入10倍量ph为4.5的醋酸水溶液混合0.3g的三氯化铁进行超声提取,提取液醇沉后,过硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0039]
1.1.1按上述条件使用1g红参粉末(af含量约为2.5%)提取af,置入100ml的水饱和正丁醇萃取三次,沉淀置于10ml的ph为4.5的醋酸水溶液混合0.3g的三氯化铁中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0040]
1.1.2使用1g生晒参粉末(af含量约为1.6%)提取af,置入100ml的水饱和正丁醇萃取三次,沉淀置于10ml的ph为4.5的醋酸水溶液混合0.3g的三氯化铁中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0041]
1.1.3沉使用1g人参果粉末(af含量约为0.23%)提取af,置入100ml的水饱和正丁醇萃取三次,沉淀置于10ml的ph为4.5的醋酸水溶液混合0.3g的三氯化铁中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0042]
1.1.4使用1g西洋参粉末(af含量约为0.76%)提取af,置入100ml的水饱和正丁醇萃取三次,沉淀置于10ml的ph为4.5的醋酸水溶液混合0.3g的三氯化铁中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0043]
1.2 af提取物中精氨酸的检测
[0044]
1.2.1检测方法:运用柱前衍生高效液相色谱法进行检测,检测1.1粗提取物和最终af中精氨酸残留量。
[0045]
1.2.2精氨酸标准品制备:精密称取分析级精氨酸10.0mg,加色谱级甲醇定容至10ml,即浓度为1mg/ml;备用。
[0046]
1.2.3样品制备:每组分别精密称取50.0mg,按照氨基酸衍生法进行衍生检测。
[0047]
1.2.4色谱条件:venusil
‑‑
aa氨基酸分析专用柱(5μm,4.6mm
×
250mm)。流动相a:乙酸钠缓冲溶液
‑
乙腈溶液(ph=6.5);流动相b:乙腈水溶液v(乙腈):v(水)=4:1。0min,0%b;4min,3%b;16min,10%b;17min,20%b;32min,34%b;30min;流速1.0ml/min;检测波长254nm;柱温40℃;进样量20μl。
[0048]
结果见表1,红参组与其他组相比,af提取率较高。
[0049]
表1:不同原料提取af对比
[0050][0051]
由表1可以总结出,从红参中提取af,最终af得率高。
[0052]
实验例二 不同溶剂提取红参中的af
[0053]
2.1按红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置入10倍量以下溶剂进行超声提取,提取液醇沉后,过硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0054]
2.1.1按上述条件萃取完后,沉淀置于10ml的ph为4.5的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0055]
2.1.2按上述条件萃取完后,沉淀置于10ml水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0056]
2.1.3按上述条件萃取完后,沉淀置于10ml的ph为9的氨水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0057]
检测方法如1.2所示。
[0058]
结果见表2,醋酸水溶液组与蒸馏水组和氨水溶液组比,af提取率较高并且纯度最高。
[0059]
表2:不同溶剂提取红参中的af对比
[0060][0061]
由表2可以总结出,以醋酸水溶液从红参中提取af,最终af得率较大提升,纯度也是最高,酸性条件抑制了af的分解,增加其稳定性。
[0062]
实验例三 不同酸性溶剂提取红参中的af
[0063]
3.1按红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置入10倍量以下溶剂进行超声提取,提取液醇沉后,过硅胶和聚丙烯酰胺凝胶柱得af,称量计算得
率并检测纯度。
[0064]
3.1.1按上述条件萃取完后,沉淀置于10ml的ph为5的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0065]
3.1.2按上述条件萃取完后,沉淀置于10ml的ph为5的柠檬酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0066]
3.1.3按上述条件萃取完后,沉淀置于10ml的ph为5的苹果酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0067]
检测方法如1.2所示。
[0068]
结果见表3;醋酸水溶液组与柠檬酸水溶液组和苹果酸水溶液组比,提取率较高。
[0069]
表3:不同酸性溶剂提取红参中的af对比
[0070][0071]
由表3可以总结出,三种酸性溶剂均能提高af得率,但醋酸水溶液组与柠檬酸水溶液组和苹果酸水溶液组比,提取率和af得率更高。
[0072]
实验例四 不同ph的醋酸水溶液提取红参中的af
[0073]
4.1按红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置入10倍量以下溶剂进行超声提取,提取液醇沉后,过硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0074]
4.1.1按上述条件萃取完后,沉淀置于10ml的ph为4的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0075]
4.1.2按上述条件萃取完后,沉淀置于10ml的ph为4.5的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0076]
4.1.3按上述条件萃取完后,沉淀置于10ml的ph为5的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0077]
4.1.4按上述条件萃取完后,沉淀置于10ml的ph为5.5的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0078]
4.1.5按上述条件萃取完后,沉淀置于10ml的ph为6的醋酸水溶液中,超声提取
60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0079]
检测方法如1.2所示。
[0080]
结果见表4,ph为4.5的醋酸水溶液组与其他组比,提取率较高。
[0081]
表4:不同ph的醋酸水溶液提取红参中的af对比
[0082][0083]
由表4可以总结出,ph为4.5的醋酸水溶液为最佳提取溶剂,提取率和af得率最高。
[0084]
实验例五 不同量的三氯化铁混合ph为4.5的醋酸水溶液提取红参中的af
[0085]
5.1按红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置入10倍量以下溶剂进行超声提取,提取液醇沉后,过硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0086]
5.1.1按上述条件萃取完后,沉淀置于10ml的ph为4.5的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0087]
5.1.2按上述条件萃取完后,沉淀置于10ml的ph为4.5的醋酸水溶液中并混合0.1g的三氯化铁固体,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0088]
5.1.3按上述条件萃取完后,沉淀置于10ml的ph为4.5的醋酸水溶液中并混合0.3g的三氯化铁固体,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0089]
5.1.4按上述条件萃取完后,沉淀置于10ml的ph为4.5的醋酸水溶液中并混合0.5g的三氯化铁固体,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱得af,称量计算得率并检测纯度。
[0090]
检测方法如1.2所示。
[0091]
结果见表5,ph为4.5的醋酸水溶液中混合0.3g的三氯化铁组与其他组比,提取率较高。
[0092]
表5:不同量的三氯化铁混合对红参中的af提取的比较结果
[0093][0094]
由表5可以总结出,ph为4.5的醋酸水溶液中混合0.3g的三氯化铁为最佳比例,提取率和af得率最高。
[0095]
实施例1
[0096]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为4.5的冰醋酸水溶液中并混合0.3g的三氯化铁固体,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为2.05%,最终af纯度大于98.5%。
[0097]
实施例2
[0098]
精确称量生晒参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为4.5的冰醋酸水溶液中并混合0.3g的三氯化铁固体,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.2%,最终af纯度大于98.5%。
[0099]
实施例3
[0100]
精确称量人参果粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为4.5的冰醋酸水溶液中并混合0.3g的三氯化铁固体,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为0.19%,最终af纯度大于98.5%。
[0101]
实施例4
[0102]
精确称量西洋参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为4.5的冰醋酸水溶液中并混合0.3g的三氯化铁固体,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为0.57%,最终af纯度大于98.5%。
[0103]
实施例5
[0104]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为4.5的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.47%,最终af纯度大于98.5%。
[0105]
实施例6
[0106]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300
硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为0.74%,最终af纯度为96.3%。
[0107]
实施例7
[0108]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为9的氨水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,粗提率为6.4%过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为0.19%,最终af纯度为94.9%。
[0109]
实施例8
[0110]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为5的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.34%,最终af纯度大于98.5%。
[0111]
实施例9
[0112]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为5的柠檬酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.25%,最终af纯度大于98.5%。
[0113]
实施例10
[0114]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为5的苹果酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.12%,最终af纯度大于98.5%。
[0115]
实施例11
[0116]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为4的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.29%,最终af纯度大于98.5%。
[0117]
实施例12
[0118]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为4.5的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.47%,最终af纯度大于98.5%。
[0119]
实施例13
[0120]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为5的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.34%,最终af纯度大于98.5%。
[0121]
实施例14
[0122]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置
于10ml的ph为5.5的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.19%,最终af纯度大于98.5%。
[0123]
实施例15
[0124]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为6的醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.03%,最终af纯度大于98.5%。
[0125]
实施例16
[0126]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为4.5的冰醋酸水溶液中,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.47%,最终af纯度大于98.5%。
[0127]
实施例17
[0128]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为4.5的冰醋酸水溶液中并混合0.1g的三氯化铁固体,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.79%,最终af纯度大于98.5%。
[0129]
实施例18
[0130]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为4.5的冰醋酸水溶液中并混合0.3g的三氯化铁固体,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为2.05%,最终af纯度大于98.5%。
[0131]
实施例19
[0132]
精确称量红参粉末(80目)1.0g置入100ml的水饱和正丁醇萃取三次,所得沉淀置于10ml的ph为4.5的冰醋酸水溶液中并混合0.5g的三氯化铁固体,超声提取60min,提取液经乙醇醇沉洗脱,抽滤得粗提取物,过200
‑
300硅胶和聚丙烯酰胺凝胶柱收集含af洗脱液,浓缩冻干计算af得率为1.83%,最终af纯度大于98.5%。
[0133]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1