广谱抗变异新冠病毒IgY和复合抗体及制备方法和组合制剂与流程
广谱抗变异新冠病毒igy和复合抗体及制备方法和组合制剂
技术领域
1.本发明涉及生物药品技术领域,具体涉及一种广谱抗变异新冠病毒igy和复合抗体及制备方法和组合制剂。
背景技术:
2.sars
‑
cov
‑
2冠状病毒是之前从未在人体中发现的新型冠状病毒,迄今为止,全球确诊人数已达一亿人,死亡人数已超过200万人。面对这场浩劫,全球医药界已紧急启动疫苗和治疗药物的研发;但是,大量的研究和临床经验显示:新冠病毒糖基化程度非比寻常,研究发现hiv的糖基化位点是流感病毒的3
‑
6倍(这是hiv疫苗研发迟迟无法成功的主要原因之一),而新冠病毒的糖基化位点则是hiv病毒2倍以上,这就意味着新冠病毒极易产生变异;目前在欧洲和美国广泛传播的新冠病毒大部分都是此前传播的病毒之变体,且变异后的病毒传染性强得多。对人类更严重的威胁是,病毒发生变异,常规方法制成的抗体将减弱甚至失去其应有的中和作用;同时,新冠病毒还具有免疫逃逸机制,会使药物的疗效进一步大打折扣。新冠病毒的这些特点对于治疗药物的研发带来巨大的挑战。
3.另外,迄今为止,世界各国除了依赖疫苗预防外,基本上还是采用戴口罩、洗手、封城、隔离以及保持社交距离等传统防疫手段;如何研究开发一种更简便有效的预防方法也是摆在国际医药界的重要课题。
技术实现要素:
4.本发明的目的是针对新冠病毒易突变和变异以及具有免疫逃逸功能的特点,研究开发解决因新冠病毒变异和免疫逃逸带来的难题的新型广谱抗变异新冠病毒igy抗体和抗突变新冠病毒igy抗体以及组合抗体和相应产品,为全球抗疫作贡献。
5.本发明提供一种广谱抗变异新冠病毒igy抗体的制备方法,其特征在于,包括以下步骤:
6.s1、制备新冠病毒广谱性中和表位的抗原:分别在单一的新冠病毒广谱性中和表位的抗原成份和新冠病毒广谱性中和表位组合式复合抗原成份中加入佐剂,制得单一的新冠病毒广谱性中和表位的抗原和新冠病毒广谱性中和表位组合式复合抗原;
7.s2、制备免疫蛋:将所述单一的新冠病毒广谱性中和表位的抗原和所述新冠病毒广谱性中和表位组合式复合抗原免疫产蛋禽类,得到抗变异新冠病毒的免疫蛋;
8.s3、分离抗体:从所述免疫蛋中分离抗所述广谱抗变异新冠病毒igy抗体。
9.在本发明提供的制备方法中,所述单一的新冠病毒广谱性中和表位的抗原成份包括新冠病毒rbd侧面的保守性区域抗原成份、新冠病毒亚基七肽重复区(hr)结构域抗原成份、s309抗体结合的新冠病毒s1表位抗原成份、新冠病毒n末端结构域抗原成份、新冠病毒的n蛋白抗原成份和新冠病毒m蛋白抗原成份,所述新冠病毒广谱性中和表位组合式复合抗原成份为所述新冠病毒rbd侧面的保守性区域抗原成份、所述新冠病毒亚基七肽重复区(hr)结构域抗原成份、所述s309抗体结合的新冠病毒s1表位抗原成份、所述新冠病毒n末端
结构域抗原成份、所述新冠病毒的n蛋白抗原成份和所述新冠病毒m蛋白抗原成份中的多种混合制得。
10.本发明还提供一种抗突变新冠病毒igy抗体的制备方法,包括以下步骤:
11.s1、制备突变新冠病毒的抗原:分别在新冠病毒突变g614重组蛋白抗原成份、新冠病毒突变抗原表位n501y抗原成份和新冠病毒突变抗原表位de484k抗原成份中加入佐剂,制得新冠病毒突变g614重组蛋白抗原、新冠病毒突变抗原表位n501y抗原和新冠病毒突变抗原表位de484k抗原;
12.s2、制备免疫蛋:将所述新冠病毒突变g614重组蛋白抗原、所述新冠病毒突变抗原表位n501y抗原和所述新冠病毒突变抗原表位de484k抗原免疫产蛋禽类,得到抗突变新冠病毒的免疫蛋;
13.s3、分离抗体:从所述免疫蛋中分离抗所述抗突变新冠病毒igy抗体。
具体实施方式
14.围绕解决新冠病毒易突变和变异以及“免疫逃逸”造成的难题,本发明从三个方面着手,第一、优选多种保守性强的抗原表位,研发一种结合保守性强的抗原表位的广谱抗变异新冠病毒igy抗体;第二、针对近期最流行的突变新冠病毒,研发抗突变新冠病毒igy抗体;第三、将几种不同功能和特点的抗体混合组成复合抗体,发挥不同抗体的协同作用。具体如下所叙:
15.一、广谱抗变异新冠病毒igy抗体的制备
16.一)制备广谱性中和表位抗原
17.1.优选保守性强的抗原表位
18.鉴于新冠病毒的高频率突变性,优选保守性强的抗原表位,制备针对这些保守性强的抗原表位的广谱igy中和抗体,是解决新冠病毒突变甚至变异而造成抗体药减效或失效的最有效方法。
19.以下是本发明在深入剖析新冠病毒的结构以及各抗原表位功能的基础上,优选出的六个有代表性之保守性强的抗原表位:
20.(1)新冠病毒rbd侧面的保守性区域,是对冠状病毒具有广谱中和能力的抗体h014所针对的抗原表位,代表了一类全新的广谱性中和表位;因此,选择新冠病毒rbd侧面的这个保守性区域作为保守性强的抗原表位的抗原之一。
21.(2)s2亚基是高度保守的,其中含有促进病毒与细胞融合的关键蛋白片段,包括融合肽,两个七肽重复区(hr1和hr2)以及跨膜结构域。鉴于s2的跨膜结构域在不同属的冠状病毒间也是非常保守的,因此,选择新冠病毒的亚基七肽重复区(hr)结构域作为保守性强的抗原表位的抗原之一。
22.(3)s309抗体与新冠病毒s蛋白结合的表位在新冠病毒中非常保守,迄今为止报道的11839个新冠病毒分离株(isolate)中只有4株在这一表位上出现突变;因此,选择s309抗体结合的新冠病毒s1的这个表位作为保守性强的抗原表位的抗原之一。
23.(4)n端结构域(ntd)ntd含有较为保守的结合rna的正电荷分布区域,因此,选择新冠病毒的n末端结构域作为保守性强的抗原表位的抗原之一。
24.(5)新冠病毒n蛋白的相应位点相对保守,是一种高度免疫原性的磷蛋白,在病毒
ttcctttaca
39.23041 atcatatggt ttccaaccca ctaatggtgt tggttaccaa ccatacagag tagtagtact
40.23101 ttcttttgaa cttctacatg caccagcaac tgtttgtgga cct
41.ii.基因密码子优化与合成
42.基于大肠杆菌的密码子偏爱性对sars
‑
cov
‑
2的rbd侧面的保守性区域基因人工合成,5
′
端引入bglⅱ酶切位点,3
′
端引入xhoⅰ酶切位点。
43.iii.连接与转化
44.合成的rbd侧面的保守性区域基因用bglⅱ和xhoⅰ37℃双酶切过夜,载体pgex
‑
4t
‑
1用bamhⅰ和xhoⅰ37℃双酶切过夜,酶切后的目的基因和载体分别经琼脂糖凝胶电泳后割胶纯化回收;将回收的目的基因与载体以摩尔比5∶1的比例混合,16℃连接过夜,构建含有目的基因的重组质粒,转化大肠杆菌dh5。
45.iv.重组质粒的筛选与鉴定
46.挑取单个菌落于含50mg/l氨苄青霉素的lb培养基中37℃培养过夜后,小提质粒,对目的基因的重组质粒进行测序,测序结果与ncbi数据库中公布的序列以blast进行比较,结果完全一致的菌,挑取并保藏。
47.v.sds
‑
page分析rbd侧面的保守性区域目的蛋白的表达经dna测序验证的重组质粒转化大肠杆菌bl21(de3),挑取含重组原核表达载体的单个菌落接种于含50mg/l氨苄青霉素的lb培养基,37℃培养过夜后,按1%接种于新鲜的lb培养基(含50mg/l氨苄青霉素),37℃继续培养至od600约为1.0时,加入乳糖至终浓度为1g/l诱导9h,每隔1h取1ml菌液作全菌sds
‑
page电泳,考马斯亮蓝r2250染色。当诱导重组蛋白达到最佳表达时间后收菌,4℃、10000r/m离心10min,弃上清液。菌体沉淀用适量谷氨酰转肽酶裂解缓冲液重悬后,超声破碎菌体,4℃、12000r/m离心15min,分别取上清液和沉淀留样电泳。电泳结果和ncbi数据库中公布rbd侧面的保守性区域蛋白大小及gst标签融合和切除的蛋白大小比较。
48.vi.western blot鉴定目的rbd侧面的保守性区域蛋白将诱导表达的产物先行sds
‑
page,然后以半干法电转移至硝酸纤维素膜上,取下硝酸纤维素膜tbs短暂漂洗后经5%光明脱脂奶粉室温封闭1h,tbst漂洗3次后,与gst tag单抗孵育过夜,次日tbst漂洗3次后,与irdye800标记的羊抗鼠igg孵育1h,最后tbst 3次洗膜经odyssey红外激光成像系统扫描实验果。通过和h014抗体的特异结合,来鉴定rbd基因在pgex
‑
4t
‑
1表达的重组蛋白是目的rbd侧面的保守性区域蛋白。
49.rbd侧面的保守性区域重组目的蛋白表达的sds2page和western blot鉴定试验重复三次,表明表达和生产的rbd侧面的保守性区域重组蛋白抗原是正确的。
50.(2)采用真核表达系统制作新冠病毒的亚基七肽重复区(hr)结构域抗原成份
51.i.从genbank中获取sars
‑
cov
‑
2之亚基七肽重复区(hr)结构域基因序列
52.tcttatg tccttccctc agtcagcacc tcatggtgta
53.3181 gtcttcttgc atgtgactta tgtccctgca caagaaaaga acttcacaac tgctcctgcc
54.3241 atttgtcatg atggaaaagc acactttcct cgtgaaggtg tctttgtttc aaatggcaca
55.3301 cactggtttg taacacaaag gaatttttat gaaccacaaa tcattactac agacaacaca
56.3361 tttgtgtctg gtaactgtga tgttgtaata ggaattgtca acaacacagt ttatgatcct
57.3421 ttgcaacctg aattagactc attcaaggag gagttagata aatattttaa gaatcataca
58.3481 tcaccagatg ttgatttagg tgacatctct ggcattaatg cttcagttgt aaacattcaa
59.3541 aaagaaattg accgcctcaa tgaggttgcc aagaatttaa atgaatctct catcgatctc
60.3601 caagaacttg gaaagtat
61.ii.大肠杆菌偏爱密码子优化sars
‑
cov
‑
2亚基七肽重复区(hr)结构域基因与合成
62.根据ncbi公布的sars
‑
cov
‑
2亚基七肽重复区(hr)结构域基因序列,进行大肠杆菌密码子优化并人工合成,5
′
端引入bglⅱ酶切位点,3
′
端引入xhoⅰ酶切位点。
63.iii.连接与转化
64.大肠杆菌偏爱密码子优化的sars
‑
cov
‑
2人工合成亚基七肽重复区(hr)结构域基因用bglⅱ和xhoⅰ37℃双酶切过夜,载体pgex
‑
4t
‑
1用bamhⅰ和xhoⅰ37℃双酶切过夜,酶切后的目的基因和载体分别经琼脂糖凝胶电泳后割胶纯化回收;将回收的目的基因与载体以摩尔比5∶1的比例混合,16℃连接过夜,构建含有目的基因的重组质粒,转化大肠杆菌dh5。
65.iv.重组质粒的筛选与鉴定
66.挑取单个菌落于含50mg/l氨苄青霉素的lb培养基中37℃培养过夜后,小提质粒,n基因的测序,与大肠杆菌偏爱密码子优化亚基七肽重复区(hr)结构域基因比对。
67.v.sds
‑
page分析n目的蛋白的表达
68.经dna测序验证的重组质粒转化大肠杆菌bl21(de3),挑取含重组原核表达载体的单个菌落接种于含50mg/l氨苄青霉素的lb培养基,37℃培养过夜后,按1%接种于新鲜的lb培养基(含50mg/l氨苄青霉素),37℃继续培养至od600约为1.0时,加入乳糖至终浓度为1g/l诱导9h,每隔1h取1ml菌液作全菌sds2page电泳,考马斯亮蓝r2250染色。当诱导重组蛋白达到最佳表达时间后收菌,4℃、10000r/m离心10min,弃上清液。菌体沉淀用适量谷氨酰转肽酶裂解缓冲液重悬后,超声破碎菌体,4℃、12000r/m离心15min,分别取上清液和沉淀留样电泳。电泳结果和亚基七肽重复区(hr)结构域蛋白ncbi数据库中公布亚基七肽重复区(hr)结构域蛋白大小及gst标签融合和切除的蛋白大小比较。
69.vi.western blot鉴定n目的蛋白
70.将诱导表达的产物先行sds
‑
page,然后以半干法电转移至硝酸纤维素膜上,取下硝酸纤维素膜tbs短暂漂洗后经5%光明脱脂奶粉室温封闭1h,tbst漂洗3次后,与gst tag单抗孵育过夜,次日tbst漂洗3次后,与irdye800标记的羊抗鼠igg孵育1h,最后tbst3次洗膜经odyssey红外激光成像系统扫描实验果。通过和1a9抗体的特异结合,来鉴定亚基七肽重复区(hr)结构域基因在pgex
‑
4t
‑
1表达的重组蛋白是目的蛋白。
71.重组亚基七肽重复区(hr)结构域蛋白表达的sds
‑
page和western blot鉴定试验重复三次,表明表达和生产的亚基七肽重复区(hr)结构域重组蛋白抗原是正确的。
72.(3)采用真核表达系统制作s309抗体结合的新冠病毒s1表位抗原成份
73.i.从genbank中获取sars
‑
cov
‑
2之s309抗体结合的新冠病毒s1表位基因序列
74.mgilpspgmpallslvsllsvllmgcvaetgtqcvnlttrtqlppaytnsftrgvyypdkvfrssvlhstqdlflpffsnvtwfhaihvsgtngtkrfdnpvlpfndgvyfasteksniirgwifgttldsktqsllivnnatnvvikvcefqfcndpflgvyyhknnkswmesefrvyssannctfeyvsqpflmdlegkqgnfknlrefvfknidgyfkiyskhtpinlvrdlpqgfsaleplvdlpiginitrfqtllalhrsyltpgdsssgwtagaaayyvgylqprtfllkynengtitdavdcaldplsetkctlksftvekgiyqtsnfrvqptesivrfpnitnlcpfgevfnatrfasvyawnrkrisncvadysvlynsasfstfkcygvsptklndlcftnvyadsfvirgdevrqiapgqtgkiadynyklpddftgcviawnsnnldskvggnynylyrlfrksnlkpferdisteiyqagstpcngvegfncyfplqsygfqptngvgyqpyrvvvlsfellhapatvcgpkkstnlvknkcvnfnfngltgtgvltesnkkflpfqqfgrdiadttdavrdpqtleilditpcsfggvsvitpgtntsnqvavlyqdvnctevpvaihadqltptwrvystgsnvfqtragcligaehvnnsyecdipigagicasyqtqtnspsgagsvasqsiiaytmslgaensvaysnnsiaiptnftisvtteilpvsmtktsvdctmyicgdstecsnlllqygsfctqlnraltgiaveqdkntqevfaqvkqiyktppikdfggfnfsqilpdpskpskrsfiedllfnkvtladagfikqygdclgdiaardlicaqkfngltvlpplltdemiaqytsallagtitsgwtfgagaalqipfamqmayrfngigvtqnvlyenqklianqfnsaigkiqdslsstasalgklqdvvnqnaqalntlvkqlssnfgaissvlndil
75.ii.大肠杆菌偏爱密码子优化sars
‑
cov
‑
2之s309抗体结合的新冠病毒s1表位基因与合成
76.根据ncbi公布的sars
‑
cov
‑
2之s309抗体结合的新冠病毒s1表位基因序列,进行大肠杆菌密码子优化并人工合成,5
′
端引入bglⅱ酶切位点,3
′
端引入xhoⅰ酶切位点。
77.iii.连接与转化
78.大肠杆菌偏爱密码子优化的sars
‑
cov
‑
2人工合成s309抗体结合的新冠病毒s1表位基因用bglⅱ和xhoⅰ37℃双酶切过夜,载体pgex
‑
4t
‑
1用bamhⅰ和xhoⅰ37℃双酶切过夜,酶切后的目的基因和载体分别经琼脂糖凝胶电泳后割胶纯化回收;将回收的目的基因与载体以摩尔比5∶1的比例混合,16℃连接过夜,构建含有目的基因的重组质粒,转化大肠杆菌dh5。
79.iv.重组质粒的筛选与鉴定
80.挑取单个菌落于含50mg/l氨苄青霉素的lb培养基中37℃培养过夜后,小提质粒,n基因的测序,与大肠杆菌偏爱密码子优化的sars
‑
cov
‑
2人工合成s309抗体结合的新冠病毒s1表位基因比对。
81.v.sds
‑
page分析目的蛋白的表达
82.经dna测序验证的重组质粒转化大肠杆菌bl21(de3),挑取含重组原核表达载体的单个菌落接种于含50mg/l氨苄青霉素的lb培养基,37℃培养过夜后,按1%接种于新鲜的lb培养基(含50mg/l氨苄青霉素),37℃继续培养至od600约为1.0时,加入乳糖至终浓度为1g/l诱导9h,每隔1h取1ml菌液作全菌sds2page电泳,考马斯亮蓝r2250染色。当诱导重组蛋白达到最佳表达时间后收菌,4℃、10000r/m离心10min,弃上清液。菌体沉淀用适量谷氨酰转肽酶裂解缓冲液重悬后,超声破碎菌体,4℃、12000r/m离心15min,分别取上清液和沉淀留样电泳。电泳结果和ncbi数据库中公布sars
‑
cov
‑
2之s309抗体结合的新冠病毒s1表位基因蛋白大小及gst标签融合和切除的蛋白大小比较。
83.vi.western blot鉴定目的蛋白
84.将诱导表达的产物先行sds
‑
page,然后以半干法电转移至硝酸纤维素膜上,取下硝酸纤维素膜tbs短暂漂洗后经5%光明脱脂奶粉室温封闭1h,tbst漂洗3次后,与gst tag单抗孵育过夜,次日tbst漂洗3次后,与irdye800标记的羊抗鼠igg孵育1h,最后tbst3次洗膜经odyssey红外激光成像系统扫描实验果。通过和s309抗体的特异结合,来鉴定表达的重组蛋白是目的蛋白。
85.重组蛋白表达的sds
‑
page和western blot鉴定试验重复三次,表明表达和生产的重组sars
‑
cov
‑
2之s309抗体结合的新冠病毒s1表位基因蛋白抗原是正确的。
86.(4)采用真核表达系统制作新冠病毒的n末端结构域抗原成份
87.构建ntd原核表达载体pgex
‑
4t
‑1‑
ntd表达与鉴定:
88.i.从genbank中获取sars
‑
cov
‑
2之ntd基因序列
89.tttt attgccacta gtctctagtc agtgtgttaa tcttacaacc
90.61 agaactcaat taccccctgc atacactaat tctttcacac gtggtgttta ttaccctgac
91.121 aaagttttca gatcctcagt tttacattca actcaggact tgttcttacc tttcttttcc
92.181 aatgttactt ggttccatgc tatacatgtc tctgggacca atggtactaa gaggtttgat
93.241 aaccctgtcc taccatttaa tgatggtgtt tattttgctt ccactgagaa gtctaacata
94.301 ataagaggct ggatttttgg tactacttt
95.ii.基因密码子优化与合成
96.基于大肠杆菌的密码子偏爱性对sars
‑
cov
‑
2的ntd基因人工合成,5
′
端引入bglⅱ酶切位点,3
′
端引入xhoⅰ酶切位点。
97.iii.合成的ntd基因用bglⅱ和xhoⅰ37℃双酶切过夜,载体pgex
‑
4t
‑
1用bamhⅰ和xhoⅰ37℃双酶切过夜,酶切后的目的基因和载体分别经琼脂糖凝胶电泳后割胶纯化回收;将回收的目的基因与载体以摩尔比5∶1的比例混合,16℃连接过夜,构建含有ntd目的基因的重组质粒pgex
‑
4t
‑1‑
ntd,转化大肠杆菌dh5。
98.iv.重组质粒pgex
‑
4t
‑1‑
ntd的筛选与鉴定
99.挑取单个菌落于含50mg/l氨苄青霉素的lb培养基中37℃培养过夜后,小提质粒,酶切并测序鉴定构建的pgex
‑
4t
‑1‑
ntd质粒是含有密码子优化的ntd序列。
100.v.sds
‑
page分析ntd目的蛋白的表达
101.经dna测序验证的重组质粒转化大肠杆菌bl21(de3),挑取含重组原核表达载体的单个菌落接种于含50mg/l氨苄青霉素的lb培养基,37℃培养过夜后,按1%接种于新鲜的lb培养基(含50mg/l氨苄青霉素),37℃继续培养至od600约为1.0时,加入乳糖至终浓度为1g/l诱导9h,每隔1h取1ml菌液作全菌sds2page电泳,考马斯亮蓝r2250染色。当诱导重组蛋白达到最佳表达时间后收菌,4℃、10000r/m离心10min,弃上清液。菌体沉淀用适量谷氨酰转肽酶裂解缓冲液重悬后,超声破碎菌体,4℃、12000r/m离心15min,分别取上清液和沉淀留样电泳。电泳结果和ntd蛋白ncbi数据库中公布ntd蛋白大小及gst标签融合和切除的蛋白大小比较。
102.vi.western blot鉴定ntd目的蛋白
103.将诱导表达的产物先行sds
‑
page,然后以半干法电转移至硝酸纤维素膜上,取下硝酸纤维素膜tbs短暂漂洗后经5%光明脱脂奶粉室温封闭1h,tbst漂洗3次后,与gst tag
单抗孵育过夜,次日tbst漂洗3次后,与irdye800标记的羊抗鼠igg孵育1h,最后tbst 3次洗膜经odyssey红外激光成像系统扫描实验果。通过和ntd抗体的特异结合,来鉴定ntd基因在pgex
‑
4t
‑
1表达的重组蛋白是目的ntd蛋白。
104.ntd重组目的蛋白表达的sds
‑
page和western blot鉴定试验重复三次,表明表达和生产的ntd重组蛋白抗原是正确的。
105.(5)采用真核表达系统制作新冠病毒n蛋白抗原成份
106.i.从genbank中获取sars
‑
cov
‑
2之n基因序列
107.1 atgtctgata atggacccca aaatcagcga aatgcacccc gcattacgtt tggtggaccc
108.61 tcagattcaa ctggcagtaa ccagaatgga gaacgcagtg gggcgcgatc aaaacaacgt
109.121 cggccccaag gtttacccaa taatactgcg tcttggttca ccgctctcac tcaacatggc
110.181 aaggaagacc ttaaattccc tcgaggacaa ggcgttccaa ttaacaccaa tagcagtcca
111.241 gatgaccaaa ttggctacta ccgaagagct accagacgaa ttcgtggtgg tgacggtaaa
112.301 atgaaagatc tcagtccaag atggtatttc tactacctag gaactgggcc agaagctgga
113.361 cttccctatg gtgctaacaa agacggcatc atatgggttg caactgaggg agccttgaat
114.421 acaccaaaag atcacattgg cacccgcaat cctgctaaca atgctgcaat cgtgctacaa
115.481 cttcctcaag gaacaacatt gccaaaaggc ttctacgcag aagggagcag aggcggcagt
116.541 caagcctctt ctcgttcctc atcacgtagt cgcaacagtt caagaaattc aactccaggc
117.601 agcagtaggg gaacttctcc tgctagaatg gctggcaatg gcggtgatgc tgctcttgct
118.661 ttgctgctgc ttgacagatt gaaccagctt gagagcaaaa tgtctggtaa aggccaacaa
119.721 caacaaggcc aaactgtcac taagaaatct gctgctgagg cttctaagaa gcctcggcaa
120.781 aaacgtactg ccactaaagc atacaatgta acacaagctt tcggcagacg tggtccagaa
121.841 caaacccaag gaaattttgg ggaccaggaa ctaatcagac aaggaactga ttacaaacat
122.901 tggccgcaaa ttgcacaatt tgcccccagc gcttcagcgt tcttcggaat gtcgcgcatt
123.961 ggcatggaag tcacaccttc gggaacgtgg ttgacctaca caggtgccat caaattggat
124.1021 gacaaagatc caaatttcaa agatcaagtc attttgctga ataagcatat tgacgcatac
125.1081 aaaacattcc caccaacaga gcctaaaaag gacaaaaaga agaaggctga tgaaactcaa
126.1141 gccttaccgc agagacagaa gaaacagcaa actgtgactc ttcttcctgc tgcagatttg
127.1201 gatgatttct ccaaacaatt gcaacaatcc atgagcagtg ctgactcaac tcaggcctaa
128.ii.大肠杆菌偏爱密码子优化sars
‑
cov
‑2‑
n基因与合成
129.根据ncbi公布的sars
‑
cov
‑2‑
n基因序列,进行大肠杆菌密码子优化并人工合成,5
′
端引入bglⅱ酶切位点,3
′
端引入xhoⅰ酶切位点。
130.iii.连接与转化
131.大肠杆菌偏爱密码子优化的sars
‑
cov
‑
2人工合成n基因用bglⅱ和xhoⅰ37℃双酶切过夜,载体pgex
‑
4t
‑
1用bamhⅰ和xhoⅰ37℃双酶切过夜,酶切后的目的基因和载体分别经琼脂糖凝胶电泳后割胶纯化回收;将回收的目的基因与载体以摩尔比5∶1的比例混合,16℃
连接过夜,构建含有目的基因的重组质粒pgex
‑
4t
‑1‑
n,转化大肠杆菌dh5。
132.iv.重组质粒pgex
‑
4t
‑1‑
n的筛选与鉴定
133.挑取单个菌落于含50mg/l氨苄青霉素的lb培养基中37℃培养过夜后,小提质粒,n基因的测序,与大肠杆菌偏爱密码子优化n基因比对。
134.v.sds
‑
page分析n目的蛋白的表达
135.经dna测序验证的重组质粒转化大肠杆菌bl21(de3),挑取含重组原核表达载体的单个菌落接种于含50mg/l氨苄青霉素的lb培养基,37℃培养过夜后,按1%接种于新鲜的lb培养基(含50mg/l氨苄青霉素),37℃继续培养至od600约为1.0时,加入乳糖至终浓度为1g/l诱导9h,每隔1h取1ml菌液作全菌sds2page电泳,考马斯亮蓝r2250染色。当诱导重组蛋白达到最佳表达时间后收菌,4℃、10000r/m离心10min,弃上清液。菌体沉淀用适量谷氨酰转肽酶裂解缓冲液重悬后,超声破碎菌体,4℃、12000r/m离心15min,分别取上清液和沉淀留样电泳。电泳结果和n蛋白ncbi数据库中公布n蛋白大小及gst标签融合和切除的蛋白大小比较。
136.vi.western blot鉴定n目的蛋白
137.将诱导表达的产物先行sds
‑
page,然后以半干法电转移至硝酸纤维素膜上,取下硝酸纤维素膜tbs短暂漂洗后经5%光明脱脂奶粉室温封闭1h,tbst漂洗3次后,与gst tag单抗孵育过夜,次日tbst漂洗3次后,与irdye800标记的羊抗鼠igg孵育1h,最后tbst3次洗膜经odyssey红外激光成像系统扫描实验果。通过和n蛋白抗体的特异结合,来鉴定n基因在pgex
‑
4t
‑
1表达的重组蛋白是目的n蛋白。
138.重组n蛋白表达的sds
‑
page和western blot鉴定试验重复三次,表明表达和生产的n重组蛋白抗原是正确的。
139.(6)采用真核表达系统制作新冠病毒m蛋白抗原成份
140.i.从genbank中获取sars
‑
cov
‑
2之m基因序列
141.gene 1..669
142./gene="m"
143./locus_tag="gu280_gp05"
144./db_xref="geneid:43740571"
145.cds 1..669
146./gene="m"
147./locus_tag="gu280_gp05"
148./note="orf5;structural protein"
149./codon_start=1
150./product="membrane glycoprotein"
151./protein_id="yp_009724393.1"
152./db_xref="geneid:43740571"
153./translation="madsngtitveelkklleqwnlvigflfltwicllqfayanrnr
154.flyiikliflwllwpvtlacfvlaavyrinwitggiaiamaclvglmwlsyfiasfrl
155.fartrsmwsfnpetnillnvplhgtiltrplleselvigavilrghlriaghhlgrcd
156.ikdlpkeitvatsrtlsyyklgasqrvagdsgfaaysryrignyklntdhssssdnia
157.llvq"
158.origin
159.1 atggcagatt ccaacggtac tattaccgtt gaagagctta aaaagctcct tgaacaatgg
160.61 aacctagtaa taggtttcct attccttaca tggatttgtc ttctacaatt tgcctatgcc
161.121 aacaggaata ggtttttgta tataattaag ttaattttcc tctggctgtt atggccagta
162.181 actttagctt gttttgtgct tgctgctgtt tacagaataa attggatcac cggtggaatt
163.241 gctatcgcaa tggcttgtct tgtaggcttg atgtggctca gctacttcat tgcttctttc
164.301 agactgtttg cgcgtacgcg ttccatgtgg tcattcaatc cagaaactaa cattcttctc
165.361 aacgtgccac tccatggcac tattctgacc agaccgcttc tagaaagtga actcgtaatc
166.421 ggagctgtga tccttcgtgg acatcttcgt attgctggac accatctagg acgctgtgac
167.481 atcaaggacc tgcctaaaga aatcactgtt gctacatcac gaacgctttc ttattacaaa
168.541 ttgggagctt cgcagcgtgt agcaggtgac tcaggttttg ctgcatacag tcgctacagg
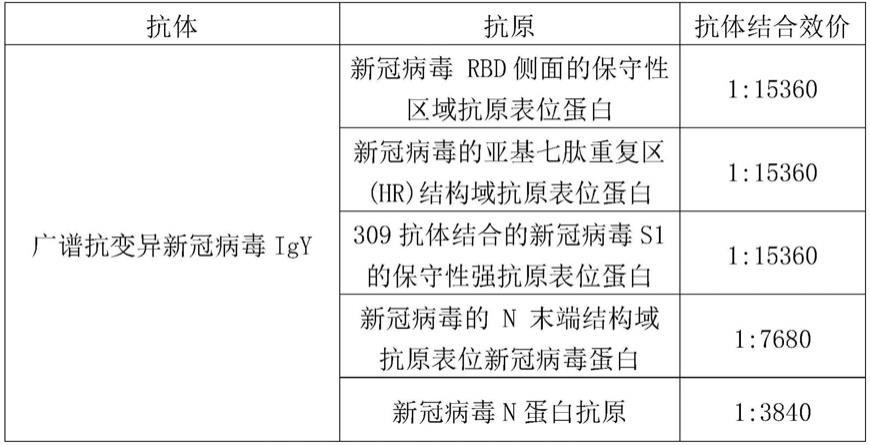
169.601 attggcaact ataaattaaa cacagaccat tccagtagca gtgacaatat tgctttgctt
170.661 gtacagtaa
171.ii.大肠杆菌偏爱密码子优化sars
‑
cov
‑2‑
m基因与合成
172.根据ncbi公布的sars
‑
cov
‑2‑
m基因序列,进行大肠杆菌密码子优化并人工合成,5
′
端引入bglⅱ酶切位点,3
′
端引入xhoⅰ酶切位点。
173.iii.连接与转化
174.大肠杆菌偏爱密码子优化的sars
‑
cov
‑
2人工合成m基因用bglⅱ和xhoⅰ37℃双酶切过夜,载体pgex
‑
4t
‑
1用bamhⅰ和xhoⅰ37℃双酶切过夜,酶切后的目的基因和载体分别经琼脂糖凝胶电泳后割胶纯化回收;将回收的目的基因与载体以摩尔比5∶1的比例混合,16℃连接过夜,构建含有目的基因的重组质粒pgex
‑
4t
‑1‑
m,转化大肠杆菌dh5。
175.iv.重组质粒pgex
‑
4t
‑1‑
m的筛选与鉴定
176.挑取单个菌落于含50mg/l氨苄青霉素的lb培养基中37℃培养过夜后,小提质粒,n基因的测序,与大肠杆菌偏爱密码子优化m基因比对。
177.v.sds
‑
page分析m目的蛋白的表达
178.经dna测序验证的重组质粒转化大肠杆菌bl21(de3),挑取含重组原核表达载体的单个菌落接种于含50mg/l氨苄青霉素的lb培养基,37℃培养过夜后,按1%接种于新鲜的lb培养基(含50mg/l氨苄青霉素),37℃继续培养至od600约为1.0时,加入乳糖至终浓度为1g/l诱导9h,每隔1h取1ml菌液作全菌sds2page电泳,考马斯亮蓝r2250染色。当诱导重组蛋白达到最佳表达时间后收菌,4℃、10000r/m离心10min,弃上清液。菌体沉淀用适量谷氨酰转肽酶裂解缓冲液重悬后,超声破碎菌体,4℃、12000r/m离心15min,分别取上清液和沉淀留样电泳。电泳结果和n蛋白ncbi数据库中公布m蛋白大小及gst标签融合和切除的蛋白大小比较。
179.vi.western blot鉴定m目的蛋白
180.将诱导表达的产物先行sds
‑
page,然后以半干法电转移至硝酸纤维素膜上,取下硝酸纤维素膜tbs短暂漂洗后经5%光明脱脂奶粉室温封闭1h,tbst漂洗3次后,与gst tag单抗孵育过夜,次日tbst漂洗3次后,与irdye800标记的羊抗鼠igg孵育1h,最后tbst3次洗膜经odyssey红外激光成像系统扫描实验果。通过和n蛋白抗体的特异结合,来鉴定n基因在
pgex
‑
4t
‑
1表达的重组蛋白是目的m蛋白。
181.重组m蛋白表达的sds
‑
page和western blot鉴定试验重复三次,表明表达和生产的m重组蛋白抗原是正确的。
182.3.制备优选的新冠病毒广谱性中和表位的抗原
183.具体实施方法如下:
184.a.制作单一的新冠病毒广谱性中和表位的抗原
185.将按以上方法制成的六种不同的新冠病毒广谱性中和表位的抗原成份:(1)新冠病毒rbd侧面的保守性区域抗原成份、(2)新冠病毒亚基七肽重复区(hr)结构域抗原成份、(3)s309抗体结合的新冠病毒s1表位抗原成份、(4)新冠病毒n末端结构域抗原成份、(5)新冠病毒的n蛋白、(6)新冠病毒m蛋白抗原成份,分别按1
‑
10:1
‑
10比例(通常为1:1)与福氏佐剂或其它佐剂混合,置入高速匀浆器以30,000rpm高速匀化,形成油包水乳液,即分别制得六种不同的新冠病毒广谱性中和表位的抗原。
186.b.制作新冠病毒广谱性中和表位组合式复合抗原
187.将按以上方法制成的六种不同的新冠病毒广谱性中和表位抗原成份任意分为两组,第一组(a组)可由以下三种新冠病毒广谱性中和表位抗原成份组成:(1)新冠病毒rbd侧面的保守性区域抗原成份、(2)新冠病毒亚基七肽重复区(hr)结构域抗原成份、(3)s309抗体结合的新冠病毒s1表位抗原成份;第二组(b组)可由以下三种新冠病毒广谱性中和表位抗原成份组成:(4)新冠病毒n末端结构域抗原成份、(5)新冠病毒的n蛋白、(6)新冠病毒m蛋白,两组均可任意组合;然后,每组先分别按1
‑
10:1
‑
10:1
‑
10比例(通常为1:1:1)混合均匀制成两组新冠病毒广谱性中和表位组合式复合抗原成份,再分别按1
‑
10:1
‑
10比例(通常为1:1)在新冠病毒广谱性中和表位组合式复合抗原成份中加入福氏佐剂或其它佐剂,置入高速匀浆器以30,000rpm高速匀化,形成油包水乳液,即制得两组新冠病毒广谱性中和表位组合式复合抗原。
188.c.制作两种新冠病毒广谱性中和表位复合抗原
189.将按以上方法制成的六种不同的新冠病毒广谱性中和表位的抗原成份:(1)新冠病毒rbd侧面的保守性区域抗原成份、(2)新冠病毒亚基七肽重复区(hr)结构域抗原成份、(3)s309抗体结合的新冠病毒s1表位抗原成份、(4)新冠病毒n末端结构域(ntd)抗原成份、(5)新冠病毒的n蛋白、(6)新冠病毒m蛋白,按1
‑
10:1
‑
10:1
‑
10:1
‑
10:1
‑
10:1
‑
10比例(通常为1:1:1:1:1:1)混合均匀制成新冠病毒广谱性中和表位的复合抗原成份,再按1
‑
10:1
‑
10比例(通常为1:1)在新冠病毒广谱性中和表位复合抗原成份中加入福氏佐剂或其它佐剂,置入高速匀浆器以30,000rpm高速匀化,形成油包水乳液,即制得一种综合型新冠病毒广谱性中和表位复合抗原。
190.实际应用中,也可将六种不同的新冠病毒广谱性中和表位的抗原成份中的其中一种与其它1
‑
5种新冠病毒广谱性中和表位的抗原成份按任意比例混合制成新冠病毒广谱性中和表位复合抗原成份,然后再按1
‑
10:1
‑
10比例(通常为1:1)与福氏佐剂或其它佐剂混合,置入高速匀浆器以30,000rpm高速匀化,形成油包水乳液,即制得另一种复配型新冠病毒广谱性中和表位复合抗原。
191.(二)制备抗广谱性中和表位抗原的免疫蛋
192.本发明可选用任何产蛋禽类(包括鸡、鸵鸟、鸭、鹅)免疫制备免疫蛋,限于篇幅仅
以母鸡为例说明,其它禽类完全可依下文所述方法同样进行。
193.分别采用前面方法制备的六种单一的新冠病毒广谱性中和表位抗原和两种新冠病毒广谱性中和表位组合式复合抗原以及两种新冠病毒广谱性中和表位复合抗原免疫产蛋鸡,每隔两周注射一次,共注射2
‑
5次,最后一次注射后的至少第12天后检取产蛋鸡所产免疫蛋,并进行编码标记,得到六种抗不同的新冠病毒广谱性中和表位抗原的免疫蛋和两种抗新冠病毒广谱性中和表位组合式复合抗原的免疫蛋以及两种抗新冠病毒广谱性中和表位复合抗原的免疫蛋。
194.(三)制备广谱抗变异新冠病毒igy抗体粗提物
195.采用纯水提取法、氯仿萃取法、冷乙醇沉淀法或硫酸铵沉淀法制备广谱抗变异新冠病毒igy抗体粗提物。本发明以纯水提取法为例说明,其他制备方法参照常规方法操作,具体操作过程,这里就不赘述。
196.纯水提取法制备广谱抗变异新冠病毒igy抗体粗提物。的具体操作方法如下:
197.把所制备的十种广谱抗变异新冠病毒igy免疫蛋分别用流动水洗净,酒精擦洗消毒,再用打蛋机分别打碎十种广谱抗变异新冠病毒igy免疫蛋,采用蛋黄筛筛滤去蛋清,留下蛋黄,搅拌均匀;再按蛋黄液体积的3
‑
8倍加入蒸馏水,进行稀释并混合均匀,用1.0n hci溶液调ph至5.5
‑
6.5;将调好ph值的稀释液进一步充分搅拌均匀,然后将其冷却至2
‑
6℃,静置12小时
‑
24小时;将稀释液于高速离心;取分离所得的上清液置超滤器中进行超滤浓缩10
‑
20倍;继而加入浓度为1.0
‑
3.0%的海藻酸钠液,缓慢添加海藻酸钠液至终浓度为0.1
‑
0.2%,搅拌至出现浑浊;再加入1.0
‑
3.0%cacl2液,至终浓度为0.1
‑
0.2%,搅拌均匀,3
‑
4℃静置8
‑
12小时;高速离心并取上清液,得到十种广谱抗变异新冠病毒igy粗提物。
198.分别是:
199.1.抗新冠病毒rbd侧面的保守性区域抗原igy
200.2.抗新冠病毒亚基七肽重复区(hr)结构域抗原igy
201.3.抗s309抗体结合的新冠病毒s1表位抗原igy
202.4.抗新冠病毒n末端结构域抗原(ntd)igy
203.5.抗新冠病毒的n蛋白igy
204.6.抗新冠病毒m蛋白igy
205.7.抗新冠病毒广谱性中和表位组合式复合抗原a
‑
igy
206.8.抗新冠病毒广谱性中和表位组合式复合抗原b
‑
igy
207.9.抗新冠病毒广谱性中和表位综合型复合抗原igy
208.10.抗新冠病毒广谱性中和表位复配型复合抗原igy
209.(四)制备广谱抗变异新冠病毒纯igy溶液或干粉
210.将制得的十种广谱抗变异新冠病毒igy粗提物溶解于ph7.0、0.01mol/l的m pb磷酸盐缓冲液中,再先后分别过离子交换柱和凝胶层析柱或者亲和层析柱层析,得到广谱抗变异新冠病毒纯igy溶液。广谱抗变异新冠病毒纯igy溶液经过冷冻干燥或中低温喷雾干燥或者流化床干燥以及其他不影响抗体活性的干燥方式制得十种广谱抗变异新冠病毒纯igy干粉。
211.分别是:
212.1.抗新冠病毒rbd侧面的保守性区域抗原纯igy溶液或干粉
213.2.抗新冠病毒亚基七肽重复区(hr)结构域抗原纯igy溶液或干粉
214.3.抗s309抗体结合的新冠病毒s1表位抗原纯igy溶液或干粉
215.4.抗新冠病毒n末端结构域抗原(ntd)纯igy溶液或干粉
216.5.抗新冠病毒的n蛋白纯igy溶液或干粉
217.6.抗新冠病毒m蛋白纯igy溶液或干粉
218.7.抗新冠病毒广谱性中和表位组合式复合抗原a纯igy溶液或干粉
219.8.抗新冠病毒广谱性中和表位组合式复合抗原b纯igy溶液或干粉
220.9.抗新冠病毒广谱性中和表位综合型复合抗原纯igy溶液或干粉
221.10.抗新冠病毒广谱性中和表位复配型复合抗原纯igy溶液或干粉
222.二、抗突变新冠病毒igy的制备
223.考虑到新冠病毒的高突变性,即使是能识别保守表位的抗体也无法识别所有突变新冠病毒。特别是,欧洲最近发现的n501y和南非近期发现的de484k两种变异新冠病毒产生突变的部位都是新冠病毒与人类细胞结合的关键表位,这将使之前研发的抗体药的实际效果受到很大影响。因此,要彻底解决新冠病毒易突变而影响疗效的难题,必须针对当前出现的关键抗原位点的突变,研制相应的几种抗突变新冠病毒igy。本发明以g614、n510k、de484k为例说明,其它今后出现的关键表位突变的新冠病毒可参照这三种关键表位突变的的新冠病毒,制作相应的抗体来对付。具体过程不赘述。
224.(一)制备抗新冠病毒g614
‑
igy
225.d614g变异株新冠病毒可以增强s蛋白与人体细胞ace2受体的结合力,从而大大增加新冠病毒的传染性;同时,会在一定程度上影响针对该病毒峰值蛋白的治疗药物的有效性。
226.目前,分子流行病学抽样调研发现,d614g变异株已占全球新冠病毒发病的70%以上,成为最主要的新冠流行毒株。为了对付d614g变异株的大流行,本发明研制一种专门
227.对付d614新冠病毒之突变s1(g614)igy,具体做法如下:
228.1.采用真核表达系统制备目前流行的新冠病毒突变g614重组蛋白抗原成份
229.(1)从gisaid公布的hcov
‑
19/usa/wy
‑
wyphl
‑
00088/2020的s1 g614基因序列中获取新冠病毒之突变s1(g614)基因序列
230.atgtttgtttttcttgttttattgccactagtctctagtcagtgtgttaatcttacaaccagaactcaattaccccctgcatacactaattctttcacacgtggtgtttattaccctgacaaagttttcagatcctcagttttacattcaactcaggacttgttcttacctttcttttccaatgttacttggttccatgctatacatgtctctgggaccaatggtactaagaggtttgataaccctgtcctaccatttaatgatggtgtttattttgcttccactgagaagtctaacataataagaggctggatttttggtactactttagattcgaagacccagtccctacttattgttaataacgctactaatgttgttattaaagtctgtgaatttcaattttgtaatgatccatttttgggtgtttattaccacaaaaacaacaaaagttggatggaaagtgagttcagagtttattctagtgcgaataattgcacttttgaatatgtctctcagccttttcttatggaccttgaaggaaaacagggtaatttcaaaaatcttagggaatttgtgtttaagaatattgatggttattttaaaatatattctaagcacacgcctattaatttagtgcgtgatctccctcagggtttttcggctttagaaccattggtagatttgccaataggtattaacatcactaggtttcaaactttacttgctttacatagaagttatttgactcctggtgattcttcttcaggttggacagctggtgctgcagcttattatgtgggttatcttcaacctaggacttttctattaaaatataatgaaaatggaaccattacagatgctgtagactgtgcacttgaccctctctcagaaacaaagtgtacgttgaaatcct
tcactgtagaaaaaggaatctatcaaacttctaactttagagtccaaccaacagaatctattgttagatttcctaatattacaaacttgtgcccttttggtgaagtttttaacgccaccagatttgcatctgtttatgcttggaacaggaagagaatcagcaactgtgttgctgattattctgtcctatataattccgcatcattttccacttttaagtgttatggagtgtctcctactaaattaaatgatctctgctttactaatgtctatgcagattcatttgtaattagaggtgatgaagtcagacaaatcgctccagggcaaactggaaagattgctgattataattataaattaccagatgattttacaggctgcgttatagcttggaattctaacaatcttgattctaaggttggtggtaattataattacctgtatagattgtttaggaagtctaatctcaaaccttttgagagagatatttcaactgaaatctatcaggccggtagcacaccttgtaatggtgttgaaggttttaattgttactttcctttacaatcatatggtttccaacccactaatggtgttggttaccaaccatacagagtagtagtactttcttttgaacttctacatgcaccagcaactgtttgtggacctaaaaagtctactaatttggttaaaaacaaatgtgtcaatttcaacttcaatggtttaacaggcacaggtgttcttactgagtctaacaaaaagtttctgcctttccaacaatttggcagagacattgctgacactactgatgctgtccgtgatccacagacacttgagattcttgacattacaccatgttcttttggtggtgtcagtgttataacaccaggaacaaatacttctaaccaggttgctgttctttatcagggtgttaactgcacagaagtccctgttgctattcatgcagatcaacttactcctacttggcgtgtttattctacaggttctaatgtttttcaaacacgtgcaggctgtttaataggggctgaacatgtcaacaactcatatgagtgtgacatacccattggtgcaggtatatgcgctagttatcagactcagactaattctcctcggcgggcacgtagtgtagctagtcaatccatcattgcctacactatgtcacttggtgcagaaaattcagttgcttactctaataactctattgccatacccacaaattttactattagtgttaccacagaaattctaccagtgtctatgaccaagacatcagtagattgtacaatgtacatttgtggtgattcaactgaatgcagcaatcttttgttgcaatatggcagtttttgtacacaattaaaccgtgctttaactggaatagctgttgaacaagacaaaaacacccaagaagtttttgcacaagtcaaacaaatttacaaaacaccaccaattaaagattttggtggttttaatttttcacaaatattaccagatccatcaaaaccaagcaagaggtcatttattgaagatctacttttcaacaaagtgacacttgcagatgctggcttcatcaaacaatatggtgattgccttggtgatattgctgctagagacctcatttgtgcacaaaagtttaacggccttactgttttgccacctttgctcacagatgaaatgattgctcaatacacttctgcactgttagcgggtacaatcacttctggttggacctttggtgcaggtgctgcattacaaataccatttgctatgcaaatggcttataggtttaatggtattggagttacacagaatgttctctatgagaaccaaaaattgattgccaaccaatttaatagtgctattggcaaaattcaagactcactttcttccacagcaagtgcacttggaaaacttcaagatgtggtcaaccaaaatgcacaagctttaaacacgcttgttaaacaacttagctccaattttggtgcaatttcaagtgttttaaatgatatcctttcacgtcttgacaaagttgaggctgaagtgcaaattgataggttgatcacaggcagacttcaaagtttgcagacatatgtgactcaacaattaattagagctgcagaaatcagagcttctgctaatcttgctgctactaaaatgtcagagtgtgtacttggacaatcaaaaagagttgatttttgtggaaagggctatcatcttatgtccttccctcagtcagcacctcatggtgtagtcttcttgcatgtgacttatgtccctgcacaagaaaagaacttcacaactgctcctgccatttgtcatgatggaaaagcacactttcctcgtgaaggtgtctttgtttcaaatggcacacactggtttgtaacacaaaggaatttttatgaaccacaaatcattactacagacaacacatttgtgtctggtaactgtgatgttgtaataggaattgtcaacaacacagtttatgatcctttgcaacctgaattagactcattcaaggaggagttagataaatattttaagaatcatacatcaccagatgttgatttaggtgacatctctggcattaatgcttcagttgtaaacattcaaaaagaaattgaccgcctcaatgaggttgccaagaatttaaatgaatctctcatcgatctccaagaacttggaaagtatgagcagtatataaaatggccatggtacatttggctaggttttatagctggcttgattgccatagtaatggtgacaattatgctttgctgtatgaccagttgctgtagttgtctcaagggctgttgttcttgtggatcctgctgcaaatttgatgaagacgactctgagccagtgctcaaaggagtcaaattacattacacataa
231.(2)大肠杆菌密码子优化人工合成
232.根据gisaid公布的hcov
‑
19/usa/wy
‑
wyphl
‑
00088/2020的s1 g614基因序列做大肠杆菌密码子优化并人工合成,5
′
端引入bglⅱ酶切位点,3
′
端引入xhoⅰ酶切位点。
233.(3)连接与转化
234.s1 g614的基因用bglⅱ和xhoⅰ37℃双酶切过夜,载体pgex
‑
4t
‑
1用bamhⅰ和xhoⅰ37℃双酶切过夜,酶切后的目的基因和载体分别经琼脂糖凝胶电泳后割胶纯化回收;将回收的目的基因与载体以摩尔比5∶1的比例混合,16℃连接过夜,构建含有目的基因的重组质粒pgex
‑
4t
‑1‑
s1 g614,转化大肠杆菌dh5。
235.(4)重组质粒pgex
‑
4t
‑1‑
s1 g614的筛选与鉴定
236.挑取单个菌落于含50mg/l氨苄青霉素的lb培养基中37℃培养过夜后,小提质粒,以p3/p4为引物,以抽提的质粒为模板进行pcr反应鉴定,将扩增出目的基因的重组质粒进行测序,测序结果与gisaid数据库中公布的序列以blast进行比较,挑取结果完全一致的菌株培养并保藏。
237.(5)sds
‑
page分析s1 g614蛋白的表达
238.经dna测序验证的重组质粒转化大肠杆菌bl21(de3),挑取含重组原核表达载体的单个菌落接种于含50mg/l氨苄青霉素的lb培养基,37℃培养过夜后,按1%接种于新鲜的lb培养基(含50mg/l氨苄青霉素),37℃继续培养至od600约为1.0时,加入乳糖至终浓度为1g/l诱导9h,每隔1h取1ml菌液作全菌sds2page电泳,考马斯亮蓝r2250染色。当诱导重组蛋白达到最佳表达时间后收菌,4℃、10000r/m离心10min,弃上清液。菌体沉淀用适量谷氨酰转肽酶裂解缓冲液重悬后,超声破碎菌体,4℃、12000r/m离心15min,分别取上清液和沉淀留样电泳。电泳结果和s1 g614蛋白gisaid数据库中公布蛋白大小及gst标签融合和切除的蛋白大小比较。
239.(6)western blot鉴定s1 g614目的蛋白
240.将诱导表达的产物先行sds
‑
page,然后以半干法电转移至硝酸纤维素膜上,取下硝酸纤维素膜tbs短暂漂洗后经5%光明脱脂奶粉室温封闭1h,tbst漂洗3次后,与gst tag单抗孵育过夜,次日tbst漂洗3次后,与irdye800标记的羊抗鼠igg孵育1h,最后tbst3次洗膜经odyssey红外激光成像系统扫描实验果。通过和s1 g614抗体的特异结合,来鉴定s1 g614基因在pgex
‑
4t
‑
1表达的重组蛋白是目的s1 g614蛋白。
241.s1 g614重组目蛋白表达的sds
‑
page和western blot鉴定试验重复三次,表明表达和生产s1 g614重组蛋白抗原是正确的。
242.2.制作携带g614突变s1重组蛋白抗原
243.将所制得的新冠病毒突变g614重组蛋白抗原成份按1
‑
10:1
‑
10比例(通常为1:1)加入福氏佐剂或其它佐剂,置入高速匀浆器以30,000rpm高速匀化,形成油包水乳液,即制得单一的携带g614突变s1重组蛋白抗原。
244.3.制备抗新冠病毒突变g614表位抗原的免疫蛋
245.本发明可选用任何产蛋禽类(包括鸡、鸵鸟、鸭、鹅)免疫制备免疫蛋,限于篇幅仅以母鸡为例说明,其它禽类完全可依下文所述方法同样进行。
246.采用制备的携带g614突变s1重组蛋白抗原免疫产蛋鸡,每隔两周注射一次,共注射2
‑
5次,最后一次注射后的至少第12天后检取产蛋鸡所产免疫蛋,编码标记,得到抗新冠病毒突变g614表位抗原的免疫蛋。
gattgctgat
263.1261 tataattata aattaccaga tgattttaca ggctgcgtta tagcttggaa ttctaacaat
264.1321 cttgattcta aggttggtgg taattataat tacctgtata gattgtttag gaagtctaat
265.1381 ctcaaacctt ttgagagaga tatttcaact gaaatctatc aggccggtag cacaccttgt
266.1441 aatggtgttg aaggttttaa ttgttacttt cctttacaat catatggttt ccaacccact
267.1501 aatggtgttg gttaccaacc atacagagta gtagtacttt cttttgaact tctacatgca
268.1561 ccagcaactg tttgtggacc taaaaagtct actaatttgg ttaaaaacaa atgtgtcaat
269.1621 ttc
270.(2)大肠杆菌密码子优化人工合成
271.根据n501y基因序列做大肠杆菌密码子优化并人工合成,5
′
端引入bglⅱ酶切位点,3
′
端引入xhoⅰ酶切位点。
272.(3)连接与转化
273.n501y的基因用bglⅱ和xhoⅰ37℃双酶切过夜,载体pgex
‑
4t
‑
1用bamhⅰ和xhoⅰ37℃双酶切过夜,酶切后的目的基因和载体分别经琼脂糖凝胶电泳后割胶纯化回收;将回收的目的基因与载体以摩尔比5∶1的比例混合,16℃连接过夜,构建含有目的基因的重组质粒,转化大肠杆菌dh5。
274.(4)重组质粒的筛选与鉴定
275.挑取单个菌落于含50mg/l氨苄青霉素的lb培养基中37℃培养过夜后,小提质粒,以p3/p4为引物,以抽提的质粒为模板进行pcr反应鉴定,将扩增出目的基因的重组质粒进行测序,测序结果与gisaid数据库中公布的序列以blast进行比较,挑取结果完全一致的菌株培养并保藏。
276.(5)sds
‑
page分析n501y基因蛋白的表达
277.经dna测序验证的重组质粒转化大肠杆菌bl21(de3),挑取含重组原核表达载体的单个菌落接种于含50mg/l氨苄青霉素的lb培养基,37℃培养过夜后,按1%接种于新鲜的lb培养基(含50mg/l氨苄青霉素),37℃继续培养至od600约为1.0时,加入乳糖至终浓度为1g/l诱导9h,每隔1h取1ml菌液作全菌sds2page电泳,考马斯亮蓝r2250染色。当诱导重组蛋白达到最佳表达时间后收菌,4℃、10000r/m离心10min,弃上清液。菌体沉淀用适量谷氨酰转肽酶裂解缓冲液重悬后,超声破碎菌体,4℃、12000r/m离心15min,分别取上清液和沉淀留样电泳。电泳结果和gisaid数据库中公布蛋白大小及gst标签融合和切除的蛋白大小比较。
278.(6)western blot鉴定n501y目的蛋白
279.将诱导表达的产物先行sds
‑
page,然后以半干法电转移至硝酸纤维素膜上,取下硝酸纤维素膜tbs短暂漂洗后经5%光明脱脂奶粉室温封闭1h,tbst漂洗3次后,与gst tag单抗孵育过夜,次日tbst漂洗3次后,与irdye800标记的羊抗鼠igg孵育1h,最后tbst3次洗
膜经odyssey红外激光成像系统扫描实验果。通过和s1 g614抗体的特异结合,来鉴定n501y基因在pgex
‑
4t
‑
1表达的重组蛋白是目的n501y蛋白。
280.s1 n501y重组目的蛋白表达的sds
‑
page和western blot鉴定试验重复三次,表明表达和生产n501y重组蛋白抗原是正确的。
281.2.制作n501y重组蛋白抗原
282.将所制得的新冠病毒n501y重组蛋白抗原成份按1
‑
10:1
‑
10比例(通常为1:1)加入福氏佐剂或其它佐剂,置入高速匀浆器以30,000rpm高速匀化,形成油包水乳液,即制得n501y重组蛋白抗原。
283.3.制备抗新冠病毒n501y变异表位抗原的免疫蛋
284.本发明可选用任何产蛋禽类(包括鸡、鸵鸟、鸭、鹅)免疫制备免疫蛋,限于篇幅仅以母鸡为例说明,其它禽类完全可依下文所述方法同样进行。
285.采用制备的n501y变异表位抗原免疫产蛋鸡,每隔两周注射一次,共注射2
‑
5次,最后一次注射后的至少第12天后检取产蛋鸡所产免疫蛋,编码标记,得到抗新冠病毒n501y突变表位抗原的免疫蛋。
286.4.制备抗新冠病毒n501y变异表位抗原igy抗体粗提物
287.采用纯水提取法、氯仿萃取法、冷乙醇沉淀法或硫酸铵沉淀法制备抗新冠病毒n501y突变表位抗原igy抗体粗提物。本发明以纯水提取法为例说明,其他制备方法参照常规方法操作,具体操作过程,这里就不赘述。
288.纯水提取法制备抗新冠病毒n501y变异表位抗原igy抗体粗提物。的具体操作方法如下:
289.把所制备的抗新冠病毒n501y变异表位抗原的免疫蛋用流动水洗净,酒精擦洗消毒,再用打蛋机打碎免疫蛋,采用蛋黄筛筛滤去蛋清,留下蛋黄,搅拌均匀;再按蛋黄液体积的3
‑
8倍加入蒸馏水,进行稀释并混合均匀,用1.0n hci溶液调ph至5.5
‑
6.5;将调好ph值的稀释液进一步充分搅拌均匀,然后将其冷却至2
‑
6℃,静置12小时
‑
24小时;将稀释液于高速离心;取分离所得的上清液置超滤器中进行超滤浓缩10
‑
20倍;继而加入浓度为1.0
‑
3.0%的海藻酸钠液,缓慢添加海藻酸钠液至终浓度为0.1
‑
0.2%,搅拌至出现浑浊;再加入1.0
‑
3.0%cacl2液,至终浓度为0.1
‑
0.2%,搅拌均匀,3
‑
4℃静置8
‑
12小时;高速离心并取上清液,得到抗新冠病毒n501y变异表位抗原igy抗体粗提物。
290.5.制备抗新冠病毒n501y变异表位抗原纯igy溶液或干粉
291.将制得的抗新冠病毒n501y变异表位抗原igy抗体粗提物溶解于ph7.0、0.01mol/l的m pb磷酸盐缓冲液中,再先后分别过离子交换柱和凝胶层析柱或者亲和层析柱层析,得到抗新冠病毒突变g614表位抗原纯igy溶液。再经过冷冻干燥或中低温喷雾干燥或者流化床干燥以及其他不影响抗体活性的干燥方式制得抗新冠病毒n501y变异表位抗原纯igy干粉。
292.(三)制备抗新冠病毒de484k
‑
igy
293.南非最近新发现的变异毒株比英国早前发现的n501y新冠病毒变异株更容易传播。
294.这种新变异体和造成英国本土疫情突然紧张的英国新冠变异病毒比起来,突变得更多,更具传染性,其传染性增加了40%
‑
70%,传播指数增加0.4,达到了1.5
‑
1.7之间。特
别是,对年轻人影响更大,对疫苗耐药性也稍强。
295.本发明针对de484k这个新冠病毒与人类细胞结合的关键表位之突变位点,研制一种抗新冠病毒de484k
‑
igy。具体操作如下:
296.具体操作如下:
297.1.采用真核表达系统制备新冠病毒变异抗原表位de484k抗原成份
298.(1)从genbank中获取新冠病毒变异抗原表位de484k基因序列
299.agtc
300.961 caaccaacag aatctattgt tagatttcct aatattacaa acttgtgccc ttttggtgaa
301.1021 gtttttaacg ccaccagatt tgcatctgtt tatgcttgga acaggaagag aatcagcaac
302.1081 tgtgttgctg attattctgt cctatataat tccgcatcat tttccacttt taagtgttat
303.1141 ggagtgtctc ctactaaatt aaatgatctc tgctttacta atgtctatgc agattcattt
304.1201 gtaattagag gtgatgaagt cagacaaatc gctccagggc aaactggaaa gattgctgat
305.1261 tataattata aattaccaga tgattttaca ggctgcgtta tagcttggaa ttctaacaat
306.1321 cttgattcta aggttggtgg taattataat tacctgtata gattgtttag gaagtctaat
307.1381 ctcaaacctt ttgagagaga tatttcaact gaaatctatc aggccggtag cacaccttgt
308.1441 aatggtgtta aaggttttaa ttgttacttt cctttacaat catatggttt ccaacccact
309.1501 aatggtgttg gttaccaacc atacagagta gtagtacttt cttttgaact tctacatgca
310.1561 ccagcaactg tttgtggacc taaaaagtct actaatttgg ttaaaaacaa atgtgtcaat
311.1621 ttc
312.(2)大肠杆菌密码子优化人工合成
313.根据gisaid公布的hcov
‑
19/usa/wy
‑
wyphl
‑
00088/2020的de484k基因序列做大肠杆菌密码子优化并人工合成,5
′
端引入bglⅱ酶切位点,3
′
端引入xhoⅰ酶切位点。
314.(3)连接与转化
315.de484k的基因用bglⅱ和xhoⅰ37℃双酶切过夜,载体pgex
‑
4t
‑
1用bamhⅰ和xhoⅰ37℃双酶切过夜,酶切后的目的基因和载体分别经琼脂糖凝胶电泳后割胶纯化回收;将回收的目的基因与载体以摩尔比5∶1的比例混合,16℃连接过夜,构建含有目的基因的重组质粒pgex
‑
4t
‑1‑
de484k,转化大肠杆菌dh5。
316.(4)重组质粒pgex
‑
4t
‑1‑
de484k的筛选与鉴定
317.挑取单个菌落于含50mg/l氨苄青霉素的lb培养基中37℃培养过夜后,小提质粒,
以p3/p4为引物,以抽提的质粒为模板进行pcr反应鉴定,将扩增出目的基因的重组质粒进行测序,测序结果与gisaid数据库中公布的序列以blast进行比较,挑取结果完全一致的菌株培养并保藏。
318.(5)sds
‑
page分析de484k蛋白的表达
319.经dna测序验证的重组质粒转化大肠杆菌bl21(de3),挑取含重组原核表达载体的单个菌落接种于含50mg/l氨苄青霉素的lb培养基,37℃培养过夜后,按1%接种于新鲜的lb培养基(含50mg/l氨苄青霉素),37℃继续培养至od600约为1.0时,加入乳糖至终浓度为1g/l诱导9h,每隔1h取1ml菌液作全菌sds2page电泳,考马斯亮蓝r2250染色。当诱导重组蛋白达到最佳表达时间后收菌,4℃、10000r/m离心10min,弃上清液。菌体沉淀用适量谷氨酰转肽酶裂解缓冲液重悬后,超声破碎菌体,4℃、12000r/m离心15min,分别取上清液和沉淀留样电泳。电泳结果和de484k蛋白gisaid数据库中公布蛋白大小及gst标签融合和切除的蛋白大小比较。
320.(6)western blot鉴定de484k目的蛋白
321.将诱导表达的产物先行sds
‑
page,然后以半干法电转移至硝酸纤维素膜上,取下硝酸纤维素膜tbs短暂漂洗后经5%光明脱脂奶粉室温封闭1h,tbst漂洗3次后,与gst tag单抗孵育过夜,次日tbst漂洗3次后,与irdye800标记的羊抗鼠igg孵育1h,最后tbst3次洗膜经odyssey红外激光成像系统扫描实验果。通过和de484k单抗的特异结合,来鉴定de484k基因在pgex
‑
4t
‑
1表达的重组蛋白是目的de484k蛋白。
322.de484k重组目蛋白表达的sds
‑
page和western blot鉴定试验重复三次,表明表达和生产de484k重组蛋白抗原是正确的。
323.2.制作de484k重组蛋白抗原
324.将所制得的新冠病毒de484k重组蛋白抗原成份按1
‑
10:1
‑
10比例(通常为1:1)加入福氏佐剂或其它佐剂,置入高速匀浆器以30,000rpm高速匀化,形成油包水乳液,即制得de484k重组蛋白抗原。
325.3.制备抗新冠病毒de484k变异表位抗原的免疫蛋
326.本发明可选用任何产蛋禽类(包括鸡、鸵鸟、鸭、鹅)免疫制备免疫蛋,限于篇幅仅以母鸡为例说明,其它禽类完全可依下文所述方法同样进行。
327.采用制备的de484k突变表位抗原免疫产蛋鸡,每隔两周注射一次,共注射2
‑
5次,最后一次注射后的至少第12天后检取产蛋鸡所产免疫蛋,编码标记,得到抗新冠病毒de484k变异表位抗原的免疫蛋。
328.4.制备抗新冠病毒de484k变异表位抗原igy抗体粗提物
329.采用纯水提取法、氯仿萃取法、冷乙醇沉淀法或硫酸铵沉淀法制备抗新冠病de484k突变表位抗原igy抗体粗提物。本发明以纯水提取法为例说明,其他制备方法参照常规方法操作,具体操作过程,这里就不赘述。
330.纯水提取法制备抗新冠病毒de484k变异表位抗原igy抗体粗提物。的具体操作方法如下:
331.把所制备的抗新冠病毒de484k变异表位抗原的免疫蛋用流动水洗净,酒精擦洗消毒,再用打蛋机打碎免疫蛋,采用蛋黄筛筛滤去蛋清,留下蛋黄,搅拌均匀;再按蛋黄液体积的3
‑
8倍加入蒸馏水,进行稀释并混合均匀,用1.0n hci溶液调ph至5.5
‑
6.5;将调好ph值的
稀释液进一步充分搅拌均匀,然后将其冷却至2
‑
6℃,静置12小时
‑
24小时;将稀释液于高速离心;取分离所得的上清液置超滤器中进行超滤浓缩10
‑
20倍;继而加入浓度为1.0
‑
3.0%的海藻酸钠液,缓慢添加海藻酸钠液至终浓度为0.1
‑
0.2%,搅拌至出现浑浊;再加入1.0
‑
3.0%cacl2液,至终浓度为0.1
‑
0.2%,搅拌均匀,3
‑
4℃静置8
‑
12小时;高速离心并取上清液,得到抗新冠病毒de484k变异表位抗原igy抗体粗提物。
332.5.制备抗新冠病毒de484k变异表位抗原纯igy溶液或干粉
333.将制得的抗新冠病毒de484k变异表位抗原igy抗体粗提物溶解于ph7.0、0.01mol/l的m pb磷酸盐缓冲液中,再先后分别过离子交换柱和凝胶层析柱或者亲和层析柱层析,得到抗新冠病毒突变de484k表位抗原纯igy溶液。再经过冷冻干燥或中低温喷雾干燥或者流化床干燥以及其他不影响抗体活性的干燥方式制得抗新冠病毒de484k变异表位抗原纯igy干粉。
334.三、广谱抗变异新冠病毒复合抗体的制备
335.将几种不同功能和特点的抗体混合组成复合抗体,结合不同抗体的协同作用达到最佳的广谱抗变异效果。
336.联合用药,既可有效避免病毒的逃逸突变,还可防止病毒变异导致的药效减弱或消失。
337.使用多种个抗体组合的另一优势是它们往往有协同效应,也就是说,它们产生中和作用的总剂量要比其中任何一个抗体药单独使用的剂量低。例如,16ng/ml的cov2
‑
2196和63ng/ml的cov2
‑
2130联合用药取得的中和活性相当于每个抗体单独用药在250ng/ml剂量上得到的活性。由此可见,联合用药使同效剂量降低了3倍,即这种协同效应反而降低了抗体药的成本。
338.本发明采用以下两种抗体复合:
339.(一)广谱抗变异新冠病毒igy与抗突变新冠病毒igy组合:
340.将广谱抗变异新冠病毒igy与抗当前流行的突变新冠病毒igy组合起来,进一步强化对传染性超强的变异新冠病毒的抑灭作用。具体操作如下:
341.将前面制备的十种广谱抗变异新冠病毒igy溶液或干粉任意组合按一定比例与前面制备的三种抗突变新冠病毒igy混合,充分搅拌均匀,即制成广谱抗变异新冠病毒复合igy抗体溶液或干粉。
342.(二)广谱抗变异新冠病毒igy与抗突变新冠病毒igy以及抗新冠病毒纳米抗体组合:
343.纳米抗体是一种新型抗体,与普通抗体相比较特异性更高,亲和力以及结合抗原的能力更强;鉴于纳米抗体呈椭圆形、体积小,相对分子质量仅为单克隆抗体的1/10,因而还具有较强的组织穿透能力。本发明将广谱抗变异新冠病毒igy与抗突变新冠病毒igy复合,再与抗新冠病毒纳米抗体组合起来,制成一种混合型广谱抗变异新冠病毒复合抗体,结合了igy抗体和纳米抗体各自的优势,使疗效进一步提高。
344.四、广谱抗变异新冠病毒igy组合制剂及其预期功效
345.本发明提供了上述的广谱抗变异新冠病毒igy与抗突变新冠病毒igy以及抗新冠病毒纳米抗体及其组合在制备用于防治新冠病毒感染和新冠肺炎的药物、消毒产品、保健品或医疗器械中的应用。
346.本发明还提供了一种组合物,包括了上述的广谱抗变异新冠病毒igy与抗突变新冠病毒igy以及抗新冠病毒纳米抗体及其组合溶液或干粉以及至少一种其它药学上可接受的组分。
347.在本发明的组合物中,所述广谱抗变异新冠病毒igy与抗突变新冠病毒igy以及抗新冠病毒纳米抗体及其组合溶液或干粉添加辅料或基料或者化学药、中药,制成雾化吸入疗法的雾化剂、超声雾化除空气新冠病毒溶剂、喷雾剂、口喷剂、鼻喷剂、滴鼻剂、滴眼剂、雾化剂、中央空调雾化加湿填充剂、空气消毒剂、室内外消毒剂、外包装喷雾消毒剂、洗手液、粉剂、片剂、口含片、口服液、口服剂、胶囊剂中的至少一种。
348.本发明还提供了上述的组合物在制备用于防治新冠病毒感染和新冠肺炎的药物、消毒产品、保健品或医疗器械中的应用。
349.如上所叙,可将所制备的广谱抗变异新冠病毒igy与抗突变新冠病毒igy以及抗新冠病毒纳米抗体及其组合溶液或干粉制成各种稳定制剂。所述制剂包括但不限于这些制剂:
350.优选地,该制剂还包括赋形剂、填充剂、溶剂、助溶剂、表面活性剂和胶囊辅料中一种或多种。
351.优选地,该制剂为雾化吸入预防感染和治疗的雾化剂、空气除新冠病毒剂、消毒剂、消毒液、洗手液等。
352.优选地,该制剂为片剂、喷雾剂、粉剂、液剂或胶囊。
353.实施本发明的广谱抗变异新冠病毒igy与抗突变新冠病毒igy以及抗新冠病毒纳米抗体及其组合应用于防治新冠病毒感染和新冠肺炎,具有以下有益效果:一、本发明充分利用了igy抗体可以和较多的抗原作用位点结合的特点,研制结合多个保守性强的表位抗原的广谱抗变异新冠病毒igy,解决新冠病毒易变异以及“免疫逃逸”造成的难题。二、研制抗突变新冠病毒igy,专门对付关键表位突变的新冠病毒变异株,以解决这种传染性特强的变异新冠病毒大流行的问题。三、本发明的广谱抗变异新冠病毒igy与抗突变新冠病毒igy以及抗新冠病毒纳米抗体及其组合除了可制成各种制剂用于防治新冠病毒感染和新冠肺炎外,还特别的可用于中央空调杀灭新冠病毒、净化空气。具体做法是将这种广谱抗变异新冠病毒igy或复合igy按一定比例添加到中央空调加湿器的水中,充分搅拌均匀,再经过雾化后与空调新风混合输送入室内。这样,一方面,室内的人就不会被室内可能散布的新冠病毒感染了;另一方面,空调系统排放到室外的空气中也就不会残留新冠病毒了;从而,既有效防止室内的人感染新冠病毒,又避免了空调废气将新冠病毒排放到室外空间而造成疫情扩散。由于igy是国际公认的天然安全物质,美国食品医药管理局(fda)已将igy列入「一般公认安全物质(generally accepted as safe,gras)」范畴,人体吸入igy不但没有任何毒副作用,而且,鉴于igy是一种天然成份的免疫球蛋白,吸入体内还能增强免疫力;这是酒精和其它化学消毒剂完全不可相提并论的。值得高度重视的是:我国这次再度出现零散疫情,其中有不少就是由于国际机场的空调排气系统将海外旅客呼出的毒株播撒到机场周边村庄或住宅而酿成的。在所有机场特别是国际机场采用本发明的广谱抗变异新冠病毒复合igy或复合igy的雾化剂杀灭空气中散布的新冠病毒、彻底净化机场内空气,是阻断海外流行的传染性更强的新冠病毒在我国传播,杜绝这种悲剧重演的有力措施。四、本发明研制的广谱抗变异igy抗体可以常温存储和外用,可采用喷雾或雾化吸入方式将高浓度抗体直接
作用在新冠病毒聚集的咽喉和肺泡处,比注射到体内进入血液循环的施药方式更精准高效和安全。五、鉴于禽类与以人为代表的哺乳动物亲缘关系较远,采用igy抗体防治新冠肺炎有利于疾病控制;不会将人类疾病的病原微生物引入到病人的体内,可以解决治疗上的后顾之忧。六、这种广谱抗变异新冠病毒igy抗体不但有助于抗击这之疫情以度过目前的危机,还将有可能成为人类对付未来未知的高突变和高传染性的冠状病毒引起的疫情的有力武器。
354.下面结合试验例和实施例,对本发明的广谱抗变异新冠病毒igy与抗突变新冠病毒igy以及抗新冠病毒纳米抗体及其组合的具体实施应用作进一步说明:
355.试验例1:
356.广谱抗变异新冠病毒igy对六个有代表性之保守性强的抗原表位抗原的抗体结合效价检测。
357.分别选择:1.新冠病毒rbd侧面的保守性区域抗原表位蛋白,2.新冠病毒的亚基七肽重复区(hr)结构域抗原表位蛋白,3.309抗体结合的新冠病毒s1的保守性强抗原表位蛋白,4.新冠病毒的n末端结构域抗原表位新冠病毒蛋白,5.新冠病毒n蛋白抗原,6.新冠病毒的m蛋白抗原,用“elisa”方法(酶联免疫法)检测所制得的广谱抗变异新冠病毒igy的抗体效价,结果如下表所示:
[0358][0359][0360]
注:测试样本中的广谱抗变异新冠病毒igy抗体溶液浓度为1mg/ml。
[0361]
从以上检测结果可看出,所制备的广谱抗变异新冠病毒igy抗体对相对应的六个有代表性之保守性强的抗原表位抗原都有很高的抗体结合效价。
[0362]
试验例2:
[0363]
广谱抗变异新冠病毒igy和抗突变新冠病毒igy复合igy对流行的几种变异和未变异新冠病毒毒株的抗体结合效价检测。
[0364]
分别选择:1.未突变d614新冠病毒毒株,2.突变g614新冠病毒毒株,3.新冠病毒n501y突变毒株,4.新冠病毒de484k突变毒株,用“elisa”方法(酶联免疫法)检测所制得的
广谱抗变异新冠病毒igy的抗体效价,结果如下表所示:
[0365][0366]
注:测试样本中的广谱抗变异新冠病毒igy和抗突变新冠病毒igy复合igy抗体溶液浓度为1mg/ml。
[0367]
从以上检测结果可看出,所制备的广谱抗变异新冠病毒igy和抗突变新冠病毒igy复合igy抗体对对流行的几种变异新冠病毒毒株都有很高的抗体结合效价。
[0368]
实施例1:釆用中和试验法测定广谱抗变异新冠病毒复合igy中和变异新冠病毒的效价
[0369]
1.试验材料:
[0370]
(1)抗广谱抗变异新冠病毒复合igy:蛋白含量40mg/ml 1号标本1份
[0371]
(2)hrp酶标兔抗鸡igg
[0372]
(3)阴性抗体(未免疫鸡蛋的igy抗体):蛋白含量60mg/ml 2号标本1份
[0373]
(4)阳性对照:新冠病毒感染病人恢复期血清1份,标本3号
[0374]
(5)阴性对照:婴儿脐带血清1份,标本4号
[0375]
(6)病毒:
[0376]
a.sars
‑
cov
‑
2病毒分离株i:从sars
‑
cov
‑
2病毒感染病人咽试子标本分离鉴定。
[0377]
b.sars
‑
cov
‑
2病毒分离株ii:从sars
‑
cov
‑
2病毒感染病人血清标本分离鉴定。
[0378]
(7)细胞:非洲绿猴肾传代细胞。
[0379]
2.正式试验:
[0380]
在vero e6细胞培养检测广谱抗变异新冠病毒复合igy抗体试验实验目的:
[0381]
在vero e6细胞培养内,釆用中和试验法,测定广谱抗变异新冠病毒复合igy(用分离的2株sars
‑
cov
‑
2病毒株);用reed
‑
muench法,计算50%抗体中和终点。
[0382]
固定病毒
‑
稀释抗体法
[0383]
将上述广谱抗变异新冠病毒复合igy抗体、sars
‑
cov
‑
2病毒感染病人恢复期血清及婴儿脐带血清,分别在56℃灭活1小时后,分别用egale’s液2倍稀释9个浓度,既l 8—1:1024与100tcid50 sars
‑
cov
‑
2病毒分离株i和sars
‑
cov
‑
2病毒分离株ii之病毒悬液混合37℃水浴1小时后,接种vero e6细胞96孔培养板,每浓度4孔,同时设广谱抗变异新冠病毒复合igy抗体、病人恢复期血清及婴儿脐带血清对照,病毒对照、正常细胞对照。37℃5%co2孵箱培养5天,每天在倒置显微镜下观察病毒(cpe),以25%以下形态变化为“+”,26%~50%形态变化为“++”,51%~75%形态变化为“+++”,76%~100%形态变化为“++++”,以病毒对照出现“+++++++”时结束试验。
[0384]
用reed
‑
muench法,计算50%抗体中和终点。
[0385]
3.广谱抗变异新冠病毒复合igy抗体中和试验检测结果
[0386]
广谱抗变异新冠病毒复合igy抗体1号标本:1:1024的抗体可保护50%细胞不产生细胞病变。
[0387]
阴性抗体2号标本:不能中和sars
‑
cov
‑
2病毒。
[0388]
阳性对照:
[0389]
sars
‑
cov
‑
2病毒感染病人恢复期血清3号标本:1:64的血清可保护50%细胞不产生细胞病变。
[0390]
阴性对照:
[0391]
婴儿脐带血清4号标本:不能中和sars
‑
cov
‑
2病毒。
[0392]
实施例2:生产用于中央空调广谱抗变异新冠病毒复合igy雾化剂,将这种雾化剂按一定比例添加到中央空调加湿器的水中,充分搅拌均匀,再经过雾化后与空调新风混合输送入室内。,达到杀灭室内空气中可能存在的新冠病毒的效果。
[0393]
配方:
[0394][0395]
工艺:
[0396]
(1)将配方量医药级甘油用紫外光照射灭菌消毒24小时,无菌密封备用;
[0397]
(2)按配方量蒸馏水加热至至90℃,保持10分钟,再冷却至60℃,然后加入医药级甘油,,低速揽拌60分钟至充分溶解;然后,冷却至室温,形成溶液a;
[0398]
(3)一边搅拌一边将广谱抗变异新冠病毒复合igy抗体溶液或干粉加入溶液a中,低速搅拌60min,直至完全混合均匀,得溶液b;
[0399]
(4)用ph计测量溶液b的ph值,用柠檬酸调节ph值至6.8
±
0.1;
[0400]
(5)静置至上部泡沫全部消溶后,再将溶液b分装在清洗消毒过的塑料桶中,贴上标签出厂。
[0401]
实施例3:生产广谱抗变异新冠病毒复合igy抗体化雾剂,供各种雾化吸入机和公共环境空气消毒机、空气清新器和家庭用空气消毒器、空气清新器以及手持雾化器的药用雾化液。
[0402]
配方:
[0403][0404]
工艺:
[0405]
(1)将配方量k
‑
30、s
‑
40、吐温
‑
80、薄荷油、香精用紫外光照射灭菌消毒24小时,无菌密封备用;
[0406]
(2)按配方量蒸馏水加热至至90℃,保持10分钟,然后分别加入s
‑
40和k
‑
30分散剂,搅拌30分钟以上,溶解均匀;再冷却至60℃,分别缓慢加入吐温(滴加)和薄荷油以及甘油(滴加),低速揽拌60分钟至充分溶解;然后,冷却至室温,形成溶液a;
[0407]
(3)一边搅拌一边将广谱抗变异新冠病毒复合igy抗体溶液或干粉加入溶液a中,低速搅拌60min,直至完全混合均匀,得溶液b;
[0408]
(4)一边搅拌一边将香精加入溶液b中,低速搅拌60min,直至完全溶解,得溶液c;
[0409]
(5)用ph计测量溶液c的ph值,用柠檬酸调节ph值至6.8
±
0.1;
[0410]
(6)静置至上部泡沫全部消溶后,再将溶液c分装在清洗消毒过的喷雾瓶或雾化器中,贴上标签出厂。
[0411]
实施例4:生产广谱抗变异新冠病毒复合igy鼻喷剂或滴鼻剂或滴眼剂
[0412]
配方:
[0413]
[0414][0415]
工艺:
[0416]
(1)将配方量k
‑
30、s
‑
40、吐温
‑
80、薄荷油、香精用紫外光照射灭菌消毒24小时,无菌密封备用;
[0417]
(2)按配方量蒸馏水加热至至90℃,再分别加入s
‑
40和k
‑
30分散剂,搅拌30分钟以上,溶解均匀;再冷却至60℃,分别缓慢加入吐温(滴加)和薄荷油以及甘油(滴加),低速揽拌60分钟至充分溶解;然后,冷却至室温,形成溶液a;
[0418]
(3)一边搅拌一边将抗突变sars
‑
cov
‑
2多结合位点复合igy溶液或干粉加入溶液a中,低速搅拌60min,直至完全混合均匀,得溶液b;
[0419]
(4)一边搅拌一边将香精加入溶液b中,低速搅拌60min,直至完全溶解,得溶液c;
[0420]
(5)用ph计测量溶液c的ph值,用柠檬酸调节ph值至6.8
±
0.1;
[0421]
(6)静置至上部泡沫全部消溶后,再将溶液c分装在清洗消毒过的滴鼻器或滴眼器以及鼻用喷雾瓶中,贴上标签出厂。
[0422]
实施例5:生产广谱抗变异新冠病毒复合igy口喷剂或漱口水
[0423]
配方:
[0424][0425][0426]
工艺:
[0427]
(1)将配方量k
‑
30、s
‑
40、吐温
‑
80、薄荷油、香精用紫外光照射灭菌消毒24小时,无菌密封备用;
[0428]
(2)按配方量蒸馏水加热至至90℃,再分别加入s
‑
40和k
‑
30分散剂,搅拌30分钟以上,溶解均匀;再冷却至60℃,分别缓慢加入吐温(滴加)和薄荷油以及甘油(滴加),低速揽拌60分钟至充分溶解;然后,冷却至室温,形成溶液a;
[0429]
(3)一边搅拌一边将广谱抗变异新冠病毒复合igy溶液或干粉加入溶液a中,低速搅拌60min,直至完全混合均匀,得溶液b;
[0430]
(4)一边搅拌一边将香精加入溶液b中,低速搅拌60min,直至完全溶解,得溶液c;
[0431]
(5)用ph计测量溶液c的ph值,用柠檬酸调节ph值至6.8
±
0.1;
[0432]
(6)静置至上部泡沫全部消溶后,再将溶液c分装在清洗消毒过的口腔用喷雾罐或漱口瓶中,贴上标签出厂。
[0433]
实施例6:生产广谱抗变异新冠病毒复合igy洗手液
[0434]
配方:
[0435]
原料含量(%)广谱抗变异新冠病毒复合igy溶液或干粉0.01403(脂肪醇聚氧乙烯醚磺基琥珀酸单酯二钠)33.48503(脂肪醇聚氧乙烯醚硫酸铵,浓度70%)20.51医药级甘油2.00海藻精华0.10香精(玫瑰花香精)0.05薄荷油0.05ml蒸馏水43.81
[0436]
工艺:
[0437]
(1)将配方量海藻精华、医药级甘油、薄荷油、香精以及403、503发泡剂用紫外光照射灭菌消毒24小时,无菌密封备用;
[0438]
(2)将配方量蒸馏水加热至90℃,停留15分钟;再冷却至60℃,一边搅拌一边先后加入海藻精华和医药级甘油,低速揽拌30分钟,直至完全溶解,冷却至室温,得溶液a;
[0439]
(3)一边搅拌一边将香精(玫瑰花香精)加入溶液a中,低速搅拌60min,直至完全溶解,得溶液b;
[0440]
(4)将403加热至80℃,然后一边搅拌一边将503徐徐滴加入到403中,低速搅拌30min,得到溶液c;
[0441]
(5)保持溶液c温度在80℃,一边搅拌一边将薄荷油徐徐滴加入到溶液c中,低速搅拌60min,得到溶液d;
[0442]
(6)将溶液d加热至90℃高温灭菌5min,然后冷却至室温;
[0443]
(7)一边搅拌一边将溶液b缓慢地加到溶液d中,低速搅拌60min;如未形成均质稳定的乳状溶液,则需延长搅拌时间,制得溶液e;
[0444]
(8)一边搅拌一边将广谱抗变异新冠病毒复合igy溶液或干粉缓慢地加到溶液e中,低速搅拌60min;如未形成均质稳定的乳状溶液,则需延长搅拌时间,制得溶液f;
[0445]
(9)用ph计测量溶液f的ph值,采用柠檬酸或ph4.5磷酸氢二钠
–
柠檬酸缓冲液调节ph值至4.5
±
0.1;
[0446]
(10)静置一夜,直至上部泡沫全部消溶后,再将溶液f液分装在清洗消毒过的洗手
液容器中,贴上标签出厂。
[0447]
实施例7:生产广谱抗变异新冠病毒复合igy口含片
[0448]
配方:
[0449][0450][0451]
工艺
[0452]
(1)山梨糖醇过60目筛两次备用;
[0453]
(2)羧甲基纤维素分散于30%乙醇中制成1%乙醇溶液;
[0454]
(3)将(1)项用适量(2)项制软材,14目筛网制粒,60℃通风干燥,18目筛整粒;用40目筛筛出适量细粉与抗突变sars
‑
cov
‑
2多结合位点复合igy充分混匀;
[0455]
(4)再拌入硬脂酸镁,一起与整批颗粒混合均匀,密闭4小时以上;
[0456]
(5)压片机压片,每片600mg;
[0457]
(6)检验合格后,包装,全验出厂。
[0458]
实施例8:生产广谱抗变异新冠病毒复合igy粉剂,供粉未雾化装置作药用粉剂。
[0459]
配方:
[0460]
原料重量百分比(%)广谱抗变异新冠病毒复合igy干粉10.0药用葡萄糖90.0
[0461]
工艺:
[0462]
(1)将配方量广谱抗变异新冠病毒复合igy干粉和配方量药用葡萄糖混合,充分搅拌均匀;
[0463]
(2)将粉剂分装,检验出厂。
[0464]
本发明所包含的信息,在未脱离上述权利要求的精神和保护范围下,本发明各种偏离精确的描述,对于与本发明相关的本领域技术人员来说是显而易见的。本发明并不认为限制在所定义的程序、性质或组成的范围内,因为优选的实施例和其他描述只用于说明目前提供发明的特定方面。对于在化学、生物化学或相关领域的技术人员来说,实现本发明于各种修改的描述模式,都应属于本发明所附权利要求的保护范围内。
[0465]
应当理解的是,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进或变换都应属于本发明所附权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1