一种可重复利用的核酸荧光探针及相应的核酸检测方法
1.本发明涉及生物技术领域中一种可重复利用的核酸荧光探针及相应的核酸检测方法。
背景技术:
2.可靠、经济、快速的核酸检测方法对于sars
‑
cov
‑
2的预防,控制,诊断和治疗至关重要。基于定量rt
‑
pcr(rt
‑
qpcr)的核酸检测方法在全球范围内广泛使用。商业化的定量rt
‑
pcr试剂盒包含聚合酶和荧光探针(taqman探针)等试剂,其中荧光探针的合成不仅成本高昂,而且耗时。在大流行期间这些试剂的短缺导致了测试能力的严重瓶颈。为了传染病防控和可持续发展,开发可以重复利用的探针系统势在必行,目前的可重复使用的探针系统通常基于非均相溶液系统,且需要额外添加清洗剂以完成探针的循环利用,这样既费时费力,也没有达到高效的节约成本。仿生的能量耗散系统可以为探针的自动循环使用提供有力的工具。所谓“能量耗散”指的是当体系内分子处于平衡态时,加入外源的能量分子,使体系在一段时间内偏离平衡态,当能量分子逐渐被消耗掉后,体系的分子重新回到初始状态。如果我们把目标核酸分子作为能量分子,设计探针系统,则可以借鉴能量耗散的理念实现探针的自动重置,从而达到重复使用多次的目的。
技术实现要素:
3.本发明所要解决的技术问题是如何重复利用荧光探针。
4.为解决上述技术问题,本发明首先提供了一种可重复利用的核酸荧光探针。
5.本发明提供的可重复利用的核酸荧光探针,其包含荧光探针、淬灭探针以及含有与目标物结合区域的dna;所述荧光探针标记有荧光基团,所述淬灭探针标记有淬灭基团;荧光探针、淬灭探针通过含有与目标物结合区域的dna连接或者结合到一起,所述淬灭基团能淬灭所述荧光基团的荧光信号,所述核酸荧光探针中所有单链dna的3’端进行硫代修饰。
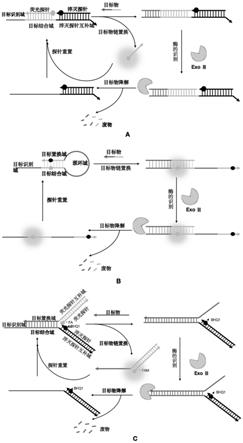
6.本发明提供的可重复利用的核酸荧光探针工作原理如下:核酸荧光探针的荧光探针、淬灭探针通过含有与目标物结合区域的dna连接或者结合到一起,所述淬灭基团淬灭所述荧光基团的荧光信号,初始为荧光信号为未激活状态;目标物能通过链置换结合到核酸荧光探针的目标物结合区域,将核酸荧光探针变构为与核酸外切酶有较高亲和性的底物复合物,此时所述淬灭基团与所述荧光基团分开,荧光信号被激活;核酸外切酶切割底物复合物后导致目标物降解,核酸荧光探针通过重新杂交(re
‑
hybridization)回到初始状态,所述淬灭基团淬灭所述荧光基团的荧光信号,实现自动重置,从而达到可重复使用的效果。
7.上述可重复利用的核酸荧光探针中,所述3’端进行硫代修饰为修饰3
‑
4个核苷酸,具体可为修饰4个核苷酸。
8.上述可重复利用的核酸荧光探针,具体可为a、b、c中的任一种:
9.a、线性dna探针;
10.b、dna发夹探针;
11.c、three
‑
way junction(twj)dna纳米探针。
12.上述可重复利用的核酸荧光探针中,a所述的线性dna探针由以下a1
‑
a3共三条单链dna组成:
13.a1荧光基团标记链;
14.a2淬灭基团标记链;
15.a3非标记链:由目标识别域、目标结合域、淬灭探针互补域依次连接而成;其中目标结合域与所述a1荧光基团标记链稳定结合,淬灭探针互补域与所述a2淬灭基团标记链稳定结合。
16.所述a2的淬灭基团淬灭所述a1的荧光基团的荧光信号。
17.其中,所述a1、a2、a3的摩尔比可为1:1:1。
18.上述可重复利用的核酸荧光探针中,所述a1荧光基团标记链长度为20个核苷酸;所述a2淬灭基团标记链长度为22个核苷酸;所述a3非标记链,目标识别域长度为6个核苷酸;目标结合域长度为20个核苷酸。
19.上述可重复利用的核酸荧光探针中,b所述的dna发夹探针为一条包含以下b1
‑
b4的结构域的dna单链:
20.b1目标识别域;
21.b2以荧光基团标记的目标结合域;
22.b3颈环域;
23.b4以淬灭基团标记的目标置换域;
24.其中,所述b2与所述b4形成稳定结合。
25.所述b4的淬灭基团淬灭所述b2的荧光基团的荧光信号。
26.其中,所述b1目标识别域长度为16个核苷酸;所述b2以荧光基团标记的目标结合域长度为10个核苷酸;所述b3颈环域长度为20个核苷酸;所述b4以淬灭基团标记的目标置换域长度为10个核苷酸。
27.上述可重复利用的核酸荧光探针中,c所述的three
‑
way junction dna纳米探针由c1
‑
c4共四条dna单链组成:
28.c1荧光基团标记的荧光探针链;
29.c2淬灭基团标记的淬灭探针链;
30.c3包含目标置换域和荧光探针互补域的链;
31.c4包含目标识别域、目标结合域和淬灭探针互补域的链;
32.所述c1与所述c3中的荧光探针互补域稳定结合;所述c2与所述c4中的淬灭探针互补域稳定结合;所述c3的目标置换域与所述c4的目标结合域稳定结合。
33.所述c2的淬灭基团淬灭所述c1的荧光基团的荧光信号。
34.其中,所示c1、c2、c3、c4的摩尔比可为1:1:1:1。
35.其中,所述c1的长度为20个核苷酸;所述c2的长度为22个核苷酸;c3中所述目标置换域的长度为17个核苷酸;c4中所述目标识别域的长度为18个核苷酸。
36.上述可重复利用的核酸荧光探针中,所述荧光基团可选为fam,所述淬灭基团可选为bhq1。
37.上述a、c中的荧光基团修饰于5’端,上述b中的荧光基团修饰于t碱基上。
38.上述a、c中的淬灭基团修饰于3’端或距离3’较近的t碱基上,上述b中淬灭基团修饰于距离3’较近的t碱基上。
39.上述可重复利用的核酸荧光探针中,为检测sars
‑
cov
‑
2病毒,以序列表序列1为目标物,所述核酸荧光探针由序列表序列2所示的单链dna、序列表序列3所示的单链dna、序列表序列4所示的单链dna构成。
40.上述可重复利用的核酸荧光探针中,为检测sars
‑
cov
‑
2病毒,以序列表序列1为目标物,所述核酸荧光探针由序列表序列5所示的单链dna构成。
41.上述可重复利用的核酸荧光探针中,为检测sars
‑
cov
‑
2病毒,以序列表序列8为目标物,所述核酸荧光探针由序列表序列6所示的单链dna、序列表序列7所示的单链dna、序列表序列9所示的单链dna、序列表序列10所示的单链dna构成。
42.上述可重复利用的核酸荧光探针中,为检测sars
‑
cov
‑
2病毒,以序列表序列11为目标物,所述核酸荧光探针由序列表序列6所示的单链dna、序列表序列7所示的单链dna、序列表序列12所示的单链dna、序列表序列13所示的单链dna构成。
43.上述可重复利用的核酸荧光探针中,为检测sars
‑
cov
‑
2病毒,以序列表序列14为目标物,所述核酸荧光探针由序列表序列6所示的单链dna、序列表序列7所示的单链dna、序列表序列15所示的单链dna、序列表序列16所示的单链dna构成。
44.上述可重复利用的核酸荧光探针中,所述重复利用,利用次数可达5次(含)以上,具体可为5
‑
10次。
45.本发明还提供使用上述可重复利用的核酸荧光探针的核酸检测方法,包括将核酸荧光探针与多个待测样本依次混合,检测与每个待测样本混合时的荧光信号,判断该待测样本是否含有目标物,判断标准如下:若待测样本中存在目标物则荧光信号发生未激活
‑
激活
‑
未激活的动态变化,若待测样本中不存在目标物则荧光信号不发生动态变化。
46.本发明的可重复利用的核酸检测方法,具体包括如下步骤:
47.s1、根据目标物设计上述核酸荧光探针;
48.s2、目标物的单次检测:在含有s1中的核酸荧光探针的探针体系中加入待测样本与核酸外切酶构成检测体系,测定荧光强度,同时设置阴性对照;
49.s3、目标物的多次检测:多次添加不同的待测样本,重复步骤s2;
50.s4、对检测的荧光信号进行分析,按如下标准来确定待测样本中是否存在目标物:
51.若待测样本中存在目标物,目标物与核酸荧光探针链置换反应后荧光信号从off态变为on态,其被核酸外切酶降解后探针重新杂交,导致荧光从on态又变为off态,荧光信号动态变化与阴性对照不同;
52.若待测样本中不存在目标物,荧光信号动态变化与阴性对照相同,荧光信号保持off态,荧光信号动态变化与阴性对照相同。
53.上述方法中,所述核酸外切酶可为exoⅲ。
54.本发明还提供产品,所述产品由x1和x2组成;所述x1为所述核酸荧光探针,所述x2为进行检测所需的试剂和/或仪器。
55.上述产品中,所述检测所需的试剂可含有核酸外切酶和/或反应缓冲液(1
×
neb buffer 1),也可仅为核酸外切酶;所述仪器可为实时荧光检测仪。
56.为解决上述技术问题,本发明还提供了所述核酸荧光探针、所述方法、所述产品在
制备核酸检测试剂中的应用。
57.可重复使用的分子探针是一种应对临床样本急剧增加的情况的有效方法,特别在生物试剂生产能力较差的地区。在这里,发明人通过使用dna纳米技术构建仿生能量耗散系统,开发了可以重复使用的核酸探针系统,可以用于sars
‑
cov
‑
2的检测。提取的sars
‑
cov
‑
2的rna逆转录的dna序列作为燃料链,以驱动dna探针系统进入非平衡状态,燃料链逐渐并被酶消耗后,从而探针系统的自动重置。因此,dna探针可以重复使用。本发明的探针系统可以重复使用至少五次,可以在均质溶液中运行,有效节约试剂成本,为短时间内需应对大量临床样本的核酸检测场景提供解决方案。本发明中的方法将在核酸检测和其他类型的液体活检中广泛应用。
附图说明
58.图1为本发明的核酸荧光检测探针系统示意图。其中图1的a图为线性dna探针结构示意图;图1的b图为dna发夹探针结构示意图;图1的c图为three
‑
way junction(twj)dna纳米结构示意图。
59.图2为本发明实施例1的线性dna探针多次目标检测的荧光强度
‑
时间轨迹图。
60.图3为本发明实施例1的dna发夹探针多次目标检测的荧光强度
‑
时间轨迹图。
61.图4为本发明实施例2的待测样本提取流程。
62.图5为本发明实施例2的three
‑
way junction(twj)dna纳米探针多次目标检测荧光信号与探针凝胶表征图,其中图5的a图为sars
‑
cov
‑
2(e,orf,n)基因存在时的荧光强度
‑
时间轨迹,图5的b图为多次目标检测后(e,orf,n)探针凝胶表征图。
63.图6为本发明实施例2的three
‑
way junction(twj)dna纳米探针多次目标检测结果图。
具体实施方式
64.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
65.下述实施例中的定量试验,均设置三次重复实验,结果取平均值。
66.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
67.本发明检测方法为一种基于能量耗散可重复利用的核酸传感以核酸动态结合为信号基元的生物目标物指认方法,通过目标物能通过链置换反应将核酸荧光探针变构为核酸外切酶(exoⅲ)的最适底物,酶切割底物后导致目标物降解,核酸荧光探针通过重新杂交(re
‑
hybridization)使系统回到初始状态,实现自动重置,从而达到重复使用的效果。具体地,包括如下步骤:
68.s1、根据目标物设计核酸荧光探针,要求所设计的核酸探针与目标物通过toehold介导的链置换反应后会形成对核酸外切酶(exoⅲ)具有较好亲和力的新的复合物,链置换反应之后荧光信号处于on状态,核酸外切酶(exoⅲ)降解后荧光信号处于off状态。
69.本发明提供的可重复利用的核酸荧光探针,其包含荧光探针、淬灭探针以及含有
与目标物结合区域的dna;所述荧光探针标记有荧光基团,所述淬灭探针标记有淬灭基团;荧光探针、淬灭探针通过含有与目标物结合区域的dna连接或者结合到一起,所述淬灭基团能淬灭所述荧光基团的荧光信号,所述核酸荧光探针中所有单链dna的3’端进行硫代修饰。本发明的核酸荧光探针系统示意图如图1所示,所述核酸荧光探针可选线性dna探针(见实施例1,流程见图1的a图)、dna发夹探针(见实施例1,流程见图1的b图)、three
‑
way junction(twj)dna纳米探针(见实施例2,流程见图1的c图)中的任一种。
70.s2、目标物的单次检测
71.在含有s1中的核酸荧光探针的探针体系中加入待测样本与核酸外切酶(exoⅲ)构成检测体系,记录荧光强度,同时设置阴性对照;
72.s3、目标物的多次检测
73.多次添加不同的待测样本,重复步骤s2;
74.s4、对检测记录的荧光信号进行分析,通过各待测样本和阴性对照荧光的信号强度来确定待测样本中是否存在目标物:
75.若待测样本中存在目标物,目标物与核酸荧光探针链置换反应后荧光信号从off态变为on态,其被核酸外切酶(exoⅲ)降解后探针重新杂交,导致荧光从on态又变为off态,荧光信号动态变化与阴性对照不同;
76.若待测样本中不存在目标物,荧光信号动态变化与阴性对照相同,荧光信号保持off态,荧光信号动态变化与阴性对照相同。
77.实施例1使用线性dna探针和dna发夹探针的检测方法
78.本实施例基于线性dna探针或dna发夹探针检测序列表序列1所示的寡核苷酸目标物,以按照序列1合成的单链寡核苷酸(上海生工有限公司合成)作为模拟的待测样本。
79.具体步骤如下:
80.s1、根据序列表序列1所示的寡核苷酸目标物,设计核酸荧光探针,本实施例所用的核酸荧光探针为线性dna探针或dna发夹探针,具体序列见表1:
81.表1各核酸序列
[0082][0083]
注:表1中*表示硫代。序列5中下划线指示的序列为b1目标识别域,波浪线指示的序列为b2以荧光基团标记的目标结合域,双下划线指示的序列为b3颈环域,虚下划线指示的序列为b4以淬灭基团标记的目标置换域。
[0084]
1)图1的a图为线性dna探针结构示意图,设计线性dna探针,由以下a1
‑
a3共三条单链dna组成(具体序列见表1中的a1、a2、a3):
[0085]
a1荧光基团标记链(带荧光基团标记的单链dna,即荧光探针);
[0086]
a2淬灭基团标记链(带淬灭基团标记的单链dna,即淬灭探针);
[0087]
a3非标记链(非标记的单链dna),由目标识别域、目标结合域(即与目标物结合区域)、淬灭探针互补域依次连接而成;其中目标结合域与所述a1荧光基团标记链稳定结合,淬灭探针互补域与所述a2淬灭基团标记链稳定结合。
[0088]
其中,所述a1、所述a2和所述a3的单链dna的3’端均进行了硫代修饰,具体硫代修饰的长度为3
‑
4个核苷酸。
[0089]
上述a1荧光基团标记链的荧光基团修饰于5’端,荧光基团选fam。
[0090]
上述a2淬灭基团标记链的淬灭基团可修饰于3’或距离3’较近的t碱基上,淬灭基团选为bhq1,具体表1的a2中淬灭基团修饰于距离3’较近的t碱基上。
[0091]
所述a2的淬灭基团淬灭所述a1的荧光基团的荧光信号。
[0092]
其中,所示a1、a2、a3的摩尔比为1:1:1。
[0093]
其中,所述a1荧光基团标记链长度为20个核苷酸,以保证在室温及合适的离子强度下能够稳定存在。
[0094]
其中,所述a2淬灭基团标记链长度为22个核苷酸,以保证在室温及合适的离子强度下能够稳定存在。
[0095]
其中,所述a3非标记链,目标识别域长度为6个核苷酸;目标结合域长度为20个核苷酸,淬灭探针互补域长度为22个核苷酸。
[0096]
即设计获得了如下一套核酸荧光探针w1(见表1):
[0097]
w1、以序列表序列1为目标物,所述核酸荧光探针由序列表序列2所示的单链dna、序列表序列3所示的单链dna、序列表序列4所示的单链dna构成。
[0098]
2)图1的b图为dna发夹探针结构示意图,设计dna发夹探针,为一条包含以下b1
‑
b4的结构域的dna单链b(见表1中的b):
[0099]
b1目标识别域(表1序列5中下划线指示的序列);
[0100]
b2以荧光基团标记的目标结合域(表1序列5中波浪线指示的序列);
[0101]
b3颈环域(表1序列5中双下划线指示的序列);
[0102]
b4以淬灭基团标记的目标置换域(表1序列5中虚下划线指示的序列);
[0103]
其中,所述b2与所述b4形成稳定结合。
[0104]
b含有与目标物结合区域,且即被荧光基团标记(可视为荧光探针),又被荧光基团标记(可视为淬灭探针)。
[0105]
其中,所述包含以下b1
‑
b4的结构域的dna单链的3’端进行了硫代修饰,具体硫代修饰的长度为3
‑
4个核苷酸。
[0106]
上述b中淬灭基团修饰于距离3’较近的t碱基上,淬灭基团选为bhq1。荧光基团修饰于t碱基上,荧光基团选为fam。
[0107]
所述b4的淬灭基团淬灭所述b2的荧光基团的荧光信号。
[0108]
其中,所述b1目标识别域长度为16个核苷酸;所述b2以荧光基团标记的目标结合域长度为10个核苷酸;所述b3颈环域长度为20个核苷酸;所述b4以淬灭基团标记的目标置换域长度为10个核苷酸。
[0109]
即设计获得了如下一套核酸荧光探针w2:
[0110]
w2、以序列表序列1为目标物,所述核酸荧光探针由序列表序列5所示的单链dna构成。
[0111]
按照表1,合成所需的核酸荧光探针w1和核酸荧光探针w2。
[0112]
s2、目标物的单次检测
[0113]
s2
‑
1、建立探针体系
[0114]
建立探针体系(48μl):反应缓冲液环境为1
×
neb buffer 1(10mm bis
‑
tris
‑
propane
‑
hcl,10mm mgcl2,1mm dtt,ph 7,25℃),分别加入核酸荧光探针,核酸荧光探针具体为w1
‑
w2中的任一套,使核酸荧光探针中各单链dna在体系中的浓度均为100nm。使体系总体积等于48μl,其余的体积则用ddh2o补充。
[0115]
应用退火程序确保识别组成的寡核苷酸链正确结合。pcr退火程序设定程序如下:95℃,2min;85℃,1min;75℃,1min;65℃,1min;55℃,1min;45℃,1min;37℃,5min;37℃,保持。
[0116]
以核酸荧光探针w1建立探针体系1,以核酸荧光探针w2建立探针体系2。
[0117]
s2
‑
2单次检测
[0118]
实时荧光检测仪监测目标物的单次检测:针对表1中的寡核苷酸目标物,第一个个待测样本分别建立2种检测体系:以探针体系1建立检测体系1,以探针体系2建立检测体系2。
[0119]
50μl检测体系:其中48μl为上述探针体系(探针体系1/探针体系2),加入100nm的待测样本,4u/ml的exoⅲ,使体系的终体积达到50μl后,离心,立刻放入实时荧光检测仪进
行检测,实时荧光检测仪设置的程序如下:50μl体积,37℃检测,时间间隔为5s/cycle,400cycles,gain=8。
[0120]
s3、目标物的多次检测
[0121]
步骤s2单次检测结束之后,向体系里多次补加100nm的待测样本,直至完成10次检测,其检测方法与程序设置同步骤s3实时检测荧光信号。
[0122]
s4、对检测记录的荧光信号进行分析,通过各待测样本和阴性对照荧光的信号强度来确定待测样本中是否存在目标物:
[0123]
若待测样本中存在目标物,目标物与核酸荧光探针链置换反应后荧光信号从off态变为on态,其被核酸外切酶(exoⅲ)降解后探针重新杂交,导致荧光从on态又变为off态,荧光信号动态变化与阴性对照不同;
[0124]
若待测样本中不存在目标物,荧光信号动态变化与阴性对照相同,荧光信号保持off态,荧光信号动态变化与阴性对照相同。
[0125]
结果见图2、图3,表明针对待测样本,以核酸荧光探针w1和以核酸荧光探针w2检测的结果表明探针系统在10次重复利用中表现的结果均一致,且均能检出目标物的存在。
[0126]
实施例2使用three
‑
way junction(twj)dna纳米探针的检测方法
[0127]
本实施例在中日友好医院临床检验科的病毒检测实验室进行。
[0128]
为验证本发明检测方法的效果,针对sars
‑
cov
‑
2设置本实施例2,所用的待测样本获取方式见图4:
[0129]
取健康人与covid
‑
19患者(核酸检测阳性)共110人(其中55份阳性,55份阴性)的鼻咽拭子(来源于康为世纪生物科技有限公司),病毒灭活,用核酸提取试剂盒(天隆科技、qex
‑
dna/rna病毒)对病毒rna进行提取,通过rt
‑
pcr试剂盒(qiagen,210212)对rna进行反转录与扩增,使用lambda外切酶(neb,m0262s)产生单链作为检测体系的待测样本。
[0130]
本实施例基于three
‑
way junction(twj)dna纳米探针,对以上取得的待测样本进行sars
‑
cov
‑
2检测,具体步骤如下:
[0131]
s1、针对sars
‑
cov
‑
2的n基因(目标序列为寡核苷酸目标物1)、sars
‑
cov
‑
2的orf基因(目标序列为寡核苷酸目标物2)和sars
‑
cov
‑
2的e基因(目标序列为寡核苷酸目标物3),分别设计three
‑
way junction(twj)dna纳米探针。图1的c图为three
‑
way junction(twj)dna纳米探针结构示意图,设计的three
‑
way junction(twj)dna纳米探针具体见表2,由c1
‑
c4共四条dna单链组成:
[0132]
c1荧光基团标记的荧光探针链(即荧光探针);
[0133]
c2淬灭基团标记的淬灭探针链(即淬灭探针);
[0134]
c3包含目标置换域和荧光探针互补域的链;
[0135]
c4包含目标识别域、目标结合域(即与目标物结合区域)和淬灭探针互补域的链;
[0136]
室温下(25℃),所述c1与所述c3中的荧光探针互补域稳定结合;所述c2与所述c4中的淬灭探针互补域稳定结合;所述c3的目标置换域与所述c4的目标结合域稳定结合。
[0137]
所述c1、所述c2、所述c3和所述c4的单链dna的3’端均进行了硫代修饰,具体硫代修饰的长度为3
‑
4个核苷酸。上述c1中的荧光基团修饰于5’端,荧光基团选为fam。上述c2中的淬灭基团修饰于距离3’较近的t碱基上,淬灭基团选为bhq1。
[0138]
所述c2的淬灭基团淬灭所述c1的荧光基团的荧光信号。
[0139]
其中,所述c1、c2、c3、c4的摩尔比为1:1:1:1。
[0140]
其中,所述c1的长度为20个核苷酸;所述c2的长度为22个核苷酸;c3中所述目标置换域的长度为17个核苷酸;c4中所述目标识别域的长度为18个核苷酸,以保证在室温及合适的离子强度下能够稳定存在。
[0141]
c1是发明人设计的通用荧光探针,c2是发明人设计的通用淬灭探针。针对sars
‑
cov
‑
2的不同目标基因,分别设计c3和c4:选择寡核苷酸目标物1作为目标物时的c3标为c3
‑
1,c4标为c4
‑
1;选择寡核苷酸目标物2作为目标物时的c3标为c3
‑
2,c4标为c4
‑
2;选择寡核苷酸目标物3作为目标物时的c3标为c3
‑
3,c4标为c4
‑
3。具体如下:
[0142]
目标基因为n基因,选择寡核苷酸目标物1作为目标物,设计获得了一套核酸荧光探针w3,所用c3、c4分别为表2中c3
‑
1和c4
‑
1:
[0143]
w3、以序列表序列8为目标物,所述核酸荧光探针由序列表序列6所示的单链dna、序列表序列7所示的单链dna、序列表序列9所示的单链dna、序列表序列10所示的单链dna构成。
[0144]
目标基因为orf基因,选择寡核苷酸目标物2作为目标物,设计获得了一套核酸荧光探针w4,所用c3、c4分别为表2中c3
‑
2和c4
‑
2:
[0145]
w4、以序列表序列11为目标物,所述核酸荧光探针由序列表序列6所示的单链dna、序列表序列7所示的单链dna、序列表序列12所示的单链dna、序列表序列13所示的单链dna构成。
[0146]
目标基因为e基因,选择寡核苷酸目标物3作为目标物,设计获得了一套核酸荧光探针w5,所用c3、c4分别为表2中c3
‑
3和c4
‑
4:
[0147]
w5、以序列表序列14为目标物,所述核酸荧光探针由序列表序列6所示的单链dna、序列表序列7所示的单链dna、序列表序列15所示的单链dna、序列表序列16所示的单链dna构成。
[0148]
表2各核酸序列
[0149]
[0150][0151]
注:表1中*表示硫代。
[0152]
按照表1,合成所需的核酸荧光探针。
[0153]
s2、目标物的单次检测
[0154]
s2
‑
1、建立探针体系
[0155]
建立探针体系(48μl):反应缓冲液环境为1
×
neb buffer 1(10mm bis
‑
tris
‑
propane
‑
hcl,10mm mgcl2,1mm dtt,ph 7,25℃),分别加入核酸荧光探针,核酸荧光探针具体为w3
‑
w5中的任一套,使核酸荧光探针中各单链dna在体系中的浓度均为100nm。使体系总体积等于48μl,其余的体积则用ddh2o补充。
[0156]
应用退火程序确保识别组成的寡核苷酸链正确结合。pcr退火程序设定程序如下:95℃,2min;85℃,1min;75℃,1min;65℃,1min;55℃,1min;45℃,1min;37℃,5min;37℃,保持。
[0157]
以核酸荧光探针w3建立探针体系3,以核酸荧光探针w4建立探针体系4,以核酸荧光探针w5建立探针体系5。
[0158]
s2
‑
2单次检测
[0159]
实时荧光检测仪监测目标物的单次检测:针对每种目标物,对第一个待测样本分别建立3种检测体系:以探针体系3建立检测体系3,以探针体系4建立检测体系4,以探针体系5建立检测体系5。每种检测体系均按照如下方式建立:
[0160]
50μl检测体系:其中48μl为上述探针体系(探针体系3/探针体系4/探针体系5),加入100nm的待测样本,4u/ml的exoⅲ,使体系的终体积达到50μl后,离心,立刻放入实时荧光检测仪进行检测,实时荧光检测仪设置的程序如下:50μl体积,37℃检测,时间间隔为5s/cycle,400cycles,gain=8。
[0161]
s3、目标物的多次检测
[0162]
步骤s2单次检测结束之后,向体系里多次补加100nm的其它待测样本,其检测方法与程序设置同步骤s3实时检测荧光信号,结果见图5的a图。
[0163]
s4、对检测记录的荧光信号进行分析,通过各待测样本和阴性对照荧光的信号强度来确定待测样本中是否存在目标物:
[0164]
若待测样本中存在目标物,目标物与核酸荧光探针链置换反应后荧光信号从off态变为on态,其被核酸外切酶(exoⅲ)降解后探针重新杂交,导致荧光从on态又变为off态,荧光信号动态变化与阴性对照不同;
[0165]
若待测样本中不存在目标物,荧光信号动态变化与阴性对照相同,荧光信号保持off态,荧光信号动态变化与阴性对照相同。
[0166]
凝胶表征多次检测目标物后的探针结构,凝胶电泳条件为8%丙烯酰胺
‑
n
‑
n亚甲基双丙烯酰胺,电压120v,时间45分钟,多次检测后目标物被降解完全。分析结果和多次检测目标物后的探针结构结果见图5的b图。
[0167]
结果表明,来源于110人的鼻咽拭子的待测样品(其中55份阳性,55份阴性),由于探针可以重复使用5次,以上样品共消耗荧光探针22份。以核酸荧光探针w3检测的结果、以核酸荧光探针w4检测的结果、以核酸荧光探针w5检测的结果均与诊断结果一致(见图6)。
[0168]
这些结果说明提取的sars
‑
cov
‑
2的rna逆转录的dna序列能量耗散的燃料链,以驱动dna探针系统进入非平衡状态,燃料链逐渐并被酶消耗后,从而探针系统的自动重置。因此,dna探针可以重复使用。本发明的探针系统可以重复使用至少五次,可以在均质溶液中运行,有效节约试剂成本,为短时间内需应对大量临床样本的核酸检测场景提供解决方案。本发明中的方法将在核酸检测和其他类型的液体活检中广泛应用。
[0169]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1