一种活性增强型食用菌多糖的制备方法及其在减肥、增加肠道有益菌群中的应用
本发明属于食用菌深加工技术领域,具体而言,涉及一种活性增强型裂褶菌多糖的制备方法及其在减肥、增加肠道有益菌群中的应用。
背景技术:
裂褶菌是一种大型珍稀食药用菌。除了肉质韧脆,香味浓郁,裂褶菌中还含有多种生物活性物质,如多糖、多酚及麦角甾醇等。早在上世纪60年代,日本学者就通过菌丝深层发酵技术获得了裂褶菌胞外多糖并证实其具有抗肿瘤作用。随后,人们发现裂褶菌多糖还具有免疫调节、抗癌、抗病毒和抗氧化等多种生物功能。在未实现人工驯化栽培之前,人们主要通过菌丝体深层发酵技术获得裂褶菌多糖,如中国专利cn108676107a公开了一种利用双水相萃取法从裂褶菌发酵液中分离裂褶菌多糖的技术。
近年来,裂褶菌在我国云南、湖北、四川等地逐步实现人工栽培,从子实体中大规模获得裂褶菌多糖成为可能。研究显示,从发酵液中分离的多糖与从子实体中提取的多糖在理化性质、生物活性等方面均存在显著差异。因此开展裂褶菌子实体多糖理化性质、结构和生物功能的研究,对于挖掘裂褶菌的健康功效,提高裂褶菌产品附加值具有重要的理论意义。众所周知,多糖常常与蛋白质相连,这样的结构赋予多糖良好的生物活性,因而粗多糖具有较高的生物活性,一旦通过物理或化学的降解处理,会导致多糖生物活性显著下降。然而,由于裂褶菌多糖的分子量通常在百万以上,导致其在水中很难完全溶解,大大限制了裂褶菌多糖在产业中的应用。虽然有文献报道采用超声降解、羧甲基化、硫酸化等方法对裂褶多糖进行物理、化学改性,以期提高多糖水溶性,但这些方法存在衍生化试剂价格昂贵,收率偏低,产生副产物,引入新杂质以及生物活性降低等诸多问题。因此,亟需开发一种简单、高效、廉价的裂褶子实体多糖的制备方法,既能降低多糖分子量又能增强其生物活性。
技术实现要素:
针对裂褶菌子实体多糖分子量大、生物活性低、制备费用高的问题,本发明人在摸索既能降低多糖分子量又能增强其生物活性的工艺时意外发现,在对裂褶菌子实体进行高能电子流电离辐射处理,从处理的子实体中提取的裂褶菌多糖分子量显著下降;除此之外,提取的裂褶菌多糖不仅能有效提高肠道菌群多样性,促进肠道有益菌群的生长,抑制肠道中的潜在致病菌的生长,并且能有效抵御体重的增加,可作为天然、无副作用的减肥及调节肠道菌群的辅助食品。
基于上述研究成果,本发明的目的在于提供一种从有限电子流照射的裂褶菌中制备裂褶菌多糖的方法,以及其在减肥、增加肠道有益菌群中的应用,该方法降解多糖的效率高、能耗和生产成本低、降解效果和产品均一性好,并且多糖生物活性得到显著增强。为了实现上述技术目的,本发明人通过大量试验研究并不断探索,最终获得了如下技术方案:一种活性增强型裂褶菌多糖的制备方法,该方法包括如下步骤:
(1)取裂褶菌子实体,烘干后粉碎并过筛,将得到的子实体粉末装入袋中,放入电子流照射装置中进行高能电子流照射处理,所述电子流为β射线,β射线的吸收剂量为5~500kgy,辐射剂量率为10~50kgy/min;
(2)取高能电子流照射后的料粉,加入10~50倍量的水浸泡,使粉末充分吸水膨胀,调节ph值为6.0~7.0,加入复合酶进行酶解反应,酶的用量为每千克料粉加入木瓜蛋白酶5~30万u、纤维素酶3~10万u及果胶酶2~10万u,在36~37℃条件下酶解3~5h;
(3)将酶解液置于亚临界萃取釜中,进行亚临界去离子水提取,提取温度为195~250℃,反应釜压力为9.0~15.0mpa,料液比为1:8~1:15,处理时间为5~20min;完成后,加入2~5倍体积的去离子水,搅拌溶解后过滤,上清液保留并进行浓缩;
(4)将浓缩的上清液,放入-5~-20℃的冷库中反复冻融1~3次,解冻后快速离心除去蛋白等杂质,取上清液加入无水乙醇至终浓度为60~80%,3~5℃静置过夜;
(5)离心获得多糖沉淀,沉淀经真空干燥后粉碎,得裂褶菌多糖。
进一步优选地,如上所述活性增强型裂褶菌多糖的制备方法,其中步骤(1)中裂褶菌子实体被烘干后粉碎并过80目筛。
进一步优选地,如上所述活性增强型裂褶菌多糖的制备方法,其中步骤(1)中所述β射线的吸收剂量为20~100kgy,辐射剂量率为10~30kgy/min。再进一步优选地,所述β射线的吸收剂量为40~60kgy,辐射剂量率为10~15kgy/min。
进一步优选地,如上所述活性增强型裂褶菌多糖的制备方法,其中步骤(2)中酶的用量为每千克料粉加入木瓜蛋白酶10~15万u、纤维素酶4~6万u及果胶酶4~6万u。
进一步优选地,如上所述活性增强型裂褶菌多糖的制备方法,其中步骤(3)中所述亚临界去离子水提取的温度为195~210℃,反应釜压力为9.0~11.0mpa,料液比为1:10~1:15,处理时间为5~15min。
进一步优选地,如上所述活性增强型裂褶菌多糖的制备方法,其中步骤(5)得到的裂褶菌多糖的分子量为48~120kda,主要由摩尔比为(0.8~1.2):(0.3~0.5):(0.1~0.3):(5.0~6.5):(0.2~0.5)的甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸和葡萄糖组成。
另外,本发明还提供了上述制备方法得到的活性增强型裂褶菌多糖在制备调节肠道菌群结构的药品、食品或保健品中的应用,所述调节肠道菌群结构为选择性刺激肠道益生菌属akkermansiaceae,lachnospiraceae和bacteroidaceae的生长,降低lactobacillaceae属菌群及有害菌streptococcusazizii的丰度。进一步优选地,所述的药品为片剂、丸剂、分散剂、颗粒剂、喷雾剂或膏药贴剂。
与现有技术相比,本发明制备的活性增强型裂褶菌多糖中多糖含量为60%以上,且多糖溶解性增加、黏度降低,生物活性显著增强,能显著降低小鼠体重的增加,并能选择性刺激三种重要益生菌属akkermansiaceae,lachnospiraceae和bacteroidaceae的生长,降低lactobacillaceae属菌群及有害菌streptococcusazizii的丰度,有效调节肠道菌群结构并抑制肥胖的产生。除此之外,活性增强型裂褶菌多糖还增加了小鼠肠道内总scfas及乙酸、丙酸、2-甲基丙酸、戊酸和3-甲基丁酸等小分子有机酸的含量,而且通过选择性富集具有促scfas产生的lachnospiraceae,oscillibacter和blautia菌属的生长,改善了scfas介导的能量供应调控情况。综上所述:该制备方法简便、成本低,制备的活性增强型裂褶菌多糖具有良好的减肥效果,以及增加肠道有益菌群的特性。
附图说明
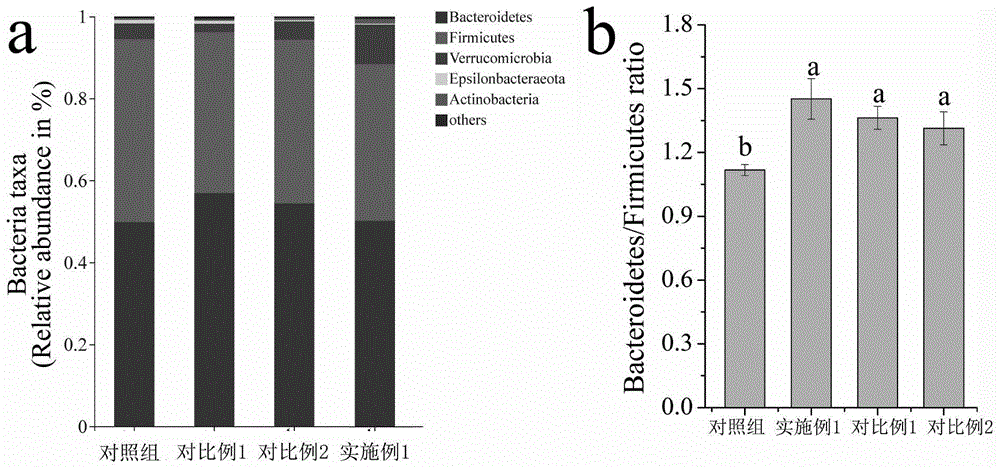
图1为各实验组小鼠肠道菌群在门分类水平上的组成及厚壁菌门与拟杆菌门细菌数量的比值;
图2为各实验组小鼠的肠道菌群组成在种水平上的差异性分析;
图3为各实验组小鼠的肠道菌群组成在科分类水平上的变化。
具体实施方式
通过以下实施例对本发明进行详细描述,以使本发明的优点和特征能更易于被本领域技术人员理解,但并不以任何方式限制本发明。在不背离本发明的技术解决方案前提下,凡是利用本发明说明书内容所作的、本领域普通科技人员易于实现的任何改动或改变都将包括在本发明的专利保护范围内。
实施例1
裂褶菌子实体烘干后粉碎并过筛,裂褶菌粉末大小为80目;取裂褶菌粉末装入袋中,放入电子流照射装置中进行电子流照射处理,其中电子流为β射线,吸收剂量为50kgy,辐射剂量率为10kgy/min;取电子流照射后的料粉,加入40倍量的水浸泡,使粉末充分吸水膨胀,调节ph值为6.2,加入复合酶,酶的用量为每千克原料加入木瓜蛋白酶12万u、纤维素酶5万u及果胶酶5万u,37℃条件下酶解3h;将酶解液置于亚临界萃取釜中,进行亚临界去离子水提取,提取温度为198℃,反应釜压力为10.2mpa,料液比为1:12,处理时间为10min;完成后,加入5倍体积的去离子水,搅拌溶解后过滤,上清液保留并浓缩,放入-15℃冷库中冻融2次,解冻后快速离心除去蛋白等杂质,取上清液加入无水乙醇至终浓度为80%(体积百分数),4℃静置过夜;离心获得多糖沉淀,沉淀经真空干燥后粉碎,得裂褶菌多糖(该裂褶菌多糖记为it-多糖)。
对比例1:从未处理的裂褶菌中提取裂褶菌多糖
裂褶菌子实体烘干后粉碎并过筛,裂褶菌粉末大小为80目;取裂褶菌粉末,加入40倍量的水浸泡,使粉末充分吸水膨胀,调节ph值为6.2,加入复合酶,酶的用量为每千克原料加入木瓜蛋白酶12万u、纤维素酶5万u及果胶酶5万u,37℃条件下酶解3h;将酶解液置于亚临界萃取釜中,进行亚临界去离子水提取,提取温度为198℃,反应釜压力为10.2mpa,料液比为1:12,处理时间为10min;完成后,加入5倍体积的去离子水,搅拌溶解后过滤,上清液保留并浓缩,放入-15℃冷库中冻融2次,解冻后快速离心除去蛋白等杂质,取上清液加入无水乙醇至终浓度为80%(体积百分数),4℃静置过夜;离心获得多糖沉淀,沉淀经真空干燥后粉碎,得裂褶菌多糖(该裂褶菌多糖记为nt-多糖)。
对比例2:有限电子流对裂褶菌多糖直接进行照射处理
将对比例1制备的nt-多糖多糖粉末装入袋中,放入电子流照射装置中进行电子流照射处理,其中电子流为β射线,吸收剂量为50kgy,辐射剂量率为10kgy/min;完成后得到裂褶菌多糖(该裂褶菌多糖记为dt-多糖)。
实验分析
(1)多糖含量测定:采用苯酚-硫酸法测定提取的粗多糖中总糖含量。
(2)平均分子量测定:采用高效液相排阻色谱法(hpsec)检测各样品的平均分子量。
(3)单糖组成测定:经三氟乙酸水解、pmp衍生化后用hplc法测定。
(4)对α-淀粉酶和α-葡萄糖苷酶抑制活性测定:
α-淀粉酶抑制活性的测定:精密吸取20.0μl不同多糖溶液(2.0mg/ml)和20.0μlα-淀粉酶溶液(1.0u/ml)混合在1.5ml离心管中,在37℃条件下水浴10min。再加入0.5%淀粉溶液40.0μl,37℃条件下继续反应10min。最后加入dns试剂80.0μl,在沸水浴中加热5min后取出。在540nm波长处测量吸光值,以阿卡波糖作为阳性对照,每个样品设3个重复。α-淀粉酶抑制率按下列公式计算:
其中,a0为空白组吸光值,即pbs(ph=7.0)代替样品;a1为样品组反应吸光值;a2为对照组吸光值,即pbs代替α-淀粉酶溶液。
α-葡萄糖苷酶抑制活性的测定:精密吸取pbs(ph=6.8)120.0μl,不同多糖溶液(2.0mg/ml)20.0μl和α-葡萄糖苷酶溶液(1000u/ml)20.0μl混合在1.5ml离心管中,在37℃条件下水浴10min。再加入20.0μl浓度为5mmol/l的pnpg,37℃下继续反应20min。最后加入80.0μl浓度为0.2mol/lna2co3溶液,充分混匀后在405nm波长处测定吸光值,以阿卡波糖作为阳性对照,每个样品设3个重复。α-葡萄糖苷酶抑制率按下列公式计算:
其中,a0为空白组吸光值,即pbs(ph=6.8)代替样品;a1为样品组反应吸光值;a2为对照组吸光值,即pbs代替α-葡萄糖苷酶溶液。
(5)动物实验:准备40只健康小鼠,雄性,体重为20~22g,并随机分为4组,每组10只,喂养于华中农业大学动物实验中心的spf级实验室。1为空白组,2为实施例1多糖组,3为对比例1多糖组,4为对比例2多糖组。25℃,12/12h光照-黑暗循环,自由饮水,不限饮食,正常喂养7天后开始实验。所有小鼠开始喂食高脂高糖饲料,同时对实验组小鼠进行多糖定量灌胃(100mg/kg体重),空白组灌入相应体积的灭菌水,每次灌胃体积均按0.1ml/10g计算。每天称重,记录数据,第二天修正灌胃数据。按照此方法连续喂养4周。喂养最后1天,收集小鼠肠道粪便(小肠,结肠,盲肠和直肠)于液氮中预冻,再转移到-80℃冰箱中保存,其中直肠粪便用于测序,小肠、结肠和盲肠粪便用于测定短链脂肪酸含量。为了保证样本量充足且减少实验误差,将组内任意3个样本混为1个样本,并设置3个重复。
(6)盲肠短链脂肪酸含量测定:称取约100mg粪便样本于2ml研磨管中,加入一颗钢珠,加入900μl甲醇和100ul内标(1000μg/ml的2-乙基丁酸,甲醇配制)于50hz冷冻研磨仪中研磨3min,重复研磨2次。然后置于冰水浴超声30min后,于-20℃静置30min,4℃、13000r/min条件下离心15min。将上清转移至1.5ml离心管中,加入50mg无水硫酸钠,涡旋,4℃、13000r/min条件下继续离心15min,取上清。使用0.22μm有机滤膜过滤,进行gc-ms检测分析。
(7)微生物菌群结构及多样性分析:小鼠直肠粪便委托公司进行肠道微生物测序(n=3)。将miseq测序得到的pereads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤得到优化序列,对优化序列提取非重复序列,去除没有重复的单序列。然后按照97%相似性对非重复序列(不含单序列)进行otu聚类,在聚类过程中去除嵌合体,得到otu的代表序列。采用rdpclassifier贝叶斯算法对97%相似水平的otu代表序列进行物种分类学分析,通过与16s细菌和古菌核糖体数据库、its真菌数据库和功能基因数据库进行比对,得到各样本的群落物种组成。基于otu可以进行多种多样性指数分析,基于otu聚类分析结果,可以对otu进行多种多样性指数分析以及对测序深度的检测;基于分类学信息,可以在各个分类水平上进行群落结构的统计分析。
结果分析
(1)不同组多糖降血糖效果、对小鼠体重以及肠道中scfa含量的影响
实施例1、对比例1和对比例2获得的多糖常规指标如下表所示。实施例1多糖中总糖含量显著高于对比例1和对比例2,蛋白质含量显著低于对比例1和对比例2。相较于对比例1,实施例1和对比例2多糖分子量显著降低,对比例2对多糖直接进行高能电子流电离辐射处理能有效降低其分子量。实施例1多糖对α-淀粉酶和α-葡萄糖苷酶抑制活性显著高于对比例1和对比例2,这表明高能电子流电离辐射处理多糖生物活性并不高,对多糖直接高能电子流电离辐射处理,虽然降低了分子量,但是生物学活性并没有显著上升。
喂养4周后,小鼠体重增加最快的是空白对照组,其次是对比例2和对比例1,增加最少的是实施例1。实施例1小鼠盲肠中scfa总量最高,达到328.52μg/ml,远高于对比例1、对比例2和空白对照组。另外,除了丁酸,实施例1小鼠盲肠中乙酸、丙酸、2-甲基丙酸、戊酸和3-甲基丁酸含量均高于对比例1、对比例2和空白对照组。整体而言,实施例1处理多糖显著提高了小鼠肠道中scfas含量。
(2)不同组多糖对小鼠肠道菌群组成和含量的影响
各实验组小鼠的肠道菌群在门分类水平上的组成及厚壁菌门与拟杆菌门细菌数量的比值如图1所示。由图1a可知:小鼠的肠道菌群主要由5个门组成,即拟杆菌门(bacteroidetes)、厚壁菌门(firmicutes)、疣微菌门(verrucomicrobia)、变形菌门(proteobacteria)和epsilonbacteraeota菌门,其中的优势菌群是拟杆菌门和厚壁菌门,两者相对丰度之和均占整个菌群的85%以上,与报道称肠腔中接近90%的微生物属于拟杆菌门和厚壁菌门的结果相一致。从图1b中可知,与对照组组相比,实施例1、对比例1和对比例2多糖的拟杆菌门/厚壁菌门比例均显著增加,这可能与前述小鼠体重增加缓慢有关。
各实验组小鼠的肠道菌群在种水平上的差异性分析如图2所示。与对照组相比,对比例2组中norank_d_bacteria,ruminococcaceae_ucg-010,flavobacteriaceae,motilimonas,hanstrueperaneustonica,γ-proteobacteria,blautia和thiohalorhabdaceae菌群相对丰度显著升高,而致病菌eggerthellaceae和streptococcus相对丰度显著降低(图2a)。与对照组相比,实施例1中bacteroidesthetaiotaomicron,brevundimonasbullata,acinetobacterlwoffii,exiguobacteriumaurantiacum等15种菌群显著增加,而eggerthellaceae和parvibacter等病原菌显著降低(图2b)。norank_f_muribaculaceae,bacteroidesthetaiotaomicron,bacteroides和parasutterella是实施例1和对比例2组之间的主要差异菌群(图2c)。
各实验组小鼠的肠道菌群组成在科分类水平上的变化如图3所示。从图3a中可以看出,拟s24-7菌科(muribaculaceae),乳杆菌科(lactobacillaceae),毛螺旋菌科(lachnospiraceae),akkermansiaceae菌科,瘤胃菌科(ruminococcaceae)和拟杆菌科(bacteroidaceae)是小鼠肠道中的优势科菌群。与对照组相比,实施例1组的拟s24-7菌科(图3b)、akkermansiaceae科(图3d)和拟杆菌科(图3g)相对含量差异显著;实施例1与对比例相比,其拟杆菌门s24-7菌科、乳杆菌科(图3c)、akkermansiaceae科和拟杆菌科相对含量显著差异。此外,与对照组组、对比例1和对比例2相比,实施例1组出现了拟杆菌科菌群。
以上的研究结果显示实施例1制备的活性增强型裂褶菌多糖能够上调拟杆菌/拟杆菌的比例,并增加了akkermansiaceae,lachnospiraceae,bacteroidaceaceae属的相对丰度,并降低了lactobacillaceae属菌群及有害菌streptococcusazizii的丰度,有效调节肠道菌群结构并抑制肥胖的产生。除此之外,实施例1制备的活性增强型裂褶菌多糖还增加了小鼠肠道内总scfas及乙酸、丙酸、2-甲基丙酸、戊酸和3-甲基丁酸等小分子有机酸的含量,而且通过选择性富集具有促scfas产生的lachnospiraceae,oscillibacter和blautia菌属的生长,改善了scfas介导的能量供应调控情况。本发明的研究结果表明,活性增强型裂褶菌多糖可以作为潜在的健康补充剂或预防肥胖的益生元。
- 还没有人留言评论。精彩留言会获得点赞!