富血小板血浆来源性外泌体的分离方法及其应用与流程
1.本发明属于外泌体提取技术领域,涉及一种富血小板血浆来源性外泌体的分离方法,还涉及了富血小板血浆来源性外泌体的应用。
背景技术:
2.腱骨结合部损伤及愈合问题广泛存在于全身各关节,在膝关节交叉韧带、肩关节肩袖以及跟腱止点等重要位置尤显突出。在美国,肌腱劳损约占运动损伤的30%~50%,每年约有20万例前交叉韧带(anterior cruciate ligament,acl)损伤;而肩袖(rotator cuff)损伤约占肩关节疾病的50%,发病率随年龄增长而逐步升高,美国每年用于肩袖手术及康复的费用高达70亿美元。尽管随着关节镜技术及相关器械的发展,交叉韧带及肩袖损伤的治疗已取得显著疗效,但韧带重建后长期疗效并不乐观,约有32%的acl重建患者预后不满意,10%需要再次手术,肩袖修复术后再断裂率也高达30%~94%。手术的成功与否很大程度上取决于腱-骨界面的生物愈合,牢固的腱骨界面愈合是是保证韧带重建成功并发挥功能先决条件。通过各种生物学方法优化腱骨愈合的速度与强度,使腱骨界面恢复至自然韧带止点的生物力学强度,是目前运动医学领域的研究热点,因此寻求生物学方法促进腱骨愈合的有效疗法尤为重要。但目前国内外尚无富血小板血浆来源性外泌体应用于腱骨愈合的报道,也无富血小板血浆来源性外泌体对骨髓间充质干细胞增殖分化作用的相关研究。
3.研究过程中发现提取分离富血小板血浆来源性外泌体,需要在无菌条件下进行,需要专业技术人员操作。现有技术中缺少操作简单且能实现无菌操作的工艺。
技术实现要素:
4.本发明的目的是针对上述问题,提供一种分离富血小板血浆来源性外泌体的离心管,还提供了富血小板血浆来源性外泌体的应用。
5.为达到上述目的,本发明采用了下列技术方案:
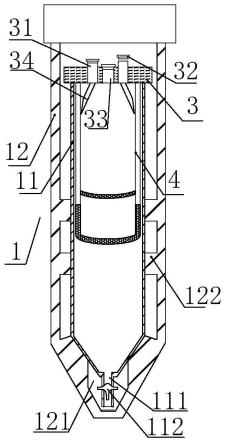
6.一种富血小板血浆来源性外泌体的分离方法,采用第一离心管和第二离心管进行分离,第一离心管包括第一离心管体、第一离心管体上侧设置的密封盖和第一离心管体外侧设有的套管,第一离心管体包括其内侧设有的滤芯、其管壁下侧设有的出液管和出液管上设有的阀门;第二离心管包括第二离心管体和第二离心管体上侧设置的密封盖,密封盖包括加液口、取液口和盖子,取液口设在密封盖的中间位置,加液口设在取液口的一侧,加液口和取液口均盖有盖子;
7.包括以下步骤,
8.1)将盖有密封盖的第一离心管体安装于套管内,从加液口添加血小板样本到第一离心管体中;离心后,从取液口取滤芯上侧液体并弃去;
9.2)从套管中取出盖有密封盖的第一离心管体,打开出液阀门,将滤芯下侧液体转移到第二离心管中;
10.3)从第二离心管的加液口加入.0-.5g/ml蔗糖溶液到第二离心管中,静置-5分钟,离心后,从取液口吸取上清液并弃去,从加液口加入pbs缓冲液到第二离心管中;
11.4)再次离心,从第二离心管的取液口吸取上清液并弃去,取剩余液体于-80℃保存,备用。
12.在上述的富血小板血浆来源性外泌体的分离方法中,滤芯包括翻边和滤芯部分,滤芯部分包括第一滤膜、第二滤膜和第三滤膜,滤芯部分下侧的侧壁设置有第一滤膜,滤芯部分的底边设置有第二滤膜,滤芯部分内腔设置有第三滤膜。
13.在上述的富血小板血浆来源性外泌体的分离方法中,第一滤膜和第二滤膜的孔径为0.15-0.35μmμm,第三滤膜的孔径为0.2-8μm。
14.在上述的富血小板血浆来源性外泌体的分离方法中,第三滤膜高于第一滤膜的上端。
15.在上述的富血小板血浆来源性外泌体的分离方法中,步骤3)中,蔗糖溶液的物质的量浓度为1.1-1.2g/ml。
16.在上述的富血小板血浆来源性外泌体的分离方法中,步骤3)中,步骤3)中,蔗糖溶液的物质的量浓度为1.05-1.2g/ml。
17.在上述的富血小板血浆来源性外泌体的分离方法中,套管包括其底壁设有的容纳腔和其内侧壁设有的至少一个环形卡件;步骤)中,将第一离心管体安装于套管内时,第一离心管体与环形卡件过盈配合,出液管安装于容纳腔内。
18.在上述的富血小板血浆来源性外泌体的分离方法中,容纳腔底壁上侧铺设缓冲垫,缓冲垫包括中间设有的圆形凸台,且出液管设在圆形凸台上方。
19.在上述的富血小板血浆来源性外泌体的分离方法中,缓冲垫为硅胶垫或者橡胶垫。
20.在上述的富血小板血浆来源性外泌体的分离方法中,步骤3)中加入pbs缓冲液至原来的液面高度。
21.在上述的富血小板血浆来源性外泌体的分离方法中,环形卡件靠近第一离心管体的侧壁设有凹凸花纹。
22.在上述的富血小板血浆来源性外泌体的分离方法中,密封盖还包括设于加液口下方的加液导管,通过加液口加入的液体经加液导管导流后,沿着滤芯侧壁或第二离心管体侧壁流向管底。
23.富血小板血浆来源性外泌体的应用,富血小板血浆来源性外泌体用于诱导肌腱干细胞增殖分化。
24.富血小板血浆来源性外泌体的应用,应用富血小板血浆来源性外泌体制备治疗腱骨愈合的组合物。
25.以上方法得到的富血小板血浆来源性外泌体在诱导肌腱干细胞增殖分化中的应用。
26.以上方法得到的富血小板血浆来源性外泌体在制备治疗腱骨愈合的组合物中的应用。
27.与现有的技术相比,本发明的优点在于:
28.(1)本发明从血小板样本中提取富血小板血浆来源性外泌体。使用密闭的第一离
心管和第二离心管进行分离,保障了在无菌条件下提取富血小板血浆来源性外泌体,提高了提取过程的效率。
29.步骤1)和步骤2)中,使用第一离心管提取富血小板血浆来源性外泌体。操作过程中,盖有密封盖的第一离心管体从加液口加入液体,通过取液口和出液管取液,保障盖有密封盖的第一离心管体始终处于密封状态,避免了细菌和病毒的干扰。
30.步骤3)和步骤4)中,第二离心管从加液口加入液体,通过取液口吸取液体,保障盖有密封盖的第一离心管体始终处于密封状态,避免了细菌和病毒的干扰。
31.(2)本发明中,初步提取出的富血小板血浆来源性外泌体从出液管取出,无需拆卸密封盖和滤芯,即可取出初步提取液,保障了在无菌条件下提取富血小板血浆来源性外泌体,提高了提取过程的效率。
32.(3)本发明中,在上清液样本中,加入1.0-1.5g/ml蔗糖溶液,使富血小板血浆来源性外泌体富集,静置后结合离心操作分离富血小板血浆来源性外泌体。其后,加入pbs缓冲液后再次离心。在蔗糖溶液和pbs缓冲液的协调作用下,富集后的富血小板血浆来源性外泌体更容易离心出来,提高了富血小板血浆来源性外泌体的提取纯度。
33.(4)步骤1)中的离心管体安装有滤芯,从而对样本进行多次过滤,实现了在无菌条件下提取富血小板血浆来源性外泌体,提高了提取过程的效率。
34.(5)经研究发现,富血小板血浆来源性外泌体具有多种重要生物学功能,能够转运血小板的主要生长因子。富血小板血浆来源性外泌体植入肩袖损伤术后腱骨界面,发现其能够促进腱骨愈合过程中生长因子的生成、有效促进肌腱干细胞成骨分化。
35.本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
36.图1是第一离心管的结构示意图。
37.图2是滤芯中翻边的位置示意图。
38.图3是缓冲垫的结构示意图。
39.图4是环形卡件表面凹凸花纹的结构示意图。
40.图5是第二离心管的结构示意图。
41.图中:第一离心管1、第一离心管体11、出液管111、阀门112、容纳腔121、缓冲垫1211、圆形凸台1212、环形卡件122、凹凸花纹1221、套管12、第二离心管2、第二离心管体21、密封盖3、加液口31、盖子32、取液口33、加液导管34、滤芯4、滤芯部分41、第一滤膜411、第二滤膜412、第三滤膜413、翻边42。
具体实施方式
42.下面结合具体附图对本发明进行进一步说明。
43.实施例1
44.富血小板血浆来源性外泌体的分离方法,如图1-5所示,采用第一离心管1和第二离心管2进行分离,第一离心管1包括第一离心管体11、第一离心管体11上侧设置的密封盖3和第一离心管体11外侧设有的套管12,第一离心管体11包括其内侧设有的滤芯4、其管壁下
侧设有的出液管111和出液管111上设有的阀门112;
45.第二离心管2包括第二离心管体21和第二离心管体21上侧设置的密封盖3;
46.密封盖3包括加液口31、取液口33和盖子32,取液口33设在密封盖3的中间位置,加液口31设在取液口33的一侧,加液口31和取液口33均盖有盖子32;
47.分离方法包括以下步骤,
48.1)将盖有密封盖3的第一离心管体11安装于套管12内,从加液口31添加血小板样本到第一离心管体11中;离心后,从取液口33取滤芯4上侧液体并弃去;
49.2)从套管12中取出盖有密封盖3的第一离心管体11,打开出液阀门112,将滤芯4下侧液体转移到第二离心管2中;
50.3)从第二离心管2的加液口31加入1.0g/ml蔗糖溶液到第二离心管2中,静置2-5分钟,离心后,从取液口33吸取上清液并弃去,从加液口31加入pbs缓冲液到第二离心管2中;
51.4)再次离心,从第二离心管2的取液口33吸取上清液并弃去,取剩余液体于-80℃保存,备用。
52.优选方案,滤芯4包括翻边42和滤芯部分41,滤芯部分41包括第一滤膜411、第二滤膜412和第三滤膜413,滤芯部分41下侧的侧壁设置有第一滤膜411,滤芯部分41的底边设置有第二滤膜412,滤芯部分41内腔设置有第三滤膜413。翻边42安装于第一离心管体11侧壁的上端,一方面翻边42结构便于滤芯4的安装,另一方面也能保障滤芯4在离心时固定比较牢固。
53.优选方案,第一滤膜411和第二滤膜412的孔径为0.15μmμm,第三滤膜413的孔径为0.2μm。第一滤膜411和第二滤膜412的滤孔小于第三滤膜413的滤孔,从样本中的大颗粒经过两次过滤分离出富血小板血浆来源性外泌体。即离心过滤后,样本中的大颗粒留在滤膜上侧,滤膜下侧为离心和过滤后的富血小板血浆来源性外泌体。以上提到的滤膜分布结构及滤膜孔径大小分布实现了两次过滤,对样本中富血小板血浆来源性外泌体的分离效果更佳。据此得到的富血小板血浆来源性外泌体更纯,便于排出样本中的干扰因子,利于观察富血小板血浆来源性外泌体对腱骨愈合的效果。
54.优选方案,套管12包括其底壁设有的容纳腔121和其内侧壁设有的至少一个环形卡件122;步骤1)中,将第一离心管体11安装于套管12内时,第一离心管体11与环形卡件122过盈配合,出液管111安装于容纳腔121内。环形卡件122与第一离心管体11过盈配合,便于固定第一离心管体11的外侧壁。使其在离心过程中与外套管之间不发生相对位移。容纳腔121为出液管111提供了空间,起到保护出液管111的作用,避免了出液管111随着离心或设备转移而破损情况的发生。
55.优选方案,容纳腔121底壁上侧铺设缓冲垫1211,缓冲垫1211包括中间设有的圆形凸台1212,且出液管111设在圆形凸台1212上方。缓冲垫1211为硅胶垫或者橡胶垫。缓冲垫1211的中间的圆形区域厚度增加而形成圆形凸台1212,在转移设备或者离心过程中起到保护出液管111的作用。
56.优选方案,环形卡件122靠近第一离心管体11的侧壁设有凹凸花纹1221。环形卡件122表面设有凹凸花纹1221,便于夹持第一离心管体11的外侧壁。并且,在离心过程中,夹持第一离心管体11的凹凸花纹1221起到缓冲的作用。
57.优选方案,步骤3)中加入pbs缓冲液至原来的液面高度。
58.优选方案,密封盖3还包括设于加液口31下方的加液导管34,通过加液口31加入的液体经加液导管34导流后,沿着滤芯4侧壁或第二离心管体21侧壁流向管底。加液导管34呈倾斜设置,加液导管34的下侧开口较其上侧更靠近滤芯4的内侧壁或第二离心管2的内侧壁,从而将液体沿着滤芯4的内侧壁或第二离心管2的内侧壁进入离心管体11或第二离心管体21。加液导管34的开口处设置为斜切面,便于体液样本的倒流。
59.实施例2
60.富血小板血浆来源性外泌体的分离方法,如图1-5所示,采用第一离心管1和第二离心管2进行分离,第一离心管1包括第一离心管体11、第一离心管体11上侧设置的密封盖3和第一离心管体11外侧设有的套管12,第一离心管体11包括其内侧设有的滤芯4、其管壁下侧设有的出液管111和出液管111上设有的阀门112;
61.第二离心管2包括第二离心管体21和第二离心管体21上侧设置的密封盖3;
62.密封盖3包括加液口31、取液口33和盖子32,取液口33设在密封盖3的中间位置,加液口31设在取液口33的一侧,加液口31和取液口33均盖有盖子32;
63.分离方法包括以下步骤,
64.1)将盖有密封盖3的第一离心管体11安装于套管12内,从加液口31添加血小板样本到第一离心管体11中;离心后,从取液口33取滤芯4上侧液体并弃去;
65.2)从套管12中取出盖有密封盖3的第一离心管体11,打开出液阀门112,将滤芯4下侧液体转移到第二离心管2中;
66.3)从第二离心管2的加液口31加入1.5g/ml蔗糖溶液到第二离心管2中,静置2-5分钟,离心后,从取液口33吸取上清液并弃去,从加液口31加入pbs缓冲液到第二离心管2中;
67.4)再次离心,从第二离心管2的取液口33吸取上清液并弃去,取剩余液体于-80℃保存,备用。
68.优选方案,滤芯4包括翻边42和滤芯部分41,滤芯部分41包括第一滤膜411、第二滤膜412和第三滤膜413,滤芯部分41下侧的侧壁设置有第一滤膜411,滤芯部分41的底边设置有第二滤膜412,滤芯部分41内腔设置有第三滤膜413。翻边42安装于第一离心管体11侧壁的上端,一方面翻边42结构便于滤芯4的安装,另一方面也能保障滤芯4在离心时固定比较牢固。
69.优选方案,第一滤膜411和第二滤膜412的孔径为0.35μmμm,第三滤膜413的孔径为8μm。第一滤膜411的下侧与第二滤膜412的边缘相连且设置为一体。第一滤膜411和第二滤膜412的滤孔小于第三滤膜413的滤孔,从样本中的大颗粒经过两次过滤分离出富血小板血浆来源性外泌体。即离心过滤后,样本中的大颗粒留在滤膜上侧,滤膜下侧为离心和过滤后的富血小板血浆来源性外泌体。以上提到的滤膜分布结构及滤膜孔径大小分布实现了两次过滤,对样本中富血小板血浆来源性外泌体的分离效果更佳。据此得到的富血小板血浆来源性外泌体更纯,便于排出样本中的干扰因子,利于观察富血小板血浆来源性外泌体对腱骨愈合的效果。
70.优选方案,套管12包括其底壁设有的容纳腔121和其内侧壁设有的至少一个环形卡件122;步骤1)中,将第一离心管体11安装于套管12内时,第一离心管体11与环形卡件122过盈配合,出液管111安装于容纳腔121内。环形卡件122与第一离心管体11过盈配合,便于固定第一离心管体11的外侧壁。使其在离心过程中与外套管之间不发生相对位移。容纳腔
121为出液管111提供了空间,起到保护出液管111的作用,避免了出液管111随着离心或设备转移而破损情况的发生。
71.优选方案,容纳腔121底壁上侧铺设缓冲垫1211,缓冲垫1211包括中间设有的圆形凸台1212,且出液管111设在圆形凸台1212上方。缓冲垫1211为硅胶垫或者橡胶垫。缓冲垫1211的中间的圆形区域厚度增加而形成圆形凸台1212,在转移设备或者离心过程中起到保护出液管111的作用。
72.优选方案,环形卡件122靠近第一离心管体11的侧壁设有凹凸花纹1221。环形卡件122表面设有凹凸花纹1221,便于夹持第一离心管体11的外侧壁。并且,在离心过程中,夹持第一离心管体11的凹凸花纹1221起到缓冲的作用。
73.优选方案,步骤3)中加入pbs缓冲液至原来的液面高度。
74.优选方案,密封盖3还包括设于加液口31下方的加液导管34,通过加液口31加入的液体经加液导管34导流后,沿着滤芯4侧壁或第二离心管体21侧壁流向管底。加液导管34呈倾斜设置,加液导管34的下侧开口较其上侧更靠近滤芯4的内侧壁或第二离心管2的内侧壁,从而将液体沿着滤芯4的内侧壁或第二离心管2的内侧壁进入离心管体11或第二离心管体21。加液导管34的开口处设置为斜切面,便于体液样本的倒流。
75.实施例3
76.富血小板血浆来源性外泌体的分离方法,如图1-5所示,采用第一离心管1和第二离心管2进行分离,第一离心管1包括第一离心管体11、第一离心管体11上侧设置的密封盖3和第一离心管体11外侧设有的套管12,第一离心管体11包括其内侧设有的滤芯4、其管壁下侧设有的出液管111和出液管111上设有的阀门112;第二离心管2包括第二离心管体21和第二离心管体21上侧设置的密封盖3,密封盖3包括加液口31、取液口33和盖子32,取液口33设在密封盖3的中间位置,加液口31设在取液口33的一侧,加液口31和取液口33均盖有盖子32;
77.分离方法包括以下步骤,
78.1)将盖有密封盖3的第一离心管体11安装于套管12内,从加液口31添加血小板样本到第一离心管体11中,盖上套管12的盖子后离心;离心后,卸下套管12的盖子后,离心后,从取液口33取滤芯4上侧液体并弃去;
79.2)从套管12中取出盖有密封盖3的第一离心管体11,打开出液阀门112,将滤芯4下侧液体转移到第二离心管2中;
80.3)从第二离心管2的加液口31加入1.1g/ml蔗糖溶液到第二离心管2中,静置2-5分钟,离心后,从取液口33吸取上清液并弃去,从加液口31加入pbs缓冲液到第二离心管2中;
81.4)再次离心,从第二离心管2的取液口33吸取上清液并弃去,取剩余液体于-80℃保存,备用。
82.优选方案,滤芯4包括翻边42和滤芯部分41,滤芯部分41包括第一滤膜411、第二滤膜412和第三滤膜413,滤芯部分41下侧的侧壁设置有第一滤膜411,滤芯部分41的底边设置有第二滤膜412,滤芯部分41内腔设置有第三滤膜413。
83.优选方案,第一滤膜411和第二滤膜412的孔径为0.2μmμm,第三滤膜413的孔径为1μm。
84.优选方案,套管12包括其底壁设有的容纳腔121和其内侧壁设有的至少一个环形
卡件122;步骤1)中,将第一离心管体11安装于套管12内时,第一离心管体11与环形卡件122过盈配合,出液管111安装于容纳腔121内。
85.优选方案,容纳腔121底壁上侧铺设缓冲垫1211,缓冲垫1211包括中间设有的圆形凸台1212,且出液管111设在圆形凸台1212上方。缓冲垫1211为硅胶垫或者橡胶垫。
86.优选方案,环形卡件122靠近第一离心管体11的侧壁设有凹凸花纹1221。
87.优选方案,步骤3)中加入pbs缓冲液至原来的液面高度。
88.优选方案,密封盖3还包括设于加液口31下方的加液导管34,通过加液口31加入的液体经加液导管34导流后,沿着滤芯4侧壁或第二离心管体21侧壁流向管底。
89.实施例4
90.富血小板血浆来源性外泌体的分离方法,如图1-5所示,采用第一离心管1和第二离心管2进行分离,第一离心管1包括第一离心管体11、第一离心管体11上侧设置的密封盖3和第一离心管体11外侧设有的套管12,第一离心管体11包括其内侧设有的滤芯4、其管壁下侧设有的出液管111和出液管111上设有的阀门112;
91.第二离心管2包括第二离心管体21和第二离心管体21上侧设置的密封盖3;
92.密封盖3包括加液口31、取液口33和盖子32,取液口33设在密封盖3的中间位置,加液口31设在取液口33的一侧,加液口31和取液口33均盖有盖子32;
93.分离方法包括以下步骤,
94.1)将盖有密封盖3的第一离心管体11安装于套管12内,从加液口31添加血小板样本到第一离心管体11中,盖上套管12的盖子后离心;离心后,卸下套管12的盖子后,从取液口33取滤芯4上侧液体并弃去;
95.2)从套管12中取出盖有密封盖3的第一离心管体11,打开出液阀门112,将滤芯4下侧液体转移到第二离心管2中;
96.3)从第二离心管2的加液口31加入1.05g/ml蔗糖溶液到第二离心管2中,静置2-5分钟,离心后,从取液口33吸取上清液并弃去,从加液口31加入pbs缓冲液到第二离心管2中;
97.4)再次离心,从第二离心管2的取液口33吸取上清液并弃去,取剩余液体于-80℃保存,备用。
98.优选方案,滤芯4包括翻边42和滤芯部分41,滤芯部分41包括第一滤膜411、第二滤膜412和第三滤膜413,滤芯部分41下侧的侧壁设置有第一滤膜411,滤芯部分41的底边设置有第二滤膜412,滤芯部分41内腔设置有第三滤膜413。
99.优选方案,第一滤膜411和第二滤膜412的孔径为0.18μmμm,第三滤膜413的孔径为5μm。
100.优选方案,套管12包括其底壁设有的容纳腔121和其内侧壁设有的至少一个环形卡件122;步骤1)中,将第一离心管体11安装于套管12内时,第一离心管体11与环形卡件122过盈配合,出液管111安装于容纳腔121内。
101.优选方案,容纳腔121底壁上侧铺设缓冲垫1211,缓冲垫1211包括中间设有的圆形凸台1212,且出液管111设在圆形凸台1212上方。缓冲垫1211为硅胶垫或者橡胶垫。
102.优选方案,环形卡件122靠近第一离心管体11的侧壁设有凹凸花纹1221。
103.优选方案,步骤3)中加入pbs缓冲液至原来的液面高度。
104.优选方案,密封盖3还包括设于加液口31下方的加液导管34,通过加液口31加入的液体经加液导管34导流后,沿着滤芯4侧壁或第二离心管体21侧壁流向管底。
105.实施例5
106.富血小板血浆来源性外泌体的分离方法,如图1-5所示,采用第一离心管1和第二离心管2进行分离,第一离心管1包括第一离心管体11、第一离心管体11上侧设置的密封盖3和第一离心管体11外侧设有的套管12,第一离心管体11包括其内侧设有的滤芯4、其管壁下侧设有的出液管111和出液管111上设有的阀门112;第二离心管2包括第二离心管体21和第二离心管体21上侧设置的密封盖3,密封盖3包括加液口31、取液口33和盖子32,取液口33设在密封盖3的中间位置,加液口31设在取液口33的一侧,加液口31和取液口33均盖有盖子32;
107.分离方法包括以下步骤,
108.1)将盖有密封盖3的第一离心管体11安装于套管12内,从加液口31添加血小板样本到第一离心管体11中;离心后,从取液口33取滤芯4上侧液体并弃去;
109.2)从套管12中取出盖有密封盖3的第一离心管体11,打开出液阀门112,将滤芯4下侧液体转移到第二离心管2中;
110.3)从第二离心管2的加液口31加入1.2g/ml蔗糖溶液到第二离心管2中,静置2-5分钟,离心后,从取液口33吸取上清液并弃去,从加液口31加入pbs缓冲液到第二离心管2中;
111.4)再次离心,从第二离心管2的取液口33吸取上清液并弃去,取剩余液体于-80℃保存,备用。
112.优选方案,滤芯4包括翻边42和滤芯部分41,滤芯部分41包括第一滤膜411、第二滤膜412和第三滤膜413,滤芯部分41下侧的侧壁设置有第一滤膜411,滤芯部分41的底边设置有第二滤膜412,滤芯部分41内腔设置有第三滤膜413。
113.优选方案,第一滤膜411和第二滤膜412的孔径为0.16μmμm,第三滤膜413的孔径为0.3μm。
114.优选方案,套管12包括其底壁设有的容纳腔121和其内侧壁设有的至少一个环形卡件122;步骤1)中,将第一离心管体11安装于套管12内时,第一离心管体11与环形卡件122过盈配合,出液管111安装于容纳腔121内。
115.优选方案,容纳腔121底壁上侧铺设缓冲垫1211,缓冲垫1211包括中间设有的圆形凸台1212,且出液管111设在圆形凸台1212上方。缓冲垫1211为硅胶垫或者橡胶垫。
116.优选方案,环形卡件122靠近第一离心管体11的侧壁设有凹凸花纹1221。
117.优选方案,步骤3)中加入pbs缓冲液至原来的液面高度。
118.优选方案,密封盖3还包括设于加液口31下方的加液导管34,通过加液口31加入的液体经加液导管34导流后,沿着滤芯4侧壁或第二离心管体21侧壁流向管底。
119.对比例
120.对比例1与实施例5基本相同,不同之处在于,步骤3)中不加入蔗糖溶液。
121.对比例2与实施例5基本相同,不同之处在于,步骤3)中不加入pbs缓冲液。
122.对比例3与实施例5基本相同,不同之处在于,步骤1)中的离心管不使用滤芯。
123.(1)造模与分组:对30只大耳白兔构建兔肩袖损伤术后腱骨修复动物模型,按照动物实验科研设计常用分组方法随机(随机数字表法)分为7组,其中实施例1-5组(兔建模完
成后,将实施例1-5收集到的prp-exos注入腱骨界面内);对比例1和2组(兔建模完成后,腱骨界面注射对比例1和2收集到的prp-exos)。
124.(2)术后3、6、12周分析腱骨界面骨性结构的生成情况,如表1所示。
125.表1
[0126][0127][0128]
通过表1可知,与对比例1-2中的损伤腱骨愈合情况相比,实施例1-5中提取的富血小板血浆来源性外泌体,可以有效促进腱骨愈合过程中生长因子的生成、有效促进肌腱干细胞成骨分化;可见在提取过程中,在蔗糖溶液和pbs缓冲液的协同作用下,提取到的富血小板血浆来源性外泌体促进肌腱干细胞成骨分化的效果更佳。与对比例3中的损伤腱骨愈合情况相比,实施例1-5中提取的富血小板血浆来源性外泌体,也可以有效促进肌腱干细胞成骨分化。
[0129]
可见,在分离富血小板血浆来源性外泌体的过程中,步骤1)中使用滤芯离心,配合使用蔗糖溶液和pbs缓冲液,分离出的富血小板血浆来源性外泌体纯度更高,干扰因子更少,可以有效促进肌腱干细胞成骨分化。
[0130]
应用例1
[0131]
以上实施例方法得到的富血小板血浆来源性外泌体在诱导肌腱干细胞增殖分化中的应用。
[0132]
应用例2
[0133]
以上实施例方法得到的富血小板血浆来源性外泌体在制备治疗腱骨愈合的组合物中的应用。
[0134]
优选方案,治疗腱骨愈合的组合物包括富血小板血浆来源性外泌体和药物载体;药物载体为富血小板血浆、注射用生理盐水、水凝胶和生物膜中的一种或几种。富血小板血浆来源性外泌体的浓度为0.1-5mg/ml。
[0135]
(1)制备治疗腱骨愈合的组合物,治疗腱骨愈合的组合物包括实施例1收集到的prp-exos富血小板血浆来源性外泌体和药物载体;药物载体为富血小板血浆、注射用生理盐水、水凝胶和生物膜的混合液。富血小板血浆来源性外泌体的浓度为2mg/ml。
[0136]
(2)造模与分组:对30只大耳白兔构建兔肩袖损伤术后,随机(随机数字表法)分为两组,其中实验组(每天注射一次步骤1制备的治疗腱骨愈合的组合物);空白组(每天注射一次统计量的生理盐水)。
[0137]
(3)术后3、6、12周分析腱骨界面骨性结构的生成情况,如表2所示。
[0138]
表2
[0139][0140]
通过表2可知,与空白组中的兔肩袖损伤术后愈合情况相比,实验组制备的治疗腱骨愈合的组合物,肩袖损伤后愈合效果更佳。可见,实验组制备的治疗腱骨愈合的组合物可以有效促进腱骨愈合过程中生长因子的生成、有效促进肌腱干细胞成骨分化。
[0141]
本文中所描述的具体实施例仅仅是对本发明精神作举例说明。本发明所属技术领域的技术人员可以对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,但并不会偏离本发明的精神或者超越所附权利要求书所定义的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1