一种基于苯并噻唑酚-半花菁体系的荧光探针及其制备方法和应用
本发明属于荧光探针检测技术领域,具体涉及一种基于苯并噻唑酚-半花菁体系的荧光探针及其制备方法和应用。
背景技术:
线粒体是重要的能量供应细胞器,在细胞代谢中发挥重要作用,包括能量产生、细胞活性氧(ros)产生、钙调节、氧化还原信号传导、细胞凋亡触发等。线粒体的特定ph值也与其功能密切相关,并直接影响所有的生化过程,因此其在生理条件下维持一个碱性基质(ph~8),当质子穿过内膜时,提供一个质子动力(ψh+),驱动通过h+-atp合酶产生atp,离子和代谢产物进入线粒体;同时,质子动力可以进一步调节na+/k+/ca2+稳态,进而调节脱氢酶活性,与atp合酶、腺嘌呤核苷酸转位酶和三羧酸(tca)循环结合。当线粒体ph值遭到破坏时,在线粒体中则会产生过量的活性氧,其可进一步诱导线粒体自噬、凋亡和酸化。更重要的是,线粒体自噬导致的ph异常与各种病理状况密切相关,包括神经代谢性疾病、心血管疾病、雷氏综合征等。因此,迫切需要开发一种能够实时定量检测线粒体ph变化的方法来阐明线粒体相关的生理和病理过程。
荧光分析方法由于其优异的灵敏度、高选择性和空间分辨率,已经成为一种优秀的检测技术,在现代生物分析和实时生物成像线粒体ph中越来越受到关注。为了靶向定位检测线粒体内的ph,人们早期开发了绿色荧光蛋白(gfp)突变体。然而此方法存在各种干扰因素,如不恰当的蛋白表达和错误折叠成非荧光状态,可导致结果不准确。与之相反,小分子荧光探针由于受到生物体的干扰较少,更容易应用于活细胞的检测;并且,与采用单一探测窗口的强度荧光探针相比,比率荧光探针通过对两个发射波段的自校准,具有准确、定量的测量效果。然后迄今为止,鲜有比率荧光探针用于监测线粒体ph值,而且这些探针的pka值大多在酸性/中性(6.2-7.4)范围,远不是检测线粒体ph值(ph~8.0)的理想范围。
因此,需要进一步研究开发一种新的荧光探针用于线粒体ph检测。
技术实现要素:
有鉴于此,本发明的目的之一在于提供一种基于苯并噻唑酚-半花菁体系的荧光探针;本发明的目的之二在于提供一种基于苯并噻唑酚-半花菁体系的荧光探针的制备方法;本发明的目的之三在于提供一种基于苯并噻唑酚-半花菁体系的荧光探针在检测ph方面的应用。
为达到上述目的,本发明提供如下技术方案:
1.一种基于苯并噻唑酚-半花菁体系的荧光探针,所述荧光探针的化学结构式如下所示:
2.上述荧光探针的制备方法,所述合成的路线为:
优选的,所述合成的具体方法包括如下步骤:
(1)将苯并噻唑苯酚和六亚甲基四胺按照1:1~1.2的物质的量之比混合,加入三氟乙酸使其溶解,在油浴中搅拌回流6h,冷却后调节ph至中性,减压抽滤后用饱和食盐水洗涤,再通过硅胶柱层析法纯化得到化合物2;
(2)将化合物2和半花菁衍生物溶解在乙醇中,然后滴加哌啶,油浴中混合搅拌回流;
(3)步骤(2)中搅拌回流后的产物减压蒸馏得到固体产物,通过硅胶柱层析法即可得荧光探针1。
进一步优选的,步骤(1)中所述半花菁衍生物的结构式为:
进一步优选的,步骤(1)中所述油浴温度为75℃,所述回流反应时间为6h。
进一步优选的,步骤(2)中所述化合物2和半花菁衍生物的物质的量之比为1:1~1.2。
进一步优选的,步骤(2)中所述哌啶的添加标准为:每1mmol化合物2滴加1滴哌啶。
进一步优选的,步骤(2)中所述搅拌回流具体为在80℃下搅拌回流2h以上。
进一步优选的,步骤(1)中硅胶柱层析法采用体积比为10:1的石油醚和乙酸乙酯作为洗脱剂;
步骤(3)中所述硅胶柱层析法中洗脱剂为二氯甲烷和甲醇按照50:1的体积比混合而成。
3.上述荧光探针在检测ph方面的应用。
本发明的有益效果在于:本发明提供了一种基于苯并噻唑酚-半花菁体系的荧光探针,该荧光探针具有较强的灵敏度和选择性、响应速度快、较宽的线性检测范围(ph3.0-10.0)以及合适的pka值(7.92),该探针可在裸眼比色下对待测物的ph进行半定量,可以用于高通量大样本的检测;并且其具有良好的生物相容性、细胞毒性低,还可用于线粒体ph值的实时监测,在由线粒体ph异常导致的各种病理过程中具有潜在、广阔的应用前景;本发明还提供了该荧光探针的制备方法,具有反应条件温和、后处理方便、收率高、成本低等优点。
本发明的其他优点、目标和特征在某种程度上将在随后的说明书中进行阐述,并且在某种程度上,基于对下文的考察研究对本领域技术人员而言将是显而易见的,或者可以从本发明的实践中得到教导。本发明的目标和其他优点可以通过下面的说明书来实现和获得。
附图说明
为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作优选的详细描述,其中:
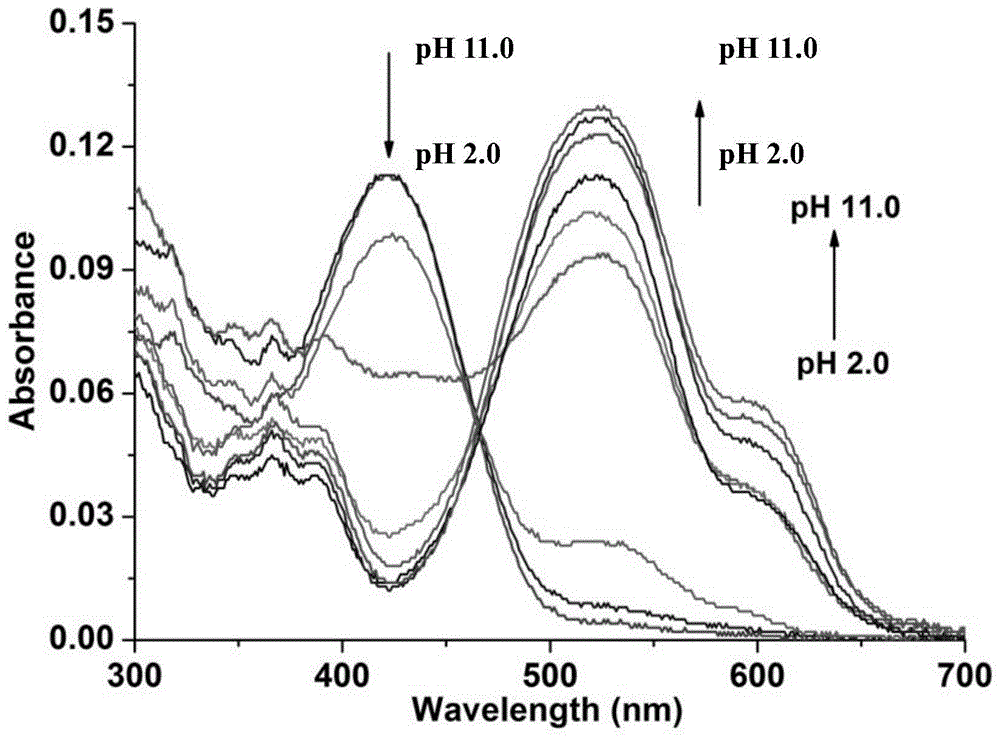
图1为ph对实施例1中制备的荧光探针1(probe1)的紫外-可见吸收光谱的影响;
图2为ph对实施例1中制备的荧光探针1(probe1)的荧光光谱的影响;
图3为实施例1中制备的荧光探针1(probe1)对ph的选择性选择;
图4为实施例1中制备的荧光探针1(probe1)对ph的定性检测;
图5为实施例1中制备的荧光探针1(probe1)对ph的定量检测,其中a为ph为6.0、6.5、7.0、7.5、8.0、8.5时,测试得到的荧光光谱和荧光强度比值r、b为ph为8.5、9.0、9.5、10.0时,测试得到的荧光光谱和荧光强度比值r、c为ph为3.0~6.5时,测试得到的荧光光谱和选择ph分别为3.0、4.0、5.0、6.0、6.5荧光强度比值r;
图6为荧光探针1(probe1)与mito-tracker-green的共定位情况,其中a~h分别表示:荧光探针1(probe1)在蓝色通道(a)、黄色通道下的细胞成像(b)、细胞成像a和b的叠加图(c)、mito-tracker-green在绿色通道下的荧光成像(d)、细胞成像c和d的叠加图(e)、细胞成像e和明场成像的叠加图(f)、荧光强度相关图(g)、穿过海拉细胞白线段的荧光强度分布图(h);
图7为荧光探针1(probe1)在不同ph中与海拉细胞共孵育后的共聚焦荧光显微镜下观察到的荧光成像强度变化图。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。需要说明的是,在不冲突的情况下,以下实施例及实施例中的特征可以相互组合。
实施例1
一种基于苯并噻唑酚-半花菁体系的荧光探针1,其结构式如下所示:
该探针的制备反应式为:
具体的制备方法如下:
(1)在50ml圆底烧瓶中依次加入2mmol苯并噻唑苯酚(454mg)和2mmol六亚甲基四胺(280mg)后,将其溶于10ml的三氟乙酸中,在75℃的油浴中用磁力搅拌器搅拌回流6h,冷却至室温,用naoh调节ph至中性,减压抽滤得到淡黄色固体,继续用饱和食盐水洗涤;粗产物通过硅胶柱层析法,采用体积比为10:1的石油醚和乙酸乙酯作为洗脱剂纯化得到化合物2;
(2)将1mmol化合物2(255mg)和1mmol半花菁衍生物(302mg)加入100ml圆底烧瓶中,加25ml乙醇溶解,滴加1滴哌啶后在80℃的油浴中,用磁力搅拌器搅拌回流2h,然后减压蒸馏蒸发出溶剂,得到固体粗产物,其中半花菁衍生物的结构式为:
(3)上述粗产物通过硅胶柱层析法进行纯化(洗脱剂中二氯甲烷和甲醇的体积比为50:1),即可得到317mg荧光探针1(probe1)。
probe1(产率:59%):1hnmr(400mhz,dmso-d6)δ=8.97(t,j=7.2,1h),8.55(d,j=16.3,1h),8.39(dd,j=8.8,2.0,1h),8.16(d,j=7.9,1h),8.08(d,j=8.1,1h),7.86-7.79(m,1h),7.56(dd,j=14.3,7.4,1h),7.45(d,j=7.1,1h),7.43-7.37(m,1h),7.22(d,j=8.8,1h),7.16(d,j=5.5,1h),4.10(s,1h),1.79(s,1h).13cnmr(100mhz,dmso-d6)δ181.98,163.92,161.90,153.41,151.86,143.95,142.39,135.36,134.73,133.08,129.47,129.41,127.13,126.95,126.66,125.80,123.34,122.74,120.25,118.87,115.36,111.14,52.47,51.97,34.86,29.51.
esi-msm/z[(m-i)+]:411.1
实施例2
对实施例1中制备的基于苯并噻唑酚-半花菁体系的荧光探针1(probe1)进行性能检测,具体如下:
1、ph对基于苯并噻唑酚-半花菁体系的荧光探针1(probe1)的紫外-可见吸收光谱的影响:
将5μm荧光探针1(probe1)加入具有不同ph值的b-r缓冲溶液(ph分别为2.0、3.0、4.0、5.0、6.0、7.0、8.0/9.0、10.0)中,溶解后测试其在300~700nm范围内的紫外-可见吸收光谱。测试结果如图1所示,随着b-r缓冲溶液ph值从2.0到10.0变化,荧光探针1(probe1)在365nm和423nm处的吸收峰强度逐渐减弱、在在523nm和595nm处出现新的吸收峰且吸收峰强度逐渐增强,且出现最大吸收峰出现红移,在465nm处有明显的等吸收点。由此说明ph能够影响荧光探针1(probe1)的紫外-可见吸收分的位置和吸收光谱的强度。
2、ph对基于苯并噻唑酚-半花菁体系的荧光探针1(probe1)的荧光光谱的影响:
将5μm荧光探针1(probe1)加入具有不同ph值的b-r缓冲溶液(ph分别为2.0、3.0、4.0、5.0、6.0、7.0、8.0/9.0、10.0、11.0)中,溶解后测试其在370nm波长激发下荧光光谱。测试结果如图2所示,随着b-r缓冲溶液ph值从2.0到10.0变化,荧光探针1(probe1)在576nm处的荧光峰强度下降、458nm处的荧光峰强度增强,且荧光探针1(probe1)显示的红色荧光变为蓝色荧光,表现出对ph值的比率型响应方式。由此说明ph能够影响荧光探针1(probe1)的荧光光谱的强度。
3、基于苯并噻唑酚-半花菁体系的荧光探针1(probe1)对ph的选择性选择:
向含有5μm荧光探针1(probe1)的ph=7.4的b-r缓冲溶液中,分别加入25μm的其他生物相关分析物(分别为k+、zn2+、ca2+、fe2+、no2-、clo-、so32-、h2s、h2o2、gsh、cys、hcy),测试加入前后溶液的荧光光谱和荧光强度的变化。测试结果如图3所示,在加入其他生物相关分析物(分别为k+、zn2+、ca2+、fe2+、no2-、clo-、so32-、h2s、h2o2、gsh、cys、hcy)后,含有5μm荧光探针1(probe1)的ph=7.4的b-r缓冲溶液的荧光光谱和荧光强度比没有明显变化。由此可证,荧光探针1(probe1)在即使含有其他生物相关分析物(k+、zn2+、ca2+、fe2+、no2-、clo-、so32-、h2s、h2o2、gsh、cys、hcy)时,仍然可以高选择性、高灵敏性的检测ph。
4、基于苯并噻唑酚-半花菁体系的荧光探针1(probe1)对ph的定性检测:
将5μm荧光探针1(probe1)加入具有不同ph值的b-r缓冲溶液(ph分别为2.0、3.0、4.0、5.0、6.0、7.0、8.0/9.0、10.0、11.0)中,观察溶液在可见光下的颜色变化。颜色变化如图4所示,随着ph值的增加,裸眼可见溶液颜色由浅黄色变为深紫色;其中ph值≤5时为黄色,且ph值越小,黄色越浅;当ph值≥6时为紫色且ph值越大,紫色越深。由此说明荧光探针1(probe1)可以用来定性检测溶液的ph值大小。
5、基于苯并噻唑酚-半花菁体系的荧光探针1(probe1)对ph的定量检测:
将5μm荧光探针1(probe1)加入具有不同ph值的b-r缓冲溶液(ph分别为3.0、4.0、5.0、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、11.0)中,分别测试荧光强度变化,结果如图5所示。当ph为3.0-6.5时,测试得到的荧光光谱和分别选择其中ph为3.0、4.0、5.0、6.0、6.5时的荧光强度比值r(其中r为458nm和576nm处荧光强度的比值)如图5中c所示;当ph为6.0、6.5、7.0、7.5、8.0、8.5时,测试得到的荧光光谱和荧光强度比值r(其中r为458nm和576nm处荧光强度的比值)如图5中a所示;当ph为8.5、9.0、9.5、10.0时,测试得到的荧光光谱和荧光强度比值r(其中r为458nm和576nm处荧光强度的比值)如图5中b所示。从图5可知,当ph值从3.0增加到10.0时,荧光强度比值r(i458/i576)从0.14增大到5.86,即显著gsh增加了42倍;而且在ph=6~8.5(r2=0.9972)和8.5-10.0(r2=0.9923)的ph范围内,比值r与ph呈线性关系(图5a和5b);此外,当ph值从10.0降低到3.0时,r’(i576/i458)与ph的反比显示出43倍(从0.16到6.92)的增加,并且在ph范围3.0~6.5(r2=0.9814)中呈线性关系(图5c)。因此,通过两组比率数据分析,荧光探针1(probe1)在很宽的范围内(ph3.0~10.0)对ph值都具有比率响应,说明本发明的荧光探针1(probe1)可以很好的定量检测溶液的ph值大小,并且可以计算荧光探针1(probe1)的pka=7.92。
实施例3
由于荧光探针1(probe1)的pka=7.92,故非常适合于线粒体碱性(ph~8.0)基质变化的监测和成像。采用实施例1中制备的基于苯并噻唑酚-半花菁体系的荧光探针1(probe1)检测线粒体中的ph值,具体检测如下:
采用来源于湖南大学生物医学工程中心的hela细胞,在添加了10%(v/v)的胎牛血清、青霉素(100μg/ml)和链霉素(100μg/ml)的dmem培养基中进行增殖。在细胞成像研究中,首先将细胞接种到共聚焦培养皿中,并在37℃的5%co2培养箱中培养24h;然后用pbs缓冲液(ph=7.4)洗涤细胞三次,分为若干组。荧光图像是通过使用波长为760nm的锁模钛蓝宝石激光源(maitaideepsee,80mhz,90fs)激发探针,利用olympusfv1000激光共聚焦显微镜ix81、60物镜、数值孔径(na)=0.7、变焦*2获得的。图像信号由内部pmts以40hz的扫描速度、800×800像素采集。
荧光探针1(probe1)通过与线粒体特异性荧光染料mito-tracker-green在hela细胞中的共定位实验,验证了其具有线粒体靶向性。具体实验方法如下:用mito-tracker-green(100nm)与荧光探针1(probe1)共染细胞,先在培养基中加入5μm荧光探针1(probe1),和细胞共同孵育30min;然后用新鲜培养基洗涤细胞;随后,加入100nmmito-tracker-green继续孵育30min;最后观察荧光探针1(probe1)与mito-tracker-green的共定位情况。具体检测结果如图6所示,其中a~h分别表示:荧光探针1(probe1)在蓝色通道(a)、黄色通道下的细胞成像(b)、细胞成像a和b的叠加图(c)、mito-tracker-green在绿色通道下的荧光成像(d)、细胞成像c和d的叠加图(e)、细胞成像e和明场成像的叠加图(f)、荧光强度相关图(g)、穿过海拉细胞白线段的荧光强度分布图(h)。在不同荧光通道下,细胞染色部分呈现蓝色和黄色荧光,这表明荧光探针1(probe1)的荧光与来自mito-trackergreen的绿色荧光高度重叠,其皮尔逊系数为0.92。该结果表明,荧光探针1(probe1)能特异定位于活细胞线粒体内,具有很好的线粒体靶向性。
本发明实施例中制备的荧光探针1(probe1)还具有动态成像特征,其可利用共聚焦荧光显微镜成像技术进一步监测线粒体ph波动导致的荧光响应变化。具体实验方法如下:将细胞培养液换成不同ph值的b-r缓冲溶液(4.5-8.5),然后分别加入10μmprobe1分时间段共同培育30min,最后在共聚焦荧光显微镜下观察荧光成像强度变化。具体检测结果如图7所示,随着细胞ph值(4.5-8.5)的增加,红色通道(redchannel)下probe1的荧光强度逐渐降低,颜色变化显著,直至ph=8.5时几乎观察不到荧光;明场(brightfield)和混合视野(merge)的颜色变化同上。上述结果表明,probe1具有较强的穿透能力,并可用于监测线粒体ph值在较长时间内的波动。
综上所述,本发明提供了一种基于苯并噻唑酚-半花菁体系的荧光探针,该荧光探针具有较强的灵敏度和选择性、响应速度快、较宽的线性检测范围(ph3.0-10.0)以及合适的pka值(7.92),该探针可在裸眼比色下对待测物的ph进行半定量,可以用于高通量大样本的检测;并且其具有良好的生物相容性、细胞毒性低,还可用于线粒体ph值的实时监测,在由线粒体ph异常导致的各种病理过程中具有潜在、广阔的应用前景;本发明还提供了该荧光探针的制备方法,具有反应条件温和、后处理方便、收率高、成本低等优点。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!