一种离体肝肾灌注系统及肝细胞再生方法与流程
本发明涉及细胞培养
技术领域:
,尤其涉及一种离体肝肾灌注系统及肝细胞再生方法。
背景技术:
:人原代肝细胞是指从人肝组织取出后立即培养的肝细胞,可用于肝脏基础研究、药物开发、细胞移植、生物人工肝以及肝脏再生。然而,原代肝细胞来源困难,存在严重的伦理问题。肝细胞再生成为解决这一难题的重要途径。目前肝细胞再生的方法有两种,一是体外法,即在培养皿通过细胞因子(例如jhepatol.2017mar;66(3):494-503.)或者小分子化合物(例如cellres.2019jan;29(1):8-22、又如cellstemcell.2018dec6;23(6):806-819.e4.)将干细胞分化成肝样细胞或者肝祖细胞;二是体内法,即将肝细胞或者干细胞移植到免疫缺陷的动物体内,实现细胞扩增或者再生(例如hepatology.2012sep;56(3):1044-52、又如natbiotechnol.2007august25(8):903–910.)。体外法简单易行,但由于在培养皿中进行,细胞产量有限,且细胞分化相对较低。体内法能得到大量、高分化的肝细胞,但免疫缺陷的动物需要苛刻的饲养条件、极高技术操作要求以及较高的失败率,导致成本难以降低。因此,现有技术存在缺陷,需要改进。技术实现要素:本发明要解决的技术问题是:提供一种离体肝肾灌注系统及肝细胞再生方法,以解决
背景技术:
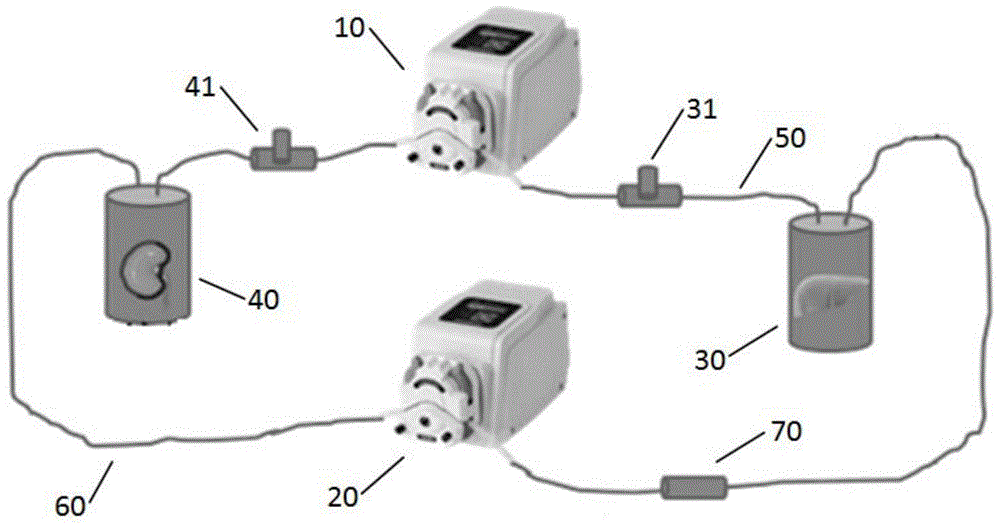
提出的问题。本发明的技术方案如下:提供一种离体肝肾灌注系统,包括:第一蠕动泵,第二蠕动泵,肝脏培养室,肾脏培养室,分别连通所述肝脏培养室、肾脏培养室的第一导管、第二导管,与所述肝脏培养室连通的加入口,与所述肾脏培养室连通的输出口;所述第一蠕动泵的泵头夹住所述第一导管,所述第二蠕动泵的泵头夹住所述第二导管;所述肝脏培养室、肾脏培养室、第一导管、第二导管均充有肝细胞培养液;所述肝细胞培养液为:添加0.05vol%-0.15vol%的携氧载体的基础培养液,所述携氧载体,用于给培养的组织供氧。所述第一蠕动泵和第二蠕动泵用于分别驱动第一导管和第二导管内的肝细胞培养液,从而可以对放置在肝脏培养室内的肝脏、放置在肾脏培养室内的肾脏进行灌注,也即利用正常的离体动物肾脏串联在灌注系统中,将肝脏代谢废物通过泌尿系统排出体外,为肝脏的生长提供良好的营养。所述肝细胞培养液为添加0.05vol%-0.15vol%的携氧载体的基础培养液,解决了肝脏、肾脏对氧气的需求,携氧载体可将氧气运输至组织深处,避免缺氧导致离体的肝脏、肾脏损伤、坏死。处于离体条件下的肝脏组织,由于没有血液免疫细胞的攻击,基本没有免疫排斥,为人肝细胞扩增或者再生提供更优的免疫环境。提供肝脏的实验动物不再需要进行免疫相关基因的基因编辑,也不要极高的饲养条件,可进一步降低成本,提高扩增和再生效率。所述携氧载体,由以下体积比的物质组成,携氧纳米载体:普朗尼克f-68(10%):甘油:水=(3-4):(0.7-1.3):(0.1-0.3):(4-6),所述携氧纳米载体为全氟萘烷或者全氟三丙胺;其制备方法为:将携氧纳米载体、10vol%普朗尼克f-68、甘油、水混合后,在0℃-6℃的温度下,15000-45000rpm搅拌1min-25min,然后通氧气20s-30min,获得携氧载体。所述基础培养基由以下物质组成:(1±0.015)%v/v的its通用型培养添加剂、(2±0.03)mmol/l的l-谷氨酰胺、(10±0.15)μg/l的表皮生长因子、(18±0.25)mg/l的氢化可的松、(40±0.60)μg/l的地塞米松、(1±0.015)%v/v的青链霉素、50-500μg/ml硫酸亚铁和(5±0.075)%v/v的胎牛血清。基础培养基中的铁离子,可以促进延胡索酰乙酰乙酸水解酶(fah)基因缺陷的动物的肝细胞凋亡或者坏死,为外源肝细胞再生或扩增提供微环境。所述加入口、输出口均设置在第一导管上,所述加入口靠近肝脏培养室,所述输出口靠近肾脏培养室,所述第一蠕动泵的泵头设置在加入口与输出口之间;离体肝肾灌注装置在组装前,肝脏培养室、肾脏培养室、第一导管、第二导管、加入口、输出口均需要在120℃、90kpa下灭菌15-30分钟。所述加入口、输出口均为三通,所述肝脏培养室、肾脏培养室均为500ml-5l的培养瓶。所述离体肝肾灌注系统,还包括:安装在所述第二导管上的检测装置;所述检测装置设置在第二蠕动泵的泵头与肝脏培养室之间。所述检测装置为明德生物pt1000血气分析平台。本发明还提供一种肝细胞再生方法,前述的离体肝肾灌注系统,包括以下步骤;s1:将实验动物麻醉后转移到无菌生物工作台中。s2:解剖并暴露实验动物的肝门静脉,用37±0.5℃预热的hanks-肝素钠溶液原位灌注实验动物的肝脏10-20min,至肝脏组织中血液被冲干净;同样的,解剖并暴露实验动物的肾静脉,用37±0.5℃预热的hanks-肝素钠溶液原位灌注实验动物肝脏10-20min,至肾脏组织中血液被冲干净。s3:在步骤s2完成后,用37±0.5℃预热的肝细胞培养液分别灌注实验动物的肝脏和肾脏10-20min。s4:将实验动物的主动脉和上腔静脉用缝合线打结封住;在实验动物的肝门静脉插入第一插管并固定住,在持续灌注肝细胞培养液的同时分离肝脏与周围的结缔组织和黏连器官;在实验动物的肾静脉插入第二插管并固定住,在持续灌注肝细胞培养液的同时分离肾脏与周围的结缔组织和黏连器官。s5:将分离后的肝脏放入肝脏培养室内,第一插管与肝脏培养室的输液口连接继续灌注肝细胞培养液;将分离后的肾脏放入肾脏培养室,第二插管与肝脏培养室的输液口连接继续灌注肝细胞培养液;启动第一蠕动泵、第二蠕动泵,形成自循环。也即随着蠕动泵的运行,肾脏与肝脏形成串联,肝脏代谢废物通过肾脏过滤排出,为肝脏的生长提供良好的营养。s6:将人原代肝细胞或肝样细胞从加入口中加入至肝脏培养室中进行培养4-12周,培养过程中,每隔3-60小时从加入口加入一次新的肝细胞培养液,并从输出口输出旧的肝细胞培养液,新的肝细胞培养液的体积为0.5-2.0个肝脏培养室的体积。或者,在培养过程中,持续不断的从加入口加入新的肝脏再生培养液,并从输出口输出旧的肝细胞培养液,每3-60小时加入的肝细胞培养液的体积为0.5-2.0个肝脏培养室的体积。s7:采用胶原酶灌注法收获肝细胞。所述胶原酶灌注法包括以下步骤。ss1:从肝脏培养室中取出实验动物肝脏,二步胶原酶法消化肝组织直至肝组织失去弹性。ss2:将肝组织转移到盛有足量肝细胞洗液的培养皿中,用无菌镊子侧破肝组织,得到肝细混合液。ss3:肝细胞混合液经过70μm细胞筛,以去除组织团块,获得肝细胞悬液。ss4:将肝细胞悬液转移至离心管中,在(50-200)×g、0-8℃条件下,离心1.5-15min。ss5:去掉离心管内的上清液,获得沉淀肝细胞,用肝细胞洗液对沉淀肝细胞进行重悬,然后重复离心1-3次,获得清洗肝细胞。ss6:铺板培养液重悬清洗肝细胞,获得再生肝细胞悬液;取适量再生肝细胞悬液用台盼蓝拒染法检测细胞活力与活细胞数。ss7:再生肝细胞悬液以(1.5-2.5)×105活细胞/cm2的接种密度,接种到胶原包被的培养板或培养皿中,摇匀,在37±0.2℃、5%co2培养箱中培养4-6h后,将铺板培养液换成肝细胞维持培养液。所述肝样细胞为干细胞诱导形成。当所述干细胞为间充质干细胞;诱导的方法为:s11:间充质干细胞在常规培养基中培养,其中常规培养基的成分为:imdm培养液+10%胎牛血清+100units/ml青霉素+100mg/ml链霉素;在细胞融合度为85%时,加入肝细胞诱导液,其中肝细胞诱导液成分为:imdm培养液(购买至美国gibco公司)、100units/ml青霉素(购买至美国gibco公司)、100mg/ml链霉素(购买至美国gibco公司)、25mmhepesbuffersolution(购买至美国gibco公司)、1倍体积的its+1liquidmediasupplement(购买至美国sigma公司)、20μg/mldexamethasone(购买至美国sigma公司)、20ng/mlhgf(购买至美国cellsciences公司);s12:每3天换1次肝细胞诱导液,持续诱导培养2周;s13:向肝细胞诱导液补加入30ng/ml的humanoncostatinm,继续诱导1周,获得肝样细胞。当所述干细胞为胚胎干细胞,所述诱导方法为:s21:rpmi基础培养基补充1mml-谷氨酰胺、0.5%v/v胎牛血清、100ng/ml激活素-a、025ng/mlwnt3a,胚胎干细胞在此培养基中诱导培养2天;s22:rpmi基础培养基补充1mml-谷氨酰胺、0.5%v/v胎牛血清、100ng/ml激活素-a、继续诱导培养2天;s23:培养基换成hcm基础培养基,添加20ng/ml重组人骨形态发生蛋白、30ng/ml成纤维细胞生长因子-4,继续诱导培养6天,每3天换1次液;s24:hcm基础培养基补加20ng/ml肝细胞生长因子,诱导培养5天,每3天换1次液;s25:hcm基础培养基补加10μg/mlhumanoncostatinm,100nm地塞米松,诱导培养15天,每3天换1次液;培养结束后,获得肝样细胞。当所述干细胞为诱导多能肝细胞,所述诱导方法为:s31:诱导多能干细胞在cdm-pva培养基,补加10ng/ml激活素-a、12ng/ml碱性成纤维细胞生长因子,培养2天;所述cdm-pva培养基为250mldmem-f12、250mlimdm、0.5g聚乙烯醇、5ml浓缩脂类、20μl硫代甘油、25μg/ml转铁蛋白、10μg/l重组人胰岛素、100units/ml青霉素、100mg/ml链霉素;s32:换液,换成cdm-pva培养基,补加100ng/ml激活素-a、100ng/ml碱性成纤维细胞生长因子、10ng/ml重组人骨形态发生蛋白4、10μmly294002、3μmchir99021,培养24小时;s33:换液,换成cdm-pva培养基,补加100ng/ml激活素-a、100ng/ml碱性成纤维细胞生长因子、10ng/ml重组人骨形态发生蛋白4、10μmly294002,培养24小时;s34:换液,换成rpmi-b27培养基,补加100ng/ml激活素-a、100ng/ml碱性成纤维细胞生长因子,诱导培养24小时;rpmi-b27培养基为490mlrpmi1640,补加10mlb27、5mlneaa、100units/ml青霉素、100mg/ml链霉素;s35:换液,换成rpmi-b27培养基,补加50ng/ml激活素-a,诱导培养3天;s36:换液,换成rpmi-b27培养基,补加20ng/ml重组人骨形态发生蛋白4、10ng/ml成纤维细胞生长因子-10,诱导培养3天;s37:换液,换成肝细胞基底培养基,补加50ng/mlhgf、30ng/mlhumanoncostatinm,诱导培养3天,获得肝样细胞。所述实验动物为延胡索酰乙酰乙酸水解酶(fah)基因缺陷的动物,优选的,所述实验动物为sd大鼠。所述hanks-肝素钠溶液的配方为:8.00g/l氯化钠、0.40g/l氯化钾、3.57g/l羟乙基哌嗪乙磺酸、0.06g/l二水磷酸氢二钠、0.06g/l磷酸二氢钾、1g/l葡萄糖、1mm丙酮酸钠溶解于1l灭菌注射用水中,ph值为7.4,临用前加入肝素钠配置成0.5g/l,用0.22μm微孔滤器过滤除菌。本发明主要解决以下几个问题:1)避免免疫排斥问题处于离体条件下的肝脏组织,由于没有血液免疫细胞的攻击,基本没有免疫排斥,为人肝细胞扩增或者再生提供更优的免疫环境。提供肝脏的实验动物不再需要进行免疫相关基因的基因编辑,也不要极高的饲养条件,可进一步降低成本,提高扩增和再生效率。2)肝脏自损伤,促进修复基于已公布专利方法(申请号:201811248009.9),构建fah基因缺陷的实验动物。利用fah基因缺陷肝脏的自损伤机理,培养基中加入铁离子,促进肝细胞凋亡或者坏死,为外源肝细胞再生或扩增提供微环境。3)肾排除毒素肝细胞培养液循环灌注,由于培养时间长,培养基中会累积肝脏代谢的废物,对肝细胞的生长不利。利用正常的离体动物肾脏串联在灌注系统中,将肝脏代谢废物通过泌尿系统排出体外,为肝脏的生长提供良好的营养。4)携氧材料解决氧气问题为解决肝脏对氧气的需求,肝细胞培养液含有携氧载体,可将氧气运输至组织深处,避免缺氧损伤。采用上述方案,本发明提供一种离体肝肾灌注系统及肝细胞再生方法,通过将肝脏离体后放置于离体肝肾灌注系统中培养,保证氧气和养分的供应,模拟体内的肝细胞再生微环境,让人原代肝细胞或肝样细胞在离体的肝脏中获得扩增或者再生,从而实现获得大量、高分化的肝细胞,满足应用需求。附图说明图1为本发明的离体肝肾灌注系统的结构示意图;图2为本发明的流程示意图;图3人原代肝细胞的图片;图4为间充质干细胞的图片;图5为肝样细胞接种后不同时间点白蛋白分泌量图;图6为人原代肝细胞白蛋白鉴定(白光)的图片;图7为人原代肝细胞白蛋白鉴定(dapi)的图片;图8为人原代肝细胞白蛋白鉴定(绿色荧光)的图片;图9为人原代肝细胞白蛋白鉴定(混合成像)的图片;图10为人原代间充质干细胞(白光)的图片;图11为人原代间充质干细胞(红色荧光)的图片。具体实施方式以下结合附图和具体实施例,对本发明进行详细说明。请参阅图1-图11,本发明提供一种离体肝肾灌注系统,包括:第一蠕动泵10,第二蠕动泵20,肝脏培养室30,肾脏培养室40,分别连通所述肝脏培养室30、肾脏培养室40的第一导管50、第二导管60,与所述肝脏培养室30连通的加入口31,与所述肾脏培养室40连通的输出口41;所述第一蠕动泵10的泵头夹住所述第一导管50,所述第二蠕动泵20的泵头夹住所述第二导管60;所述肝脏培养室30、肾脏培养室40、第一导管50、第二导管60均充有肝细胞培养液;所述肝细胞培养液为:添加0.01vol%的携氧载体的基础培养液,所述携氧载体,用于给培养的组织供氧。所述第一蠕动泵10和第二蠕动泵20用于分别驱动第一导管50和第二导管60内的肝细胞培养液,从而可以对放置在肝脏培养室30内的肝脏、放置在肾脏培养室40内的肾脏进行灌注,也即利用正常的离体动物肾脏串联在灌注系统中,将肝脏代谢废物通过泌尿系统排出体外,为肝脏的生长提供良好的营养。所述肝细胞为添加0.01vol%的携氧载体的基础培养液,解决了肝脏、肾脏对氧气的需求,携氧载体可将氧气运输至组织深处,避免缺氧导致离体的肝脏、肾脏损伤、坏死。处于离体条件下的肝脏组织,由于没有血液免疫细胞的攻击,基本没有免疫排斥,为人肝细胞扩增或者再生提供更优的免疫环境。提供肝脏的实验动物不再需要进行免疫相关基因的基因编辑,也不要极高的饲养条件,可进一步降低成本,提高扩增和再生效率。所述携氧载体,由以下体积比的物质组成,携氧纳米载体:普朗尼克f-68(10%):甘油:水=3.5:1:0.2:5.3,所述携氧纳米载体为全氟萘烷或者全氟三丙胺;其制备方法为:将携氧纳米载体、10vol%普朗尼克f-68、甘油、水混合后,用匀浆机在4℃的温度下,30000rpm搅拌5min,然后通氧气2min,获得携氧载体。所述基础培养基由以下物质组成:(1±0.015)%v/v的its通用型培养添加剂、(2±0.03)mmol/l的l-谷氨酰胺、(10±0.15)μg/l的表皮生长因子、(18±0.25)mg/l的氢化可的松、(40±0.60)μg/l的地塞米松、(1±0.015)%v/v的青链霉素、50-500μg/ml硫酸亚铁和(5±0.075)%v/v的胎牛血清。基础培养基中的铁离子,可以促进延胡索酰乙酰乙酸水解酶(fah)基因缺陷的动物的肝细胞凋亡或者坏死,为外源肝细胞再生或扩增提供微环境。所述加入口31、输出口41均设置在第一导管50上,所述加入口31靠近肝脏培养室30,所述输出口41靠近肾脏培养室40,所述第一蠕动泵10的泵头设置在加入口31与输出口41之间;离体肝肾灌注装置在组装前,肝脏培养室30、肾脏培养室40、第一导管50、第二导管60、加入口31、输出口41均需要在120℃、90kpa下灭菌15-30分钟。所述加入口31、输出口41均为三通,所述肝脏培养室30、肾脏培养室40均为500ml培养瓶。所述离体肝肾灌注系统,还包括:安装在所述第二导管60上的检测装置70;所述检测装置70设置在第二蠕动泵20的泵头与肝脏培养室30之间。所述检测装置70为明德生物pt1000血气分析平台。本发明还提供一种肝细胞再生方法,前述的离体肝肾灌注系统,包括以下步骤;s1:将实验动物用戊巴比妥钠麻醉后转移到无菌生物工作台中。s2:解剖并暴露实验动物的肝门静脉,用37±0.5℃预热的hanks-肝素钠溶液原位灌注实验动物的肝脏15min,至肝脏组织中血液被冲干净;同样的,解剖并暴露实验动物的肾静脉,用37±0.5℃预热的hanks-肝素钠溶液原位灌注实验动物肝脏15min,至肾脏组织中血液被冲干净。s3:在步骤s2完成后,用37±0.5℃预热的肝细胞培养液分别灌注实验动物的肝脏和肾脏15min。s4:将实验动物的主动脉和上腔静脉用缝合线打结封住;在实验动物的肝门静脉插入第一插管并固定住,在持续灌注肝细胞培养液的同时分离肝脏与周围的结缔组织和黏连器官;在实验动物的肾静脉插入第二插管并固定住,在持续灌注肝细胞培养液的同时分离肾脏与周围的结缔组织和黏连器官。s5:将分离后的肝脏放入肝脏培养室30内,第一插管与肝脏培养室30的输液口连接继续灌注肝细胞培养液;将分离后的肾脏放入肾脏培养室40,第二插管与肝脏培养室30的输液口连接继续灌注肝细胞培养液;启动第一蠕动泵10、第二蠕动泵20,形成自循环。也即随着蠕动泵的运行,肾脏与肝脏形成串联,肝脏代谢废物通过肾脏过滤排出,为肝脏的生长提供良好的营养。s6:将人原代肝细胞或肝样细胞从加入口31中加入至肝脏培养室30中进行培养8周,培养过程中,每隔48小时从加入口31加入一次新的肝细胞培养液,并从输出口41输出旧的肝细胞培养液,新的肝细胞培养液的体积为1个肝脏培养室30的体积。s7:采用胶原酶灌注法收获肝细胞。所述胶原酶灌注法包括以下步骤。ss1:从肝脏培养室30中取出实验动物肝脏,二步胶原酶法消化肝组织直至肝组织失去弹性。ss2:将肝组织转移到盛有足量肝细胞洗液的培养皿中,用无菌镊子侧破肝组织,得到肝细混合液。ss3:肝细胞混合液经过70μm细胞筛,以去除组织团块,获得肝细胞悬液。ss4:将肝细胞悬液转移至离心管中,在50×g、4℃条件下,离心5min。ss5:去掉离心管内的上清液,获得沉淀肝细胞,用肝细胞洗液对沉淀肝细胞进行重悬,然后重复离心2次,获得清洗肝细胞。ss6:铺板培养液重悬清洗肝细胞,获得再生肝细胞悬液;取适量再生肝细胞悬液用台盼蓝拒染法检测细胞活力与活细胞数。ss7:再生肝细胞悬液以(1.5-2.5)×105活细胞/cm2的接种密度,接种到胶原包被的培养板或培养皿中,摇匀,在37±0.2℃、5%co2培养箱中培养4-6h后,将铺板培养液换成肝细胞维持培养液。所述肝样细胞为干细胞诱导形成。可采用下列任意一种干细胞。当所述干细胞为间充质干细胞;诱导的方法为:s11:间充质干细胞在常规培养基中培养,其中,常规培养基的成分为:imdm培养液+10%胎牛血清+100units/ml青霉素+100mg/ml链霉素;在细胞融合度为85%时,加入肝细胞诱导液。其中,肝细胞诱导液成分为:imdm培养液(购买至美国gibco公司、100units/ml青霉素(购买至美国gibco公司)、100mg/ml链霉素(购买至美国gibco公司)、25mmhepesbuffersolution(购买至美国gibco公司)、1倍体积的its+1liquidmediasupplement(购买至美国sigma公司)、20μg/mldexamethasone(购买至美国sigma公司)、20ng/mlhgf(购买至美国cellsciences公司);s12:每3天换1次肝细胞诱导液,持续诱导培养2周;s13:向肝细胞诱导液补加入30ng/ml的humanoncostatinm,继续诱导1周,获得肝样细胞。当所述干细胞为胚胎干细胞,所述诱导方法为:s21:rpmi基础培养基补充1mml-谷氨酰胺、0.5%v/v胎牛血清、100ng/ml激活素-a、025ng/mlwnt3a,胚胎干细胞在此培养基中诱导培养2天;s22:rpmi基础培养基补充1mml-谷氨酰胺、0.5%v/v胎牛血清、100ng/ml激活素-a、继续诱导培养2天;s23:培养基换成hcm基础培养基,添加20ng/ml重组人骨形态发生蛋白、30ng/ml成纤维细胞生长因子-4,继续诱导培养6天,每3天换1次液;s24:hcm基础培养基补加20ng/ml肝细胞生长因子,诱导培养5天,每3天换1次液;s25:hcm基础培养基补加10μg/mlhumanoncostatinm,100nm地塞米松,诱导培养15天,每3天换1次液;培养结束后,获得肝样细胞。当所述干细胞为诱导多能肝细胞,所述诱导方法为:s31:诱导多能干细胞在cdm-pva培养基,补加10ng/ml激活素-a、12ng/ml碱性成纤维细胞生长因子,培养2天;所述cdm-pva培养基为250mldmem-f12、250mlimdm、0.5g聚乙烯醇、5ml浓缩脂类、20μl硫代甘油、25μg/ml转铁蛋白、10μg/l重组人胰岛素、100units/ml青霉素、100mg/ml链霉素;s32:换液,换成cdm-pva培养基,补加100ng/ml激活素-a、100ng/ml碱性成纤维细胞生长因子、10ng/ml重组人骨形态发生蛋白4、10μmly294002、3μmchir99021,培养24小时;s33:换液,换成cdm-pva培养基,补加100ng/ml激活素-a、100ng/ml碱性成纤维细胞生长因子、10ng/ml重组人骨形态发生蛋白4、10μmly294002,培养24小时;s34:换液,换成rpmi-b27培养基,补加100ng/ml激活素-a、100ng/ml碱性成纤维细胞生长因子,诱导培养24小时;rpmi-b27培养基为490mlrpmi1640,补加10mlb27、5mlneaa、100units/ml青霉素、100mg/ml链霉素;s35:换液,换成rpmi-b27培养基,补加50ng/ml激活素-a,诱导培养3天;s36:换液,换成rpmi-b27培养基,补加20ng/ml重组人骨形态发生蛋白4、10ng/ml成纤维细胞生长因子-10,诱导培养3天;s37:换液,换成肝细胞基底培养基,补加50ng/mlhgf、30ng/mlhumanoncostatinm,诱导培养3天,获得肝样细胞。在本实施例中,所述实验动物为sd大鼠。所述hanks-肝素钠溶液的配方为:8.00g/l氯化钠、0.40g/l氯化钾、3.57g/l羟乙基哌嗪乙磺酸、0.06g/l二水磷酸氢二钠、0.06g/l磷酸二氢钾、1g/l葡萄糖、1mm丙酮酸钠溶解于1l灭菌注射用水中,ph值为7.4,临用前加入肝素钠配置成0.5g/l,用0.22μm微孔滤器过滤除菌。检验检测一、溶解氧和ph。利用血气分析仪(pt1000,明德生物)检测培养液中氧含量和ph的变化,正常溶液氧分压在80mmhg-100mmhg之间,溶液ph值在7.26~7.44范围之内。(1)将运氧载体稀释1/200后加入100μl至200ml培养基中混匀。(2)将混匀后的培养基取1ml至血气试剂包上样口处。(3)将上样后的试剂包插入血气分析仪检测插口处,点击“检测”按钮即开始检测。(4)检测后打印结果表1.血氧分析仪检测结果样品1样品2样品3ph6.9027.3787.331co2分压<15mmhg<15mmhg<15mmhgo2分压199.2mmhg220.7mmhg237.5mmhg二、人血清白蛋白分泌、供体动物白蛋白分泌。通过人/大鼠白蛋白elisakit分别分析人血清白蛋白的分泌和供体动物白蛋白的分泌。请参阅图4。实验开始前,各试剂均应平衡至室温;试剂或样品配制时,均需充分混匀,并尽量避免起泡。(1)加样:分别设空白孔、标准孔、待测样品孔。空白孔加样品稀释液100μl,余孔分别加标准品或待测样品100μl。给酶标板覆膜,37℃孵育90分钟。(2)弃去液体,甩干,每个孔中加入detectionalbuminantibody工作液100μl(在使用前15分钟内配制),酶标板加上覆膜,37℃温育1小时。(3)弃去孔内液体,甩干,用ttbs洗板3次,每次浸泡1-2分钟,大约350μl/每孔,甩干并在吸水纸上轻拍将孔内液体拍干。(4)每孔加hrpconjugate工作液(临用前15分钟内配制)100μl,加上覆膜,37℃温育30分钟。(5)弃去孔内液体,甩干,洗板5次,方法同步骤3。(6)每孔加底物溶液90μl,酶标板加上覆膜37℃避光孵育15分钟。(7)每孔加终止液50μl,终止反应,此时蓝色立转黄色。(8)立即用酶标仪在450nm波长测量各孔的光密度(od值)。应提前打开酶标仪电源,预热仪器,设置好检测程序。(9)实验完毕后,未使用完的试剂按规定保存温度放回冰箱保存。三、人肝细胞的纯度鉴定:绿色荧光鉴定间充质/骨髓干细胞、人原代肝细胞,红色荧光检测人白蛋白。(1)将样品细胞培养板取出,pbs洗3遍,晃一下即可弃去。(2)加4%多聚甲醛(pfa),盖住细胞,静置30min。(3)弃去,pbs再洗3遍,弃去pbs。(4)0.1%triton-x100(溶于pbs)加入培养板中,盖住细胞,静置15min。(5)弃去triton,加10%山羊血清pbs封闭1小时。(6)在冰上做,按说明书比例加一抗(用10%山羊血清pbs溶解一抗)盖住细胞,盖上盖子,封口膜封好,在层析柜的摇床中开慢速摇晃孵育过夜。(7)弃去一抗,加pbs室温摇床摇晃3次,5min/次。(8)加二抗。该过程要避光,二抗按说明书比例直接溶解于预冷pbs中,二抗种属性要对应一抗种属性。锡箔纸包住二抗管子和培养板,于培养板中加入二抗锡箔纸盖好,在摇床上摇摆孵育1小时。(9)过程避光,弃去二抗,pbs室温洗3次,5min/次,弃pbs。(10)直接滴加dapi到培养板,盖住细胞即可,避光室温静置15min。(11)避光弃去dapi,用pbs室温洗3次,5min/次,后加入300ulpbs封盖避光于leica倒置荧光显微镜处拍照。结果分析:人原代肝细胞与间充质干细胞在形态上存在显著差异,人原代肝细胞细胞核小而高亮、细胞质丰富、细胞呈多边形,而间充质干细胞细胞核不明显、呈梭形,如图3、图4所示。接种细胞后,通过收集培养系统中的培养液,通过elisa试剂盒分别检测人白蛋白、大鼠白蛋白水平,结果显示人白蛋白水平随着培养时间的延长逐步提升,而大鼠白蛋白分泌水平随培养时间的延长逐步下降,人白蛋白分泌水平在接种后第六周首次超过大鼠白蛋白的分泌水平,说明人肝细胞在大鼠肝脏中得到了明显的扩增并逐步成为主要的细胞类群,如图5所示。进一步,通过两步胶原酶消化获取肝脏中的肝细胞,分别对再生的肝细胞、间充质干细胞(阴性对照)进行白蛋白检测,如图6-图11所示,再生的人肝细胞高表达人白蛋白,且阳性细胞率达到90%以上,而间充质干细胞白蛋白信号为阴性。综上所述,本发明为通过将肝脏离体后放置于离体肝肾灌注系统中培养,保证氧气和养分的供应,模拟体内的肝细胞再生微环境,让人原代肝细胞或肝样细胞在离体的肝脏中获得扩增或者再生,从而实现获得大量、高分化的肝细胞,满足应用需求。本发明专利利用的是fah基因缺陷大鼠肝脏作为再生模型,其它动物的肝脏,如猴、猪、兔、小鼠等动物模型,只是规格大小之别,使用的方法和原理基本一致,同样在本专利保护范围内。以上仅为本发明的较佳实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1