一种叔丁氧羰基保护的氨类化合物的合成方法及应用与流程
1.本发明涉及有机合成技术领域,具体涉及一种叔丁氧羰基保护的氨类化合物的合成方法及应用。
背景技术:
2.sting(干扰素基因刺激因子,tmem173,mita等)是胞内应答dna入侵的关键节点分子,在胞质dna刺激下,识别胞质dna受体的信号,对诱导产生干扰素的过程起关键作用。宿主细胞的dna识别受体识别外源或内源“非己”dna后,将信号传递给节点分子sting,然后sting迅速二聚化并从内质网转移至核外周小体上。sting的活化导致irf3和nkκb途径的上调,从而导致干扰素
‑
β和其它细胞因子的诱导。
3.专利wo2019134705a1公开了一类式(i)所示的化合物,具有sting激活作用的小分子化合物,
[0004][0005]
其中,l选自被0~4个r
n
任选取代的c4~c6的亚烷基、被0~4个r
n
任选取代的c4~c6的亚烯基、被0~4个r
n
任选取代的c4~c6的亚炔基;r
n
选自卤素、羟基、氨基、c1~c6烷基、c1~c6烷氧基、c1~c6烷氨基、卤素取代的c1~c6烷基。
[0006]
专利wo2006084369公开了一种制备(e)
‑
(4
‑
氨基丁
‑2‑
烯
‑1‑
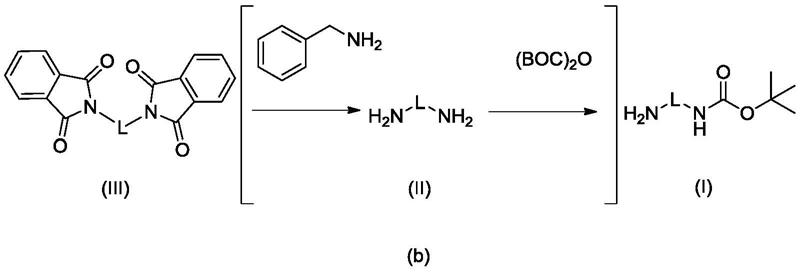
基)氨基甲酸叔丁酯的方法:
[0007][0008]
步骤一,以邻苯二甲酰亚胺和(e)
‑
1,4
‑
二溴
‑2‑
丁烯为原料制备得到反式
‑
l,4
‑
二邻苯二甲酰亚胺
‑2‑
丁烯;步骤二,将所得的(e)
‑
l,4
‑
二邻苯二甲酰亚胺
‑2‑
丁烯与乙酸和浓盐酸(体积比为1:1)的混合溶液加热回流反应24h制备得到(e)
‑
1,4
‑
二胺
‑2‑
丁烯盐酸盐;步骤三,将所得的(e)
‑
1,4
‑
二胺
‑2‑
丁烯盐酸盐加入到10%三乙胺/甲醇溶液中,再加入溶解于甲醇溶液中的(boc)2o至反应液,回流反应,制备得到(e)
‑
二叔丁基丁
‑2‑
烯
‑
1,4
‑
二基二氨基甲酸酯,收率15.9%。该路线除反应步骤长外,步骤二用到了大量的浓盐酸且回流
反应时间长,操作过程面临的危险大,后处理中减压浓缩乙酸和盐酸花费大量成本;步骤三需要柱层析纯化才能获得终产物且收率低,不利于工业化生产,和成本节约。
[0009]
专利wo2010118006公开了一种制备1,4
‑
二胺
‑2‑
丁烯盐酸盐的方法:
[0010][0011]
将l,4
‑
二邻苯二甲酰亚胺
‑2‑
丁烯、乙醇和水合肼在室温下混合搅拌,然后将反应液加热至50℃至溶液澄清,当出现白色悬浮物时,将温度提高至60℃反应3小时并且搅拌变得非常困难;将上述反应液冷却至室温,加入浓盐酸,制备得到1,4
‑
二胺
‑2‑
丁烯盐酸盐。该路线步骤多、且观察白色悬浮物以及“搅拌变得非常困难”较为主观,反应不便控制,操作困难,且采用水合肼制备工业级反应时会有安全隐患,不利于工业化生产。
[0012]
用于合成l片段的原料价格较高、且现有的该类原料的合成方法需要用到大量的浓盐酸,技术人员操作过程面临的危险较大,因此,开发一条简单易行、节约成本、又对环境友好的合成路线对科研、经济、社会都具有十分重要意义。
技术实现要素:
[0013]
本发明的目的就是提供一种新的式(i)所示化合物的制备方法及其应用。
[0014]
具体而言,本发明提供一种式(i)所示的化合物的制备方法,包括以下步骤:
[0015][0016]
由式(iv)化合物制备得到式(iii)化合物,
[0017]
由式(iii)化合物经连续反应,制备得到式(i)化合物,
[0018]
其中,l选自c2‑
16
亚烷基、c2‑
16
亚烯基、c2‑
16
亚炔基,所述的亚烷基、亚烯基或亚炔基任选进一步被0
‑
4个选自f、cl、br、i、oh、cf3、nh2、no2、氰基、c1‑6烷基、c1‑6烷氧基、c2‑6烯基、c2‑6炔基、c3‑
12
碳环基或3至12元杂环基的取代基所取代,所述的杂环基含有1至4个任选自n、o或s的杂原子;
[0019]
所述的x选自卤素。
[0020]
本发明的优选实施方案,一种式(i)所示的化合物的制备方法,包括以下步骤,
[0021][0022]
步骤(a)中,式(iv)化合物与式(v)发生亲核反应,制备得到式(iii)化合物;
[0023]
进一步,步骤(a)中包含以下步骤:在溶剂中、在
‑
5℃~40℃条件下,化合物(iv)与式(v)发生亲核反应,制备得到式(iii)化合物,所述的溶剂选自甲醇、乙醇、异丙醇、二氯甲烷、氯仿、n,n
‑
二甲酰亚胺或二甲亚砜中的一种或多种;
[0024]
更进一步,步骤(a)中包含以下步骤:室温下,将式(iv)化合物溶解于n,n
‑
二甲基甲酰胺中,降至0~10℃,分批加入式(v)化合物至混合溶液中,于室温过夜反应;反应结束后,将反应液分批加入至冰水中,充分搅拌、减压过滤、滤饼经洗涤干燥后,得到式(iii)化合物;
[0025]
其中,步骤(a)中,式(iv)化合物与式(v)化合物的摩尔比为1:2~1:3,优选1:2.~1:2.2,进一步优选1:2.05;式(iv)化合物与n,n
‑
二甲酰亚胺的摩尔体积比为3:1~1:3,优选3:1~2:1,进一步优选1:0.6。
[0026]
步骤(b)中,式(iii)化合物与苄氨发生亲核取代反应,制备得到式(ii)化合物;式(ii)化合物与(boc)2o发生缩合反应,制备得到式(i)化合物;其中,式(ii)化合物为具备良好水溶性的二氨;
[0027]
进一步,步骤(b)中包含以下步骤:在90~120℃下,式(iii)化合物与苄氨发生亲核取代反应,制备得到化合物(ii);在溶剂中、室温条件下,式(ii)化合物与(boc)2o发生缩合反应,制备得到式(i)化合物,所述的溶剂选自甲醇、乙醇、异丙醇、水或乙腈中的一种或多种;
[0028]
更进一步,步骤(b)中包含以下步骤:将式(iii)化合物与苄氨于100℃下反应48h;反应结束后,将反应液温度降至0~10℃,向反应液中加入水并充分搅拌、过滤,滤液用极性溶剂萃取,萃取后,分离得到含有苄胺的有机相部分和含有式(ii)化合物的水相部分。室温下,将在步骤(b)中得到的含式(ii)化合物的水相与乙醇混合,室温下,向混合溶液中缓慢滴加已溶解于乙醇中的(boc)2o,滴加完毕后,于室温反应过夜,反应完毕后,依次减压蒸馏、减压过滤得到滤饼即式(vi)化合物,滤液用极性溶剂萃取、分液,收集得到含有式(ii)化合物的水相和含有式(i)化合物的有机相,将含有式(i)化合物的有机相减压蒸馏得到式(i)化合物,所述极性溶剂二氯甲烷、三氯甲烷、乙酸乙酯或正丁醇中的一种,优选二氯甲烷;
[0029]
其中,步骤(b)中,式(iii)化合物与苄氨的摩尔体积比为1:1~1:8,优选1:2~1:5,进一步优选1:3.5;含有式(ii)化合物的水相与与其混合的乙醇的体积比为1:0.5~1:3,,优选1:0.5~1:1.5,进一步优选1:1;(boc)2o与溶解其的乙醇的体积比为1:0.5~1:3,优选1:1~1:2.5,进一步优选1:2;
[0030]
其中,式(vi)化合物为
[0031]
l选自c2‑
16
亚烷基、c2‑
16
亚烯基、c2‑
16
亚炔基,所述的亚烷基、亚烯基或亚炔基任选进一步被0
‑
4个选自f、cl、br、i、oh、cf3、nh2、no2、氰基、c1‑6烷基、c1‑6烷氧基、c2‑6烯基、c2‑6炔基、c3‑
12
碳环基或3至12元杂环基的取代基所取代,所述的杂环基含有1至4个任选自n、o或s的杂原子;l优选选自c2‑8亚烷基、c2‑8亚烯基、c2‑8亚炔基,所述的亚烷基、亚烯基或亚炔基任选进一步被0
‑
4个选自f、cl、br、i、oh、cf3、nh2、no2、氰基的取代基所取代;l进一步优选选自
l更进一步优选选自l更进一步优选选自
[0032]
m
+
选自na
+
或k
+
,优选选自k
+
。
[0033]
本发明的优选实施方案,一种式(i)所示的化合物的制备方法,包括以下步骤,
[0034]
步骤(a)中包含以下步骤:在溶剂中、在
‑
5℃~40℃条件下,化合物(iv)与式(v)发生亲核反应,制备得到式(iii)化合物,所述的溶剂选自甲醇、乙醇、异丙醇、二氯甲烷、三氯甲烷、n,n
‑
二甲酰亚胺或二甲亚砜中的一种或多种。
[0035]
步骤(b)中包含以下步骤:在90~120℃下,式(iii)化合物与苄氨发生亲核取代反应,制备得到化合物(ii);在溶剂中、室温条件下,式(ii)化合物与(boc)2o发生缩合反应,制备得到式(i)化合物,所述的溶剂选自甲醇、乙醇、异丙醇、水或乙腈中的一种或多种。
[0036]
l选自c2‑
16
亚烷基、c2‑
16
亚烯基、c2‑
16
亚炔基,所述的亚烷基、亚烯基或亚炔基任选进一步被0
‑
4个选自f、cl、br、i、oh、cf3、nh2、no2、氰基、c1‑6烷基、c1‑6烷氧基、c2‑6烯基、c2‑6炔基、c3‑
12
碳环基或3至12元杂环基的取代基所取代,所述的杂环基含有1至4个任选自n、o或s的杂原子;l优选选自c2‑8亚烷基、c2‑8亚烯基、c2‑8亚炔基,所述的亚烷基、亚烯基或亚炔基任选进一步被0
‑
4个选自f、cl、br、i、oh、cf3、nh2、no2、氰基的取代基所取代;l进一步优选选自、氰基的取代基所取代;l进一步优选选自、氰基的取代基所取代;l进一步优选选自l更进一步优选选自l更进一步优选选自
[0037]
m
+
选自na
+
或k
+
,优选选自k
+
。
[0038]
本发明的优选实施方案,一种式(i)所示的化合物的制备方法,包括以下步骤:
[0039]
步骤(a)中包含以下步骤:室温下,将式(iv)化合物溶解于n,n
‑
二甲基甲酰胺中,降至0~10℃,分批加入式(v)化合物至混合溶液中,于10~30℃过夜反应;反应结束后,将反应液分批加入至冰水中,充分搅拌、减压过滤、滤饼经洗涤干燥后,得到式(iii)化合物;
[0040]
步骤(b)中包含以下步骤:将式(iii)化合物与苄氨于100℃下反应48h,反应结束后,将反应液温度降至0~10℃,向反应液中加入水并充分搅拌、过滤,滤液用极性溶剂萃取,萃取后,分离得到含有苄胺的有机相部分和含有式(ii)化合物的水相部分;室温下,将
含有式(ii)化合物的水相与乙醇混合,室温下,向混合溶液中缓慢滴加已溶解于乙醇中的(boc)2o,滴加完毕后,于室温反应过夜;反应完毕后,依次减压蒸馏、减压过滤得到滤饼即式(vi)化合物,滤液用极性溶剂萃取、分液,收集得到含有式(ii)化合物的水相和含有式(i)化合物的有机相,将含有式(i)化合物的有机相减压蒸馏得到式(i)化合物,
[0041]
其中,式(vi)化合物为
[0042]
l选自c2‑
16
亚烷基、c2‑
16
亚烯基、c2‑
16
亚炔基,所述的亚烷基、亚烯基或亚炔基任选进一步被0
‑
4个选自f、cl、br、i、oh、cf3、nh2、no2、氰基、c1‑6烷基、c1‑6烷氧基、c2‑6烯基、c2‑6炔基、c3‑
12
碳环基或3至12元杂环基的取代基所取代,所述的杂环基含有1至4个任选自n、o或s的杂原子;l优选选自c2‑8亚烷基、c2‑8亚烯基、c2‑8亚炔基,所述的亚烷基、亚烯基或亚炔基任选进一步被0
‑
4个选自f、cl、br、i、oh、cf3、nh2、no2、氰基的取代基所取代;l进一步优选选自、氰基的取代基所取代;l进一步优选选自、氰基的取代基所取代;l进一步优选选自l更进一步优选选自l更进一步优选选自
[0043]
m
+
选自na
+
或k
+
,优选选自k
+
。
[0044]
本发明的优选实施方案,一种式(i)所示的化合物的制备方法,包括以下步骤:
[0045]
步骤(a)中包含以下步骤:室温下,将式(iv)化合物溶解于n,n
‑
二甲基甲酰胺中,降至0~10℃,分批加入式(v)化合物至混合溶液中,于10~30℃过夜反应;反应结束后,将反应液分批加入至冰水中,充分搅拌、减压过滤、滤饼经洗涤干燥后,得到式(iii)化合物;
[0046]
步骤(b)中包含以下步骤:将式(iii)化合物与苄氨于100℃下反应48h,反应结束后,将反应液温度降至0~10℃,向反应液中加入水并充分搅拌、过滤,滤液用极性溶剂萃取,萃取后,分离得到含有苄胺的有机相部分和含有式(ii)化合物的水相部分;室温下,将含有式(ii)化合物的水相与乙醇混合,室温下,向混合溶液中缓慢滴加已溶解于乙醇中的(boc)2o,滴加完毕后,于室温反应过夜;反应完毕后,依次减压蒸馏、减压过滤得到滤饼即式(vi)化合物,滤液用极性溶剂萃取、分液,收集得到含有式(ii)化合物的水相和含有式(i)化合物的有机相,将含有式(i)化合物的有机相减压蒸馏得到式(i)化合物,
[0047]
其中,式(vi)化合物为
[0048]
l选自c2‑
16
亚烷基、c2‑
16
亚烯基、c2‑
16
亚炔基,所述的亚烷基、亚烯基或亚炔基任选进一步被0
‑
4个选自f、cl、br、i、oh、cf3、nh2、no2、氰基、c1‑6烷基、c1‑6烷氧基、c2‑6烯基、c2‑6炔基、c3‑
12
碳环基或3至12元杂环基的取代基所取代,所述的杂环基含有1至4个任选自n、o或s的杂原子;l优选选自c2‑8亚烷基、c2‑8亚烯基、c2‑8亚炔基,所述的亚烷基、亚烯基或亚炔基任选进一步被0
‑
4个选自f、cl、br、i、oh、cf3、nh2、no2、氰基的取代基所取代;l进一步优选选自、氰基的取代基所取代;l进一步优选选自、氰基的取代基所取代;l进一步优选选自l更进一步优选选自l更进一步优选选自
[0049]
m
+
选自na
+
或k
+
,优选选自k
+
,
[0050]
其中,步骤(b)中的苄胺和式(vi)化合物可以通过以下步骤回收再利用:
[0051]
步骤(b)中含有苄胺的有机相通过减压蒸馏,回收得到苄胺;
[0052]
将步骤(b)中含有式(ii)化合物的水相在室温下与乙醇混合,加入(boc)2o反应,反应完毕后,减压除去乙醇、减压过滤得到滤饼,即得式(vi)化合物;与步骤(a)中的式(vi)化合物合并,合并后的式(vi)化合物先后与盐酸、碳酸氢钠反应制备得到式(ii)化合物,式(ii)化合物可进一步用于制备式(i)化合物。
[0053]
本发明的优选实施方案,一种式(i)所示的化合物的制备方法,其中,
[0054]
步骤(a)中,式(iv)化合物与式(v)化合物的摩尔比为1:2~1:3,优选1:2~1:2.2,进一步优选1:2.05;式(iv)化合物与n,n
‑
二甲酰亚胺的摩尔体积比为3:1~1:3,优选3:1~2:1,进一步优选1:0.6;
[0055]
步骤(b)中,式(iii)化合物与苄氨的摩尔体积比为1:1~1:8,优选1:2~1:5,进一步优选1:3.5;含有式(ii)化合物的水相与与其混合的乙醇的体积比为1:0.5~1:3,,优选1:0.5~1:1.5,进一步优选1:1;(boc)2o与溶解其的乙醇的体积比为1:0.5~1:3,优选1:1~1:2.5,进一步优选1:2;
[0056]
步骤(b)所述的极性溶剂选自二氯甲烷、三氯甲烷、乙酸乙酯或正丁醇的一种,优选二氯甲烷。
[0057]
本发明的优选实施方案,一种式(i)所示的化合物的制备方法,其中,
[0058]
步骤(b)所述的极性溶剂选自二氯甲烷,
[0059]
l选自c2‑8亚烷基、c2‑8亚烯基、c2‑8亚炔基,所述的亚烷基、亚烯基或亚炔基任选进一步被0
‑
4个选自f、cl、br、i、oh、cf3、nh2、no2、氰基的取代基所取代;
[0060]
m
+
选自na
+
或k
+
。
[0061]
本发明的优选实施方案,一种式(i)所示的化合物的制备方法,其中,
[0062]
l选自
[0063]
m
+
选自na
+
或k
+
。
[0064]
本发明的优选实施方案,一种式(i)所示的化合物的制备方法,其中,
[0065]
l选自
[0066]
m
+
选自k
+
。
[0067]
附图图1为制备化合物5及苄胺循环利用、化合物4和化合物6经反应循环利用的工艺流程。
[0068]
本发明的有益效果如下:首先,本发明首次采用苄氨与式(iii)化合物制备式(ii)化合物,不需要将式(ii)化合物从反应液中分离纯化出来,直接用含有式(ii)化合物的水相溶液与(boc)2o反应制备得到式(i)化合物,式(ii)化合物为具备良好水溶性的二氨;其次,由式(ii)制备式(i)过程中过量的苄胺可以回收利用,产生的副产物(vi)能够回收,未发生反应的式(ii)化合物可以经制备得到式(vi)化合物,然后合并副产物和新生成的式(vi)化合物,经反应后再利用,用于制备式(i)化合物,经两次循环收率可达48%,若经四次循环收率可达60%,远高于目前文献报到15.9%收率。最后,市场销售的的该类化合物(例如,(e)
‑
(4
‑
氨基丁
‑2‑
烯
‑1‑
基)氨基甲酸叔丁酯)价格高,而采用本发明路线合成则可大大降低成本。
[0069]
该合成路线具备操作简便、分离纯化简单产率高、节约成本、副产物和原料都能够有效地回收利用、关键溶剂可回收利用、对环境友好等优点。
[0070]
除非有相反的陈述,在说明书和权利要求书中使用的术语具有下述含义。
[0071]“摩尔比”就是“物质的量”的比,即mol:mol。
[0072]“摩尔体积比”是指物质的“物质的量”与“体积”相比,即mol:v,mol/l
[0073]
碳氢基团中碳原子含量的最小值和最大值通过前缀表示,例如,前缀(c
a~b
)烷基表明任何含“a”至“b”个碳原子的烷基。因此,例如,(c
1~4
)烷基是指包含1~4个碳原子的烷基。
[0074]“取代”是指分子中的氢原子被其它不同的原子或分子所替换。
[0075]“任选”或“任选地”是指随后所描述的事件或环境可以但不必须发生,该说明包括该事件或环境发生或不发生的场合。如:“任选被cl取代的烷基”指烷基可以但不必须被cl取代,说明包括烷基被cl取代的情形和烷基不被cl取代的情形。
[0076]
术语“烷基”是指具有1至20个碳原子的直链或支链饱和烃基团。适当时,烷基可具有指定数目的碳原子,例如c1‑6烷基包括具有1、2、3、4、5或6个呈直链或支链配置的碳原子的烷基。适合烷基的实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、2
‑
甲基丁基、3
‑
甲基丁基、4
‑
甲基丁基、正己基、2
‑
甲基戊基、3
‑
甲基戊基、4
‑
甲基戊基、5
‑
甲基戊基、2
‑
乙基丁基、3
‑
乙基丁基、庚基、辛基、壬基和癸基。
[0077]
术语“烯基”是指在碳原子之间具有一个或多个双键且具有2至20个碳原子的直链或支链烃基团。适当时,烯基可具有指定数目的碳原子。举例来说,如“c2‑
c6烯基”中的c2‑
c6包括具有2、3、4、5或6个呈直链或支链配置的碳原子的基团。适合烯基的实例包括但不限于乙烯基、丙烯基、异丙烯基、丁烯基、丁二烯基、戊烯基、戊二烯基、己烯基、己二烯基、庚烯
基、辛烯基、壬烯基和癸烯基。
[0078]
术语“炔基”是指具有一个或多个三键且具有2至20个碳原子的直链或支链烃基团。适当时,炔基可具有指定数目的碳原子。举例来说,如“c2‑
c6炔基”中的c2‑
c6包括具有2、3、4、5或6个呈直链或支链配置的碳原子的基团。适合炔基的实例包括但不限于乙炔基、丙炔基、丁炔基、戊炔基和己炔基。
[0079]
术语“亚烷基”是指具有1至20个碳原子的二价饱和烃链。适当时,亚烷基可具有指定数目的碳原子,例如c1‑6亚烷基包括具有1、2、3、4、5或6个呈直链配置的碳原子的亚烷基。适合亚烷基的实例包括但不限于
‑
ch2‑
、
‑
ch2ch2‑
、
‑
ch2ch2ch2‑
、
‑
ch2ch2ch2ch2‑
、
‑
ch2ch2ch2ch2ch2‑
和
‑
ch2ch2ch2ch2ch2ch2‑
。
[0080]
术语“亚烯基”是指具有2至20个碳原子和至少一个双键的二价不饱和烃链。适当时,亚烯基可具有指定数目的碳原子,例如c2‑6亚烯基包括具有2、3、4、5或6个呈直链配置的碳原子的亚烯基。双键可呈e或z构型。适合亚烯基的实例包括但不限于
‑
ch=ch
‑
、
‑
ch=chch2‑
、
‑
ch2ch=ch
‑
、
‑
ch=chch2ch2‑
、
‑
ch2ch=chch2‑
、
‑
ch2ch2ch=ch
‑
、
‑
ch=ch
‑
ch=ch
‑
、
‑
ch=chch2ch2ch2‑
、
‑
ch=ch
‑
ch=ch2ch2‑
、
‑
ch=ch2ch2ch=ch
‑
。
[0081]
术语“亚炔基”是指具有2至20个碳原子和至少一个三键的二价不饱和烃链。适当时,亚炔基可具有指定数目的碳原子,例如c2‑6亚炔基包括具有2、3、4、5或6个呈直链配置的碳原子的亚炔基。适合亚炔基的实例包括但不限于
‑
c≡c
‑
、
‑
c≡cch2‑
、
‑
ch2c≡c
‑
、
‑
c≡cch2ch2‑
、
‑
ch2c≡cch2‑
、
‑
ch2ch2c≡c
‑
、
‑
c≡c
‑
c≡c
‑
、
‑
c≡cch2ch2ch2‑
、
‑
ch2c≡cch2ch2‑
、
‑
ch2ch2c≡cch2‑
、
‑
c≡c
‑
c≡c
‑
ch2‑
、
‑
ch2c≡c
‑
c≡c
‑
ch2‑
、
‑
c≡cch2ch2ch2ch2‑
、
‑
ch2c≡cch2ch2ch2‑
、
‑
ch2ch2c≡cch2ch2‑
、
‑
ch2ch2ch2c≡cch2‑
和
‑
ch2ch2ch2ch2c≡c
‑
。
[0082]
术语“烷氧基”是指o
‑
烷基的一价基团,其中,烷基如本文所定义,烷氧基实施例包括但不限于甲氧基、乙氧基、1
‑
丙氧基、2
‑
丙氧基、1
‑
丁氧基、2
‑
甲基
‑1‑
丙氧基、2
‑
丁氧基、2
‑
甲基
‑2‑
丙氧基、1
‑
戊氧基、2
‑
戊氧基、3
‑
戊氧基、2
‑
甲基
‑2‑
丁氧基、3
‑
甲基
‑2‑
丁氧基、3
‑
甲基
‑1‑
丁氧基和2
‑
甲基
‑1‑
丁氧基等。
[0083]
术语“碳环”或者“碳环基”是指饱和或者不饱和的芳香环或者非芳香环,芳香环或者非芳香环可以是3至10元的单环、4至12元双环或者10至15元三环体系,碳环基可以连接有桥环或者螺环,非限制性实施例包括环丙基、环丁基、环戊基、1
‑
环戊基
‑1‑
烯基、1
‑
环戊基
‑2‑
烯基、1
‑
环戊基
‑3‑
烯基、环己基、1
‑
环己基
‑2‑
烯基、1
‑
环己基
‑3‑
烯基、环己烯基、环己二烯基、环庚基、环辛基、环壬基、环癸基、环十一烷基、环十二烷基、苯基、萘基。
[0084]
术语“杂环”或“杂环基”指饱和或部分不饱和单环或多环环状烃取代基,其包含3至20个环原子,其中一个或多个环原子为选自氮、氧或s(o)
m
(其中m是整数0至2)的杂原子,但不包括
‑
o
‑
o
‑
、
‑
o
‑
s
‑
或
‑
s
‑
s
‑
的环部分,其余环原子为碳。优选包含3至12个环原子,其中1~4个是杂原子;更优选包含3至10个环原子,其中1
‑
4是杂原子;更优选包含5至6个环原子;其中1
‑
3个是杂原子。单环杂环基的非限制性实例包括吡咯烷基、四氢吡喃基、1,2.3.6
‑
四氢吡啶基、哌啶基、哌嗪基、吗啉基、硫代吗啉基、高哌嗪基等。多环杂环基包括螺环、稠环和桥环的杂环基。
[0085]
各烷基、烯基、炔基、亚烷基、亚烯基、亚炔基、烷氧基、碳环基和杂环基无论是个别实体或作为较大实体的一部分都可任选被一个或多个选自由以下组成的组的任选取代基取代:c1‑6烷基、c2‑6烯基、c3‑6碳环基、氧代(=o)、
‑
oh、
‑
sh、c1‑6烷基o
‑
、c2‑6烯基o
‑
、c3‑6碳环
基o
‑
、c1‑6烷基s
‑
、c2‑6烯基s
‑
、c3‑6碳环基s
‑
、
‑
co2h、
‑
co2c1‑6烷基、
‑
nh2、
‑
nh(c1‑6烷基)、
‑
n(c1‑6烷基)2、
‑
nh(苯基)、
‑
n(苯基)2、氧代、
‑
cn、
‑
no2、
‑
卤素、
‑
cf3、
‑
ocf3、
‑
scf3、
‑
chf2、
‑
ochf2、
‑
schf2、
‑
苯基、碳环基、
‑
杂环基、
‑
杂芳基、
‑
o杂芳基、
‑
o杂环基、
‑
o苯基、、
‑
o碳环基、
‑
c(=o)苯基、
‑
c(=o)c1‑6烷基。适合取代基的实例包括但不限于甲基、乙基、丙基、异丙基、丁基、仲丁基、叔丁基、乙烯基、甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、甲硫基、乙硫基、丙硫基、异丙硫基、丁硫基、羟基、羟基甲基、羟基乙基、羟基丙基、羟基丁基、氟基、氯基、溴基、碘基、氰基、硝基、
‑
co2h、
‑
co2ch3、三氟甲基、三氟甲氧基、三氟甲硫基、二氟甲基、二氟甲氧基、二氟甲硫基、吗啉代、氨基、甲基氨基、二甲基氨基、苯基、苯氧基、苯基羰基、苯甲基和乙酰基。
附图说明
[0086]
图1制备化合物5及苄胺循环利用、化合物4和化合物6经反应循环利用的工艺流程。
[0087]
图2本发明的通用合成路线图。
[0088]
图3实施例1的合成路线图。
[0089]
图4实施例2的合成路线图。
[0090]
图5实施例3的合成路线图。
具体实施方式
[0091]
本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
[0092]
化合物的结构是通过核磁共振(nmr)或(和)质谱(ms)来确定的。nmr位移(δ)以10
‑
6(ppm)的的单位给出。nmr的测定是用(bruker avanceiii 400和bruker avance 300)核磁仪,测定溶剂为氘代二甲基亚砜(dmso
‑
d6),氘代氯仿(cdcl3),氘代甲醇(cd3od),内标为四甲基硅烷(tms)。lc
‑
ms的测定用岛津液质联用仪(shimadzu lc
‑
ms 2020(esi))。hplc的测定使用岛津高压液相色谱仪(shimadzu lc
‑
20a)。反相制备色谱使用gilson gx
‑
281反相制备色谱仪。薄层层析硅胶板用烟台黄海hsgf254或青岛gf254硅胶板,薄层层析分离纯化产品采用的规格是0.4mm~0.5mm。柱层析一般使用烟台黄海硅胶200~300目硅胶为载体。
[0093]
本发明的已知的起始原料可以采用或按照本领域已知的方法来合成,或可购买于安耐吉化学、成都科龙化工、韶远化学科技、百灵威科技等公司。
[0094]
实施例中无特殊说明,反应的温度为室温。室温为最适宜的反应温度,为10℃~30℃。过夜为12
±
3h。乙醇:乙醇。(boc)2o:boc酸酐,即二碳酸二叔丁酯。dmf:n,n
‑
二甲基甲酰胺。dmso:二甲基亚砜。dcm:二氯甲烷。
[0095]
本发明的通用合成路线如图2所示。
[0096]
实施例1
[0097]
实施例1的合成路线如图3所示。
[0098]
合成化合物3(e)
‑
l,4
‑
二邻苯二甲酰亚胺
‑2‑
丁烯
[0099][0100]
dmf(9l)加入20l反应釜中,将化合物1(e)
‑
1,4
‑
二溴
‑2‑
丁烯(3.3kg,15.43mol)加入100l反应釜中,搅拌溶解。反应釜中内温降至0℃,化合物7邻苯二甲酰亚胺钾盐(5.86kg,31.64mol)分批加入反应釜中,保持内温不高于35℃。反应体系于室温下反应15小时。将45l冰水加入100l反应釜中,分批将dmf反应液加入100l反应釜中,大力搅拌2小时。减压过滤,滤饼用5l水淋洗,滤饼置于鼓风干燥箱中60℃干燥过夜。得化合物3(e)
‑
l,4
‑
二邻苯二甲酰亚胺
‑2‑
丁烯类白色固体(5.01kg,14.47mol),收率94%。
[0101][0102]
化合物2(e)
‑
1,4
‑
二氯
‑2‑
丁烯(25g,0.20mol)溶解于dmf(150ml)中加入250ml单口瓶中,搅拌溶解。单口瓶中内温降至0℃,化合物7邻苯二甲酰亚胺钾盐(76g,0.41mol)分批加入单口瓶中,保持内温不高于35℃,反应于室温下反应48小时。将dmf反应液倒入450ml冰水中,大力搅拌2小时。减压过滤,滤饼用50ml水淋洗,滤饼置于鼓风干燥箱中60℃干燥过夜。得化合物3(e)
‑
l,4
‑
二邻苯二甲酰亚胺
‑2‑
丁烯类白色固体(65.37g,0.19mol),收率94%。
[0103]1h nmr(400mhz,cdcl3)δ7.85
‑
7.80(m,4h),7.74
‑
7.66(m,4h),5.83
‑
5.78(m,2h),4.27(dd,j=3.1,1.4hz,4h).
[0104]
ms(m+1):347.0
[0105]
合成化合物5(e)
‑
(4
‑
氨基丁
‑2‑
烯
‑1‑
基)氨基甲酸叔丁酯
[0106][0107]
将苄胺(20l)加入50l反应釜中,将化合物3(e)
‑
l,4
‑
二邻苯二甲酰亚胺
‑2‑
丁烯(2kg,5.77mol)加入反应釜中,升温搅拌溶解,反应于100℃下反应48小时。将反应内温降至10℃,大力搅拌下加入水(20l),搅拌2小时后减压过滤,滤饼用5l水淋洗。滤液用二氯甲烷萃取(20l
×
1,10l
×
3)后得到含有化合物4(e)
‑
1,4
‑
二胺
‑2‑
丁烯的水溶液,有机相减压蒸馏,回收苄胺(11.4l)。将上述水溶液和乙醇(20l)加入至100l反应釜中。20℃下,
[0108]
(boc)2o(604.27g,2.77mol)溶解于乙醇(5l)中并缓慢滴入100l反应釜中,滴加时间不小于180分钟。滴加完毕之后反应于室温下反应15小时。减压除去反应体系中的乙醇
后,减压过滤,滤饼用2l水淋洗。滤液用dcm(10l
×
1,5l
×
3)萃取,将有机相浓缩至干得黄色油状物化合物5反式(4
‑
氨基丁
‑2‑
烯
‑1‑
基)氨基甲酸叔丁酯(350.13g,1.88mol),收率32.54%。将(boc)2o(1200.15g,5.50mol)与乙醇(5l)加入水相中,室温下反应15小时,减压除去反应体系中的乙醇后,减压过滤,滤饼用2l水淋洗。合并上述滤饼干燥得白色固体化合物6(e)
‑
二叔丁基丁
‑2‑
烯
‑
1,4
‑
二基二氨基甲酸酯(710.04g,2.48mol),收率42.93%。
[0109][0110]
将二氯甲烷(1.5l)加入5l反应釜中,加入化合物6(e)
‑
二叔丁基丁
‑2‑
烯
‑
1,4
‑
二基二氨基甲酸酯(710.04g,2.48mol),分批加入盐酸(1.5l),室温下反应过夜。将水(5l)加入反应中,弃去有机相,使用碳酸氢钠将ph值调至8~9。水相用二氯甲烷(3l
×
1)萃取,弃去有机相,将水相转入20l反应釜中,加入乙醇(7l)。将(boc)2o(324.30g,1.49mol)溶于乙醇(700ml)中并缓慢滴入反应釜中,滴加时间不小于180分钟。滴加完毕之后反应于室温下反应15小时。减压除去反应体系中的乙醇后,减压过滤,滤饼用2l水淋洗。滤液用二氯甲烷(10l
×
1,5l
×
3)萃取,将有机相浓缩至干得黄色油状物化合物5(e)
‑
(4
‑
氨基丁
‑2‑
烯
‑1‑
基)氨基甲酸叔丁酯(170.05g,0.91mol),收率36.81%。将(boc)2o(700.11g,3.21mol)与乙醇(5l)加入水相中,室温下反应15小时,减压除去反应体系中的乙醇后,减压过滤,滤饼用2l水淋洗。合并上述滤饼干燥得白色固体化合物6(e)
‑
二叔丁基丁
‑2‑
烯
‑
1,4
‑
二基二氨基甲酸酯(320g,1.12mol),收率45.07%。
[0111]
化合物5:1h nmr(400mhz,meod)δ5.79
‑
5.66(m,1h),5.66
‑
5.54(m,1h),3.65(d,j=5.1hz,2h),3.23
‑
3.21(m,2h),1.46(s,9h).
[0112]
ms(m+1):187.0
[0113]
化合物6:1h nmr(400mhz,cdcl3)δ5.63(s,2h),3.73(s,4h),1.45(s,18h).
[0114]
ms(m+1):287.0
[0115]
实施例2
[0116]
实施例2的合成路线如图4所示。
[0117]
合成化合物9(2e,4e)
‑
1,6
‑
二邻苯二甲酰亚胺
‑
2,4
‑
己二烯
[0118][0119]
化合物8(2e,4e)
‑
1,6
‑
二溴己
‑
2,4
‑
二烯(5.00g,0.021mol)溶解于dmf(25ml)中加入100ml单口瓶中,搅拌溶解。单口瓶中内温降至0℃,化合物7邻苯二甲酰亚胺钾盐(8.11g,0.043mol)分批加入单口瓶中,保持内温不高于35℃,反应于室温下反应15小时。将dmf反应液倒入150ml冰水中,大力搅拌2小时。减压过滤,滤饼用50ml水淋洗,滤饼置于鼓风干燥箱
中60℃干燥过夜。得化合物9(2e,4e)
‑
1,6
‑
二邻苯二甲酰亚胺
‑
2,4
‑
己二烯
‑
类白色固体(7.41g,0.020mol),收率92%。
[0120]1h nmr(400mhz,cdcl3)δ7.86
‑
7.79(m,4h),7.73
‑
7.67(m,4h),6.27
‑
6.14(m,2h),5.78
‑
5.68(m,2h),4.29(d,j=6.1hz,4h).
[0121]
ms(m+1):373.0
[0122]
合成化合物11叔丁基((2e,4e)
‑6‑
氨基己基
‑
2,4
‑
二烯
‑1‑
基)氨基甲酸酯
[0123][0124]
苄胺(70ml)加入250ml反应瓶中,将化合物9(2e,4e)
‑
1,6
‑
二邻苯二甲酰亚胺
‑
2,4
‑
己二烯(7.01g,18.79mmol)加入反应瓶中,升温搅拌溶解,反应于100℃下反应48小时。将反应内温降至10℃,大力搅拌下加入水(70ml),搅拌2小时后减压过滤,滤饼用30ml水淋洗。滤液用二氯甲烷萃取(100mlx3),得到含有化合物10(2e,4e)
‑
1,6
‑
二胺
‑
2,4
‑
己二烯的水溶液。将上述水相和乙醇(100ml)加入至500ml反应瓶中。20℃下,(boc)2o(2.30g,10.55mmol)溶解于乙醇(50ml)中并缓慢滴入反应釜中,滴加时间不小于180分钟。滴加完毕之后反应于室温下反应15小时。减压浓缩以除去反应体系中的乙醇,反应液减压过滤,滤饼用50ml水淋洗。滤液用dcm(100mlx3)萃取,将有机相浓缩至干得化合物11叔丁基((2e,4e)
‑6‑
氨基己基
‑
2,4
‑
二烯
‑1‑
基)氨基甲酸酯,黄色油状物(0.85g,0.40mmol),收率31%。将(boc)2o(4.61g,21.15mmol)与乙醇(100ml)加入水相中,室温下反应15小时,减压除去反应体系中的乙醇后,减压过滤,滤饼用50ml水淋洗。合并上述滤饼干燥得白色固体化合物12(2e,4e)
‑
二叔丁基丁
‑
2,4
‑
己二烯
‑
1,6
‑
二基二氨基甲酸酯(2.37g,7.57mmol),收率40.29%。
[0125]
化合物11:1h nmr(400mhz,meod)δ6.22
‑
6.08(m,2h),5.79
‑
5.69(m,1h),5.67
‑
5.57(m,1h),3.66(d,j=5.5hz,2h),3.26(d,j=5.9hz,2h),1.51
‑
1.31(s,9h).
[0126]
ms(m+1):213.0
[0127]
化合物12:1h nmr(400mhz,meod)δ6.19
–
6.08(m,2h),5.68
–
5.53(m,2h),3.78
–
3.52(m,4h),1.43(s,18h).
[0128]
ms(m+1):313.0
[0129]
实施例3
[0130]
实施例3的合成路线如图5所示。
[0131]
合成化合物14(z)
‑
l,4
‑
二邻苯二甲酰亚胺
‑2‑
丁烯
[0132][0133]
化合物13(z)
‑
1,4
‑
二氯
‑2‑
丁烯(100g,0.80mol)溶解于dmf(500ml)中加入1l单口瓶中,搅拌溶解。单口瓶中内温降至0℃,化合物7邻苯二甲酰亚胺钾盐(311g,1.68mol)分批
加入单口瓶中,保证内温不高于35℃,反应于18℃下反应15小时。将dmf反应液倒入5l冰水中,大力搅拌2小时。减压过滤,滤饼用50ml水淋洗,滤饼置于鼓风干燥箱中60℃干燥过夜。得化合物14(z)
‑
l,4
‑
二邻苯二甲酰亚胺
‑2‑
丁烯类白色固体(262.02g,0.76mol),收率94%。
[0134]1h nmr(400mhz,cdcl3)δ7.87
‑
7.83(m,4h),7.78
‑
7.67(m,4h),5.77
‑
5.62(m,2h),4.67
‑
4.48(m,2h).
[0135]
ms(m+1):347.0
[0136]
合成化合物16(z)
‑
(4
‑
氨基丁
‑2‑
烯
‑1‑
基)氨基甲酸叔丁酯
[0137][0138]
苄胺(2l)加入5l反应瓶中,将化合物14(z)
‑
l,4
‑
二邻苯二甲酰亚胺
‑2‑
丁烯(262.02g,0.76mol)加入反应釜中,升温搅拌溶解,反应于100℃下反应48小时。将反应内温降至10℃,大力搅拌下加入水(2l),搅拌2小时后减压过滤,滤饼用500ml水淋洗。滤液用二氯甲烷萃取(2l x 1,1lx3),得到含有化合物15(z)
‑
1,4
‑
二胺
‑2‑
丁烯的水溶液。将上述水相和乙醇(2l)加入至5l反应釜中。20℃下,(boc)2o(116.15g,0.53mol)溶解于乙醇(500ml)中并缓慢滴入反应釜中,滴加时间不小于180分钟。滴加完毕之后反应于20℃下反应15小时。减压浓缩以除去反应体系中的乙醇,反应液减压过滤,滤饼用2l水淋洗。滤液用dcm(1l x 1,500mlx3)萃取,将有机相浓缩至干得黄色油状物化合物16(z)
‑
(4
‑
氨基丁
‑2‑
烯
‑1‑
基)氨基甲酸叔丁酯(42.11g,0.22mol),收率29.7%)。将(boc)2o(120.08g,0.55mol)与乙醇(2l)加入水相中,室温下反应15小时,减压除去反应体系中的乙醇后,减压过滤,滤饼用2l水淋洗。合并上述滤饼干燥得白色固体化合物17(z)
‑
二叔丁基丁
‑2‑
烯
‑
1,4
‑
二基二氨基甲酸酯(81.55g,0.29mol),收率38.16%。
[0139]
化合物16:1h nmr(400mhz,meod)δ5.63
‑
5.52(m,1h),5.49
‑
5.40(m,1h),3.67(d,j=6.8hz,2h),3.33
‑
3.30(m,2h),1.43(s,9h).
[0140]
ms(m+1):187.0。
[0141]
化合物17:1h nmr(400mhz,meod)δ5.50
–
5.42(m,2h),3.77
–
3.61(m,4h),1.43(s,18h).
[0142]
ms(m+1):287.0。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1