一种丁醚脲杂质A、B的合成方法与流程
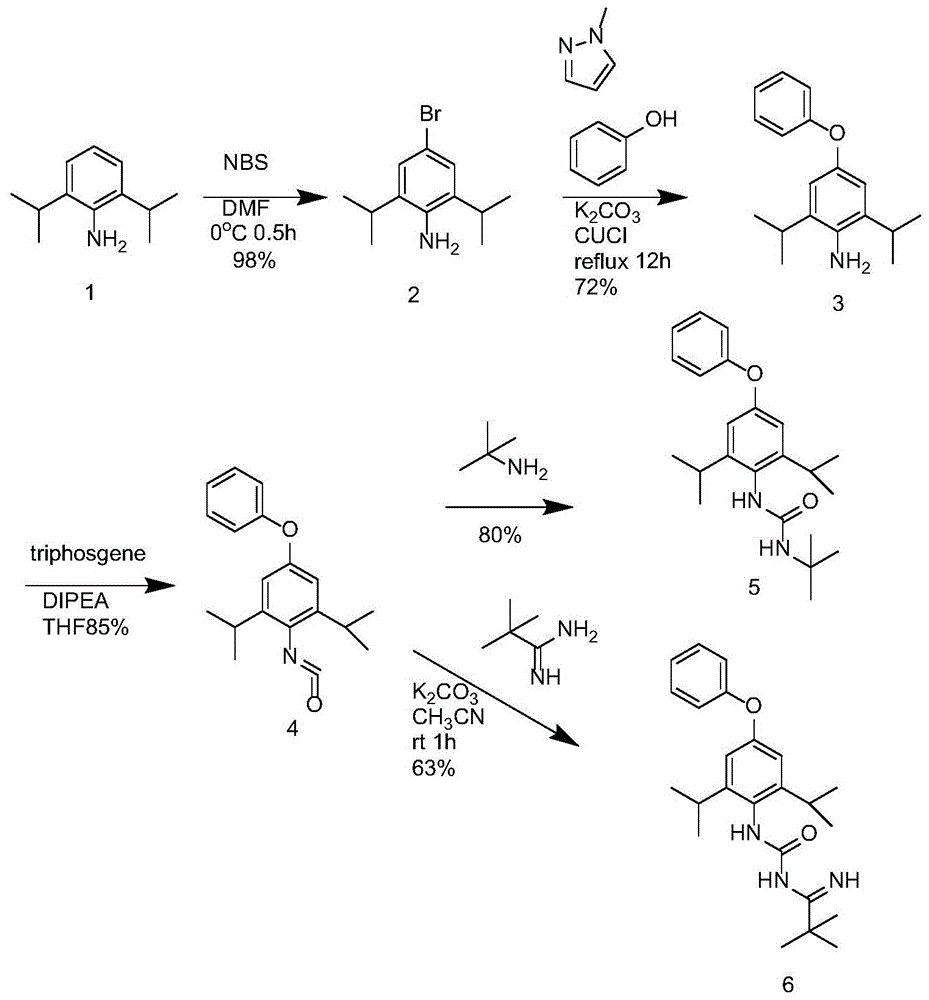
本发明涉及药物化学领域,尤其涉及一种丁醚脲杂质a和丁醚脲杂质b的合成方法。
背景技术:
丁醚脲(又名杀螨隆,结构如下化合物i)是汽巴-嘉基公司80年代开发出的一种新型硫脲杀虫、杀螨剂。该药是一种选择性杀虫剂,具有内吸和熏蒸作用。
丁醚脲杂质a,b是生产丁醚脲过程中所产生的两种副产物,由于其含量较低,用提纯的方式很难将其富集。目前尚没有文献报道其合成方法。这给生产和申报农药工作带来了很多不便。
为了规范地进行对杂质进行研究,并将其控制在一个安全、合理的限度范围之内,提高丁醚脲的质量及安全性,提供丁醚脲杂质a,b的合成方法具有重要意义。
技术实现要素:
本发明为提供丁醚脲杂质a,b用于丁醚脲生产中杂质的定性及定量分析,从而可以提高丁醚脲的质量标准,为人民群众安全用药提供重要的指导意义,提供了丁醚脲杂质的制备方法。
本发明的第一方面,提供了丁醚脲杂质a的制备方法,包括以下步骤:
步骤s1、取2,6-异丙基苯胺溶于dmf中得到第一反应液,滴加nbs的dmf溶液,反应一段时间,加入水和乙酸乙酯混合均匀,分液得到第一有机相,所述第一有机相经水洗、干燥、浓缩,得到化合物2;
步骤s2、取所述化合物2、碳酸钾、苯酚、氯化亚铜、1-甲基咪唑溶于有机溶剂中得到第二反应液,加热回流至反应完成,加入水与乙酸乙酯混合均匀,分液得到第二有机相,所述第二有机相经碱洗、干燥、浓缩、柱层析得到化合物3;
步骤s3、将所述化合物3与dipea依次加入溶于thf中,冷却后得到第三反应液,将三光气的thf溶液滴入所述第三反应液中,搅拌至反应完全,分液得到第三有机相,所述第三有机相经无水硫酸钠干燥,减压浓缩,得到化合物4;
步骤s4、取所述化合物4溶于thf中,冷却得到第四反应液,将叔丁胺的thf溶液滴入所述第四反应液,搅拌至反应完全,加入乙酸乙酯与水,分液得到第四有机相,所述第四有机相经无水硫酸钠干燥,减压浓缩,得到化合物5,即丁醚脲杂质a。
本发明的第二方面,提供了丁醚脲杂质b的制备方法,包括以下步骤:步骤s1、取2,6-异丙基苯胺溶于dmf中得到第一反应液,滴加nbs的dmf溶液,反应一段时间,加入水和乙酸乙酯混合均匀,分液得到第一有机相,所述第一有机相经水洗、干燥、浓缩,得到化合物2;
步骤s2、取所述化合物2、碳酸钾、苯酚、氯化亚铜、1-甲基咪唑溶于有机溶剂中得到第二反应液,加热回流至反应完成,加入水与乙酸乙酯混合均匀,分液得到第二有机相,所述第二有机相经碱洗、干燥、浓缩、柱层析得到化合物3;
步骤s3、将所述化合物3与dipea依次加入溶于thf中,冷却后得到第三反应液,将三光气的thf溶液滴入所述第三反应液中,搅拌至反应完全,分液得到第三有机相,所述第三有机相经无水硫酸钠干燥、减压浓缩,得到化合物4;
步骤s5、取叔丁基甲脒盐酸盐、碳酸钾、乙腈混合均匀,滴入所述化合物4后得到第五反应液,反应完全后过滤得滤液,滤液中加入乙酸乙酯水,分液得到第五有机相,所述第五有机相经硫酸钠干燥、柱层析,得到化合物6,即丁醚脲杂质b。
优选地,步骤s1中,所述第一反应液在滴加nbs的dmf溶液前降温至0-5℃。
优选地,步骤s1中,所述第一反应液在滴加nbs的dmf溶液后,在0-5℃下反应0.5~2小时。
优选地,步骤s1中,所述第一反应液中2,6-异丙基苯胺与dmf的质量体积比为1:8~12g/ml。
优选地,步骤s2中,所述化合物2与所述苯酚的摩尔比为1:1~1.5。
优选地,步骤s2中,所述化合物2、碳酸钾、氯化亚铜的摩尔比为1:2~2.5:5~6。
优选地,步骤s3中,所述第三反应液中,所述化合物3、dipea、thf的摩尔体积比为1:100~120:200~300。
优选地,步骤s4中所述化合物4与叔丁胺的摩尔比为1:1.3~1.5。
优选地,步骤s5中,所述化合物4与叔丁基甲脒盐酸盐的摩尔比为1:1~1.5。
本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
本发明为提供了丁醚脲杂质a,b的制备方法,以2,6-异丙基苯胺、苯酚、三光气、叔丁胺、叔丁基甲脒盐酸盐为原料,为规范地进行对杂质进行研究提供了物质基础,还可以用于丁醚脲生产中杂质的定性及定量分析,并将其控制在一个安全、合理的限度范围之内,从而可以提高丁醚脲的质量标准,为人民群众安全用药提供重要的指导意义。
附图说明
图1为本发明一种丁醚脲杂质a、b的制备方法的流程图。
具体实施方式
本发明提供了丁醚脲杂质a的制备方法,如图1所示,包括以下步骤:
步骤s1、取2,6-异丙基苯胺溶于dmf中得到第一反应液,滴加nbs的dmf溶液,反应一段时间,加入水和乙酸乙酯混合均匀,分液得到第一有机相,所述第一有机相经水洗、干燥、浓缩,得到化合物2;
步骤s2、取所述化合物2、碳酸钾、苯酚、氯化亚铜、1-甲基咪唑溶于有机溶剂中得到第二反应液,加热回流至反应完成,加入水与乙酸乙酯混合均匀,分液得到第二有机相,所述第二有机相经碱洗、干燥、浓缩、柱层析得到化合物3;
步骤s3、将所述化合物3与dipea依次加入溶于thf中,冷却后得到第三反应液,将三光气的thf溶液滴入所述第三反应液中,搅拌至反应完全,分液得到第三有机相,所述第三有机相经无水硫酸钠干燥,减压浓缩,得到化合物4;
步骤s4、取所述化合物4溶于thf中,冷却得到第四反应液,将叔丁胺的thf溶液滴入所述第四反应液,搅拌至反应完全,加入乙酸乙酯与水,分液得到第四有机相,所述第四有机相经无水硫酸钠干燥,减压浓缩,得到化合物5,即丁醚脲杂质a。
本发明还提供了丁醚脲杂质b的制备方法,包括以下步骤:步骤s1、取2,6-异丙基苯胺溶于dmf中得到第一反应液,滴加nbs的dmf溶液,反应一段时间,加入水和乙酸乙酯混合均匀,分液得到第一有机相,所述第一有机相经水洗、干燥、浓缩,得到化合物2;
步骤s2、取所述化合物2、碳酸钾、苯酚、氯化亚铜、1-甲基咪唑溶于有机溶剂中得到第二反应液,加热回流至反应完成,加入水与乙酸乙酯混合均匀,分液得到第二有机相,所述第二有机相经碱洗、干燥、浓缩、柱层析得到化合物3;
步骤s3、将所述化合物3与dipea依次加入溶于thf中,冷却后得到第三反应液,将三光气的thf溶液滴入所述第三反应液中,搅拌至反应完全,分液得到第三有机相,所述第三有机相经无水硫酸钠干燥、减压浓缩,得到化合物4;
步骤s5、取叔丁基甲脒盐酸盐、碳酸钾、乙腈混合均匀,滴入所述化合物4后得到第五反应液,反应完全后过滤得滤液,滤液中加入乙酸乙酯水,分液得到第五有机相,所述第五有机相经硫酸钠干燥、柱层析,得到化合物6,即丁醚脲杂质b。
下面通过具体实施例对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。
实施例1
本实施例提供了化合物2的制备方法(即步骤s1):
取2,6-异丙基苯胺(化合物1,53g,0.3mol),溶于n,n-二甲基甲酰胺(dmf,500ml)中,降温至0-5℃得到第一反应液,滴加n-溴代琥珀酰亚胺(nbs63g,0.36mol)的dmf(200ml)溶液,滴加完成后,0-5℃下反应0.5小时,tlc检测确认反应完全,加入水和乙酸乙酯搅拌10分钟,分液,有机相水洗两次,干燥,浓缩,得到化合物2(70g,收率98%);
对制备的化合物2进行核磁氢谱检测:
1hnmr(300mhz,dmso)δ6.93(s,2h),4.76(s,2h),2.93–3.04(m,2h),1.10(d,j=6.9hz,12h)
实施例2
本实施例提供了化合物3的制备方法(即步骤s2):
取化合物2(30g,0.11mol),碳酸钾(32.4g,0.23mol),苯酚(13.2g,0.14mol),氯化亚铜(0.58mol),1-甲基咪唑(4.7ml)溶于二甲苯(300ml)中得到第二反应液,加热回流12小时,冷却后加入水与乙酸乙酯,搅拌10分钟,分液,有机相采用碳酸钾水溶液碱洗,硫酸钠干燥,浓缩,柱层析得到化合物3(23g,收率72%)
对制备的化合物3进行核磁氢谱检测:
1hnmr(300mhz,dmso)7.21-7.23(m,2h),6.93-7.01(m,1h),6.79-6.86(m,2h),6.60(s,2h),4.50(s,2h),2.98-3.09(m,2h),1.11(d,j=6.9hz,12h)
实施例3
本实施例提供了化合物4的制备方法(即步骤s3):
化合物3(8.9g,0.33mol)与n,n-二异丙基乙胺(dipea,11.2ml)依次加入溶于四氢呋喃(thf,80ml)中,冷却至0℃得到第三反应液,三光气(32g)的thf(30ml)溶液滴入上述第三反应液中,搅拌10分钟,分液,有机相无水硫酸钠干燥,减压浓缩,得到化合物4(8.2g,收率85%)。
对制备的化合物4进行核磁氢谱检测:
1hnmr(300mhz,dmso)7.33-7.43(m,2h),7.08-7.16(m,1h),6.94-7.02(m,2h),6.80(s,2h),3.07-3.19(m,2h),1.15(d,j=7.0hz,12h)
实施例4
本实施例提供了化合物5的制备方法(即步骤s4):
取化合物4(4g,13.5mmol)溶于thf(40ml)中,冷却至0℃得到第四反应液,叔丁胺(1.4g,20.2mmol)的thf(10ml)溶液滴入上述第四反应液中,搅拌1小时,加入乙酸乙酯与水,分液,有机相用无水硫酸钠干燥,减压浓缩,得到化合物5(4.0g,收率80%);
对制备的化合物5进行核磁氢谱检测:
1hnmr(300mhz,dmso)7.33-7.43(m,2h),7.05-7.16(m,1h),6.94-7.00(m,2h),6.72(s,2h),5.94(s,1h),3.05-3.18(m,2h),1.26(s,9h),1.07(d,j=6.9hz,12h)。
实施例5
本实施例提供了化合物6的制备方法(即步骤s4):
取叔丁基甲脒盐酸盐(5.4g,39.8mmol),碳酸钾(11g,80mmol),乙腈(200ml)依次加入三口瓶中,搅拌10分钟后,将化合物4(11.8g,39.8mmol)滴入以上溶液中得到第五反应液,室温下反应2小时,过滤,除去不溶物,滤液中加入乙酸乙酯水,分出有机相,硫酸钠干燥,柱层析,得到化合物6(10g,收率63%)。
对制备的化合物5进行核磁氢谱检测(氮原子上属于活泼氢,核磁氢谱中,可以不出):
nmr(300mhz,dmso)7.33-7.43(m,2h),7.07-7.18(m,1h),6.96-7.02(m,2h),6.75(s,2h),3.06-3.17(m,2h),1.56(s,9h),1.12(d,j=6.9hz,12h)
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!