一种产泛解酸的微生物及其构建方法和应用
1.本发明涉及生物技术领域中,一种产泛解酸的微生物及其构建方法和应用。
背景技术:
2.泛酸钙又称维生素b5,是人体必需的13种维生素之一。泛酸钙只能在微生物和植物中合成,是合成辅酶a的重要前体和维持生物正常生理机能的必需维生素。同时,泛酸钙作为食品添加剂和医药原料药等也具有广泛的应用。目前,泛酸钙主要是通过生物或化学方法拆分dl-泛解酸内酯获得高纯度d-泛解酸内酯后与β-丙氨酸反应获得。
3.泛解酸内酯作为合成泛酸钙的重要前体物质,其合成目前主要是通过以石化材料通过化学方式完成。用于合成dl-泛解酸内酯的材料主要是异丁醛、甲醛等石化材料,经过一系列化学反应,如羟甲基化、酸化或者羟醛缩合等实现的。这个过程需要涉及大量氰化钠等剧毒原料或者强碱、强酸等化学试剂,并产生大量的废水、废气,对环境造成很大的破坏性和不可修复性。另一个值得注意的是,用于泛酸钙合成的dl-泛解酸内酯中l-泛解酸内酯需要去除的很干净才能获得高纯度的d-泛酸钙,这对用于dl-泛解酸内酯的拆分方法具有极高的要求。由于泛酸钙合成方法的局限,近年来泛酸钙合成企业经常受到环保督察,企业压力大,泛酸钙价格也从一吨几万到几十万元不等。
4.随着合成生物学和代谢工程的急速发展,通过设计和构建微生物细胞工厂以可再生原料通过发酵生产化学品成为替代以石化等不可再生资源为原料通过化学反应生产化学品的重要方式并已获得巨大的成功。大肠杆菌野生型细胞自身就有泛解酸合成路径。但是基于细胞自身复杂的代谢网络调控,野生型细胞难以积累可检测浓度的泛解酸。通过基因组规模系统代谢育种,设计并构建能够高效生产泛解酸的工程菌对于解决泛酸钙制造过程中污染重、原料贵等问题将具有极大的推动作用。另外,通过微生物发酵获得的泛解酸本身就是高纯度的d-泛解酸,无需后续拆分,这将极大的降低泛酸钙的生产成本和环保压力。
5.因此,研究并提供具有遗传稳定性、无需添加诱导剂和抗生素的能够以葡萄糖等为原料通过生物发酵生产高纯度泛解酸的微生物细胞对于推动泛酸钙生产、降低生产成本、减少环保压力将具有重要的意义。
技术实现要素:
6.本发明所要解决的技术问题是如何生产泛解酸。
7.为解决上述技术问题,本发明首先提供了一种重组大肠杆菌的构建方法,所述包括:对出发大肠杆菌进行如下a1-a25的改造,得到重组大肠杆菌:
8.a1、导入乙酰乳酸合成酶基因alss基因,并使所述alss基因得到表达;
9.a2、将驱动乙酰乳酸合成酶i大亚基基因ilvb基因的启动子替换为m1-93启动子,所述m1-93启动子为下述任一种dna分子:
10.a1)一条链的核苷酸序列为序列表中序列3的dna分子;
11.a2)与a1)的dna分子具有80%以上同一性且具有启动子功能的dna分子;
12.a3、将驱动乙酰乳酸合成酶ii大亚基基因ilvg基因的启动子替换为所述m1-93启动子;
13.a4、将乙酰乳酸合成酶iii调控亚基基因ilvh基因突变为ilvh突变基因,所述ilvh突变基因编码序列表中序列5所示的蛋白质;
14.a5、导入乙酰羟基酸还原异构酶编码基因ilvc基因,并使所述ilvc基因得到表达;
15.a6、导入二羟酸脱水酶编码基因ilvd基因,并使所述ilvd基因得到表达;
16.a7、导入来源于大肠杆菌的3-甲基-2-氧代丁酸羟甲基转移酶基因panb基因,记为e-panb基因,并使所述e-panb基因得到表达;
17.a8、导入2-脱氢泛酸酯-2-还原酶基因pane基因,并使所述pane基因得到表达;
18.a9、导入甘氨酸羟甲基转移酶基因glya基因,并使所述glya基因得到表达;
19.a10、将驱动氨甲基转移酶基因gcvt基因的启动子替换为所述m1-93启动子;
20.a11、将驱动甘氨酸脱羧酶基因gcvp基因的启动子替换为所述m1-93启动子;
21.a12、导入来源于谷氨酸棒杆菌的3-甲基-2-氧代丁酸羟甲基转移酶基因panb基因,记为c-panb基因,并使所述c-panb基因得到表达;
22.a13、将支链氨基酸氨基转移酶基因ilve基因突变为ilve突变基因,所述ilve突变基因编码序列表中序列12所示的蛋白质;
23.a14、导入磷酸甘油酸脱氢酶基因sera基因,并使所述sera基因得到表达;
24.a15、导入磷酸丝氨酸/磷酸羟基苏氨酸氨基转移酶基因serc基因和磷酸丝氨酸磷酸酶基因serb基因,并使所述serc基因和所述serb基因得到表达;
25.a16、敲除l-丝氨酸脱氨酶i基因sdaa基因;
26.a17、敲除丙酸激酶编码基因tdcd基因和甲酸乙酰转移酶编码基因tdce基因;
27.a18、敲除醇脱氢酶基因adhe基因;
28.a19、敲除丙酮酸甲酸裂解酶编码基因pflb基因;
29.a20、敲除富马酸还原酶编码基因frd基因;
30.a21、敲除乳酸脱氢酶基因ldha基因;
31.a22、敲除甲基乙二醛合酶基因mgsa基因;
32.a23、敲除乙酸激酶编码基因pta基因和acka基因;
33.a24、敲除核糖激酶基因ara基因;
34.a25、敲除缬氨酸-丙酮酸转氨酶基因avta基因。
35.上述方法中,所述alss基因可来源于枯草芽孢杆菌(bacillus subtilis),如枯草芽孢杆菌(bacillus subtilis)168。
36.所述ilvc基因可来源于大肠杆菌(escherichia coli),如大肠杆菌atcc 8739。
37.所述ilvd基因可来源于大肠杆菌,如大肠杆菌mg1655。
38.所述pane基因可来源于大肠杆菌,如大肠杆菌mg1655。
39.所述glya基因可来源于大肠杆菌,如大肠杆菌atcc 8739。
40.所述sera基因可来源于谷氨酸棒杆菌,如谷氨酸棒杆菌atcc13032。
41.所述serc基因和所述serb基因可来源于大肠杆菌,如大肠杆菌mg1655。
42.所述e-panb基因可来源于大肠杆菌mg1655。
43.所述c-panb基因可来源于谷氨酸棒杆菌atcc13032。
44.上述方法中,所述alss基因可编码序列表中序列2所示的alss蛋白质。
45.所述c-panb基因可编码序列表中序列10所示的c-panb蛋白质。
46.所述sera基因可编码序列表中序列14所示的sera蛋白质。
47.所述serc基因可编码序列表中序列16所示的serc蛋白质。
48.所述serb基因可编码序列表中序列17所示的serb蛋白质。
49.上述方法中,所述alss基因的序列可为序列表中序列1。
50.所述ilvh突变基因的序列可为序列表中序列4。
51.所述c-panb基因的序列可为序列表中序列9。
52.所述ilve突变基因的序列可为序列表中序列11。
53.所述sera基因的序列可为序列表中序列13。
54.所述serc基因的序列可为序列表中序列15的第89-1177位。
55.所述serb基因的序列可为序列表中序列15的第1199-2167位。
56.上述方法中,a1可通过向所述受体大肠杆菌中导入alss基因表达盒实现,所述alss基因表达盒含有启动子和由所述启动子驱动的所述alss基因。
57.a5可通过向所述受体大肠杆菌中导入ilvc基因表达盒实现,所述ilvc基因表达盒含有启动子和由所述启动子驱动的所述ilvc基因。
58.a6可通过向所述受体大肠杆菌中导入ilvd基因表达盒实现,所述ilvd基因表达盒含有启动子和由所述启动子驱动的所述ilvd基因。
59.a7可通过向所述受体大肠杆菌中导入e-panb基因表达盒实现,所述e-panb基因表达盒含有启动子和由所述启动子驱动的所述e-panb基因。
60.a8可通过向所述受体大肠杆菌中导入pane基因表达盒实现,所述pane基因表达盒含有启动子和由所述启动子驱动的所述pane基因。
61.a9可通过向所述受体大肠杆菌中导入glya基因表达盒实现,所述glya基因表达盒含有启动子和由所述启动子驱动的所述glya基因。
62.a12可通过向所述受体大肠杆菌中导入c-panb基因表达盒实现,所述c-panb基因表达盒含有启动子和由所述启动子驱动的所述c-panb基因。
63.a14可通过向所述受体大肠杆菌中导入sera基因表达盒实现,所述sera基因表达盒含有启动子和由所述启动子驱动的所述sera基因。
64.a15可通过向所述受体大肠杆菌中导入sercb基因表达盒实现,所述sercb基因表达盒含有启动子和由所述启动子驱动的所述serc基因和所述serb基因。
65.上述方法中,a1、a7、a12、a14或a15中所述启动子可为所述m1-93启动子。
66.a5或a9中所述启动子可为m1-46启动子,所述m1-46启动子为下述任一种dna分子:
67.1)一条链的核苷酸序列为序列表中序列6的dna分子;
68.2)与1)的dna分子具有80%以上同一性且具有启动子功能的dna分子。
69.a6中所述启动子可为rbsl1启动子,所述rbsl1启动子为下述任一种dna分子:
70.a1)一条链的核苷酸序列为序列表中序列7的dna分子;
71.a2)与a1)的dna分子具有80%以上同一性且具有启动子功能的dna分子。
72.a8中所述启动子可为rbsl2启动子,所述rbsl2启动子为下述任一种dna分子:
73.c1)一条链的核苷酸序列为序列表中序列8的dna分子;
74.c2)与c1)的dna分子具有80%以上同一性且具有启动子功能的dna分子。
75.这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的的核苷酸序列具有80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
76.上述80%以上同一性,可为85%、90%或95%以上的同一性。
77.所述sercb基因表达盒可如序列表中序列15所示。
78.上述方法中,所述出发大肠杆菌可为大肠杆菌atcc 8739。
79.利用所述重组大肠杆菌的构建方法得到的重组大肠杆菌,也属于本发明的保护范围。
80.在本发明的一个实施例中,以大肠杆菌atcc 8739为出发大肠杆菌,利用所述重组大肠杆菌的构建方法得到了大肠埃希氏菌(escherichia coli)span050,大肠埃希氏菌(escherichia coli)span050保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏中心登记入册编号:cgmcc no.21699。
81.本发明还提供了一种生产泛解酸的方法,所述方法包括:包括培养所述重组大肠杆菌,得到发酵产物;从所述发酵产物中得到泛解酸。
82.培养所述重组大肠杆菌可采用含有葡萄糖且能用于培养大肠杆菌的培养基进行。
83.所述培养基可为培养基1、培养基2或培养基3,所述培养基1由溶剂和溶质组成,溶剂为水,溶质及其在所述培养基1中的浓度分别为:葡萄糖20g/l、(nh4)2hpo
4 3.5g/l、kh2po43.91g/l、k2hpo
4 4.48g/l、mgso4·
7h2o 0.18g/l、甜菜碱-hcl 0.15g/l,fecl3·
6h2o 1.5μg/l、cocl2·
6h2o 0.1μg/l、cucl2·
2h2o 0.1μg/l、zncl
2 0.1μg/l、na2moo4·
2h2o 0.1μg/l、mncl2·
4h2o 0.2μg/l,h3bo
3 0.05μg/l;
84.所述培养基2由溶剂和溶质组成,溶剂为水,溶质及其在所述培养基2中的浓度分别为:葡萄糖50g/l、(nh4)2hpo
4 3.5g/l、kh2po
4 3.91g/l、k2hpo
4 4.48g/l、mgso4·
7h2o 0.18g/l、甜菜碱-hcl 0.15g/l、5g/l丝氨酸,fecl3·
6h2o 1.5μg/l、cocl2·
6h2o 0.1μg/l、cucl2·
2h2o0.1μg/l、zncl
2 0.1μg/l、na2moo4·
2h2o 0.1μg/l、mncl2·
4h2o 0.2μg/l,h3bo
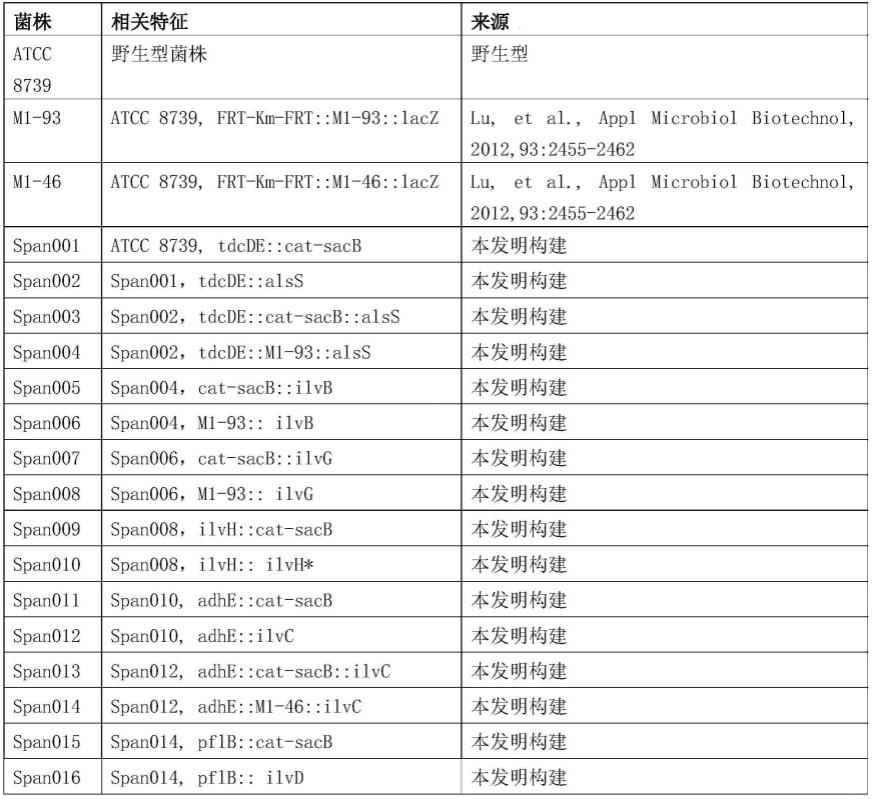
3 0.05μg/l;
85.所述培养基3由溶剂和溶质组成,溶剂为水,溶质及其在所述培养基3中的浓度分别为:葡萄糖30g/l、硫酸镁5g/l、磷酸二氢钾10.5g/l、酵母粉20g/l、磷酸氢二铵6g/l、一水柠檬酸1.84g/l,fecl3·
6h2o 1.5μg/l、cocl2·
6h2o 0.1μg/l、cucl2·
2h2o 0.1μg/l、zncl
2 0.1μg/l、na2moo4·
2h2o 0.1μg/l、mncl2·
4h2o 0.2μg/l,h3bo
3 0.05μg/l。
86.在培养过程中,可根据培养情况向培养体系中添加葡萄糖。
87.所述培养可在37℃下进行。
88.本发明还提供了下述任一应用:
89.x1、所述重组大肠杆菌的构建方法在生产泛解酸中的应用;
90.x2、所述重组大肠杆菌的构建方法在生产泛酸钙中的应用;
91.x3、所述重组大肠杆菌在生产泛解酸中的应用;
92.x4、所述重组大肠杆菌在制备生产泛解酸产品中的应用;
93.x5、所述重组大肠杆菌在生产泛酸钙中的应用;
94.x6、所述重组大肠杆菌在制备生产泛酸钙产品中的应用;
95.x7、所述生产泛解酸的方法在生产泛酸钙中的应用。
96.本发明利用重组大肠杆菌的构建方法成功得到了可以生产泛解酸的菌株,该菌株的泛解酸合成途径已打通并可以发酵过程中实现泛解酸的积累,本发明的重组大肠杆菌的构建方法与所得重组大肠杆菌具有很好的工业应用潜力。
97.生物材料保藏说明
98.分类命名:大肠埃希氏菌(escherichia coli)
99.菌株编号:span050
100.保藏单位名称:中国微生物菌种保藏管理委员会普通微生物中心
101.保藏单位简称:cgmcc
102.保藏单位地址:北京市朝阳区北辰西路1号院3号,邮政编码:100101
103.保藏日期:2021年01月22日
104.保藏中心登记入册编号:cgmcc no.21699
具体实施方式
105.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
106.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应dna/rna的5
′
末端核苷酸,末位均为相应dna/rna的3
′
末端核苷酸。
107.表1本发明所用的菌株和质粒
108.[0109][0110]
表1中,atcc 8739、m1-93和m1-46均为大肠杆菌。
[0111]
表2本发明所用的引物
[0112]
[0113]
[0114]
[0115]
[0116]
[0117][0118]
下文中,利用“/”隔开的两条引物组成相应的引物对用于扩增目标片段。
[0119]
实施例1乙酰乳酸合成酶基因alss在atcc 8739菌株中丙酸激酶编码基因tdcd和甲酸乙酰转移酶编码基因tdce位点的插入与tdcde操纵子的敲除
[0120]
从大肠杆菌atcc 8739出发,采用两步同源重组的方法将来自枯草芽孢杆菌(bacillus subtilis)168(来自atcc,编号23857)的乙酰乳酸合成酶基因alss插入染色体上丙酸激酶编码基因tdcd和甲酸乙酰转移酶编码基因tdce位点,具体步骤如下:
[0121]
第一步,以pxz-cs(tan,et al.,appl environ microbiol,2013,79:4838-4844)
质粒dna为模板,使用引物tdcde-incs-up/tdcde-incs-down扩增出2719bp的dna片段i,该片段包含tdcde上游同源臂50bp,氯霉素基因(cat)和果聚糖蔗糖转移酶基因(sacb)dna的cat-sacb片段2619bp,和tdcde基因下游同源臂50bp,用于第一步同源重组。
[0122]
扩增体系为:phusion 5x缓冲液(newengland biolabs)10μl、dntp(每种dntp各10mm)1μl、dna模板20ng、引物(10μm)各2μl、phusion high-fidelity dna聚合酶(2.5u/μl)0.5μl、蒸馏水33.5μl,总体积为50μl。
[0123]
扩增条件为98℃预变性2分钟(1个循环);98℃变性10秒、56℃退火10秒、72℃延伸2分钟(30个循环);72℃延伸10分钟(1个循环)。
[0124]
将上述dna片段i用于第一次同源重组:首先将pkd46质粒(美国耶鲁大学cgsc大肠杆菌保藏中心,cgsc#7739)通过电转化法转化至大肠杆菌atcc 8739,然后将dna片段i电转至带有pkd46的大肠杆菌atcc 8739。
[0125]
电转条件为:首先准备带有pkd46质粒的大肠杆菌atcc 8739的电转化感受态细胞(准备方法按照dower et al.,1988,nucleic acids res 16:6127-6145);将50μl感受态细胞置于冰上,加入50ng dna片段i,冰上放置2分钟,转移至0.2cm的bio-rad电击杯。使用micropulser(bio-rad公司)电穿孔仪,电击参数为电压2.5kv。电击后迅速将1ml lb培养基转移至电击杯中,吹打5次后转移至试管中,75rpm,30℃孵育2小时。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,所用引物xz-tdcde-up/xz-tdcde-down,正确的菌落扩增产物为3615bp的片段,包含tdcde上游同源臂845bp,cat-sacb片段2619bp和tdcde下游同源臂151bp。挑选一个正确的单菌落,命名为span001。
[0126]
第二步,以野生型枯草芽孢杆菌(bacillus subtilis)168基因组dna为模板,用引物tdcde-alssin-up/tdcde-alssin-down扩增出1826bp的dna片段ii,包括tdcde上游同源臂50bp,alss基因1716bp和saci的酶切位点及保护碱基共10bp,和tdcde下游同源臂50bp。dna片段ii用于第二次同源重组。扩增条件和体系同第一步中所述。将dna片段ii电转至菌株span001。
[0127]
电转条件为:首先准备带有pkd46质粒的span001的电转化感受态细胞;将50μl感受态细胞置于冰上,加入50ng dna片段ii,冰上放置2分钟,转移至0.2cm的bio-rad电击杯。使用micropulser(bio-rad公司)电穿孔仪,电击参数为电压2.5kv。电击后迅速将1ml lb培养基转移至电击杯中,吹打5次后转移至试管中,75rpm,30℃孵育4小时。将菌液转移至含有10%蔗糖的没有氯化钠的lb液体培养基(250ml烧瓶中装50ml培养基),培养24小时后在含有6%蔗糖的没有氯化钠的lb固体培养基上划线培养。经过pcr验证,所用引物为xz-tdcde-up/xz-tdcde-down,正确的菌落扩增产物为2722bp的片段,包括tdcde上游同源臂845bp,alss基因和saci酶切位点共1726bp和tdcde下游同源臂151bp。挑选一个正确的单菌落,将其命名为span002。
[0128]
span002是将乙酰乳酸合成酶基因(alss基因,核苷酸序列是序列表中序列1,编码序列2所示的alss蛋白质)整合到大肠杆菌atcc 8739的丙酸激酶编码基因tdcd和甲酸乙酰转移酶编码基因tdce位点得到的重组菌,该重组菌中丙酸激酶编码基因tdcd(编码的蛋白质序列为ncbi aca76259.1,coded_by=cp000946.1:626900..628108)和甲酸乙酰转移酶编码基因tdce(编码的蛋白质序列为ncbi aca76260.1,coded_by=cp000946.1:
628142..630436)同时被敲除。
[0129]
实施例2乙酰乳酸合成酶基因alss的调控
[0130]
从span002出发,使用人工调控元件调控整合在tdcde位点的乙酰乳酸合成酶编码基因alss的表达,具体步骤如下:
[0131]
第一步,以pxz-cs质粒dna为模板,使用引物tdcde-incs-up/alsspro-cs-down扩增出2719bp的dna片段i,包括tdcde上游同源臂50bp,cat-sacb片段2619bp和alss基因下游同源臂50bp,用于第一步同源重组。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span002。
[0132]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span002,然后将dna片段i电转至带有pkd46的大肠杆菌span002。
[0133]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-tdcde-up/tdcde-yz285-down进行验证,正确的pcr产物应该3749bp,包括tdcde上游同源臂845bp,cat-sacb片段2619bp和alss下游同源臂285bp,挑选一个正确的单菌落,命名为span003。
[0134]
第二步,以m1-93(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)的基因组dna为模板,用引物alss-pro-up/alss-pro-down扩增出188bp的dna片段ii,包括tdcde上游同源臂50bp,m1-93启动子88bp和alss下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span003。
[0135]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-tdcde-up/tdcde-yz285-down,正确的菌落扩增产物为1218bp的片段,包括tdcde上游同源臂8454bp,m1-93启动子序列88bp和alss下游同源臂285bp,挑选一个正确的单菌落,将其命名为span004。
[0136]
span004是将m1-93启动子(核苷酸序列是序列表中序列3)整合到大肠杆菌span002的alss基因上游得到的重组菌,该重组菌中m1-93启动子驱动alss基因的表达。
[0137]
实施例3乙酰乳酸合成酶基因ilvb的调控
[0138]
使用人工调控元件m1-93通过两步同源重组的方法调控乙酰乳酸合成酶i大亚基基因ilvb的表达,具体步骤如下:
[0139]
第一步,以pxz-cs质粒dna为模板,使用引物ilvb pro-catup/ilvb pro-catdown扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括ilvb上游同源臂50bp,cat-sacb片段2619bp和ilvb下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。
[0140]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span004,然后将dna片段i电转至带有pkd46的大肠杆菌span004。
[0141]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物ilvb pro-yzup/ilvb pro-yzdown进行验证,正确的pcr产物应该2996bp,包含ilvb上游同源臂123bp,cat-sacb片段2619bp和ilvb下游同源臂254bp。挑选一个正确的单菌落,命名为span005。
[0142]
第二步,以m1-93(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)
的基因组dna为模板,用引物ilvb pro-up/ilvb pro-down扩增出188bp的dna片段ii。dna片段ii包括ilvb上游同源臂50bp,m1-93启动子88bp和ilvb下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span005。
[0143]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为ilvb pro-yzup/ilvb pro-yzdown,正确的菌落扩增产物为465bp的片段,包括ilvb上游同源臂123bp,m1-93启动子88bp和ilvb下游同源臂254bp。挑选一个正确的单菌落,将其命名为span006。
[0144]
span006是将m1-93启动子(核苷酸序列是序列表中序列3)整合到大肠杆菌span004的乙酰乳酸合成酶基因ilvb(编码的蛋白质序列为ncbi aca75715.1,coded_by=cp000946.1:28583..30271)的上游得到的重组菌,该重组菌中,m1-93启动子可以驱动ilvb基因的表达。
[0145]
实施例4乙酰乳酸合成酶基因ilvg的调控
[0146]
使用人工调控元件m1-93通过两步同源重组的方法调控乙酰乳酸合成酶ii大亚基基因ilvg的表达,具体步骤如下:
[0147]
第一步,以pxz-cs质粒dna为模板,使用引物ilvg pro-catup/ilvg pro-catdown扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括ilvg上游同源臂50bp,cat-sacb片段2619bp和ilvg下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。
[0148]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span006,然后将dna片段i电转至带有pkd46的大肠杆菌span006。
[0149]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物ilvg pro-yzup/ilvg p-yzdown进行验证,正确的pcr产物应该2993bp,包括ilvg上游同源臂179bp,cat-sacb片段2619bp和ilvg下游同源臂195bp。挑选一个正确的单菌落,命名为span007。
[0150]
第二步,以m1-93(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)的基因组dna质粒dna为模板,用引物ilvg pro-up/ilvg pro-down扩增出188bp的dna片段ii。dna片段ii包括ilvg上游同源臂50bp,m1-93启动子88bp和ilvg下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span007。
[0151]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为ilvg pro-yzup/ilvg p-yzdown,正确的菌落扩增产物为462bp的片段,包括ilvg上游同源臂179bp,m1-93片段88bp和ilvg下游同源臂195bp。挑选一个正确的单菌落,将其命名为span008。
[0152]
span008是将m1-93启动子(核苷酸序列是序列表中序列3)整合到大肠杆菌span006的乙酰乳酸合成酶基因ilvg(编码的蛋白质序列为ncbi aca79830.1,coded_by=cp000946.1:4677780..4679426)的上游得到的重组菌,该重组菌中,m1-93启动子可以驱动ilvg基因的表达。
[0153]
实施例5乙酰乳酸合成酶基因ilvh的突变
[0154]
通过两步同源重组的方法在乙酰乳酸合成酶iii调控亚基基因ilvh基因中引入突变解除l-缬氨酸的反馈抑制,具体步骤如下:
[0155]
第一步,以pxz-cs质粒dna为模板,使用引物ilvh*-cat-up/ilvh*-cat-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括ilvh上游同源臂50bp,cat-sacb片段2619bp和ilvh下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。
[0156]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span008,然后将dna片段i电转至带有pkd46的大肠杆菌span008。
[0157]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物ilvh*-mutyz-up/ilvh*-mut-down进行验证,正确的pcr产物应该3165bp,包括ilvh上游同源臂202bp,cat-sacb片段2619bp和ilvh下游同源臂344bp。挑选一个正确的单菌落,命名为span009。
[0158]
第二步,以野生型大肠杆菌atcc 8739的dna为模板,用引物ilvh*-mut-up/ilvh*-mut-down扩增出467bp的dna片段ii。dna片段ii为含有突变的ilvh基因。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span009。
[0159]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为ilvh*-mutyz-up/ilvh*-mut-down,正确的菌落扩增产物为619bp的片段,包括ilvh基因上游163bp和ilvh基因456bp。挑选一个正确的单菌落,将其命名为span010。
[0160]
span010是将大肠杆菌span008的乙酰乳酸合成酶基因ilvh突变为ilvh*基因(即ilvh突变基因)得到的重组菌,该重组菌中,ilvh*基因的序列为序列表中序列4,编码序列5所示的ilvh*蛋白质。
[0161]
实施例6乙酰羟基酸还原异构酶编码基因ilvc在醇脱氢酶adhe位点的整合和adhe基因的敲除
[0162]
从span010出发,通过两步同源重组的方法将来自大肠杆菌的乙酰羟基酸还原异构酶编码基因ilvc整合到醇脱氢酶adhe位点,具体步骤包括:
[0163]
第一步,以pxz-cs质粒dna为模板,使用引物adhe-cs-up/adhe-cs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括adhe上游同源臂50bp,cat-sacb片段2619bp和adhe下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span010。
[0164]
将dna片段i用于第一次同源重组:首先将pkd46质粒(datsenko and wanner 2000,proc natl acad sci usa 97:6640-6645;质粒购买于美国耶鲁大学cgsc大肠杆菌保藏中心,cgsc#7739)通过电转化法转化至大肠杆菌span010,然后将dna片段i电转至带有pkd46的大肠杆菌span010。
[0165]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-adhe-up/xz-adhe-down进行验证,正确的pcr产物应该3167bp,包括adhe上游同源臂221bp,cat-sacb片段2619bp和adhe下游同源臂327bp。挑选一个正确的单菌落,命名为span011。
[0166]
第二步,以野生型大肠杆菌atcc 8739的基因组dna为模板,用引物adhe-ilvc-up/adhe-ilvc-down扩增出1576bp的dna片段ii。dna片段ii包括adhe上游同源臂50bp,ilvc基
因1476bp和adhe下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span011。
[0167]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-adhe-up/xz-adhe-down,正确的菌落扩增产物为2024bp的片段,包括adhe上游同源臂221bp,ilvc基因1476bp和adhe下游同源臂327bp。挑选一个正确的单菌落,将其命名为span012。
[0168]
span012是将乙酰羟基酸还原异构酶编码基因ilvc(编码的蛋白质序列为ncbi aca79824.1,coded_by=cp000946.1:4670539..4672014)整合到大肠杆菌span010的adhe位点得到的重组菌,该重组菌中醇脱氢酶基因adhe(编码的蛋白质序列为ncbi aca78022.1,coded_by=cp000946.1:2627307..2629982)同时被敲除。
[0169]
实施例7乙酰羟基酸还原异构酶编码基因ilvc的调控
[0170]
从span012出发,使用人工调控元件调控整合在醇脱氢酶基因adhe位点的乙酰羟基酸还原异构酶编码基因ilvc的表达,具体步骤如下:
[0171]
第一步,以pxz-cs质粒(tan,et al.,appl environ microbiol,2013,79:4838-4844)dna为模板,使用引物adhe-cs-up/ilvc-procs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括adhe上游同源臂50bp,cat-sacb片段2619bp和ilvc下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span012。
[0172]
将dna片段i用于第一次同源重组:首先将pkd46质粒(datsenko and wanner 2000,proc natl acad sci usa 97:6640-6645;质粒购买于美国耶鲁大学cgsc大肠杆菌保藏中心,cgsc#7739)通过电转化法转化至大肠杆菌span012,然后将dna片段i电转至带有pkd46的大肠杆菌span012。
[0173]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-adhe-up/ilvc-yz347-down进行验证,正确的pcr产物应该3187bp,包括adhe上游同源臂221bp,cat-sacb片段2619bp和ilvc下游同源臂347bp。挑选一个正确的单菌落,命名为span013。
[0174]
第二步,以m1-46(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)的基因组dna为模板,用引物ilvc-pro-up/ilvc-pro-down扩增出188bp的dna片段ii。dna片段ii包括adhe上游同源臂50bp,m1-46启动子序列88bp和ilvc下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span013。
[0175]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-adhe-up/ilvc-yz347-down,正确的菌落扩增产物为656bp的片段,包括adhe上游同源臂221bp,m1-46启动子88bp和ilvc下游同源臂347bp。挑选一个正确的单菌落,将其命名为span014。
[0176]
span014是将m1-46启动子(核苷酸序列是序列表中序列6)整合到大肠杆菌span012的ilvc基因上游得到的重组菌,该重组菌中m1-46启动子驱动ilvc基因的表达。
[0177]
实施例8二羟酸脱水酶编码基因ilvd在丙酮酸甲酸裂解酶编码基因pflb位点的整合和pflb基因的敲除
[0178]
从span014出发,通过两步同源重组的方法将来自大肠杆菌的二羟酸脱水酶编码
基因ilvd整合到丙酮酸甲酸裂解酶编码基因pflb位点并敲除pflb基因,具体步骤如下:
[0179]
第一步,以pxz-cs质粒dna为模板,使用引物pflb-cs-up/pflb-cs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括pflb上游同源臂50bp,cat-sacb片段2619bp和pflb下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span014。
[0180]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span014,然后将dna片段i电转至带有pkd46的大肠杆菌span014。
[0181]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-pflb-up600/xz-pflb-down进行验证,正确的pcr产物应该3675bp,包括pflb上游同源臂641bp,cat-sacb片段2619bp和pflb下游同源臂415bp。挑选一个正确的单菌落,命名为span015。
[0182]
第二步,以大肠杆菌mg1655(来自atcc,编号700926)的基因,用引物pflb-ilvd-up/pflb-ilvd-down扩增出1951bp的dna片段i。dna片段ii包括pflb上游同源臂50bp,ilvd基因1851bp和pflb下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span015。
[0183]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-pflb-up600/xz-pflb-down,正确的菌落扩增产物为2996bp的片段,包括pflb上游同源臂641bp,ilvd基因1851bp和pflb下游同源臂415bp。挑选一个正确的单菌落,将其命名为span016。
[0184]
span016是将二羟酸脱水酶编码基因ilvd(编码的蛋白质序列为ncbi qpa17447.1,coded_by=cp032679.1:3943375..3945225)整合到大肠杆菌span014的pflb位点得到的重组菌,该重组菌中丙酮酸甲酸裂解酶编码基因pflb(编码的蛋白质序列为ncbi aca78322.1,coded_by=cp000946.1:2956804..2959086)同时被敲除。
[0185]
实施例9二羟酸脱水酶编码基因ilvd的表达调控
[0186]
从span016出发,使用人工调控元件调控整合在丙酮酸甲酸裂解酶编码基因pflb位点的二羟酸脱水酶编码基因ilvd的表达,具体步骤如下:
[0187]
第一步,以pxz-cs质粒dna为模板,使用引物pflb-cs-up/pflb-pcs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括pflb上游同源臂50bp,cat-sacb片段2619bp和ilvd下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span016。
[0188]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span016,然后将dna片段i电转至带有pkd46的大肠杆菌span016。
[0189]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-pflb-up600/ilvd-yz496-down进行验证,正确的pcr产物应该3756bp,包括pflb上游同源臂641bp,cat-sacb片段2619bp和ilvd下游同源臂496bp。挑选一个正确的单菌落,命名为span017。
[0190]
第二步,以m1-93(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)
的基因组dna为模板,用引物pflb-pro-up/ilvd-pro-down扩增出189bp的dna片段ii。dna片段ii包括pflb上游同源臂50bp,人工调控元件rbsl1序列89bp和ilvd下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span017。
[0191]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-pflb-up600/ilvd-yz496-down,正确的菌落扩增产物为1226bp的片段,包括pflb上游同源臂641bp,rbsl1序列89bp和ilvd下游同源臂496bp。挑选一个正确的单菌落,将其命名为span018。
[0192]
span018是将rbsl1启动子(核苷酸序列是序列表中序列7)整合到大肠杆菌span016的ilvd基因上游得到的重组菌,该重组菌中rbsl1启动子驱动ilvd基因的表达。
[0193]
实施例10 3-甲基-2-氧代丁酸羟甲基转移酶基因panb在富马酸还原酶编码基因frd位点的整合和frd位点的敲除
[0194]
从span018出发,将3-甲基-2-氧代丁酸羟甲基转移酶编码基因panb整合到富马酸还原酶编码基因frd位点,具体步骤如下:
[0195]
第一步,以pxz-cs质粒dna为模板,使用引物frd-cs-up/frd-cs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括frd上游同源臂50bp,cat-sacb片段2619bp和frd下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span018。
[0196]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span018,然后将dna片段i电转至带有pkd46的大肠杆菌span018。
[0197]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-frd-up/xz-frd-down进行验证,正确的pcr产物应该3440bp,包括frd上游同源臂426bp,cat-sacb片段2619bp和frd下游同源臂395bp。挑选一个正确的单菌落,命名为span019。
[0198]
第二步,以大肠杆菌mg1655(来自atcc,编号700926)的基因组dna为模板,用引物frd-panb-up/frd-panb-down扩增出895bp的dna片段ii。dna片段ii包括frd上游同源臂50bp,panb基因795bp和frd下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span019。
[0199]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-frd-up/xz-frd-down,正确的菌落扩增产物为1661bp的片段,包括frd上游同源臂426bp,panb基因795bp和frd下游同源臂395bp。挑选一个正确的单菌落,将其命名为span020。
[0200]
span020是将3-甲基-2-氧代丁酸羟甲基转移酶基因panb(编码的蛋白质序列为ncbi qpa14045.1,coded_by=cp032679.1:148806..149600)整合到大肠杆菌span018的frd位点得到的重组菌,该重组菌中富马酸还原酶编码基因frd(编码的蛋白质序列为ncbi aca79462.1,coded_by=cp000946.1:4217304..4217699)同时被敲除。
[0201]
实施例11 3-甲基-2-氧代丁酸羟甲基转移酶基因panb的表达调控
[0202]
从span020出发,使用人工调控元件调控整合在富马酸还原酶编码基因frd位点的3-甲基-2-氧代丁酸羟甲基转移酶基因panb的表达,具体步骤如下:
[0203]
第一步,以pxz-cs质粒dna为模板,使用引物frd-cs-up/panb-pcs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括frd上游同源臂50bp,cat-sacb片段2619bp和panb下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span020。
[0204]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span020,然后将dna片段i电转至带有pkd46的大肠杆菌span020。
[0205]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-frd-up/panb-yz130-down进行验证,正确的pcr产物应该3175bp,包括frd上游同源臂426bp,cat-sacb片段2619bp和panb下游同源臂130bp。挑选一个正确的单菌落,命名为span021。
[0206]
第二步,以m1-93(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)的基因组dna为模板,用引物panb-pro-up/panb-pro-down扩增出188bp的dna片段ii。dna片段ii包括frd上游同源臂50bp,m1-93启动子序列88bp和panb下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span021。
[0207]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-frd-up/panb-yz130-down,正确的菌落扩增产物为644bp的片段,包括frd上游同源臂426bp,m1-93启动子序列88bp和panb下游同源臂130bp。挑选一个正确的单菌落,将其命名为span022。
[0208]
span022是将m1-93启动子(核苷酸序列是序列表中序列3)整合到大肠杆菌span020的panb基因上游得到的重组菌,该重组菌中m1-93启动子驱动panb基因的表达。
[0209]
实施例12 2-脱氢泛酸酯-2-还原酶基因pane在乳酸脱氢酶ldha位点的整合和ldha位点的敲除
[0210]
从span022出发,将2-脱氢泛酸酯-2-还原酶基因pane整合到乳酸脱氢酶基因ldha位点,具体步骤如下:
[0211]
第一步,以pxz-cs质粒dna为模板,使用引物ldha-csin-up/ldha-csin-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括ldha上游同源臂50bp,cat-sacb片段2619bp和ldha下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span022。
[0212]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span022,然后将dna片段i电转至带有pkd46的大肠杆菌span022。
[0213]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-ldha-up/xz-ldha-down进行验证,正确的pcr产物应该3415bp,包括ldha上游同源臂380bp,cat-sacb片段2619bp和ldha下游同源臂416bp。挑选一个正确的单菌落,命名为span023。
[0214]
第二步,以大肠杆菌mg1655(来自atcc,编号700926)的基因组dna为模板,用引物ldha-pane-up/ldha-pane-down扩增出1012bp的dna片段ii。dna片段ii包括ldha上游同源臂50bp,pane基因912bp和ldha下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片
段ii电转至菌株span023。
[0215]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-ldha-up/xz-ldha-down,正确的菌落扩增产物为1708bp的片段,包括ldha上游同源臂380bp,pane基因912bp和ldha下游同源臂416bp。挑选一个正确的单菌落,将其命名为span024。
[0216]
span024是将2-脱氢泛酸酯-2-还原酶基因pane(编码的蛋白质序列为ncbi qpa14304.1,coded_by=cp032679.1:443607..444518)整合到大肠杆菌span022的ldha位点得到的重组菌,该重组菌中乳酸脱氢酶基因ldha(编码的蛋白质序列为ncbi aca77911.1,coded_by=cp000946.1:2508048..2509037)同时被敲除。
[0217]
实施例13 2-脱氢泛酸酯-2-还原酶基因pane的表达调控
[0218]
从span024出发,使用人工调控元件调控整合在乳酸脱氢酶基因ldha位点的2-脱氢泛酸酯-2-还原酶基因pane的表达,具体步骤如下:
[0219]
第一步,以pxz-cs质粒dna为模板,使用引物ldha-csin-up/pane-procs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括ldha上游同源臂50bp,cat-sacb片段2619bp和pane下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span024。
[0220]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span024,然后将dna片段i电转至带有pkd46的大肠杆菌span024。
[0221]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-ldha-up/pane-yz245-down进行验证,正确的pcr产物应该3244bp,包括ldha上游同源臂380bp,cat-sacb片段2619bp和pane下游同源臂245bp。挑选一个正确的单菌落,命名为span025。
[0222]
第二步,以m1-93(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)的基因组dna为模板,用引物pane-pro-up/pane-pro-down扩增出189bp的dna片段ii。dna片段ii包括ldha上游同源臂50bp,人工启动子rbsl2序列89bp和pane下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span025。
[0223]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-ldha-up/pane-yz245-down,正确的菌落扩增产物为714bp的片段,包括ldha上游同源臂380bp,人工启动子rbsl2序列89bp和pane下游同源臂245bp。挑选一个正确的单菌落,将其命名为span026。
[0224]
span026是将rbsl2启动子(核苷酸序列是序列表中序列8)整合到大肠杆菌span024的pane基因上游得到的重组菌,该重组菌中rbsl2启动子驱动pane基因的表达。
[0225]
实施例14甘氨酸羟甲基转移酶基因glya在甲基乙二醛合酶基因mgsa位点的整合和mgsa位点的敲除
[0226]
从span026出发,将甘氨酸羟甲基转移酶基因glya在甲基乙二醛合酶基因mgsa位点,具体步骤如下:
[0227]
第一步,以pxz-cs质粒dna为模板,使用引物mgsa-cs-up/mgsa-cs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括mgsa上游同源臂50bp,cat-sacb片
段2619bp和mgsa下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span026。
[0228]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span026,然后将dna片段i电转至带有pkd46的大肠杆菌span026。
[0229]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-mgsa-up/xz-mgsa-down进行验证,正确的pcr产物应该3646bp,包括mgsa上游同源臂516bp,cat-sacb片段2619bp和mgsa下游同源臂511bp。挑选一个正确的单菌落,命名为span027。
[0230]
第二步,以野生型大肠杆菌atcc8739的基因组dna为模板,用引物mgsa-glya-up/mgsa-glya-down扩增出1354bp的dna片段ii。dna片段ii包括mgsa上游同源臂50bp,glya片段1254bp和mgsa下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span027。
[0231]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-mgsa-up/xz-mgsa-down,正确的菌落扩增产物为2281bp的片段,包括mgsa上游同源臂516bp,glya片段1254bp和mgsa下游同源臂511bp。挑选一个正确的单菌落,将其命名为span028。
[0232]
span028是将甘氨酸羟甲基转移酶基因glya(编码的蛋白质序列为ncbi aca76793.1,coded_by=cp000946.1:1227416..1228669)整合到大肠杆菌span026的mgsa位点得到的重组菌,该重组菌中mgsa基因(编码的蛋白质序列为ncbiaca78263.1,coded_by=cp000946.1:2883345..2883803)同时被敲除。
[0233]
实施例15甘氨酸羟甲基转移酶基因glya的调控
[0234]
从span028出发,使用人工调控元件调控整合在mgsa位点的甘氨酸羟甲基转移酶基因glya的表达,具体步骤如下:
[0235]
第一步,以pxz-cs质粒dna为模板,使用引物mgsa-cs-up/glya-procs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括mgsa上游同源臂50bp,cat-sacb片段2619bp和glya下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span028。
[0236]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span028,然后将dna片段i电转至带有pkd46的大肠杆菌span028。
[0237]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-mgsa-up/glya-yz364-down进行验证,正确的pcr产物应该3499bp,包括mgsa上游同源臂516bp,cat-sacb片段2619bp和glya下游同源臂364bp。挑选一个正确的单菌落,命名为span029。
[0238]
第二步,以m1-46(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)的基因组dna为模板,用引物glya-pro-up/glya-pro-down扩增出188bp的dna片段ii。dna片段ii包括mgsa上游同源臂50bp,m1-46启动子88bp和glya下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span029。
[0239]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-mgsa-up/glya-yz364-down,正确的菌落扩增产物为968bp的片段,包括mgsa上游同源臂516bp,m1-46启动子88bp和glya下游同源臂364bp。挑选一个正确的单菌落,将其命名为span030。
[0240]
span030是将m1-46启动子(核苷酸序列是序列表中序列6)整合到span028的glya基因上游得到的重组菌,该重组菌中m1-46启动子驱动glya基因的表达。
[0241]
实施例16大肠杆菌野生型氨甲基转移酶基因gcvt的调控
[0242]
从span030出发,使用人工调控元件调控大肠杆菌野生型氨甲基转移酶基因gcvt的表达,具体步骤如下:
[0243]
第一步,以pxz-cs质粒dna为模板,使用引物gcvt-pcat-up/gcvt-psacb-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括gcvt基因上游同源臂50bp,cat-sacb片段2619bp和gcvt下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span030。
[0244]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span030,然后将dna片段i电转至带有pkd46的大肠杆菌span030。
[0245]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物gcvt-up-500/gcvt-350-down进行验证,正确的pcr产物应该3197bp,包括gcvt基因上游同源臂228bp,cat-sacb片段2619bp和gcvt下游同源臂350bp。挑选一个正确的单菌落,命名为span031。
[0246]
第二步,以m1-93(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)的基因组dna为模板,用引物gcvt-m93-up/gcvt-m93-down扩增出188bp的dna片段ii。dna片段ii包括gcvt基因上游同源臂50bp,m1-93启动子88bp和gcvt下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span031。
[0247]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为gcvt-up-500/gcvt-350-down,正确的菌落扩增产物为666bp的片段,包括gcvt基因上游同源臂228bp,m1-93启动子88bp和gcvt下游同源臂350bp。挑选一个正确的单菌落,将其命名为span032。
[0248]
span032是将m1-93启动子(核苷酸序列是序列表中序列3)整合到大肠杆菌span030的氨甲基转移酶基因gcvt(编码的蛋白质序列为ncbi aca76476.1,coded_by=cp000946.1:862077..863171)的上游得到的重组菌,该重组菌中,m1-93启动子可以驱动gcvt基因的表达。
[0249]
实施例17大肠杆菌野生型甘氨酸脱羧酶基因gcvp的调控
[0250]
从span032出发,使用人工调控元件调控大肠杆菌野生型甘氨酸脱羧酶基因gcvp的表达,具体步骤如下:
[0251]
第一步,以pxz-cs质粒dna为模板,使用引物gcvp-pcat-up/gcvp-psacb-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括gcvp基因上游同源臂50bp,cat-sacb片段2619bp和gcvp下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span032。
[0252]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span032,然后将dna片段i电转至带有pkd46的大肠杆菌span032。
[0253]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物gcvh-up/gcvp-390-down进行验证,正确的pcr产物应该3399bp,包括gcvp基因上游同源臂390bp,cat-sacb片段2619bp和gcvp下游同源臂390bp。挑选一个正确的单菌落,命名为span033。
[0254]
第二步,以m1-93(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)的基因组dna为模板,用引物gcvp-m93-up/gcvp-m93-down扩增出188bp的dna片段ii。dna片段ii包括gcvp基因上游同源臂50bp,m1-93启动子88bp和gcvp下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span033。
[0255]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为gcvh-up/gcvp-390-down,正确的菌落扩增产物为868bp的片段,包括gcvp基因上游同源臂390bp,m1-93启动子88bp和gcvp下游同源臂390bp。挑选一个正确的单菌落,将其命名为span034。
[0256]
span034是将m1-93启动子(核苷酸序列是序列表中序列3)整合到大肠杆菌span032的甘氨酸脱羧酶基因gcvp(编码的蛋白质序列为ncbi aca76478.1,coded_by=cp000946.1:863703..866576)的上游得到的重组菌,该重组菌中,m1-93启动子可以驱动gcvp基因的表达。
[0257]
实施例18来自谷氨酸棒杆菌的3-甲基-2-氧代丁酸羟甲基转移酶基因panb在磷酸乙酰转移酶编码基因pta和乙酸激酶编码基因acka位点的整合及acka-pta位点的敲除
[0258]
从span034出发,将来自谷氨酸棒杆菌的3-甲基-2-氧代丁酸羟甲基转移酶基因panb在磷酸乙酰转移酶编码基因pta和乙酸激酶编码基因acka位点,具体步骤如下:
[0259]
第一步,以pxz-cs质粒dna为模板,使用引物acka-cs-up/pta-cs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括acka-pta基因上游同源臂50bp,cat-sacb片段2619bp和acka-pta下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span034。
[0260]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span034,然后将dna片段i电转至带有pkd46的大肠杆菌span034。
[0261]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-acka-up/xz-pta-down进行验证,正确的pcr产物应该3350bp,包括acka-pta基因上游同源臂320bp,cat-sacb片段2619bp和acka-pta下游同源臂411bp。挑选一个正确的单菌落,命名为span035。
[0262]
第二步,以谷氨酸棒杆菌atcc13032(atcc产品)的基因组dna为模板,用引物acka-panbc-up/acka-panbc-down扩增出916bp的dna片段ii。dna片段ii包括acka-pta基因上游同源臂50bp,来自谷棒的panb基因816bp和acka-pta下游同源臂50bp。用于第二次同源重组。将dna片段ii电转至菌株span035。
[0263]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。
菌落pcr对克隆进行验证,所用引物为xz-acka-up/xz-pta-down,正确的菌落扩增产物为1547bp的片段,包括acka-pta基因上游同源臂320bp,来自谷棒的panb基因816bp和acka-pta下游同源臂411bp。挑选一个正确的单菌落,将其命名为span036。
[0264]
span036是将谷氨酸棒杆菌的3-甲基-2-氧代丁酸羟甲基转移酶基因panb(panb基因,核苷酸序列是序列表中序列9,编码序列10所示的panb蛋白质)整合到大肠杆菌span034的磷酸乙酰转移酶编码基因pta和乙酸激酶编码基因acka位点得到的重组菌,该重组菌中pta基因(编码的蛋白质序列为ncbi aca77021.1,coded_by=cp000946.1:1484032..1486176)和acka基因(编码的蛋白质序列为ncbi aca77022.1,coded_by=cp000946.1:1486251..1487453)同时被敲除。
[0265]
实施例19谷氨酸棒杆菌来源的3-甲基-2-氧代丁酸羟甲基转移酶基因panb的调控
[0266]
从span036出发,使用人工调控元件调控整合在acka-pta位点的3-甲基-2-氧代丁酸羟甲基转移酶基因panb的表达,具体步骤如下:
[0267]
第一步,以pxz-cs质粒dna为模板,使用引物acka-cs-up/panbc-procs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括acka-pta基因上游同源臂50bp,cat-sacb片段2619bp和来自谷棒的panb基因下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span036。
[0268]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span036,然后将dna片段i电转至带有pkd46的大肠杆菌span036。
[0269]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物xz-acka-up/panbc-yz425-down进行验证,正确的pcr产物应该3364bp,包括acka-pta基因上游同源臂320bp,cat-sacb片段2619bp和panb下游同源臂425bp。挑选一个正确的单菌落,命名为span037。
[0270]
第二步,以m1-93(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)的基因组dna为模板,用引物panbc-pro-up/panbc-pro-down扩增出188bp的dna片段ii。dna片段ii包括acka-pta基因上游同源臂50bp,m1-93启动子88bp和panb下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span037。
[0271]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为xz-acka-up/panbc-yz425-down,正确的菌落扩增产物为833bp的片段,包括acka-pta基因上游同源臂320bp,m1-93启动子88bp和panb下游同源臂425bp。挑选一个正确的单菌落,将其命名为span038。
[0272]
span038是将m1-93启动子(核苷酸序列是序列表中序列3)整合到大肠杆菌span036的panb基因上游得到的重组菌,该重组菌中m1-93启动子驱动panb基因的表达。
[0273]
实施例20支链氨基酸氨基转移酶基因ilve的表达弱化
[0274]
从span038出发,将支链氨基酸氨基转移酶基因ilve的表达弱化,具体步骤如下:
[0275]
第一步,以pxz-cs质粒dna为模板,使用引物ilve-cat-up/ilve-sacb-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括ilve基因上游同源臂50bp,cat-sacb片段2619bp和ilve基因下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span038。
[0276]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span038,然后将dna片段i电转至带有pkd46的大肠杆菌span038。
[0277]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物ilvm-up/ilve-down进行验证,正确的pcr产物应该3832bp,包括ilve基因上游同源臂283bp,cat-sacb片段2619bp和ilve基因下游同源臂930bp。挑选一个正确的单菌落,命名为span039。
[0278]
第二步,以野生型大肠杆菌atcc 8739的基因组dna为模板,用引物ilvegtg-up/ilve-down扩增出980bp的dna片段ii。dna片段ii包括将起始密码子atg更改为gtg的ilve基因。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span039。
[0279]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为ilvm-up/ilve-down,正确的菌落扩增产物为1213bp的片段,包括ilve基因上游同源臂283bp和将起始密码子atg更换为gtg的ilve共930bp。挑选一个正确的单菌落,将其命名为span040。
[0280]
span040是将span038的ilve的起始密码子atg突变为gtg得到的重组菌,将突变后的基因记为ilve*基因(其序列为序列表中序列11),ilve*基因编码ilve*蛋白质(其序列为序列表中序列12)。
[0281]
实施例21来自谷氨酸棒杆菌的磷酸甘油酸脱氢酶基因sera在核糖激酶ara位点的整合及ara位点的敲除
[0282]
从span040出发,将来自谷氨酸棒杆菌的磷酸甘油酸脱氢酶基因sera整合在核糖激酶ara位点,具体步骤如下:
[0283]
第一步,以pxz-cs质粒dna为模板,使用引物arabcd-cs-up/arabcd-cs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括ara位点上游同源臂50bp,cat-sacb片段2619bp和ara位点下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span041。
[0284]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span041,然后将dna片段i电转至带有pkd46的大肠杆菌span041。
[0285]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物arabcd-yz300-up/arabcd-yz468-down进行验证,正确的pcr产物应该3378bp,包括ara位点上游同源臂291bp,cat-sacb片段2619bp和ara位点下游同源臂468bp。挑选一个正确的单菌落,命名为span041。
[0286]
第二步,以谷氨酸棒杆菌atcc13032(atcc产品)的基因组dna为模板,用引物arabcd-sera197-up/arabcd-sera197-down扩增出1102bp的dna片段ii。dna片段ii包括ara位点上游同源臂50bp,sera基因1002bp和ara位点下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span041。
[0287]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为arabcd-yz300-up/arabcd-yz468-down,正确的菌落扩增产物为1761bp的片段,包括包括ara位点上游同源臂291bp,sera基因1002bp和ara位点
下游同源臂468bp。挑选一个正确的单菌落,将其命名为span042。
[0288]
span042是将谷氨酸棒杆菌的磷酸甘油酸脱氢酶基因sera(sera基因,核苷酸序列是序列13,编码序列14所示的sera蛋白质)整合到大肠杆菌span040的ara位点得到的重组菌,该重组菌中ara基因(编码的蛋白质序列为ncbi aca79208.1,coded_by=cp000946.1:3929533..3931233,编码的蛋白质序列为ncbi aca79209.1,coded_by=cp000946.1:3931244..3932746)同时被敲除。
[0289]
实施例22来自谷氨酸棒杆菌的磷酸甘油酸脱氢酶基因sera的调控
[0290]
从span042出发,使用人工调控元件调控整合在ara位点的磷酸甘油酸脱氢酶基因sera的表达,具体步骤如下:
[0291]
第一步,以pxz-cs质粒dna为模板,使用引物arabcd-cs-up/sera197-procs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括ara位点上游同源臂50bp,cat-sacb片段2619bp和sera位点下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span042。
[0292]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span042,然后将dna片段i电转至带有pkd46的大肠杆菌span042。
[0293]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物arabcd-yz300-up/sera197-yz358-down进行验证,正确的pcr产物应该3268bp,包括ara位点上游同源臂291bp,cat-sacb片段2619bp和sera位点下游同源臂358bp。挑选一个正确的单菌落,命名为span043。
[0294]
第二步,以m1-93(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)的基因组dna为模板,用引物sera197-pro-up/sera197-pro-down扩增出188bp的dna片段ii。dna片段ii包括ara位点上游同源臂50bp,m1-93启动子88bp和sera基因下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span043。
[0295]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为arabcd-yz300-up/sera197-yz358-down,正确的菌落扩增产物为737bp的片段,包括ara位点上游同源臂291bp,m1-93启动子88bp和sera位点下游同源臂358bp。挑选一个正确的单菌落,将其命名为span044。
[0296]
span044是m1-93启动子(核苷酸序列是序列表中序列3)整合到大肠杆菌span042的sera基因上游得到的重组菌,该重组菌中m1-93启动子驱动sera基因的表达。
[0297]
实施例23来自大肠杆菌的磷酸丝氨酸/磷酸羟基苏氨酸氨基转移酶基因serc和磷酸丝氨酸磷酸酶基因serb在缬氨酸-丙酮酸转氨酶基因avta位点的整合及avta位点的敲除
[0298]
从span044出发,将来自大肠杆菌的磷酸丝氨酸/磷酸羟基苏氨酸氨基转移酶基因serc和磷酸丝氨酸磷酸酶基因serb整合到缬氨酸-丙酮酸转氨酶基因avta位点,具体步骤如下:
[0299]
第一步,以pxz-cs质粒dna为模板,使用引物avta-cs-up/avta-cs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括avta位点上游同源臂50bp,cat-sacb片段2619bp和avta位点下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span044。
[0300]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span044,然后将dna片段i电转至带有pkd46的大肠杆菌span044。
[0301]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物avta-yz-up/avta-yz-down进行验证,正确的pcr产物应该3454bp,包括avta位点上游同源臂416bp,cat-sacb片段2619bp和avta位点下游同源臂419bp。挑选一个正确的单菌落,命名为span045。
[0302]
第二步,以大肠杆菌mg1655(来自atcc,编号700926)的基因组dna为模板,用引物avta-sercb-up/serc-down扩增出1181的片段ii。以大肠杆菌mg1655(来自atcc,编号700926)的基因组dna为模板,使用引物serb-up/avta-sercb-down扩增出1062bp的片段iii。以引物avta-sercb-up/avta-sercb-down进行pcr扩增,模板为等摩尔的片段ii和片段iii,扩增体系和条件同实施例1中所述进行融合pcr获得片段iv。片段iv为2179bp的dna片段,将其用于第二次同源重组。片段iv包括avta上游同源臂50bp,serc基因1089bp,用于serb基因翻译起始的rbs序列21bp和serb基因969bp,以及avta下游同源臂50bp。将dna片段iv电转至菌株span045。
[0303]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为avta-yz-up/avta-yz-down,正确的菌落扩增产物为2914bp的片段,包括avta位点上游同源臂416bp,serc基因1089bp,用于serb基因翻译起始的rbs序列21bp和serb基因969bp,以及avta位点下游同源臂419bp。挑选一个正确的单菌落,将其命名为span046。
[0304]
span046是将大肠杆菌的磷酸丝氨酸/磷酸羟基苏氨酸氨基转移酶基因serc和磷酸丝氨酸磷酸酶基因serb(sercb基因簇,核苷酸序列是序列表中序列15,sercb基因簇编码序列16所示的serc蛋白质和序列17所示的serb蛋白质)整合到大肠杆菌span044的avta位点得到的重组菌,该重组菌中avta基因(编码的蛋白质序列为ncbi aca75824.1,coded_by=cp000946.1:153868..155121)同时被敲除。
[0305]
序列15中,第1-88位为m1-93启动子序列,第89-1177位为serc基因序列,第1178-1198位为用于serb基因翻译起始的rbs序列,第1199-2167位为serb基因的序列。
[0306]
实施例24整合在avta位点的sercb基因簇的表达调控
[0307]
从span046出发,使用人工调控元件调控整合在avta位点的来自大肠杆菌的磷酸丝氨酸/磷酸羟基苏氨酸氨基转移酶基因serc和磷酸丝氨酸磷酸酶基因serb基因簇的表达,具体步骤如下:
[0308]
第一步,以pxz-cs质粒dna为模板,使用引物avta-cs-up/sercb-procs-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括avta位点上游同源臂50bp,cat-sacb片段2619bp和serc基因下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span046。
[0309]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span046,然后将dna片段i电转至带有pkd46的大肠杆菌span046。
[0310]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平
板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物avta-yz-up/sercb-yz317-down进行验证,正确的pcr产物应该3456bp,包括avta位点上游同源臂416bp,cat-sacb片段2619bp和serc基因下游同源臂421bp。挑选一个正确的单菌落,命名为span047。
[0311]
第二步,以m1-93(lu,et al.,appl microbiol biotechnol,2012,93:2455-2462)的基因组dna为模板,用引物sercb-pro-up/sercb-pro-down扩增出188bp的dna片段ii。dna片段ii包括avta位点上游同源臂50bp,m1-93启动子序列88bp和serc基因下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span047。
[0312]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为avta-yz-up/sercb-yz317-down,正确的菌落扩增产物为925bp的片段,包括avta位点上游同源臂416bp,m1-93启动子序列88bp和serc基因下游同源臂421bp。挑选一个正确的单菌落,将其命名为span048。
[0313]
span048是将m1-93启动子整合到大肠杆菌span046的sercb基因簇上游得到的重组菌,含有序列15所示的sercb基因簇表达盒,该重组菌中m1-93启动子(核苷酸序列是序列表中序列15的第1-88位)驱动sercb基因簇中serc和serb基因的表达。
[0314]
实施例25 l-丝氨酸脱氨酶i基因sdaa的敲除
[0315]
从span048出发,敲除l-丝氨酸脱氨酶i的编码基因sdaa,具体步骤如下:
[0316]
第一步,以pxz-cs质粒dna为模板,使用引物sdaa-delcat-up/sdaa-delsacb-down扩增出2719bp的dna片段i,用于第一步同源重组。dna片段i包括sdaa位点上游同源臂50bp,cat-sacb片段2619bp和sdaa基因下游同源臂50bp。扩增体系和扩增条件与实施例1中所述一致。将dna片段i电转至span048。
[0317]
将dna片段i用于第一次同源重组:首先将pkd46质粒通过电转化法转化至大肠杆菌span048,然后将dna片段i电转至带有pkd46的大肠杆菌span048。
[0318]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第一步方法一致。取200μl菌液涂在含有氨苄霉素(终浓度为100μg/ml)和氯霉素(终浓度为34μg/ml)的lb平板上,30℃过夜培养后,挑选单菌落进行pcr验证,使用引物sdaa-yz-up/sdaa-yz-down进行验证,正确的pcr产物应该3428bp,包括sdaa位点上游同源臂383bp,cat-sacb片段2619bp和sdaa基因下游同源臂426bp。挑选一个正确的单菌落,命名为span049。
[0319]
第二步,以大肠杆菌atcc 8739的基因组dna为模板,用引物sdaa-yz-up/sdaadel-down扩增出433bp的dna片段ii。dna片段ii包括sdaa上游同源臂383bp和下游同源臂50bp。dna片段ii用于第二次同源重组。将dna片段ii电转至菌株span049。
[0320]
电转条件和步骤同实施例1中所述用于alss在tdcde位点整合的第二步方法一致。菌落pcr对克隆进行验证,所用引物为sdaa-yz-up/sdaa-yz-down,正确的菌落扩增产物为809bp的片段,包括sdaa位点上游同源臂383bp和sdaa基因下游同源臂426bp。挑选一个正确的单菌落,将其命名为span050。
[0321]
span050是将大肠杆菌span048的l-丝氨酸脱氨酶i基因sdaa(编码的蛋白质序列为ncbi aca77468.1,coded_by=cp000946.1:2018393..2019757)敲除得到的重组菌,该重组菌中不含有sdaa基因。
[0322]
span050已于2021年01月22日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.21699。
[0323]
实施例26使用span050生产泛解酸
[0324]
种子培养基由以下成分组成(溶剂为水):
[0325]
大量元素:葡萄糖20g/l、(nh4)2hpo
4 3.5g/l、kh2po
4 3.91g/l、k2hpo
4 4.48g/l、mgso4·
7h2o0.18g/l、甜菜碱-hcl 0.15g/l;
[0326]
微量元素:fecl3·
6h2o 1.5μg/l、cocl2·
6h2o 0.1μg/l、cucl2·
2h2o 0.1μg/l、zncl20.1μg/l、na2moo4·
2h2o 0.1μg/l、mncl2·
4h2o 0.2μg/l,h3bo
3 0.05μg/l。
[0327]
发酵培养基大部分和种子培养基相同,区别是葡萄糖浓度为50g/l,发酵培养基还含有5g/l丝氨酸。
[0328]
span050的发酵包括以下步骤:
[0329]
(1)种子培养:将lb平板上新鲜的克隆接种到含有4ml种子培养基的试管中,37℃,250rpm振荡培养过夜。然后,按照2%(v/v)的接种量将培养物转接到含有30ml种子培养基的250ml三角瓶中,在37℃,250rpm振荡培养12小时得到种子培养液用于发酵培养基接种。
[0330]
(2)发酵培养:250ml三角瓶中发酵培养基体积为25ml,将种子培养液按照终浓度od550=0.1的接种量接种于发酵培养基,37℃,250rpm,发酵60小时,得到发酵液。
[0331]
分析方法:使用安捷伦(agilent-1260)高效液相色谱仪对发酵3天的发酵液中的组分进行测定。发酵液中的葡萄糖和泛解酸浓度测定采用伯乐(biorad)公司的aminex hpx
–
87h有机酸分析柱。
[0332]
结果发现:span050菌株发酵3天,能够生产1.2g/l的泛解酸,由此可知,span050菌株中泛解酸合成途径已打通并可以发酵过程中实现泛解酸的积累。
[0333]
实施例27 span050在5l罐中的发酵
[0334]
种子培养基的组成和配制、分析方法同实施例26中所述相同。
[0335]
发酵培养基:葡萄糖30g/l、硫酸镁5g/l、磷酸二氢钾10.5g/l、酵母粉20g/l、磷酸氢二铵6g/l、一水柠檬酸1.84g/l,微量元素同实施例26发酵培养基,溶剂为水。
[0336]
补料培养基:600g/l葡萄糖,溶剂为水。
[0337]
发酵在5l发酵罐(上海保兴,biotech-5bg)中进行,包括以下步骤:
[0338]
(1)种子培养:500m l三角瓶中种子培养基为50m l,115℃灭菌15min。冷却后将重组大肠杆菌span050按照1%(v/v)的接种量接种于种子培养基,在37℃和250rpm的条件下培养12小时得到种子液,用于发酵培养基接种。
[0339]
(2)发酵培养:5l发酵罐中发酵培养基体积为3l,115℃灭菌25min。将种子液按照终浓度od550=0.2的接种量接种于发酵培养基,溶氧维持30%,用氨水作中和剂ph维持7.0,通过补料培养基将罐内葡萄糖浓度控制在5g/l以下,37℃培养3天,得到发酵液。发酵液为发酵罐内所有物质。
[0340]
结果发现:span050发酵3天后,泛解酸产量达到22g/l,具有很好的工业应用潜力。
[0341]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1