一种植入级Ⅱ型胶原蛋白的制备方法与流程
一种植入级ⅱ型胶原蛋白的制备方法
技术领域
1.本发明属于ⅱ型胶原蛋白制备领域,具体涉及一种植入级ⅱ型胶原蛋白的制备方法。
背景技术:
[0002]ⅱ型胶原蛋白是广泛存在于动物骨骼、关节、肌腱等结缔组织中的一种蛋白质,它主要由软骨细胞产生,在软骨中的含量最高,是关节软骨的主要结构蛋白,约占软骨组织干重的60%。ⅱ型胶原蛋白具有良好的生物相容性、生物可降解性、促进细胞生长等性质,因此是一种广泛应用的生物医用材料。作为软骨的关键成分,ⅱ型胶原蛋白的过度降解被认为是关节炎的关键诱因。大量研究表明,ⅱ型胶原蛋白为主要成分的人工软骨支架,可用于治疗类风湿性关节炎。动物实验表明,口服ⅱ型胶原蛋白对预防和治疗关节炎表现出明显的有益效果。因此,制备非变性、植入级的ⅱ型胶原蛋白对于其临床应用具有重要意义。
[0003]ⅱ型胶原蛋白通常是从鸡、猪、牛等动物的软骨中提取制备的。软骨中,除了ⅱ型胶原蛋白外,还含有大量的蛋白多糖,其含量高达软骨组织湿重的10%
‑
15%,因此,如何去除蛋白多糖是ⅱ型胶原蛋白提取过程中的关键步骤。ⅱ型胶原蛋白具有特征性的三重螺旋结构,在提取过程中保持ⅱ型胶原蛋白的完整结构至关重要,因为该结构的破坏将会严重影响其生物功能。同时,作为医用尤其是植入材料级的ⅱ型胶原蛋白除了需要达到非变性和高纯度的品质要求,还需要满足生物安全性的要求,尤其是内毒素的含量需要严格控制在限度以内。
[0004]
目前已经有多种方法尝试提取制备ⅱ型胶原蛋白。中国专利cn101810855a公开了一种从软骨提取ⅱ型胶原蛋白的方法,包括脱脂、去血清、表面活性剂、氧化剂处理、盐酸胍处理、酶解等多个步骤。中国专利cn103088096a公开了一种以蕲蛇为原料提取ⅱ型胶原蛋白的方法,中国专利cn103352063a公开了一种提取和浓缩ⅱ型胶原的方法,中国专利cn105132502a公开了一种从鸡软骨中提取纯净ⅱ型胶原的方法,中国专利cn105331662a也公开了一种从动物软骨中提取ⅱ型胶原蛋白的方法。上述专利均采用了4m的盐酸胍处理动物软骨,实现蛋白多糖的去除。然而,盐酸胍是一种常用的蛋白质变性剂,由于它具有离子特性,因此比尿素的变性能力更强。盐酸胍可以通过增大疏水性残基在水相中的溶解度,降低疏水相互作用;同时,高浓度(3
‑
4m)的盐酸胍能断裂氢键,使蛋白质发生不同程度的变性。现有技术中采用的4m的盐酸胍处理策略,虽然可以达到较好的多糖去除效果,但是会导致胶原蛋白发生严重的变性。
[0005]
针对上述技术问题,本发明提供了一种植入级ⅱ型胶原蛋白的制备方法,所述方法采用碱处理替换盐酸胍的步骤来去除蛋白多糖,完全避免了盐酸胍导致胶原蛋白变性的问题;制备得到的ⅱ型胶原蛋白保持良好的三重螺旋结构,为非变性的ⅱ型胶原蛋白;制备的ⅱ型胶原蛋白纯度达95%以上,内毒素含量低于0.5eu/ml,多糖含量低于0.01mg/ml,达到医用植入级标准,可用于制备软骨损伤修复药品、医疗器械、或保健食品等。
技术实现要素:
[0006]
针对上述技术问题,本发明的目的在于提供一种高纯度、低内毒素、低多糖且未变性的植入级ⅱ型胶原蛋白的制备方法,具体包括以下内容:
[0007]
第一方面,本发明提供了一种从含有ⅱ型胶原蛋白的动物组织中去除蛋白多糖的方法,所述方法为:采用碱溶液对动物组织进行处理。
[0008]
优选地,所述动物组织为动物软骨。
[0009]
优选地,所述碱溶液为氢氧化钠溶液,和/或氢氧化钾溶液。
[0010]
优选地,所述方法为:用0.01
‑
2.0m的氢氧化钠溶液浸泡处理动物软骨0.5
‑
72h。
[0011]
第二方面,本发明提供了一种非变性ⅱ型胶原蛋白的制备方法,所述方法包括下列步骤:动物软骨预处理、脱细胞、脱脂、碱处理、脱钙、酶解提取、盐析、纯化;但不包括盐酸胍处理步骤;
[0012]
所述纯化步骤包括离子交换色谱层析、亲和层析、疏水相互作用层析、凝胶过滤层析、分子筛层析中的任一种或几种的组合。
[0013]
优选地,所述脱细胞步骤包括:用酸溶液,和/或盐溶液,和/或缓冲溶液,和/或表面活性剂,和/或过氧化物溶液处理动物软骨。
[0014]
优选地,所述脱脂步骤包括:用正丁醇,和/或氯仿
‑
甲醇溶液,和/或氯仿
‑
甲醇
‑
水溶液,和/或乙醚,和/或正己烷,和/或丙酮,和/或乙醇
‑
正己烷溶液,和/或乙醇溶液,和/或表面活性剂处理动物软骨。
[0015]
优选地,所述碱处理步骤为:用氢氧化钠溶液,和/或氢氧化钾溶液处理动物软骨。
[0016]
优选地,所述方法包括以下步骤:
[0017]
(1)动物软骨预处理:剔除动物软骨表面肌腱残留物,破碎后清洗;
[0018]
(2)脱细胞:依次用nacl溶液、表面活性剂和过氧化物溶液对预处理后的动物软骨进行浸泡处理;
[0019]
(3)脱脂:用浓度为5%
‑
30%v/v的正丁醇溶液浸泡处理脱细胞后的动物软骨2
‑
5次,每次6
‑
18h;
[0020]
(4)碱处理:用0.01
‑
2.0m的氢氧化钠溶液浸泡处理脱脂后的动物软骨0.5
‑
72h;
[0021]
(5)脱钙:将碱处理后的动物软骨用盐酸溶液处理;
[0022]
(6)酶解:采用酶解法提取脱钙处理后的动物软骨中ⅱ型胶原蛋白,获得ⅱ型胶原蛋白提取液;
[0023]
(7)盐析:对ⅱ型胶原蛋白提取液进行盐析,获得ⅱ型胶原蛋白沉淀;
[0024]
(8)纯化:将ⅱ型胶原蛋白沉淀用酸溶液复溶后透析,获得非变性ⅱ型胶原蛋白。
[0025]
优选地,所述步骤(2)为:用浓度为5
‑
30%m/v的nacl溶液浸泡过夜;用超纯水冲洗后用浓度为0.1
‑
2%v/v的表面活性剂浸泡处理0.5
‑
6h;再次用超纯水冲洗后用浓度为3
‑
10%v/v的过氧化物溶液浸泡处理30
‑
60min。
[0026]
优选地,所述表面活性剂包括sds/tritonx
‑
100、na2edta、双氯苯双胍己烷、苯扎氯铵/十二烷基二甲基苄基氯化铵、苯扎溴铵中的任一种;所述过氧化物包括过氧化氢、过氧乙酸中的任一种。
[0027]
第三方面,本发明提供了一种植入级ⅱ型胶原蛋白的制备方法,所述方法为:将上述第二方面所述方法制备获得的非变性ⅱ型胶原蛋白在温度不高于25℃下进行辐射灭菌
处理,即得植入级ⅱ型胶原蛋白。
[0028]
第四方面,本发明提供了一种根据上述第三方面所述方法制备获得的植入级ⅱ型胶原蛋白。
[0029]
第五方面,本发明提供了一种植入级ⅱ型胶原蛋白,所述植入级ⅱ型胶原蛋白中包括95%以上的非变性ⅱ型胶原蛋白,所述植入级ⅱ型胶原蛋白内毒素低于0.5eu/ml,多糖含量低于0.01mg/ml。
[0030]
第六方面,本发明提供了一种上述第四或第五方面所述植入级ⅱ型胶原蛋白在制备创面损伤修复药品,或医学美容产品,或化妆品中的应用。
[0031]
本发明的有益效果是:
[0032]
(1)本发明所述方法采用碱处理的步骤代替了盐酸胍去除蛋白多糖的步骤,解决了高浓度盐酸胍导致的胶原蛋白变性问题,制备得到的为未变性的ⅱ型胶原蛋白,具有良好的三重螺旋结构和生物活性;
[0033]
(2)本发明制备的非变性ⅱ型胶原蛋白不仅达到高纯度的品质要求(ⅱ型胶原蛋白纯度达95%以上,多糖含量低于0.01mg/ml),而且满足生物安全性的要求(内毒素含量低于0.5eu/ml),可作为植入级ⅱ型胶原蛋白用于制备软骨损伤修复药品、医疗器械、保健食品等;
[0034]
(3)本发明提供的提取方法条件温和,绿色安全,操作简便,成本低,适于规模化制备。
附图说明
[0035]
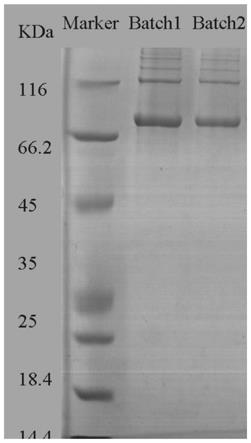
图1本发明制备的ⅱ型胶原蛋白的sds
‑
page结果,其中,所述batch1为实施例1制备的ⅱ型胶原蛋白,batch2为实施例2制备的ⅱ型胶原蛋白;
[0036]
图2本发明制备的ⅱ型胶原蛋白的圆二色谱图;
[0037]
图3本发明制备的ⅱ型胶原蛋白的热变曲线;
[0038]
图4本发明制备的ⅱ型胶原蛋白的sem图,其中a为500μm观察结果,b为300μm观察结果;
[0039]
图5本发明制备的ⅱ型胶原蛋白的tem图,其中a为1μm观察结果,b为500nm观察结果;
[0040]
图6盐酸胍对胶原蛋白溶液的影响,其中typeⅱcollagen为实施例2制备的ⅱ型胶原蛋白,100℃为对比例3中100℃加热处理的ⅱ型胶原蛋白,gu
‑
hcl为对比例3中用盐酸胍处理的ⅱ型胶原蛋白;
[0041]
图7盐酸胍处理动物软骨组织对本发明制备的ⅱ型胶原蛋白的影响,其中0m为实施例2制备的ⅱ型胶原蛋白;0.1m和4m为对比例2制备的ⅱ型胶原蛋白。
具体实施方式
[0042]
下面通过具体实施例对本发明进行详细的阐述,任何本领域的技术人员在本发明的基础上,结合本领域公知常识所能想到的技术方案,都属于本发明的保护范围。
[0043]
实施例1
[0044]
预处理:取牦牛关节软骨,剔除牦牛关节软骨表面肌腱残留物,破碎后清洗;
[0045]
脱细胞:将预处理后所得动物软骨浸泡在5%m/v的nacl溶液中震荡过夜;用超纯水将nacl清除完全后,再将动物软骨于0.1%v/v洗必泰(双氯苯双胍己烷)中浸泡震荡处理6h;用超纯水将洗必泰清除完全后,再将动物软骨浸泡于3%v/v过氧乙酸中震荡处理60min,用超纯水将过氧乙酸清除完全,取动物软骨沉淀;
[0046]
脱脂:将脱细胞处理后的动物软骨沉淀浸泡于5%v/v的正丁醇溶液中,震荡处理5次,每次6h,最后一次脱脂结束后用超纯水将正丁醇清除完全,取动物软骨沉淀;
[0047]
碱处理:将脱脂处理后的动物软骨沉淀浸泡于0.01m的氢氧化钠溶液,震荡处理72h后用超纯水将氢氧化钠清除完全,取动物软骨沉淀;
[0048]
脱钙:将碱处理后的动物软骨沉淀浸泡于0.2m盐酸溶液中震荡处理5次,每次2h,最后一次脱钙结束后用超纯水将盐酸清除完全,取动物软骨沉淀;
[0049]
酶解:将脱钙后的动物软骨沉淀置于0.5m含胃蛋白酶的醋酸溶液中震荡48h后获得ⅱ型胶原蛋白提取液;
[0050]
盐析:对所获得的ⅱ型胶原蛋白提取液进行盐析;
[0051]
所有实验操作温度均不高于25℃。
[0052]
实施例2
[0053]
预处理:取牦牛关节软骨,剔除牦牛关节软骨表面肌腱残留物,破碎后清洗;
[0054]
脱细胞:将预处理后所得动物软骨浸泡在30%m/v的nacl溶液中震荡过夜;用超纯水将nacl清除完全后,再将动物软骨于2%v/v洗必泰(双氯苯双胍己烷)中浸泡震荡处理0.5h;用超纯水将洗必泰清除完全后,再将动物软骨浸泡于10%v/v过氧化氢中震荡处理30min,用超纯水将过氧化氢清除完全,取动物软骨沉淀;
[0055]
脱脂:将脱细胞后的动物软骨沉淀浸泡于30%v/v的正丁醇溶液中,震荡处理2次,每次8h,最后一次脱脂结束后用超纯水将正丁醇清除完全,取动物软骨沉淀;
[0056]
碱处理:将脱脂处理后的动物软骨沉淀浸泡于2m的氢氧化钠溶液,震荡处理0.5h后用超纯水将氢氧化钠清除完全,取动物软骨沉淀;
[0057]
脱钙:将碱处理后的动物软骨沉淀浸泡于0.3m盐酸溶液中,震荡处理4次,每次2h,最后一次脱钙结束后用超纯水将盐酸清除完全,取动物软骨沉淀;
[0058]
酶解:将脱钙后的动物软骨沉淀置于0.3m含胃蛋白酶的醋酸溶液中,震荡48h后获得ⅱ型胶原蛋白提取液;
[0059]
盐析:对所获得的ⅱ型胶原蛋白提取液进行盐析;
[0060]
纯化:将盐析得到的ⅱ型胶原蛋白沉淀用酸溶液复溶后进行透析纯化,得到ⅱ型胶原蛋白原液。
[0061]
所有实验操作温度均不高于25℃。
[0062]
对比例1
[0063]
预处理:取牦牛关节软骨,剔除牦牛关节软骨表面肌腱残留物,破碎后清洗;
[0064]
脱细胞:将预处理后所得动物软骨浸泡在30%m/v的nacl溶液中震荡过夜;用超纯水将nacl清除完全后,再将动物软骨于2%v/v洗必泰(双氯苯双胍己烷)中浸泡震荡处理0.5h;用超纯水将洗必泰清除完全后,再将动物软骨浸泡于10%v/v过氧化氢中震荡处理30min,用超纯水将过氧化氢清除完全,取动物软骨沉淀;
[0065]
脱脂:将脱细胞后的动物软骨沉淀浸泡于30%v/v的正丁醇溶液中,震荡处理2次,
每次8h,最后一次脱脂结束后用超纯水将正丁醇清除完全,取动物软骨沉淀;
[0066]
脱钙:将脱脂后的动物软骨沉淀浸泡于0.3m盐酸溶液中,震荡处理4次,每次2h,最后一次脱钙结束后用超纯水将盐酸清除完全,取动物软骨沉淀;
[0067]
酶解:将脱钙后的动物软骨沉淀置于0.3m含胃蛋白酶的醋酸溶液中,震荡48h后获得ⅱ型胶原蛋白提取液;
[0068]
盐析:对所获得的ⅱ型胶原蛋白提取液进行盐析;
[0069]
纯化:将盐析得到的ⅱ型胶原蛋白沉淀用酸溶液复溶后进行透析纯化,得到ⅱ型胶原蛋白原液。
[0070]
所有实验操作温度均不高于25℃。
[0071]
对比例2
[0072]
预处理:取牦牛关节软骨,剔除牦牛关节软骨表面肌腱残留物,破碎后清洗;
[0073]
脱细胞:将预处理后所得动物软骨浸泡在30%m/v的nacl溶液中震荡过夜;用超纯水将nacl清除完全后,再将动物软骨于2%v/v洗必泰(双氯苯双胍己烷)中浸泡震荡处理0.5h;用超纯水将洗必泰清除完全后,再将动物软骨浸泡于10%v/v过氧化氢中震荡处理30min,用超纯水将过氧化氢清除完全,取动物软骨沉淀;
[0074]
脱脂:将脱细胞后的动物软骨沉淀浸泡于30%v/v的正丁醇溶液中,震荡处理2次,每次8h,最后一次脱脂结束后用超纯水将正丁醇清除完全,取动物软骨沉淀;
[0075]
脱钙:将脱脂处理后的动物软骨沉淀浸泡于0.3m盐酸溶液中,震荡处理4次,每次2h,最后一次脱钙结束后用超纯水将盐酸清除完全,取动物软骨沉淀;
[0076]
盐酸胍处理:将脱钙处理后的动物软骨沉淀分别浸泡于0.1m和4m的盐酸胍溶液,震荡处理24h后用超纯水将盐酸胍清除完全,取动物软骨沉淀;
[0077]
酶解:将盐酸胍处理后的动物软骨沉淀置于0.3m含胃蛋白酶的醋酸溶液中,震荡48h后获得ⅱ型胶原蛋白提取液;
[0078]
盐析:对所获得的ⅱ型胶原蛋白提取液进行盐析;
[0079]
纯化:将盐析得到的ⅱ型胶原蛋白沉淀用酸溶液复溶后进行透析纯化,得到ⅱ型胶原蛋白原液。
[0080]
所有实验操作温度均不高于25℃。
[0081]
对比例3
[0082]
将实施例2制备的胶原蛋白溶液分别通过加热处理或0.1m和4m的盐酸胍溶液处理,以未进行加热、盐酸胍处理的实施例2制备的胶原蛋白溶液为对照。其中加热处理ⅱ型胶原蛋白溶液的具体方式为:将特定浓度的胶原蛋白溶液置于100℃水浴环境下10
‑
30min;4m的盐酸胍溶液处理ⅱ型胶原蛋白溶液的具体方式为:配置盐酸胍和胶原蛋白的混合溶液,使其中盐酸胍终浓度为4m,胶原蛋白终浓度与加热处理的胶原蛋白溶液相一致,4℃条件下放置24h。
[0083]ⅱ型胶原蛋白质量评价
[0084]
1.电泳实验
[0085]
取实施例1和2制备的ⅱ型胶原蛋白进行sds
‑
page聚丙烯酰胺凝胶电泳实验。结果如图1所示,每个实施例制备的ⅱ型胶原蛋白在分子量为100kda附近仅有一条α带,为α1带,属于典型的ⅱ型胶原蛋白特征;在低分子量处没有其它的条带,表明ⅱ型胶原蛋白只有完
整的α1肽链,完全没有发生降解。
[0086]
2.圆二色谱
[0087]
圆二色谱是用于表征蛋白质二级结构的常用方法。胶原蛋白的圆二色谱通过配备有温度控制器的圆二色谱仪测定。制备浓度为1mg/ml的ⅱ型胶原蛋白储备液,在测定之前,样品在4℃平衡24小时以上。
[0088]
以本发明实施例2为例,制备的ⅱ型胶原蛋白的圆二色谱结果如图2所示,ⅱ型胶原蛋白在223nm处具有正峰,表明其具有胶原蛋白特征性的三重螺旋结构。
[0089]
3.热变曲线
[0090]
圆二色谱是研究胶原蛋白热稳定性的常用方法,通过监测波长223nm处的特征cd峰值随温度的变化趋势来测定ⅱ型胶原蛋白的热变曲线。温度范围是4℃
‑
80℃,升温速率为0.4℃/分钟,平衡时间为2分钟。
[0091]
以本发明实施例2为例,制备的ⅱ型胶原蛋白的热变曲线结果如图3所示,其热变温度为37℃,符合天然胶原蛋白的稳定性特征。
[0092]
4.sem测定
[0093]
利用hitachi s
‑
4800扫描电子显微镜(hitachi limited,japan)以5.0kv的操作电压表征ⅱ型胶原蛋白的形貌。
[0094]
以本发明实施例2为例,制备的ⅱ型胶原蛋白sem结果如图4所示,表明本发明所得到的ⅱ型胶原蛋白具有天然胶原蛋白特征性的纤维网状结构。
[0095]
5.tem测定
[0096]
利用talos f200s透射电子显微镜(fei,america)进行tem测定。将用于透射电镜制样的铜网平铺在滤纸上,在铜网上滴加15μl的胶原蛋白样品溶液,待1min后继续在上面滴加15μl的2%醋酸双氧铀溶液对样品进行着色,等待1min后吸干铜网上水分,在30℃烘箱中干燥后置于室温下干燥至少6小时等待测试,在200kv下记录tem图像。
[0097]
以本发明实施例2为例,制备的ⅱ型胶原蛋白tem结果如图5所示,表明本发明所得到的ⅱ型胶原蛋白具有天然胶原蛋白特征性的周期性条带。
[0098]
6.胶原蛋白变性检测
[0099]
参照专利2020100021713所述多肽探针fam
‑
(gpo)8检测实施例及对比例制备的ⅱ型胶原蛋白是否发生变性。检测原理:多肽探针fam
‑
(gpo)8可以特异性结合变性胶原蛋白,而完全不结合具有完整三重螺旋结构的未变性胶原蛋白。胶原蛋白变性程度越严重,检测得到的荧光强度越强。
[0100]
具体检测方法:在具有吸附作用的黑色96孔酶标板中加入不同条件下制备得到的样品溶液,在4℃环境下放置过夜后,吸干样品溶液;用pbs缓冲溶液洗涤三次酶标板,3min/次;加入1%牛血清白蛋白溶液进行封闭,4℃封闭1h后,按上述方法洗涤;随后加入20μm的荧光多肽探针fam
‑
(gpo)8,4℃孵育4h,使其与变性胶原蛋白特异性结合;按上述方法洗板,5min/次。使用infinite m200多功能酶标仪检测荧光强度,每次测量重复三次。
[0101]
对比例3所述ⅱ型胶原蛋白的检测结果如图6所示,未经过加热、盐酸胍处理的实施例2制备的胶原蛋白荧光强度很弱,而使用盐酸胍(4m)和加热处理的ⅱ型胶原蛋白荧光强度显著增加,表明盐酸胍处理的ⅱ型胶原蛋白和加热处理的ⅱ型胶原蛋白一样,发生了严重变性,因此,已公开的ⅱ型胶原蛋白提取过程中的盐酸胍处理步骤会极大地增加ⅱ型
胶原蛋白的变性风险。
[0102]
实施例2和对比例2所述ⅱ型胶原蛋白的检测结果如图7所示,与实施例2制备的ⅱ型胶原蛋白(图7中0m所示)相比,采用盐酸胍处理后,获得的ⅱ型胶原蛋白显示出较强的荧光强度,且随盐酸胍含量的增加,荧光强度越强,表明在ⅱ型胶原蛋白的制备过程中采用盐酸胍处理,会导致ⅱ型胶原蛋白的显著变性。而本发明所述方法制备的ⅱ型胶原蛋白,具有完整的三重螺旋结构,完全没有发生变性。
[0103]
7.内毒素含量测定
[0104]
参照ⅰ型胶原蛋白内毒素检测工艺,对本发明实施例1和2制备的ⅱ型胶原蛋白的内毒素含量进行测定,具体检测方法为:采用toxinsensortm显色法lal内毒素检测试剂盒,并按试剂盒说明书所述的方法,对实施例1
‑
2及对比例1所制备的ⅱ型胶原蛋白的内毒素含量进行测定,该测定方法灵敏可靠。医药行业标准规定ⅱ型胶原蛋白中内毒素的含量应低于0.5eu/ml。
[0105]
测定结果见下表1所示,相较于对比例1,本发明实施例1和2所制备的胶原蛋白内毒素含量均显著降低,且其含量低于0.5eu/ml。
[0106]
表1内毒素含量检测结果
[0107][0108]
8.多糖含量测定
[0109]
检测方法:因为阿尔新兰是一种四价阳离子,能够以高离子强度的形式与多糖进行结合,因此采用阿尔新兰对多糖含量进行检测,该方法不受蛋白质或核酸干扰。具体方法如下:(1)取空白(水)、样品、标准品(或对照品)各50μl放入2ml聚丙烯离心管中;(2)在上述每个离心管中各加入50μl 8m盐酸胍溶液,搅拌15分钟;(3)上述离心管中各加入50μl sat试剂,搅拌15分钟;(4)各加入750μl的冷ab试剂于上述溶液中,搅拌15分钟后4℃下放置过夜;(5)12000g条件下离心15分钟,取出并丢弃上清液;(6)在沉淀中加入500μl dmso溶液,充分搅拌15分钟;(7)按步骤(5)进行离心,取出并丢弃上清液;(8)在沉淀中加入500μl gu
‑
prop
‑
h2o溶液,搅拌15分钟至沉淀完全溶解;(9)依次取240μl(8)步骤所得溶液置于酶联免疫吸附酶微孔板中,读取620nm处的吸光度;(10)绘制吸光度与每个标准品中gag含量的关系曲线(0
‑
20μg)作为标准曲线,通过标准曲线计算所制备ⅱ型胶原蛋白溶液中的多糖含量。
[0110]
本发明实施例1和2及对比例1制备的ⅱ型胶原蛋白中多糖含量的检测结果如下表2所示,结果表明,相较于对比例1,本发明实施例1、2制备的ⅱ型胶原蛋白中蛋白多糖含量均显著低于0.01mg/ml,达到医药行业标准。
[0111]
表2多糖含量检测结果
[0112][0113]
9.纯度测定
[0114]
参照i型胶原蛋白纯度的检测方法(db44/t 2080
‑
2017),本发明使用sds
‑
page来检测ⅱ型胶原蛋白的纯度。利用特异性的胶原酶对ⅱ型胶原蛋白进行酶解,而后检测样品中没有被胶原酶消解的杂蛋白的含量;同时检测实验方法的染色灵敏度,确定杂蛋白的检测下限。通过软件image j处理sds
‑
page结果,从而确定ⅱ型胶原蛋白的纯度。
[0115]
具体检测方法为:通过sds
‑
page对ⅱ型胶原蛋白,胶原酶处理后的ⅱ型胶原蛋白、胶原酶进行表征;将脱色后的胶片在影像分析系统中进行扫描,计算分子量大于100kda的条带密度,ⅱ型胶原蛋白样品结果为a,胶原酶处理后的ⅱ型胶原蛋白样品结果为b,胶原酶样品结果为c,各密度以%表示。杂蛋白含量计算:a)当b
‑
c=0时,样品中胶原蛋白纯度(%):(10000
‑
bsa极限净值)/10000
×
100%;b)当b
‑
c≠0时,样品中胶原蛋白纯度(%)=a
‑
(b
‑
c)。在本实验条件下,考马斯亮蓝对bsa的染色极限能达到100ng,含量在0.5%以上的杂蛋白均能被测定。
[0116]
本发明实施例1和2制备的ⅱ型胶原蛋白纯度检测结果如下表3所示,表明本发明实施例1和2制备的ⅱ型胶原蛋白的纯度均高于95%,达到医药行业标准。
[0117]
表3胶原蛋白纯度检测结果
[0118]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1