用于同时检测BVDV、BCOV和BRV的液相芯片检测试剂盒及其专用引物和探针
用于同时检测bvdv、bcov和brv的液相芯片检测试剂盒及其专用引物和探针
技术领域
1.本发明属于生物检测技术领域中的兽医动物病原检测,具体涉及一种用于同时检测bvdv、bcov和brv的液相芯片检测试剂盒及其专用引物和探针,尤其涉及一种一步操作同时检测bvdv(包括bvdv-1和bvdv-2基因型)、bcov和brv的高通量和高准确度的液相芯片检测试剂盒及其专用引物和探针。
背景技术:
2.引起犊牛腹泻的因素错综复杂,其中传染性病毒引起的腹泻最为严重,且多呈混合性感染,牛病毒性腹泻病毒(bovine viral diarrhea virus,bvdv,包括bvdv-1和bvdv-2基因型)、牛轮状病毒(bovine rotavirus,brv)和牛冠状病毒(bovine coronavirus,bcov)是最常见的病原。然而,在临床诊断过程中这三种病因具有比较相似的临床症状且常混合感染,这对疾病预防和疫苗制苗用原料的选择造成了很大困扰。因此,需要建立能够同时检测这三种病毒的方法,以便及时采取更有效的针对性措施进行防控和针对性疫苗研发,以减少这些病毒对养牛业造成的经济损失。
3.目前对这三种病毒的检测方法主要包括分离鉴定、血清中和试验、基因芯片、elisa技术、实时荧光定量pcr技术等。其中实时荧光定量pcr技术由于其灵敏度高,特异性强,并且可以监测pcr扩增的所有过程,还能对样品定量的优势,是目前用于对这三种病毒进行同步多重检测的最常用方法。例如专利文献cn112176105a(以下称文献1)公开一种病毒bvdv、brv和bcov一管多重荧光pcr检测方法,其基于sy法实时荧光定量pcr的基本原理,可以实现对bvdv、brv和bcov的质粒标准品的最低检出限分别为1.19
×
102拷贝/μl、3.89
×
101拷贝/μl、3.74
×
101拷贝/μl,具有较高的检测灵敏度,然而该文献1公开的方法仅能检测到bvdv-1基因型,而不能检测到bvdv-2基因型。专利文献cn112094953a(以下称文献2)也公开一种用于同时检测牛病毒性腹泻病毒、牛轮状病毒和牛冠状病毒的实时荧光定量pcr检测方法,其基于taqman法实时荧光定量pcr的基本原理,可以实现对bvdv(包括bvdv-1和bvdv-2基因型)、brv和bcov的质粒标准品的最低检出限均为1
×
101拷贝/μl的高灵敏度检测。然而,由于实时荧光定量pcr检测方法每次只能同时检测每种病毒的一个荧光信号,这就导致文献2公开的方法在同时检测以上三种病毒时的准确性受到局限。
技术实现要素:
4.针对现有技术中存在的一个或多个问题,本发明的一个方面提供一种用于对bvdv、bcov和brv进行三重液相芯片检测的引物和偶联探针组合,其包含:
5.用于检测bvdv的上游引物(bvdv-f)、下游引物(bvdv-r)和偶联探针(bvdv-p),其中上游引物(bvdv-f)的核苷酸序列如sed id no:1所示,下游引物(bvdv-r)的核苷酸序列如sed id no:2所示,偶联探针(bvdv-p)的核苷酸序列如sed id no:3所示;
6.用于检测bcov的上游引物(bcov-f)、下游引物(bcov-r)和偶联探针(bcov-p),其
中上游引物(bcov-f)的核苷酸序列如sed id no:4所示,下游引物(bcov-r)的核苷酸序列如sed id no:5所示,偶联探针(bcov-p)的核苷酸序列如sed id no:6所示;
7.用于检测brv的上游引物(brv-f)、下游引物(brv-r)和偶联探针(brv-p),其中上游引物(brv-f)的核苷酸序列如sed id no:7所示,下游引物(brv-r)的核苷酸序列如sed id no:8所示,偶联探针(brv-p)的核苷酸序列如sed id no:9所示。
8.上述引物和偶联探针组合中,所述下游引物(bvdv-r)、下游引物(bcov-r)和下游引物(brv-r)的核苷酸序列的5’端均标记有生物素;所述偶联探针(bvdv-p)、偶联探针(bcov-p)和偶联探针(brv-p)的核苷酸序列的5’端均标记有胺基。
9.本发明另一方面提供一种用于对bvdv、bcov和brv进行三重液相芯片检测的试剂盒,其包含上述的引物和偶联探针组合。
10.上述试剂盒还包含分别与偶联探针(bvdv-p)、偶联探针(bcov-p)和偶联探针(brv-p)偶联的三种不同的luminex磁球,其中将偶联探针(bvdv-p)与luminex磁球偶联后的磁球称为bvdv偶联磁球,将偶联探针(bcov-p)与luminex磁球偶联后的磁球称为bcov偶联磁球,将偶联探针(brv-p)与luminex磁球偶联后的磁球称为brv偶联磁球。
11.上述试剂盒在50μl普通pcr反应体系中包含:上游引物(bvdv-f)和(bcov-f)(10μm):0.5μl,下游引物(bvdv-r)和bcov-r(10μm):1μl,上游引物(brv-f)(10μm):1μl,下游引物(brv-r)(10μm):2μl。
12.上述试剂盒还包含阳性对照品和阴性对照品,其中所述阳性对照品为含bvdv、bcov和brv目的基因片段的质粒,各阳性对照品为单一包装或混合包装,所述阴性对照品为不含bvdv、bcov和brv核酸的反应体系;使用所述试剂盒对bvdv、bcov和brv进行三重液相芯片检测时,将单一包装的阳性对照品混合或直接使用混合包装的阳性对照品。
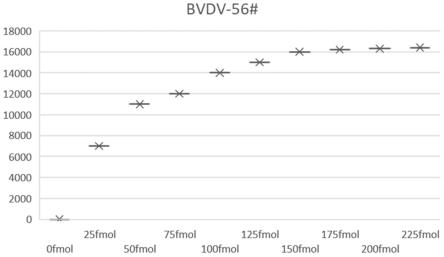
13.本发明再一方面还提供一种利用上述的引物和偶联探针组合或上述的试剂盒对bvdv、bcov和brv进行非疾病诊断目的的三重液相芯片检测的方法,其包括以下步骤:
14.1)提取待测样本的rna/dna,以提取的基因组rna/dna为模板,在上述提及的引物的引导下进行普通pcr扩增;
15.2)将步骤1)扩增得到的pcr产物与bvdv偶联磁球、bcov偶联磁球和brv偶联磁球混合进行液相芯片杂交,并进行上机分析,获得待测样本中各病毒对应偶联磁球的mfi值以及阳性对照品和阴性对照品中各病毒对应偶联磁球的mfi值;
16.3)基于步骤2)获得的mfi值对待测样本中的bvdv、bcov和brv进行定性判定。
17.上述方法中,步骤1)中所述普通pcr扩增的50μl反应体系包含:一步法pcr反应液2
×
one step rt-pcr buffer iii 25μl,takara ex taq hs 1μl,primescript rt enzyme mix ii1μl,上游引物(bvdv-f)和(bcov-f)(10μm):0.5μl,下游引物(bvdv-r)和bcov-r(10μm):1μl,上游引物(brv-f)(10μm):1μl,下游引物(brv-r)(10μm):2μl,模板2μl,ddh2o补充至50μl;
18.步骤1)中所述普通pcr扩增的反应条件为:先52℃15min,95℃2min;然后94℃30s,51℃30s,72℃30s,35个循环;最后终延伸72℃7min;
19.步骤2)中用于进行液相芯片杂交的混合体系中,所述bvdv偶联磁球、bcov偶联磁球和brv偶联磁球的个数均≥2。
20.上述方法中,步骤3)的具体定性判定标准为:
21.a、若阳性对照品和阴性对照品中各病毒对应磁球的mfi值的比值≥3时,且阳性对照品中各病毒对应磁球的mfi值≥300时,则试验成立;
22.b、计算待测样本中各病毒对应磁球的mfi值与阴性对照品中各病毒对应磁球的mfi值的比值qc;
23.c、a判定为试验成立时,当待测样本中各病毒对应磁球的mfi值≥300,且qc≥3,判为待测样本中对应病毒阳性;否则,判为阴性。
24.上述方法中,所述待测样本选自牛源用于疫苗生产的原材料血清、疫苗半成品、疫苗成品、牛源睾丸分离的原代细胞或其组合。
25.基于以上技术方案提供的用于同时检测bvdv、bcov和brv的液相芯片检测试剂盒及其专用标记引物和偶联探针能够用于液相芯片检测技术体系中同时对bvdv(包括bvdv-1和bvdv-2基因型)、bcov和brv进行鉴别检测,由于偶联探针和偶联磁球的使用,检测中每一种病毒的检测结果均是根据与偶联探针偶联的若干个(数量在2至1.25
×
104范围内,例如10、30、50、100个等)磁球的检测荧光强度中位值获得的综合值,因此利用本发明提供的试剂盒及其专用引物和探针的检测结果更加准确可靠,并且还能够满足对体系中每一种病毒的高灵敏度检测和高特异性检测的要求。因此本发明可以为疫苗用牛源原材料的筛选提供一种准确度高、灵敏度和特异性好的技术手段,确保疫苗生产用原料的纯净性,保证疫苗接种的安全性,还可以对牛源原材料的质量进行监控,并为后续处置提供客观数据,以保证牛源原材料血清、细胞及其制品(疫苗成品或疫苗半成品)等牛源产品的纯净性和安全性。另一方面,本发明利用液相芯片检测技术的检测体系中可以同时存在100种不同编号的磁球用于检测100个不同的指标,并且每一个编号的磁球数量根据体系不同可以实现单体系中含有多至1.25
×
104个磁球,即每一指标的检测结果可以多达1.25
×
104个重复,因此液相芯片检测技术具有高通量和更高准确度检测的巨大潜力,本发明提供的同时检测bvdv、bcov和brv的液相芯片检测技术可以为包含bvdv、bcov和brv在内的更高通量(即更多种病毒,例如四种、五种等)和高准确度液相芯片检测奠定基础。
附图说明
26.图1为56号磁球与牛病毒性腹泻病毒的偶联探针偶联效率的检测结果散点图;
27.图2为75号磁球与牛冠状病毒的偶联探针偶联效率的检测结果散点图;
28.图3为37号磁球与牛轮状病毒的偶联探针偶联效率的检测结果散点图。
具体实施方式
29.本发明旨在提供一种利用液相芯片技术一步操作同时检测bvdv(包括bvdv-1和bvdv-2基因型)、bcov和brv的高准确度检测试剂盒及其专用引物和探针,并为包含bvdv、bcov和brv在内的更高通量(更多种病毒,例如四种、五种等)和高准确度液相芯片检测奠定基础。
30.本研究液相芯片检测系统以luminex200系统为检测平台,该检测技术综合了流式细胞技术、化学发光技术及计算机信号处理技术,检测体系中以许多大小均一稳定的磁球为载体,磁球载体的制作严格按照两种分类荧光染料(红色和橙色)的不同搭配比例进行,每种染料有10个配比,不同比例间相互组合可将磁球分为100种(即100个编号的磁球,每一
个编号的磁球数量根据体系不同可实现单体系中含有多至1.25
×
104个磁球),在磁球上偶联不同的检测因子,因此每次检测可以同时检测多至100个指标,每个指标可以实现多达1.25
×
104个重复,可以实现高准确度和高通量检测的目标。在本研究中使用的56,75和37号luminex磁球即是100种不同颜色标记的磁球中的三种,每次检测利用三个编号的磁球同时检测三个指标,为了节约时间,在以下实施例中每次只进行100个荧光信号的收集,即每一个指标均是约30个磁球的综合结果,便可以最大限度排除错误数据的影响。因此使用液相芯片检测方法在一步操作中可以同时获得检测体系中多种病毒中每一种病毒的多个荧光信号,能够实现更高的准确度检测目的,并且更加适应于更多种病毒(更高通量)的同时高准确度检测。
31.通过以下具体实施方式详细说明本发明。
32.下述实施例中所用方法如无特别说明均为常规方法,具体步骤可参见:《分子克隆实验指南》(《molecμlar cloning:a laboratory manual》sambrook,j.,russell,david w.,molecμlar cloning:a laboratory manual,3rd edition,2001,ny,cold spring harbor)。
33.所述百分比浓度如无特别说明均为质量/质量(w/w,单位g/100g)百分比浓度、质量/体积(w/v,单位g/100ml)百分比浓度或体积/体积(v/v,单位ml/100ml)百分比浓度。
34.实施例中描述到的各种生物材料的取得途径仅是提供一种实验获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。
35.所用标记引物和偶联探针由南京金斯瑞生物科技有限公司合成。
36.实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,实施例将有助于理解本发明,但不应作为对本发明内容的限制。
37.实施例1、设计用于液相芯片技术检测bvdv、bcov和brv的标记引物和偶联探针
38.上述文献2已经公开一种利用实时荧光pcr技术同时检测bvdv、bcov和brv的3对特异性引物和探针,其分别基于bvdv的5’utr基因片段(bvdv-1和bvdv-2基因型分别对应序列表中sed id no:10和11)、brv的nsp5基因片段和bcov的n基因片段(序列表中sed id no:12)设计得到,对三种病毒质粒的最低检出浓度均为1
×
101copies/μl,具有较高的检测灵敏度。然而,当发明人将该文献2公开的引物和探针用于液相芯片检测系统中以对bvdv、bcov和brv进行同时检测时(具体检测方法请参见以下实施例3所述),结果如下表1所示,发现:阴性对照背景值高,非brv样品检测存在brv假阳性,且brv样品干扰bcov样品的检测,检测结果存在非特异性扩增和呈现假阳性现象。可见虽然文献2公开的引物探针组合在其公开的实时荧光pcr方法中可以实现高灵敏度同步检测bvdv、bcov和brv的目的,但是不同的引物和探针之间可能存在的相互干扰而在液相芯片技术检测技术中却完全不适用,也说明由于pcr技术原理和液相芯片检测技术原理的不同,适用于pcr技术原理的引物和探针并非可以直接用于液相芯片检测技术的检测体系中。
39.表1:文献2引物探针液相芯片检测结果
[0040][0041][0042]
因此,发明人重新对针对brv的特异性标记引物和偶联探针进行了设计,首先基于文献2公开的brv病毒的nsp5基因片段进行设计,但没有找到可适用于液相芯片技术中,并与分别针对bvdv和bcov的特异性标记引物和偶联探针组合同步检测bvdv、bcov和brv的特异性标记引物和偶联探针。
[0043]
随后,发明人从ncbi的核酸数据库genbank(http://www.ncbi.nlm.nih.gov)检索获得brv ls00005_osu分离株(kr052766.1)、wi79-9分离株(gu565062.1)、toporf11#1分离株(kf729678.1)、b10925分离株(ef554125.1)、ptrv分离株(fj422141.1)和ucd/irl分离株(gq428140.1)的vp7全基因序列,利用lasergener软件中megalign程序进行多序列比对,最终确定了vp7全基因序列中的保守性vp7基因片段(序列表中sed id no:13)为靶标序列,根据液相标记引物和偶联探针的设计原则,共设计了多组针对brv的偶联探针和标记引物,并与文献2公开的分别针对bvdv和bcov的特异性引物和探针组合,共同组成用于液相芯片检测系统中对bvdv、bcov和brv进行同时检测的标记引物和偶联探针组合。以下列出其中的两组,以从中筛选确定出具有较高灵敏度和检测准确度的标记引物和偶联探针组合。
[0044]
两组引物和探针的序列信息如下所示:
[0045]
组1:
[0046]
bvdv-f(上游引物):5
’‑
gaggctagccatgcccttagt-3’(sed id no:1);
[0047]
bvdv-r(下游引物):5
’‑
biotin(生物素)-ctcgtccacrtggcatctcga
ꢀ‑3’
(sed id no:2);
[0048]
bvdv-p(偶联探针):5'-amino(胺基)-liner c12(12个碳,增加偶联探针的空间结构,易与和pcr产物偶联)-cctgagtacagggkagtcgtcrgtggttcgac-3’(sed id no:3);
[0049]
bcov-f(上游引物):5
’‑
gctagtaaccaggctgatgtc-3’(sed id no:4);
[0050]
bcov-r(下游引物):5
’‑
biotin-gatgcgcgtgaagtagatctg-3’(sed id no:5);
[0051]
bcov-p(偶联探针):5'-amino-liner c12-cgatcgggacccaagtagcgatgaggc-3’(sed id no:6);
[0052]
brv-f(上游引物):5
’‑
ggctttaaaagmgagaat-3’(sed id no:7);
[0053]
brv-r(下游引物):5
’‑
biotin-rttagaaytgtggtatattc-3’(sed id no:8);
[0054]
brv-p(偶联探针):5'-amino-liner c12-cgtttggctagcggttagctcctt-3’(序列表中sed id no:9)。
[0055]
组2:
[0056]
bvdv-f1(上游引物):同bvdv-f;
[0057]
bvdv-r1(下游引物):同bvdv-r;
[0058]
bvdv-p1(偶联探针):同bvdv-p;
[0059]
bcov-f1(上游引物):同bcov-f;
[0060]
bcov-r1(下游引物):同bcov-r;
[0061]
bcov-p1(偶联探针):同bcov-p;
[0062]
brv-f1(上游引物):5
’‑
tcgattacattgttgaat-3’(sed id no:14)。
[0063]
brv-r1(下游引物):5
’‑
biotin-gctatttcgtttgatgcct-3’(sed id no:15)。
[0064]
brv-p1(偶联探针):5'-amino-liner c12-agtgatcttggccaccataataaatgc-3’(sed id no:16)。
[0065]
分别使用上述组1和组2的标记引物和偶联探针组合用于液相芯片检测系统中对同时含有系列浓度(108copies/μl、107copies/μl、106copies/μl、105copies/μl、104copies/μl、103copies/μl、102copies/μl、101copies/μl)的bvdv、bcov和brv质粒样品的混合溶液中的三种病毒质粒进行同步检测(具体检测方法如以下实施例3所述),结果如下表2所示。
[0066]
表2:组1和组2的针对bvdv、bcov和brv的特异性标记引物和偶联探针组合在液相芯片检测系统中对三种病毒质粒的检测结果
[0067][0068]
由上表2数据可知,组1的引物探针组合在保证高准确度的基础上仍能够实现对bvdv、bcov和brv三种病毒质粒的高灵敏度检测,对bvdv、bcov和brv的最低检测限分别为103copies/μl、102copies/μl、103copies/μl,且阴性对照背景值很低。而组2的引物探针组合虽然也能够高准确度同时检测同一体系中的三种病毒质粒,但其针对同一浓度条件下的样品检测时获得的荧光中位值明显比组1的引物和探针组合获得的荧光中位值低,并且针对不同病毒的检测灵敏度相对于组1的引物探针组合显著下降,对bvdv、bcov和brv的最低
检测限分别为103copies/μl、103copies/μl、105copies/μl。因此以下实施例中选择组1的引物探针组合作为使用液相芯片检测方法高准确度同步检测bvdv、bcov和brv的标记引物和偶联探针组合。
[0069]
实施例2:偶联探针与luminex磁球的偶联及偶联效率验证
[0070]
该实施例分别选择使用56/75/37号luminex磁球与实施例1中分别针对bvdv、bcov和brv三种病毒的偶联探针进行偶联及偶联效率验证,其中56号luminex磁球对应偶联针对bvdv的偶联探针,75号luminex磁球对应偶联针对bcov的偶联探针,37号luminex磁球对应偶联针对brv的偶联探针。
[0071]
2.1、偶联操作具体包括以下步骤:
[0072]
(1)分别稀释偶联探针,将合成的5’端标记胺基的偶联探针稀释至100μmol(0.1mm);
[0073]
(2)将luminex磁球恢复至室温,并上下颠倒混匀,吸100μl(1.25
×
106)至1.5ml无菌无酶离心管中,12000rpm离心2min,吸弃上清;
[0074]
(3)加入50μl 4℃保存的0.1m mes(2-[n-吗啉代]乙磺酸,购自北京索莱宝科技有限公司)ph4.5溶液并吹打混匀;
[0075]
(4)加入5μl 0.1mm的偶联探针,并吸打混匀;
[0076]
(5)现制备edc溶液,取约10mg的edc(碳化二亚胺)干粉(购自北京索莱宝科技有限公司),并用1ml的纯化水溶解于1.5ml的无菌无酶离心管中,取5μl加入到步骤(4)的溶液中,吹打混匀,室温避光孵育30min;
[0077]
(6)重复步骤(5)(取约10mg的edc干粉,并用1ml的纯化水溶解于1.5ml的无菌无酶离心管中,取5μl加入到步骤(4)的溶液中,吹打混匀,室温避光孵育30min);
[0078]
(7)1.5ml无菌无酶离心管中加入1ml 0.02%tween-20溶液,并吹打混匀,12000rpm离心2min,吸弃上清;
[0079]
(8)1.5ml无菌无酶离心管中加入1ml 0.1%sds溶液,并吹打混匀,12000rpm离心2min,吸弃上清;
[0080]
(9)1.5ml无菌无酶离心管中加入100μl te ph8.0溶液,并吹打混匀,细胞计数仪计数后2-8℃,避光保存。
[0081]
2.2、偶联效率验证操作具体包括以下步骤:
[0082]
(a)根据上述2.1中步骤(9)中偶联磁球(即luminex磁球与对应偶联探针偶联后的磁球)计数结果,用1.5
×
tmac将偶联磁球稀释至100个/μl;
[0083]
(b)稀释偶联验证生物素标记引物(即5’端生物素标记的偶联探针的反向互补序列)至10fmol/μl;
[0084]
(c)配置验证体系,60μl体系中加入33μl偶联磁球和偶联验证生物素标记引物浓度依次为0fmol、25fmol、50fmol、100fmol、125fmol、150fmol、175fmol、200fmol、225fmol,并用水补充至60μl;
[0085]
(d)96℃变性5min,50℃杂交15min;
[0086]
(e)用1
×
tmac将sape(链霉亲和素-藻红蛋白)稀释至10mg/ml;
[0087]
(f)在经过步骤(d)之后的杂交体系中加入25μl sape,并吹打混匀,50℃孵育5min,luminex 200仪器分析检测。
[0088]
偶联效率结果如图1-3所示,可见随着偶联验证生物素标记引物浓度的依次递增,液相芯片检测的mfi值(平均荧光强度)依次递增,最高可高于10000mfi,证明各luminex磁球均与对应的偶联探针偶联成功,且偶联效率高,可以用于分别检测同一体系中的bvdv、bcov和brv三种病毒。
[0089]
实施例3:一步操作同时高准确度检测bvdv、bcov和brv
[0090]
该实施例利用上述实施例1提供的组1’引物探针组合,和实施例2经过组1’中偶联探针偶联的56/75/37号luminex磁球对同一体系中的bvdv、bcov和brv三种病毒进行液相芯片检测,具体包括以下步骤。
[0091]
3.1、提取待测样本(例如牛腹泻粪便样品等)的基因组核酸
[0092]
(1)axygen试剂盒(axyprep
tm
body fluid viral dna/rna miniprep kit,购自康宁生命科学(吴江)有限公司)准备:按试剂盒说明书,预先配制含1%冰乙酸的异丙醇和在试剂buffer w1a和buffer w2中添加指定浓度的无水乙醇;
[0093]
(2)在1.5ml离心管中加入200μl的待检样品,并加入200μl buffer v-l,漩涡振荡混匀后,静置5min;
[0094]
(3)在步骤(2)的1.5ml样品及试剂混合离心管中加75μl buffer v-n,漩涡振荡混匀,12000g离心5min;
[0095]
(4)将上清转移至2ml离心管(试剂盒内提供)中,加300μl异丙醇(1%冰乙酸),上下倒置6-8次,混合均匀;
[0096]
(5)将制备管置于2ml离心管中(试剂盒内提供)中,取步骤(4)的混合液移入制备管中,6000g离心1min;
[0097]
(6)弃滤液,将制备管置回至2ml离心管中,加500μl buffer w1a,室温静置1min。12000g离心1min;
[0098]
(7)弃滤液,将制备管置回至2ml离心管中,加800μl buffer w2,12000g离心1min;
[0099]
(8)将制备管置回到2ml离心管中,12000g离心1min;
[0100]
(9)将制备管置于洁净的1.5ml离心管(试剂盒内提供)中,在制备管膜中央加40μl无酶水,室温静置1min,12000g离心1min洗脱rna/dna。
[0101]
通过以上步骤从待测样本中提取获得含有bvdv、bcov和brv三种病毒的rna/dna的待测样品。
[0102]
3.2、待测样品中bvdv、bcov和brv核酸的普通pcr扩增
[0103]
对待测样品、阴性对照和阳性对照(三种病毒质粒标准品混合样,可以按照文献2公开的方法获得三种病毒质粒标准品)pcr扩增的50μl反应体系如下表3所示,pcr反应条件如下表4所示;
[0104]
表3:pcr反应体系
[0105]
试剂名称体积(μl)2
×
one step rt-pcr buffer iii(购自takara公司)25takara ex taq hs(购自takara公司)1primescript rt enzyme mix ii(购自takara公司)1bvdv-f/bcov-f(10μm)各:0.5brv-f(10μm)1
bvdv-r/bcov-r(10μm)各:1brv-r(10μm)2模板(待测样品/阴性对照/阳性对照)2.0rna-free h2o16.5
[0106]
表4:pcr反应条件
[0107][0108]
3.3、待测样品、阳性对照和阴性对照中bvdv、bcov和brv核酸的液相芯片检测
[0109]
分别100倍稀释56/75/37号偶联磁球(实施例2获得)和sape显色液,偶联磁球稀释利用1.5
×
tmac缓冲液,sape显色液用1
×
tmac缓冲液,配置液相芯片检测体系:50μl偶联磁球(各号偶联磁球的个数可以多达约1.25
×
104个,但为了节约时间,在该实施例中3种磁球共进行100个荧光数据的收集)加15μl的h2o和5μl的pcr扩增产物(上述步骤3.2),96℃预变性5min,50℃杂交15min,加入20μl的sape显色液,混匀后,50℃静置10min,上机分析。
[0110]
3.4、结果判定标准(qualitative criteria,qc)
[0111]
如果阳性对照与阴性对照的mfi比值(positive/negative ratio,pn)≥3,且阳性对照的mfi≥300时,试验成立,然后根据待测样品中各病毒磁球的mfi值以及qc值(待测样品中各病毒磁球的mfi值/阴性对照mfi值)对结果进行判定,具体为:
[0112]
在判定为试验成立时,当各病毒磁球的mfi值≥300,qc≥3,则判定待测样本为对应病毒阳性样本;否则,判为阴性。即:若56号磁球mfi值低于300,表明样本中无牛病毒性腹泻病毒,若56号磁球mfi值≥300且qc≥3,表明样本中含有牛病毒性腹泻病毒;若75号磁球mfi值低于300,表明样本中无牛冠状病毒,若75号磁球mfi值≥300且qc≥3,表明样本中含有牛冠状病毒;若37号磁球mfi值低于300,表明样本中无牛轮状病毒,若37号磁球mfi值≥300且qc≥3,表明样本中含有牛轮状病毒。
[0113]
实施例4:本发明提供的液相芯片检测方法的特异性、敏感性和重复性
[0114]
该实施例按照上述实施例3所述的液相芯片检测方法评价其特异性、敏感性和重复性,具体包括以下步骤。
[0115]
4.1、液相芯片检测方法的特异性
[0116]
按照实施例3所述方法用dna/rna同时提取的axygen试剂盒分别对牛流行热病毒((bovine ephemeral fever virus,befv)、牛鼻气管炎病毒(infectious bovine rhinotracheitis virus,ibrv)、牛合胞体病毒(bovine respiratory syncytial virus,brsv)、多杀性巴氏杆菌(pasteurella multocida,pm)a型和b型(pma和pmb)、魏氏梭菌(clostridium perfringens,cp)a型(cpa)、曼氏杆菌(mannheimiahaemolytic,mh)、大肠杆菌(escherichia coli,ecoli)等提取基因组rna/dna,以灭活的bvdv、bcov、brv为阳性对
照,以无酶水为阴性对照,在本发明引物、偶联探针的引导下进行液相芯片检测,液相芯片试验方法参照实施例3,以验证该方法的特异性。
[0117]
检测结果如下表5所示,可见对befv、brsv、pm和mh等的核酸检测mfi值均低于300,而不同组合阳性对照样品均出现相应的阳性结果,检测结果表明用本发明的方法可特异性地检测出bvdv、bcov、brv。
[0118]
表5:bvdv、bcov、brv的液相芯片检测方法的特异性检测结果
[0119][0120]
4.2、液相芯片检测方法的敏感性
[0121]
将浓度各为108copies/μl的bvdv、bcov、brv的阳性质粒核酸混合样品(其中bvdv、bcov和brv的阳性质粒可以按照文献2公开的方法获得)按照10倍梯度依次进行稀释,其中每种病毒的浓度分别稀释至101copies/μl,以不同浓度的核酸混合样品作为模板,在本发明引物和偶联探针的引导下进行液相芯片方法检测,液相芯片试验方法参照实施例3,以验证该方法的灵敏度。
[0122]
检测结果如下表6所示,可见本发明提供的液相检测方法同步检测bvdv、bcov、brv三种阳性质粒的最低检出限分别为103copies/μl、102copies/μl、103copies/μl。
[0123]
表6:bvdv、bcov、brv的液相芯片检测方法的敏感性检测结果
[0124][0125]
4.3、液相芯片检测方法的重复性
[0126]
利用上述4.2的共8个梯度的核酸混合样品做为模板,每个核酸混合样品设置3个
重复,在本发明引物和偶联探针的指导下进行液相芯片方法检测,液相芯片试验方法参照实施例3,以验证该方法的重复性。
[0127]
检测结果如下表7所示,可见每一个浓度梯度的3个重复样品,检测结果均一致,表明本发明针对bvdv、bcov、brv的三重液相芯片检测方法的重复性较好。
[0128]
表7:bvdv、bcov、brv的液相芯片检测方法的重复性结果
[0129][0130]
实施例5:一步操作同时检测bvdv、bcov、brv的液相芯片检测试剂盒
[0131]
基于以上实施例1、2和3,本发明所提供的液相芯片检测试剂盒,包括用于bvdv、bcov、brv进行液相芯片检测的引物和偶联磁球(带偶联探针)。
[0132]
具体来讲,该试剂盒包括以下用于50μl普通pcr反应体系的试剂:一步法pcr反应液2
×
one step rt-pcr buffer iii 25μl(购于takara公司),takara ex taq hs 1μl(购于takara公司),primescript rt enzyme mix ii 1μl(购于takara公司),bvdv与bcov上游引物用量(10μm):0.5μl,bvdv与bcov下游引物用量(10μm):1μl,brv上游引物用量(10μm):1μl,brv下游引物用量(10μm):2μl,模板2μl,ddh2o补充至50μl。
[0133]
该试剂盒还应该包括sape显色液、1
×
tmac缓冲液和1.5
×
tmac缓冲液,为方便检测,试剂盒中还可包括阳性对照和阴性对照,所述阳性对照为含bvdv、bcov、brv目的基因片段的质粒,所述阴性对照为不含bvdv、bcov、brv基因组rna/dna的反应体系,如h2o(双蒸水、无菌去离子水等)。
[0134]
试剂盒中各试剂的使用可参考实施例3所述的内容,试剂盒中还可包括实施例3中所述的结果判定标准。
[0135]
实施例6:对临床样品中的bvdv、bcov、brv进行液相芯片检测
[0136]
该实施例利用上述实施例5提供的液相芯片检测试剂盒对疫苗生产牛源原材料(例如牛源血清)中的bvdv、bcov、brv外源病毒进行检测,检测方法同实施例3所述。
[0137]
检测结果如下表8所示,可见在10份牛源血清中,1份有外源病毒bvdv的污染,1份有外源病毒bcov和brv的混合污染,8份无外源病毒bvdv、bcov和brv的污染。
[0138]
表8:10份牛源血清中bvdv、bcov、brv外源病毒的液相芯片检测结果
[0139][0140]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1