一种检测呼吸道病毒病原体的NGS引物组及试剂盒
本发明属生命科学和生物技术领域,特别涉及检测甲流、乙流、合胞病毒和新冠基因组的ngs引物组及试剂盒。
背景技术:
高通量测序技术(ngs)具有快速、低成本实现对于病原体基因组进行全覆盖的能力。传统检测rna病原体的方法,对于rna会采用随机引物进行逆转录,优点是成本低,一个6~9个碱基的随机引物就可以覆盖各种rna可能。但缺点也非常明显,针对临床样本,每一个样本中核酸来源复杂,随机引物会把所有可能的rna都尽可能转录出来,特别是人源样本中核糖体rna,含量很高,这样对于特征想检测的病毒病原体检测的能力就降低了。
呼吸道感染中,甲乙流合胞病毒,以及新冠病毒,都是临床常见的病原体,并且这几个病毒由于具有广泛的传播性,针对特发的聚集病例不光需要尽快诊断,同时非常迫切希望快速、低成本实现全基因组检测,从而及时调整卫生防疫政策。
本发明首先选择了四个呼吸道病原体,临床上不仅关注检出情况,还关注病原体基因组层面是否发生突变。因此高通量测序技术是非常适合快速、低成本实现检测并测量基因组全长的技术。并创新地不再使用随机引物,而是特定设计研发了针对四个病原体基因组上特异转录引物,这样不仅可以大大提高检出效果,还可以尽可能拼接出基因组全长。
技术实现要素:
本专利旨在提供一种提高呼吸道常见病毒病原体检出能力,并同时可以尽可能覆盖全基因组的检测试剂盒。创新地不再使用随机引物进行rna逆转录,而特异设计开发了针对甲流、乙流、合胞病毒和新冠病毒的特异转录引物,每个病原体分别设计了甲流(102)、乙流(148)、合胞病毒(164)和新冠病毒(180),共594条引物。这些引物特异针对这四个病原体整个基因组,可以在检测病原体的同时尽可能覆盖全部基因组,为了病毒溯源提供技术支持。
病毒特异引物设计要点,通过生物信息算法设计特异性引物,引物只能特异针对该病原体,逆转录效率也会根据病原体基因组结构、序列碱基组成以及空间位置差异而差异非常大,并不能简单通过生物信息软件预测获得;逆转录效率差异主要导致各个引物之间产物数量差异大,这样就很难保证在一定测序数据量的要求下尽可能覆盖基因组,从而需要更大量的测序数据,造成检测成本增加和不确定。因此引物的组合需要经过大量的优化和重组,每次测序后,根据数据量不够的区域进行重新设计引物和调整,需要经过数轮整合测序分析最终才能确定引物组合。
一种检测呼吸道病毒病原体的ngs引物组,其特征在于,所述引物组由594条引物序列组成,包括检测甲流病毒的102条引物、检测乙流病毒的148条引物、检测合胞病毒的164条引物,和检测新冠病毒的180条引物,引物的碱基序列为:
(1)检测甲流病毒的引物
(2)检测乙流病毒的引物
(3)检测合胞病毒的引物
(4)检测新冠病毒的引物
本发明第二个目的是提供上述引物组在制备检测甲流、乙流、合胞病毒和新冠病毒的试剂中的应用。
本发明第三个目的是提供一种检测甲流、乙流、合胞病毒和新冠病毒的试剂盒,所述试剂盒包括上述由594条引物序列组成的引物组。
进一步地,所述引物组的工作终浓度为5~30μm。
进一步地,所述试剂盒还包括一链合成逆转录酶,一链合成缓冲液,二链合成dna聚合酶,二链合成缓冲液,无核酸酶的去离子水(nfh2o),片段化补平酶,片段化补平缓冲液,连接酶,文库接头,纯化磁珠,纯化清洗液和洗脱液。
本发明创新性地在逆转录过程中,不采用随机引物,而采用病原体特定逆转录引物,为了提高整体检出,增加把整个病毒基因组检出的可能,针对甲流、乙流、合胞病毒和新冠病毒基因组特定设计了594个引物,覆盖整个病毒基因组,提高了病毒的检测并大大提高了病毒基因组序列全长检测的可能。
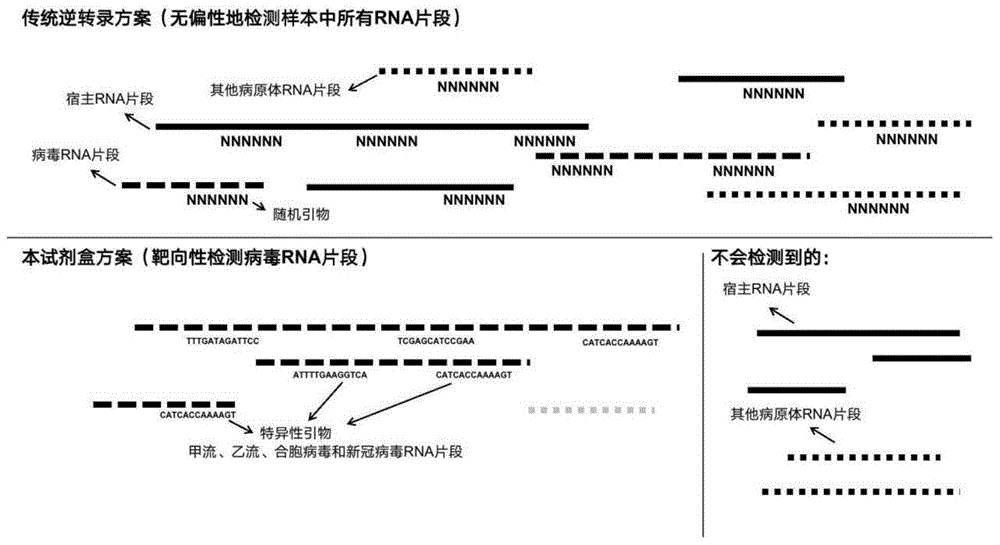
如图1所示,传统试剂盒针对病毒基因组采用随机引物方式进行逆转录,这样的随机引物在逆转录过程中就会与宿主rna以及其他病原体的rna互补配对而导致副产物的生成,这些产物也会随之被建库后测序检测到,占据了较大比例的测序数据量,因而会造成靶标病毒检测灵敏度的降低。而本发明试剂盒采用基因组特异引物进行逆转录,定向逆转录靶向病毒基因组(甲流、乙流、合胞病毒和新冠病毒),不会检测到宿主rna片段和其他病原体的rna片段。
本发明seqidno.1-seqidno.102是检测甲流病毒的引物,seqidno.103-seqidno.250是检测乙流病毒的引物,seqidno.251-seqidno.414是检测合胞病毒的引物,seqidno.415-seqidno.594是检测新冠病毒的引物,这些检测不同类型病毒的引物也可以单独与检测试剂一起组成试剂盒。本发明具有以下优势:
1、试剂盒检测范围可以覆盖甲流、乙流、合胞病毒和新冠病毒。
2、594条甲流、乙流、合胞病毒和新冠病毒基因组特异引物,这些引物均匀覆盖在四个病毒基因组上,大大提升了病毒的靶向特异性和检测灵敏度,在单端测序75bp,单文库数据量仅5~8mreads的情况下,就有可能获得接近完整的病毒基因组。
3、试剂盒基于pcr-free建库原理,避免了pcr原理建库会产生的碱基偏好问题。操作简便快速,可在3hr内完成多个样本的建库。
附图说明
图1是传统逆转录方法与本发明检测方法的对比示意图。
图2是样本中甲流基因组覆盖图。
图3是样本中乙流基因组覆盖图。
图4是样本中合胞病毒基因组覆盖图。
图5是样本中新冠病毒基因组覆盖图。
图6是实施例4同时检测dna病原体和甲流病毒基因组的原理示意图。
图7是实施例5同时检测dna病原体和乙流病毒基因组的原理示意图。
图8是实施例6同时检测dna病原体和合胞病毒基因组的原理示意图。
具体实施方式
下面结合具体实施例和附图,进一步阐述本发明。应当注意的是,实施例中未说明的常规条件和方法,通常按照所属领域实验人员常规采用方法。
实施例1:检测甲流、乙流、合胞病毒和新型冠状病毒(sars-cov-2)的特异性逆转录引物设计
首先从ncbigenebanknt数据库中下载甲流、乙流、合胞病毒和新型冠状病毒参考基因组序列。
这些基因组序列经过多重序列比对后,利用pyfasta(http://pypi.python.org/pypi/pyfasta/)将各基因组切割成400个碱基的长片段,这些片段之间允许有200个碱基的重叠区。然后在这些400碱基的长片段的首尾各50个碱基的窗口区内(可以是正义链,也可是反义链上的)去寻找13个碱基的kmer(13mer),所有kmer根据出现频率进行降序排列,选择其中出现频率最高(序列最保守)的13mer作为第一轮选出的候选引物,然后去掉所有包含该13mer的500碱基的长片段,在剩下的长片段中继续重复在两端搜索13mer,然后再依照频率降序排序->选出出现频率最高的13mer作为第二轮候选引物->去掉所有包含该13mer的400碱基的长片段,然后依照以上流程,反复迭代搜索寻找出不同株系病毒基因组上序列最保守的13mer。接着对所有挑选出的13mer引物按照以下条件进行过滤:1.这些引物的序列中不能含有连续五个及以上的相同碱基;2.分别计算各引物的tm值和所有引物的tm平均值及标准差,tm在均值2个标准差外的引物也会被过滤掉;3.去掉会形成分子内二聚体或分子间二聚体的引物。经过大量的优化和重组,每次测序后,根据数据量不够的区域进行重新设计引物和调整,经过数轮整合测序分析,最终筛选出了594条特异性引物,其中正向引物303条,反向引物291条。
594条甲流、乙流、合胞病毒和新冠基因组特异性逆转录引物序列如seqidno.1-seqidno.594所示。其中seqidno.1-seqidno.102是检测甲流病毒的引物,seqidno.103-seqidno.250是检测乙流病毒的引物,seqidno.251-seqidno.414是检测合胞病毒的引物,seqidno.415-seqidno.594是检测新冠病毒的引物
实施例2
利用中检院甲流、乙流、合胞病毒和新冠病毒核酸检测国家参考品中的灵敏度参考品,对比测试使用594条病毒靶向性引物与使用随机引物进行宏基因组建库测序的效果。
1)样本来源:中检院呼吸道病原体标准盘,以及新冠病毒标准品。
2)样本前处理方式:为模拟肺泡灌洗液样本,需向纯病毒培养物中掺入一定量的人细胞,提供宿主核酸背景。将定值的甲流、乙流、合胞病毒和sars-cov-2灵敏度参考品用1×105个/ml的人永生化白细胞稀释到100,000copies/ml,标记为s1;之后再次用该浓度的细胞对s1作2倍浓度梯度稀释,至病毒浓度为50000、25000、12500、16250、3125、1562.5、781.25、390.6、195.3copies/ml,分别标记为s2、s3、s4、s5、s6、s7、s8、s9和s10。最终各样本内均保证含有1×105个人细胞背景。
3)核酸提取:对s1-s10的各个样本均使用qiagen
4)逆转录及建库(即试剂盒说明书):
4.1.逆转录
4.1.1.第一链合成
4.1.1.1.将试剂置于冰上融解并充分混匀(注意:一链合成酶、二链合成酶需轻弹混匀,避免剧烈振荡)。
4.1.1.2.准备0.2ml无核酸酶的pcr管置于冰上预冷,根据下表依次向管内加入试剂和样本。用移液器轻轻吹打反应液使其充分混匀(避免剧烈振荡),盖上管盖并做好标记。
若使用594条病毒靶向性引物时,该缓冲液mix加入了等摩尔量混合的594条引物,反应体系中引物组的终浓度为5~30μm;若使用随机引物时,该缓冲液mix仅加入了6个碱基的随机引物,反应体系中引物的终浓度为10μm。
4.1.1.3.将装有上述反应液的pcr管放入pcr仪中,按以下程序进行反应(注:pcr热盖温度设为100℃):25℃10分钟,50℃30分钟,75℃10分钟后反应结束可4℃暂存。
4.1.1.4.反应结束后,取出pcr管置于冰上。
4.1.2.第二链合成
4.1.2.1.根据下表向4.1.1.4中pcr管中加入试剂,用移液器轻轻吹打反应液使其充分混匀(避免剧烈振荡),盖上管盖并做好标记。
4.1.2.2.将装有上述反应液的pcr管放入pcr仪中,按以下程序进行反应(注:pcr热盖温度设为25℃或off):16℃30分钟后反应结束可4℃暂存。
4.1.2.3.反应结束后,取出pcr管置于冰上。
4.2.cdna纯化
4.2.1.纯化磁珠室温平衡30min。
4.2.2.涡旋使磁珠充分悬浮,取纯化磁珠各80μl,分别加入上述获得的cdna双链合成产物溶液中,充分振荡混匀。
4.2.3.室温孵育5~10min,使dna充分结合到磁珠上,再将反应管置于磁力架上。待溶液澄清后(约5~10min),用移液器小心吸弃上清。
4.2.4.样品始终置于磁力架上,向反应管内加入200μl纯化清洗液,静置30sec,移液器小心吸弃上清。
注意:加入纯化清洗液漂洗磁珠时不要吹散磁珠;洗涤后需要使用移液器尽量吸尽残留的上清液。
4.2.5.重复步骤4.2.4一次。
4.2.6.反应管始终置于磁力架上,室温开盖晾置3~5min。
4.2.7.加入37~40μl纯化洗脱液至管内,充分振荡混匀,使磁珠悬浮,室温静置5min,再将反应管放置于磁力架上3~5min,待溶液澄清后,转移35μl上清至新的无核酸酶的pcr管中,置于冰上继续建库反应,或放在零下15℃以下冷冻保存。
4.3.文库制备
4.3.1.dna片段化补平
4.3.1.1.根据下表在4.2.7的pcr管内依次加入试剂,涡旋振荡5秒,混匀,瞬时离心5秒。
4.3.1.2.将装有上述反应液的pcr管放入pcr仪中按以下程序进行反应:37℃15分钟,75℃10分钟后反应结束可4℃暂存。
4.3.1.3.将4.3.1.2中的pcr管从pcr仪上取出置于冰上。
4.3.2.接头连接
4.3.2.1.取连接酶各5μl,分别加入步骤4.3.1.3的各pcr管中。
4.3.2.2.再向步骤4.3.2.1的每个pcr管中分别加入30μlm接头dna,注意避免交叉污染。
4.3.2.3.将上述混合液瞬时离心5秒,再快速涡旋振荡5秒,充分混匀,再次瞬时离心5秒后将pcr管置于冰上。
4.3.2.4.将步骤4.3.2.3中的pcr管放入pcr仪中按以下程序进行反应:25℃15分钟,75℃5分钟后反应结束可4℃暂存或置于冰上准备纯化。
4.4.文库纯化:
4.4.1.将纯化磁珠从2~8℃冰箱中取出,涡旋振荡混匀后室温平衡30min。
4.4.2.再次涡旋振荡均匀混合磁珠,取纯化磁珠各40μl,分别加入上述获得的文库反应粗产物中,涡旋振荡5秒混匀样本与磁珠,室温放置3~5分钟,中间无需再次混匀;
4.4.3.将反应管置于磁力架上,吸附10分钟后,使用移液器吸取上清;
4.4.4.在磁力架上沿远离磁珠方向向反应管内加入200μl纯化清洗液,静置30sec,用移液器或真空泵缓慢吸出废液;
4.4.5.重复步骤4.4.4一次;
4.4.6.从磁力架上取下反应管,放入离心机中短暂离心10秒钟,再次放回磁力架,使用10μl移液器吸尽所有废液;
注意:尽可能将纯化清洗液吸干净。
4.4.7.反应管始终置于磁力架上,室温开盖晾置3~5min;
4.4.8.从磁力架上取下离心管,加入20~40μl纯化洗脱液,涡旋振荡5秒混匀后室温放置5分钟;
将离心管置于磁力架上吸附5分钟,吸取上清于新的无核酸酶的pcr管中,置于冰上继续下一步检测,或放在零下15℃以下冷冻保存。
5)测序:所有文库均使用illuminanextseq平台分别进行单端75bp测序,以生物信息学分析方法去除宿主序列,分析获得新型冠状病毒检出reads数,并标化换算成每一百兆(1m)总数据量下测到的目标reads数(rpm),结果如下表:
甲流
乙流
合胞病毒
新冠病毒
上述结果表明,使用该试剂盒进行甲流、乙流、合胞病毒和新冠病毒ngs检测时,在即使含有较高的宿主核酸背景的情况下,该检测方法检测灵敏度依然能达到约低于1000copies/ml,而在相当的总测序数据量时,若使用随机引物进行逆转录,其检测灵敏度仅能达到约3000copies/ml。特异性逆转录的使用能够有效提升约10~100倍左右的检测灵敏度。
实施例3
对4个真实的痰液/咽拭子样本核酸分别是甲流、乙流、合胞病毒和新冠病毒患者进行ngs检测,验证逆转录引物组效果。
1)样本来源及核酸提取:4例目标病毒患者痰液/咽拭子样本,经过qiagen
2)逆转录及建库实验步骤同实施例2。
3)所有文库均使用illuminanextseq平台分别进行单端75bp测序(se75),以生物信息学分析方法去除宿主序列,分析获得新型冠状病毒检出reads数以及有参拼接后的基因组比对率,如下表:
图2是样本中甲流基因组覆盖图,图3是样本中乙流基因组覆盖图,图4是样本中合胞病毒基因组覆盖图,图5是样本中新冠病毒基因组覆盖图。
上述结果表明,使用该试剂盒均能有效检测出各阳性样本中靶向病毒,并且在se75测序条件下,全部样本在总数据量10m左右的情况下就能得到较高的病毒基因组覆盖度(有参拼接的比对率达到99%以上)。
实施例4
利用检测甲流病毒的引物组(seqidno.1-seqidno.102)检测甲流病毒的同时,实现对dna病原体的无偏宏基因组检测。
如图6所示是同时检测dna病原体和甲流病毒基因组的原理示意图。对样本进行总核酸的提取后,若其中存在甲流病毒rna,则会被102条特异逆转录引物所靶向结合,随后经cdna一链合成和二链合成形成双链的dna中间产物。这些中间产物和样本中的其他dna随后经过片段化酶作用被打断成更小的片段,再经过末端修复和末端加a尾后与测序接头连接,构建成最终的文库。
具体检测方法:
1)样本来源及核酸提取:4例甲流病毒阳性痰液/咽拭子样本,经过杰毅生物的磁珠法核酸提取试剂盒提取总核酸。所有样本核酸经cfda批准的体外诊断试剂(荧光定量pcr方法)验证为阳性。
2)逆转录及建库实验步骤同实施例2。
3)测序:所有文库均使用illuminanextseq平台分别进行单端75bp测序,以生物信息学分析方法去除宿主序列,分析获得甲流病毒和其他dna病原体检出reads数,结果如下表:
使用此试剂盒对这些甲流样本建库和测序检测,并且在se75测序条件下,全部样本在总数据量10m左右的情况下就能得到较高的病毒基因组覆盖度(有参拼接的比对率达到99%以上,实现了非常高的甲流病毒基因组覆盖度,而且检测到了各样本中的各种疑似dna病原体或定植微生物。
使用该试剂盒均能有效检测出各阳性样本中甲流病毒,并且可以实现较高的病毒基因组覆盖度;对许多病毒丰度较高的样本,即使用较低的总测序数据量也能达到较高的甲流病毒测序深度。与此同时,该试剂盒可以使用样本总核酸,无需额外消化dna,从而达到对dna病原体的无偏宏基因组检测的目的,这在临床应用中有非常大的意义,可以用于指导用药。
实施例5
利用检测乙流病毒的引物组(seqidno.103-seqidno.250)检测乙流病毒的同时,实现对dna病原体的无偏宏基因组检测。
如图7所示是同时检测dna病原体和乙流病毒基因组的原理示意图。对样本进行总核酸的提取后,若其中存在乙流病毒rna,则会被148条特异逆转录引物所靶向结合,随后经cdna一链合成和二链合成形成双链的dna中间产物。这些中间产物和样本中的其他dna随后经过片段化酶作用被打断成更小的片段,再经过末端修复和末端加a尾后与测序接头连接,构建成最终的文库。
具体检测方法:
1)样本来源及核酸提取:4例乙流病毒阳性痰液/咽拭子样本,经过杰毅生物的磁珠法核酸提取试剂盒提取总核酸。所有样本核酸经cfda批准的体外诊断试剂(荧光定量pcr方法)验证为阳性。
2)逆转录及建库实验步骤同实施例2。
3)测序:所有文库均使用illuminanextseq平台分别进行单端75bp测序,以生物信息学分析方法去除宿主序列,分析获得乙流病毒和其他dna病原体检出reads数,结果如下表:
使用此试剂盒对这些乙流样本建库和测序检测,并且在se75测序条件下,全部样本在总数据量10m左右的情况下就能得到较高的病毒基因组覆盖度(有参拼接的比对率达到99%以上,实现了非常高的乙流病毒基因组覆盖度,而且检测到了各样本中的各种疑似dna病原体或定植微生物。
使用该试剂盒均能有效检测出各阳性样本中乙流病毒,并且可以实现较高的病毒基因组覆盖度;对许多病毒丰度较高的样本,即使用较低的总测序数据量也能达到较高的乙流病毒测序深度。与此同时,该试剂盒可以使用样本总核酸,无需额外消化dna,从而达到对dna病原体的无偏宏基因组检测的目的,这在临床应用中有非常大的意义,可以用于指导用药
实施例6
利用检测合胞病毒的引物组(seqidno.251-seqidno.414)检测合胞病毒病毒的同时,实现对dna病原体的无偏宏基因组检测。
如图8所示是同时检测dna病原体和合胞病毒病毒基因组的原理示意图。对样本进行总核酸的提取后,若其中存在合胞病毒病毒rna,则会被164条特异逆转录引物所靶向结合,随后经cdna一链合成和二链合成形成双链的dna中间产物。这些中间产物和样本中的其他dna随后经过片段化酶作用被打断成更小的片段,再经过末端修复和末端加a尾后与测序接头连接,构建成最终的文库。
具体检测方法:
1)样本来源及核酸提取:4例合胞病毒病毒阳性痰液/咽拭子样本,经过杰毅生物的磁珠法核酸提取试剂盒提取总核酸。所有样本核酸经cfda批准的体外诊断试剂(荧光定量pcr方法)验证为阳性。
2)逆转录及建库实验步骤同实施例2。
3)测序:所有文库均使用illuminanextseq平台分别进行单端75bp测序,以生物信息学分析方法去除宿主序列,分析获得合胞病毒病毒和其他dna病原体检出reads数,结果如下表:
使用此试剂盒对这些合胞病毒样本建库和测序检测,并且在se75测序条件下,全部样本在总数据量10m左右的情况下就能得到较高的病毒基因组覆盖度(有参拼接的比对率达到99%以上,实现了非常高的合胞病毒病毒基因组覆盖度,而且检测到了各样本中的各种疑似dna病原体或定植微生物。
使用该试剂盒均能有效检测出各阳性样本中合胞病毒病毒,并且可以实现较高的病毒基因组覆盖度;对许多病毒丰度较高的样本,即使用较低的总测序数据量也能达到较高的合胞病毒病毒测序深度。与此同时,该试剂盒可以使用样本总核酸,无需额外消化dna,从而达到对dna病原体的无偏宏基因组检测的目的,这在临床应用中有非常大的意义,可以用于指导用药。
- 还没有人留言评论。精彩留言会获得点赞!