一种评价病毒灭活口罩对病毒灭活效率的方法与流程
1.本发明涉及病毒防护技术领域,尤其是涉及一种评价病毒灭活口罩对病毒灭活效率的方法。
背景技术:
2.目前,由病毒引起的呼吸系统疾病受到全世界普遍关注,此类疾病的传播途径、治疗方法和防护手段也成为各国竞相研究的热点,其中,如何有效阻断病毒的传播路径是预防和控制呼吸道传染病的关键,通常人们通过佩戴医用口罩将口鼻与外界风险环境进行隔离,然而,虽然普通医用口罩靠多层具有极小孔隙的滤料将细菌和病毒吸附、过滤,能够大大降低感染风险,但并不能保证对细菌或病毒100%的滤除,尤其是医护人员在高风险环境下长时间的暴露积累,健康安全存在巨大隐患。因此,既能发挥物理屏障作用,又具有杀菌抗病毒成分的病毒灭活口罩应运而生,在市场上大量出现。
3.病毒灭活口罩通过改良工艺,在生产口罩的原材料上加载具有病毒灭活作用的化学物质,如氧化铜、纳米银、石墨烯和季铵盐等,从而实现对病毒的物理、化学双重防护。然而,已上市的病毒灭活口罩因无对应检测标准,均未按照医疗器械注册上市,其灭活效果无法判断,质量参差不齐。目前,国家对医用口罩的质量监管按照如下标准进行:《gb 19083
‑
2010医用防护口罩技术要求》、《yy 0469
‑
2011医用外科口罩》和《yy/t 0969
‑
2013一次性使用医用口罩》,上述标准均未涉及对口罩病毒防护能力的要求,也无对应检测方法。因此,部分灭活口罩按照《iso18184
‑
2019纺织品纺织产品抗病毒活性的测定》标准注册上市,该标准针对纺织品原材料进行试验,在单层织物上滴加病毒液从而获得该材料对病毒滴度的影响,试验设计不考虑特定成品(如口罩),无法测试整只口罩的灭活效果,现如今,部分灭活口罩直接按照《gb2626
‑
2019呼吸防护自吸过滤式防颗粒物呼吸器》标准注册上市,将病毒灭活口罩各项性能指标降低到普通民用产品级别,与病毒灭活口罩的医疗用途完全不符。
4.为规范病毒灭活口罩的质量监管,促进其创新发展,增强人类对呼吸道传染病的防护能力,针对目前市面上已出现的病毒灭活口罩,亟需一种能有效评价病毒灭活口罩灭活效率的方法。
技术实现要素:
5.本发明的目的在于提供一种评价病毒灭活口罩对病毒灭活效率的方法,克服病毒灭活口罩的灭活效果无法评定的不足,实现对病毒灭活口罩病毒灭活效率的测定,有效推进病毒灭活口罩的质量监管及发展创新,增强对医护人员的保护及普通居民的安全防护,降低感染风险。
6.本发明提供的一种评价病毒灭活口罩对病毒灭活效率的方法,包括以下步骤:
7.s1.将宿主细胞感染病毒,加入培养基后置于co2培养箱培养,获得含病毒细胞,将含病毒细胞冻融、离心、取上清液、过滤,获得病毒悬液,备用;
8.s2.将宿主细胞加入细胞培养板,置于co2培养箱培养,获得宿主细胞板,备用;
9.s3.将口罩置于环境试验箱中进行温度预处理,恢复至室温,获得待测口罩,备用;
10.s4.将步骤s1得到的病毒悬液制备成气溶胶颗粒,模拟人体呼吸作用,使气溶胶颗粒与步骤s3得到的待测口罩充分接触,获得负载病毒的待测口罩;
11.s5.剪取步骤s4得到的负载病毒的待测口罩中心处材料作为样本,将样本浸于含胎牛血清的培养基中,获得病毒测试液;
12.s6.将病毒测试液进行连续10倍稀释,将稀释后的病毒测试液分别加入步骤s2得到的宿主细胞板中,获得培养板;
13.s7.将培养板置于co2培养箱培养,每日观察细胞病变情况,记录病变细胞孔的数目;
14.s8.将无杀菌和抗病毒成分的普通医用口罩作为阳性对照组,处理方法同步骤s3~s7;
15.s9.分别计算样品组和阳性对照组中病毒测试液的病毒滴度值,进而计算出病毒灭活口罩的灭活效率。
16.优选地,步骤s4在口罩灭活效率检测的预处理装置中进行,口罩灭活效率检测的预处理装置包括气雾室,气雾室的进口通过管道与雾化器的出口连接,气雾室的内部设有放样台,放样台位于气雾室的进口与气雾室的出口之间,气雾室的出口通过管道与呼吸模拟装置连接;
17.将待测口罩放置在放样台上,采用雾化器将步骤s1得到的病毒悬液制备成气溶胶颗粒,将气溶胶颗粒通过管道输送到气雾室中,与待测口罩的外表面充分接触,采用呼吸模拟装置模拟人体呼吸作用,使气溶胶颗粒与待测口罩充分接触,获得负载病毒的待测口罩。气溶胶颗粒与待测口罩充分接触时间优选10~30min,确保待测口罩负载病毒。
18.采用雾化器将制备好的病毒悬液雾化成直径为1~5μm的气溶胶颗粒,雾化量为2~10ml/min,将气溶胶颗粒通过管道输送到气雾室中,在气雾室的内部与待测口罩充分接触。
19.优选地,放样台与气雾室的内壁密封连接,放样台上设有放样口和环形夹具,放样口和环形夹具均为椭圆形。放样台与气雾室的内壁密封连接,避免气溶胶颗粒外泄,环形夹具与放样台铰接,通过环形夹具将待测口罩固定在放样口,使待测口罩与气溶胶颗粒充分接触。所述放样台上放置口罩,所述口罩的外表面朝向所述气雾室的进口,所述口罩的内表面朝向所述气雾室的出口;利用呼吸模拟装置模拟人体的呼吸使气溶胶颗粒与口罩内层充分接触,安全可靠。
20.优选地,呼吸模拟装置包括弹性气囊和气缸,弹性气囊的顶部设有挤压板,气缸的活塞杆与挤压板连接,气缸通过电磁阀与时间继电器连接;弹性气囊的排气量为300~700ml/次,弹性气囊的挤压频率为10~30次/min。采用气缸挤压弹性气囊,使弹性气囊内部的气体排出,压力消失后,弹性气囊自动吸气膨胀,模拟人体呼吸作用,代替真人模拟佩戴口罩时的状态,在安全的基础上保证测试结果的真实性。
21.优选地,所述气雾室的底部设有废液收集盒。采用直径为30cm的透明圆柱箱体作为气雾室,用于模拟大气环境,使含有病毒的气溶胶颗粒可以在气雾室的内部与口罩充分接触,通过废液收集盒收集气溶胶凝结后形成的液滴,防止气溶胶颗粒外泄,保证人们的安全,废液收集盒直接拧在气雾室的底部,方便拆卸。
22.优选地,步骤s1为:将宿主细胞感染病毒,加入培养基后置于37℃、5%的co2培养箱培养,次日起观察细胞病变情况,当细胞达到75~95%病变时获得含病毒细胞,将含病毒细胞在
‑
80℃的超低温冰箱完全冷冻后,置于37℃水浴锅融化,反复两次,在2800~3200rpm下离心13~17min,取上清液,采用0.22μm滤膜过滤,获得病毒悬液,备用;
23.步骤s2为:将宿主细胞以6
×
104个/ml的密度加入96孔细胞培养板,每孔0.1ml,置于37℃、5%的co2培养箱培养,获得宿主细胞板,备用。本发明方法适用于多种指示病毒和其对应的宿主细胞进行试验,采用6
×
104个/ml的密度接种细胞培养板,使细胞与病毒测试液接触后既有足够的量反应病变,又能给细胞留有生长空间,便于持续观察。
24.优选地,步骤s3为:将口罩置于环境试验箱中进行温度预处理,在67~73℃放置23~25h,在
‑
33~
‑
27℃放置23~25h,恢复至室温4h以上,获得待测口罩,备用。将口罩进行连续高低温处理,模拟口罩在极端运输或储存环境下对灭活效率的影响,将经温度预处理后的口罩恢复室温4h以上再进行后续处理,避免产生热冲击。
25.优选地,步骤s5为:剪取步骤s4得到的负载病毒的待测口罩中心处2cm
×
2cm的材料作为样本,将样本浸于10ml含10%胎牛血清的mem培养基中,在37℃、50~70prm条件下振荡50~70min,然后在2800~3200rpm条件下离心13~17min,取上清液,采用0.22μm滤膜过滤,获得病毒测试液;
26.步骤s6为:将病毒测试液进行连续10倍稀释,稀释倍数为10
‑1~10
‑8,将稀释后的病毒测试液分别加入步骤s2得到的宿主细胞板中的第1~8列,每孔0.1ml,每个稀释度做8孔重复,同时在宿主细胞板的第9列加入细胞培养液作为细胞对照组,每孔0.1ml,获得培养板。在负载病毒的待测口罩中心处剪取3块材料作为平行样本,分别制备病毒测试液进行检测,采用karber公式计算出每组病毒测试液的病毒滴度值,取平均值获得样品组的平均病毒滴度值,对灭活效率的检测结果更加准确。
27.优选地,步骤s7为:将培养板置于37℃、5%的co2培养箱培养,每日观察细胞病变情况,记录病变细胞孔的数目,连续观察直至细胞病变效应稳定。每个细胞板中病变细胞孔的数目以最后一次观察记录为结果。
28.优选地,步骤s9中,采用karber公式分别计算样品组和阳性对照组中病毒测试液的病毒滴度值:
29.lg tcid
50
=l
‑
d (s
‑
0.5)
30.病毒滴度的计算公式为:
[0031][0032]
其中,tcid
50
为病毒滴度,l为最高稀释度的对数,d为每组稀释度对数之间的差,s为阳性孔比率之和;
[0033]
计算待测口罩的病毒灭活效率,计算公式为:
[0034][0035]
将样品组和阳性对照组分别设置3个平行组,采用karber公式分别计算出每个平行组的病毒滴度值,分别取平均值获得样品组和对照组的平均病毒滴度值,进而计算出病毒灭活口罩的灭活效率。
[0036]
本发明所述的方法适用于各种指示病毒灭活效率的评价。步骤s1中的宿主细胞是根据所测试的病毒进行选择的,所测试的病毒为指示病毒。
[0037]
优选地,指示病毒为辛德毕斯病毒(sindbis),对应的宿主细胞为vero细胞。辛德毕斯病毒有包膜rna病毒,vero细胞为多种病毒的宿主细胞,适用于辛德毕斯病毒培养,在
‑
80℃的超低温冻融条件下能够使细胞壁快速、完全破解。
[0038]
优选地,步骤s1为:将对数生长期的vero细胞采用胰酶消化并计数后,加入含10%胎牛血清的mem培养基,调整细胞密度至5
×
105个/ml,获得细胞悬液,取15ml细胞悬液加入到t75细胞培养瓶后置于37℃、5%co2培养箱培养,当细胞达到90%汇合状态时,弃掉t75细胞培养瓶中的培养基,加入13~15ml含10%胎牛血清的mem培养基,继续培养细胞至超汇合状态;
[0039]
弃掉t75细胞培养瓶中的培养基,先往t75细胞培养瓶中加入1ml辛德毕斯病毒液,再加入3~4ml含10%胎牛血清的mem培养基,振摇t75细胞培养瓶使辛德毕斯病毒液与细胞充分接触后,将t75细胞培养瓶置于37℃、5%的co2培养箱孵育30min,向t75细胞培养瓶中加入25ml含10%胎牛血清的mem培养基后,将t75细胞培养瓶置于37℃、5%的co2培养箱培养,次日起观察细胞病变情况;
[0040]
当t75细胞培养瓶中的细胞达到75~95%病变时,将t75细胞培养瓶在
‑
80℃的超低温冰箱完全冷冻后,置于37℃水浴锅融化,反复两次,将t75细胞培养瓶内的液体置于50ml离心管,在2800~3200rpm下离心13~17min,取上清液,采用0.22μm滤膜过滤,获得病毒悬液。
[0041]
本发明的有益效果:
[0042]
(1)本发明方法能够实现对病毒灭活口罩灭活效率的测定,克服病毒灭活口罩的灭活效果无法评价的不足,有效推进病毒灭活口罩的发展创新,增强防护效果,降低感染风险。
[0043]
(2)本发明在口罩灭活效率检测的预处理装置中使气溶胶颗粒与待测口罩充分接触,获得负载病毒的待测口罩,所述口罩灭活效率检测的预处理装置能够将病毒悬液制备成气溶胶颗粒,使气溶胶颗粒与待测病毒灭活口罩充分接触,同时能够模拟人体呼吸作用,在安全的基础上保证测试结果的真实性。
附图说明
[0044]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0045]
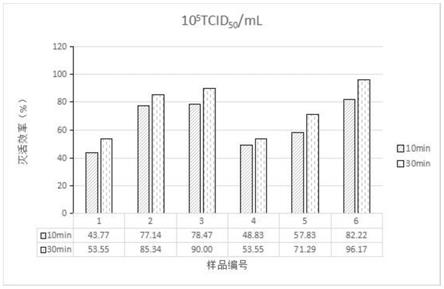
图1为本发明实施例1中制备的病毒悬液滴度为105tcid
50
/ml时,不同类型的口罩在不同测试时间下对辛德毕斯病毒灭活效率的柱状图;
[0046]
图2为本发明实施例1中制备的病毒悬液滴度为104tcid
50
/ml时,不同类型的口罩在不同测试时间下对辛德毕斯病毒灭活效率的柱状图;
[0047]
图3为本发明实施例1中测试时间为10min时,不同类型的口罩在不同病毒滴度下对辛德毕斯病毒灭活效率的柱状图;
[0048]
图4为本发明实施例1中测试时间为30min时,不同类型的口罩在不同病毒滴度下对辛德毕斯病毒灭活效率的柱状图;
[0049]
图5为本发明实施例中口罩灭活效率检测的预处理装置的结构图;
[0050]
图6本发明实施例中口罩灭活效率检测的预处理装置工作时的结构图;
[0051]
附图标记说明:
[0052]
图中:1
‑
雾化器、2
‑
气雾室、3
‑
放样台、4
‑
废液收集盒、5
‑
电磁阀、6
‑
时间继电器、7
‑
活塞杆、8
‑
气缸、9
‑
挤压板、10
‑
弹性气囊、11
‑
环形夹具、12
‑
放样口、13
‑
待测口罩。
具体实施方式
[0053]
应当指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明,除非另有指明,本发明使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。
[0054]
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0055]
实施例1
[0056]
以指示病毒为辛德毕斯病毒(sindbis virus)为例,一种评价病毒灭活口罩对病毒(辛德毕斯病毒)灭活效率的方法,对应的宿主细胞为vero细胞,包括以下步骤:
[0057]
s1.将对数生长期的vero细胞采用胰酶消化并计数后,加入含10%胎牛血清的mem培养基,调整细胞密度至5
×
105个/ml,获得细胞悬液,取15ml细胞悬液加入到t75细胞培养瓶后置于37℃、5%co2培养箱培养,当细胞达到90%汇合状态时,弃掉t75细胞培养瓶中的培养基,加入13ml含10%胎牛血清的mem培养基,继续培养细胞至超汇合状态;
[0058]
弃掉t75细胞培养瓶中的培养基,先往t75细胞培养瓶中加入1ml辛德毕斯病毒液,再加入3ml含10%胎牛血清的mem培养基,振摇t75细胞培养瓶使辛德毕斯病毒液与细胞充分接触后,将t75细胞培养瓶置于37℃、5%的co2培养箱孵育30min,向t75细胞培养瓶中加入25ml含10%胎牛血清的mem培养基后,将t75细胞培养瓶置于37℃、5%的co2培养箱培养,次日起观察细胞病变情况;
[0059]
当t75细胞培养瓶中的细胞达到75%病变时,将t75细胞培养瓶在
‑
80℃的超低温冰箱完全冷冻后,置于37℃水浴锅融化,反复两次,将t75细胞培养瓶内的液体置于50ml离心管,在2800rpm下离心13min,取上清液,采用0.22μm滤膜过滤,获得病毒悬液。
[0060]
s2.将vero细胞以6
×
104个/ml的密度加入96孔细胞培养板,每孔0.1ml,置于37℃、5%的co2培养箱培养,获得宿主细胞板,备用;
[0061]
s3.将口罩置于环境试验箱中进行温度预处理,在67℃放置23h,然后在
‑
33℃放置23h,恢复至室温4h,获得待测口罩,备用;
[0062]
s4.在口罩灭活效率检测的预处理装置中对步骤s3得到的待测口罩进行处理,如图5至图6所示,口罩灭活效率检测的预处理装置包括气雾室2,气雾室2的进口通过管道与雾化器1的出口连接,气雾室2的内部设有放样台3,放样台3与气雾室2的内壁密封连接,放
样台3位于气雾室2的进口与气雾室2的出口之间靠近出口的位置,放样台3上设有放样口12和环形夹具11,放样台3与环形夹具11铰接,放样口12与环形夹具11均为椭圆形,气雾室2的出口通过管道与呼吸模拟装置连接,气雾室2的底部设有废液收集盒4,能够随时拆卸;
[0063]
呼吸模拟装置包括弹性气囊10和气缸8,弹性气囊10的顶部设有挤压板9,气缸8的活塞杆7与挤压板9连接,气缸8通过电磁阀5与时间继电器6连接;
[0064]
将待测口罩13放置在放样台3,使待测口罩13覆盖在放样口12上,采用环形夹具11固定待测口罩13,待测口罩13的外表面朝向气雾室2的进口,采用雾化器1将步骤s1得到的病毒悬液制备成直径为1~5μm的气溶胶颗粒,雾化量为2ml/min,将气溶胶颗粒通过管道输送到气雾室2中,与待测口罩13的外表面充分接触,启动时间继电器6,时间继电器6控制电磁阀5启动,电磁阀5推动气缸8,气缸8的活塞杆7伸出,通过挤压板9挤压弹性气囊10,弹性气囊10的容积为1000ml,挤压频率为10次/min,使弹性气囊10内部的气体排出模拟人体呼气,排气量为300ml/次,时间继电器6的运行时间结束后控制电磁阀5关闭,气缸8的活塞杆7收缩,弹性气囊10上方的压力消失,弹性气囊10自动吸气膨胀模拟人体吸气,通过模拟人体的呼吸作用使气溶胶颗粒与待测口罩13充分接触10min,获得负载病毒的待测口罩;
[0065]
s5.在步骤s4得到的负载病毒的待测口罩中心处剪取3块2cm
×
2cm的材料作为平行样本,将样本分别浸于10ml含10%胎牛血清的mem培养基中,在37℃、50prm条件下振荡50min,然后在2800rpm条件下离心13min,取上清液,采用0.22μm滤膜过滤,获得病毒测试液;
[0066]
s6.将每份病毒测试液分别进行连续10倍稀释,稀释倍数为10
‑1~10
‑8,将稀释后的病毒测试液分别加入步骤s2得到的宿主细胞板中的第1~8列,每孔0.1ml,每个稀释度做8孔重复,同时在宿主细胞板的第9列加入细胞培养液作为细胞对照组,每孔0.1ml,获得培养板;
[0067]
s7.将培养板置于37℃、5%的co2培养箱培养,每日观察细胞病变情况,记录病变细胞孔的数目,连续观察直至细胞病变效应稳定;
[0068]
s8.将无杀菌和抗病毒成分的普通医用口罩作为阳性对照组,处理方法同步骤s3~s7;
[0069]
s9.每个细胞板中病变细胞孔的数目以最后一次观察记录为结果,采用karber公式分别计算出每个平行组的病毒滴度值,分别取平均值获得样品组和对照组的平均病毒滴度值,进而计算出病毒灭活口罩的灭活效率,karber公式为:
[0070]
lg tcid
50
=l
‑
d(s
‑
0.5)
[0071]
病毒滴度值的计算公式为:
[0072][0073]
其中,tcid
50
为病毒滴度,l为最高稀释度的对数,d为每组稀释度对数之间的差,s为阳性孔(cpe)比率之和;
[0074]
计算待测口罩的病毒灭活效率,计算公式为:
[0075][0076]
实施例2
[0077]
一种评价病毒灭活口罩对病毒(辛德毕斯病毒)灭活效率的方法,对应的宿主细胞为vero细胞,包括以下步骤:
[0078]
s1.将对数生长期的vero细胞采用胰酶消化并计数后,加入含10%胎牛血清的mem培养基,调整细胞密度至5
×
105个/ml,获得细胞悬液,取15ml细胞悬液加入到t75细胞培养瓶后置于37℃、5%co2培养箱培养,当细胞达到90%汇合状态时,弃掉t75细胞培养瓶中的培养基,加入14ml含10%胎牛血清的mem培养基,继续培养细胞至超汇合状态;
[0079]
弃掉t75细胞培养瓶中的培养基,先往t75细胞培养瓶中加入1ml辛德毕斯病毒液,再加入3.5ml含10%胎牛血清的mem培养基,振摇t75细胞培养瓶使辛德毕斯病毒液与细胞充分接触后,将t75细胞培养瓶置于37℃、5%的co2培养箱孵育30min,向t75细胞培养瓶中加入25ml含10%胎牛血清的mem培养基后,将t75细胞培养瓶置于37℃、5%的co2培养箱培养,次日起观察细胞病变情况;
[0080]
当t75细胞培养瓶中的细胞达到85%病变时,将t75细胞培养瓶在
‑
80℃的超低温冰箱完全冷冻后,置于37℃水浴锅融化,反复两次,将t75细胞培养瓶内的液体置于50ml离心管,在3000rpm下离心15min,取上清液,采用0.22μm滤膜过滤,获得病毒悬液。
[0081]
s2.将vero细胞以6
×
104个/ml的密度加入96孔细胞培养板,每孔0.1ml,置于37℃、5%的co2培养箱培养,获得宿主细胞板,备用;
[0082]
s3.将口罩置于环境试验箱中进行温度预处理,在70℃放置24h,然后在
‑
30℃放置24h,恢复至室温5h,获得待测口罩,备用;
[0083]
s4.在口罩灭活效率检测的预处理装置中对步骤s3得到的待测口罩进行处理,如图5至图6所示,口罩灭活效率检测的预处理装置包括气雾室2,气雾室2的进口通过管道与雾化器1的出口连接,气雾室2的内部设有放样台3,放样台3与气雾室2的内壁密封连接,放样台3位于气雾室2的进口与气雾室2的出口之间靠近出口的位置,放样台3上设有放样口12和环形夹具11,放样台3与环形夹具11铰接,放样口12与环形夹具11均为椭圆形,气雾室2的出口通过管道与呼吸模拟装置连接,气雾室2的底部设有废液收集盒4,能够随时拆卸;
[0084]
呼吸模拟装置包括弹性气囊10和气缸8,弹性气囊10的顶部设有挤压板9,气缸8的活塞杆7与挤压板9连接,气缸8通过电磁阀5与时间继电器6连接;
[0085]
将待测口罩13放置在放样台3,使待测口罩13覆盖在放样口12上,采用环形夹具11固定待测口罩13,待测口罩13的外表面朝向气雾室2的进口,采用雾化器1将步骤s1得到的病毒悬液制备成直径为1~5μm的气溶胶颗粒,雾化量为6ml/min,将气溶胶颗粒通过管道输送到气雾室2中,与待测口罩13的外表面充分接触,启动时间继电器6,时间继电器6控制电磁阀5启动,电磁阀5推动气缸8,气缸8的活塞杆7伸出,通过挤压板9挤压弹性气囊10,弹性气囊10的容积为1000ml,挤压频率为20次/min,使弹性气囊10内部的气体排出模拟人体呼气,排气量为500ml/次,时间继电器6的运行时间结束后控制电磁阀5关闭,气缸8的活塞杆7收缩,弹性气囊10上方的压力消失,弹性气囊10自动吸气膨胀模拟人体吸气,通过模拟人体的呼吸作用使气溶胶颗粒与待测口罩13充分接触20min,获得负载病毒的待测口罩;
[0086]
s5.在步骤s4得到的负载病毒的待测口罩中心处剪取3块2cm
×
2cm的材料作为平行样本,将样本分别浸于10ml含10%胎牛血清的mem培养基中,在37℃、60prm条件下振荡60min,然后在3000rpm条件下离心15min,取上清液,采用0.22μm滤膜过滤,获得病毒测试液;
[0087]
s6.将每份病毒测试液分别进行连续10倍稀释,稀释倍数为10
‑1~10
‑8,将稀释后的病毒测试液分别加入步骤s2得到的宿主细胞板中的第1~8列,每孔0.1ml,每个稀释度做8孔重复,同时在宿主细胞板的第9列加入细胞培养液作为细胞对照组,每孔0.1ml,获得培养板;
[0088]
s7.将培养板置于37℃、5%的co2培养箱培养,每日观察细胞病变情况,记录病变细胞孔的数目,连续观察直至细胞病变效应稳定;
[0089]
s8.将无杀菌和抗病毒成分的普通医用口罩作为阳性对照组,处理方法同步骤s3~s7;
[0090]
s9.每个细胞板中病变细胞孔的数目以最后一次观察记录为结果,采用karber公式分别计算出每个平行组的病毒滴度值,分别取平均值获得样品组和对照组的平均病毒滴度值,进而计算出病毒灭活口罩的灭活效率,karber公式为:
[0091]
lg tcid
50
=l
‑
d(s
‑
0.5)
[0092]
病毒滴度的计算公式为:
[0093][0094]
其中,tcid
50
为病毒滴度,l为最高稀释度的对数,d为每组稀释度对数之间的差,s为阳性孔(cpe)比率之和;
[0095]
计算待测口罩的病毒灭活效率,计算公式为:
[0096][0097]
实施例3
[0098]
一种评价病毒灭活口罩对病毒(辛德毕斯病毒)灭活效率的方法,对应的宿主细胞为vero细胞,包括以下步骤:
[0099]
s1.将对数生长期的vero细胞采用胰酶消化并计数后,加入含10%胎牛血清的mem培养基,调整细胞密度至5
×
105个/ml,获得细胞悬液,取15ml细胞悬液加入到t75细胞培养瓶后置于37℃、5%co2培养箱培养,当细胞达到90%汇合状态时,弃掉t75细胞培养瓶中的培养基,加入15ml含10%胎牛血清的mem培养基,继续培养细胞至超汇合状态;
[0100]
弃掉t75细胞培养瓶中的培养基,先往t75细胞培养瓶中加入1ml辛德毕斯病毒液,再加入4ml含10%胎牛血清的mem培养基,振摇t75细胞培养瓶使辛德毕斯病毒液与细胞充分接触后,将t75细胞培养瓶置于37℃、5%的co2培养箱孵育30min,向t75细胞培养瓶中加入25ml含10%胎牛血清的mem培养基后,将t75细胞培养瓶置于37℃、5%的co2培养箱培养,次日起观察细胞病变情况;
[0101]
当t75细胞培养瓶中的细胞达到95%病变时,将t75细胞培养瓶在
‑
80℃的超低温冰箱完全冷冻后,置于37℃水浴锅融化,反复两次,将t75细胞培养瓶内的液体置于50ml离心管,在3200rpm下离心17min,取上清液,采用0.22μm滤膜过滤,获得病毒悬液。
[0102]
s2.将vero细胞以6
×
104个/ml的密度加入96孔细胞培养板,每孔0.1ml,置于37℃、5%的co2培养箱培养,获得宿主细胞板,备用;
[0103]
s3.将口罩置于环境试验箱中进行温度预处理,在73℃放置25h,然后在
‑
27℃放置25h,恢复至室温6h,获得待测口罩,备用;
[0104]
s4.在口罩灭活效率检测的预处理装置中对步骤s3得到的待测口罩进行处理,如图5至图6所示,口罩灭活效率检测的预处理装置包括气雾室2,气雾室2的进口通过管道与雾化器1的出口连接,气雾室2的内部设有放样台3,放样台3与气雾室2的内壁密封连接,放样台3位于气雾室2的进口与气雾室2的出口之间靠近出口的位置,放样台3上设有放样口12和环形夹具11,放样台3与环形夹具11铰接,放样口12与环形夹具11均为椭圆形,气雾室2的出口通过管道与呼吸模拟装置连接,气雾室2的底部设有废液收集盒4,能够随时拆卸;
[0105]
呼吸模拟装置包括弹性气囊10和气缸8,弹性气囊10的顶部设有挤压板9,气缸8的活塞杆7与挤压板9连接,气缸8通过电磁阀5与时间继电器6连接;
[0106]
将待测口罩13放置在放样台3,使待测口罩13覆盖在放样口12上,采用环形夹具11固定待测口罩13,待测口罩13的外表面朝向气雾室2的进口,采用雾化器1将步骤s1得到的病毒悬液制备成直径为1~5μm的气溶胶颗粒,雾化量为10ml/min,将气溶胶颗粒通过管道输送到气雾室2中,与待测口罩13的外表面充分接触,启动时间继电器6,时间继电器6控制电磁阀5启动,电磁阀5推动气缸8,气缸8的活塞杆7伸出,通过挤压板9挤压弹性气囊10,弹性气囊10的容积为1000ml,挤压频率为30次/min,使弹性气囊10内部的气体排出模拟人体呼气,排气量为700ml/次,时间继电器6的运行时间结束后控制电磁阀5关闭,气缸8的活塞杆7收缩,弹性气囊10上方的压力消失,弹性气囊10自动吸气膨胀模拟人体吸气,通过模拟人体的呼吸作用使气溶胶颗粒与待测口罩13充分接触30min,获得负载病毒的待测口罩;
[0107]
s5.在步骤s4得到的负载病毒的病毒灭活口罩中心处剪取3块2cm
×
2cm的材料作为样品,将样品分别浸于10ml含10%胎牛血清的mem培养基中,在37℃、70prm条件下振荡70min,然后在3200rpm条件下离心17min,取上清液,采用0.22μm滤膜过滤,获得病毒测试液;
[0108]
s6.将每份病毒测试液分别进行连续10倍的稀释,稀释倍数为10
‑1~10
‑8,将稀释后的病毒测试液分别加入步骤s2得到的宿主细胞板中的第1~8列,每孔0.1ml,每个稀释度做8孔重复,同时在宿主细胞板的第9列加入细胞培养液作为细胞对照组,每孔0.1ml,获得培养板;
[0109]
s7.将培养板置于37℃、5%的co2培养箱培养,每日观察细胞病变,记录病变细胞孔的数目,连续观察直至细胞病变效应稳定;
[0110]
s8.将无杀菌和抗病毒成分的普通医用口罩做为阳性对照组,处理方法同步骤s3~s7;
[0111]
s9.每个细胞板中病变细胞孔的数目以最后一次观察记录为结果,采用karber公式分别计算出每个平行组的病毒滴度值,分别取平均值获得样品组和对照组的平均病毒滴度值,进而计算出病毒灭活口罩的灭活效率,karber公式为:
[0112]
lg tcid
50
=l
‑
d(s
‑
0.5)
[0113]
病毒滴度的计算公式为:
[0114][0115]
其中,tcid
50
为病毒滴度,l为最高稀释度的对数,d为每组稀释度对数之间的差,s为阳性孔(cpe)比率之和;
[0116]
计算待测口罩的病毒灭活效率,计算公式为:
[0117][0118]
测试例
[0119]
选取市场上6种不同品牌的具有病毒灭活功能的口罩,采用实施例1的测试方法进行对辛德毕斯病毒的灭活效率测试,口罩类型分别为1#~6#,将无杀菌和抗病毒成分的普通医用口罩作为阳性对照组,分别采用病毒滴度值为105tcid
50
/ml和104tcid
50
/ml的病毒悬液对每组口罩进行测试,步骤s4中气溶胶颗粒与待测口罩接触时间分别为10min和30min,测试结果见表1。
[0120]
表1
[0121]
[0122]
[0123][0124]
对表1数据进行整理,获得不同类型的口罩对辛德毕斯病毒灭活效率的柱状图:病毒悬液滴度为105tcid
50
/ml时,不同类型的口罩在不同测试时间下对辛德毕斯病毒灭活效率的柱状图见图1;病毒悬液滴度为104tcid
50
/ml时,不同类型的口罩在不同测试时间下对辛德毕斯病毒灭活效率的柱状图见图2;测试时间为10min时,不同类型的口罩在不同病毒悬液滴度下对辛德毕斯病毒灭活效率的柱状图见图3;测试时间为30min时,不同类型的口罩在不同病毒悬液滴度下对辛德毕斯病毒灭活效率的柱状图见图4。
[0125]
由上述试验结果可知:(1)病毒灭活口罩通过其添加的灭菌抗病毒成分发挥作用,相对于普通医用口罩,能够表现出不同程度的病毒灭活效果;(2)在相同滴度条件下,病毒悬液滴度为105tcid
50
/ml时,6种类型的口罩与病毒接触作用30min时的灭活效率均高于与病毒接触作用10min时的灭活效率;病毒悬液滴度为104tcid
50
/ml时,除类型为4#的口罩外,其它5种类型的口罩与病毒接触作用30min时的灭活效率均高于与病毒接触作用10min时的灭活效率,类型为4#的口罩与病毒接触作用30min时的灭活效率略低于与病毒接触作用10min时的灭活效率;(3)在不同病毒滴度条件下,口罩与病毒接触作用10min和30min组均表现出,病毒悬液滴度越小,口罩的灭活效率越高。
[0126]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1