一种制备亚砜类化合物的绿色方法
1.本发明涉及一种制备亚砜类化合物的绿色方法,属于绿色化学和有机合成技术领域。
背景技术:
2.硫化物常存在于生物和药物活性化合物中,硫化物的氧化是有机合成的关键反应之一,在化学和生物学方面具有重要的意义。
3.亚砜类化合物具有广谱生物活性,是一类重要的中间体,广泛应用于医药、农药、精细化工、有机合成等领域。有机硫化物的氧化是制备亚砜类化合物最常用的方法。
4.亚砜的制备通常需要使用大量的强氧化剂和催化剂。常用的氧化剂包括碘酸、间氯苯甲酸、次卤酸、高氯酸钠、铬酸、高锰酸钾等,但是使用这些强氧化剂,实验过程复杂、反应时间长、稳定性差、对环境不友好,过渡金属催化剂的使用也带来了严重的环境问题,随着对环境问题的日益关注,有毒有害氧化剂的使用将被逐渐淘汰。
5.因此,开发一种绿色环保、低价安全、适用范围广的制备亚砜类化合物的方法意义重大。
技术实现要素:
6.针对现有技术中存在的问题,本发明提供了一种制备亚砜类化合物的绿色方法,该方法简单高效、绿色环保、应用范围广泛,适于规模化生产。
7.本发明的技术方案如下:
8.在室温、敞口、中性条件下,以mbr
x
(m为fe
2+
、fe
3+
、ce
3+
等)为催化剂,过氧化氢为氧化剂,将原料硫化物氧化得到亚砜类化合物。
9.反应以有机硫化物为原料,所述原料硫化物的结构如式i所示:
[0010][0011]
其中r1、r2可为芳基、芳杂环、烷基、烯基、脂环烃、酯基、氰基、羧基等常见官能团。
[0012]
所述催化剂为febr2、febr3、cebr3以及feso
4-kbr、fecl
3-kbr、fe(no3)
3-kbr、ce(no3)
3-kbr、cecl
3-kbr、ce(otf)
3-kbr等金属(fe
2+
、fe
3+
、ce
3+
等)和溴化物的组合中的任意一种,催化剂与原料硫化物的摩尔比为0.05-0.5∶1
[0013]
所述反应所用过氧化氢浓度为3-30%,过氧化氢与原料硫化物的摩尔比为2-5∶1。
[0014]
所述反应于溶剂中进行,所用溶剂为四氢呋喃、乙腈、2-甲基四氢呋喃、乙醇、甲醇、叔丁醇。
[0015]
所述反应的较佳反应时间为0.1-1h。
[0016]
所述反应的处理方法为,反应结束后用na2s2o3溶液淬灭,采用有机溶剂(如乙酸乙
酯、二氯甲烷)萃取。收集有机相,无水硫酸钠干燥,过滤,浓缩,即得亚砜类化合物。
[0017]
本发明实现了以h2o2为氧化剂、mbr
x
(m为fe
2+
、fe
3+
、ce
3+
等)为催化剂的放大量制备亚砜类化合物的绿色方法,避免了使用昂贵且复杂的催化剂,降低了生产成本,反应条件温和,反应过程简单,产率高,安全环保,符合绿色化学理念,具有广阔的应用前景。
附图说明
[0018]
图1和图2是实施例1的1h-nmr及
13
c-nmr谱图
[0019]
图3和图4是实施例2的1h-nmr及
13
c-nmr谱图
[0020]
图5和图6是实施例3的1h-nmr及
13
c-nmr谱图
[0021]
图7和图8是实施例4的1h-nmr及
13
c-nmr谱图
[0022]
图9和图10是实施例5的1h-nmr及
13
c-nmr谱图
[0023]
图11和图12是实施例6的1h-nmr及
13
c-nmr谱图
[0024]
图13和图14是实施例7的1h-nmr及
13
c-nmr谱图
[0025]
图15和图16是实施例8的1h-nmr及
13
c-nmr谱图
[0026]
图17和图18是实施例9的1h-nmr及
13
c-nmr谱图
[0027]
图19和图20是实施例10的1h-nmr及
13
c-nmr谱图
[0028]
图21和图22是实施例11的1h-nmr及
13
c-nmr谱图
具体实施方式
[0029]
下面结合具体实施例对本发明进行进一步说明。以下实施例只用于解释本发明,但不应解释为限制本发明的范围。应当指出的是,在不脱离本发明构思的前提下,对本发明公开的内容可以做出若干调整和改进,这些都属于本发明的保护范围。
[0030]
实施例1:
[0031][0032]
将2-甲基四氢呋喃36ml、1a(1g,7.23mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(0.72mmol,0.27g),h2o2水溶液(30%,21.7mmol,2.22ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物1b(产率:99.4%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:7.67-7.58(m,2h),7.55-7.43(m,3h),2.71(d,j=0.7hz,3h).
13
c-nmr(100mhz,cdcl3)δ:145.75,131.03,129.36,123.49,43.98.
[0033]
实施例2:
[0034][0035]
将2-甲基四氢呋喃32ml、2a(1g,6.48mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(0.65mmol,0.25g),h2o2水溶液(30%,19.4mmol,1.99ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物2b(产率:97.1%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:7.66-7.48(m,2h),7.15-6.88(m,2h),3.84(s,3h),2.68(s,3h).
13
c-nmr(100mhz,cdcl3)δ:161.98,136.66,125.46,114.86,55.54,44.03.
[0036]
实施例3:
[0037][0038]
将2-甲基四氢呋喃40ml、3a(1g,8.05mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(0.81mmol,0.31g),h2o2水溶液(30%,24.15mmol,2.47ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物3b(产率:99.4%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:2.71(d,j=0.7hz,3h),7.43-7.55(m,3h),7.58-7.67(m,2h).
13
c-nmr(100mhz,cdcl3)δ:145.75,131.03,129.36,123.49,43.98.
[0039]
实施例4:
[0040][0041]
将2-甲基四氢呋喃24ml、4a(1g,4.67mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加cebr3(0.47mmol,0.18g),h2o2水溶液(30%,14.0mmol,1.43ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物4b(产率:97.0%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:7.43-7.15(m,5h),3.99-3.76(m,2h).
13
c-nmr(100mhz,cdcl3)δ:130.15,128.98,128.38,77.26,57.30.
[0042]
实施例5:
[0043][0044]
将2-甲基四氢呋喃25ml、5a(1g,4.92mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(0.49mmol,0.19g),h2o2水溶液(30%,14.8mmol,1.5ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物5b(产率:97.2%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:7.73-7.56(m,1h),7.56-7.42(m,1h),2.71-2.65(m,1h).
13
c-nmr(100mhz,cdcl3)δ:144.88,132.57,125.45,125.16,43.98.
[0045]
实施例6:
[0046][0047]
将2-甲基四氢呋喃25ml、6a(1g,4.92mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(0.49mmol,0.19g),h2o2水溶液(30%,14.8mmol,1.5ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物6b(产率:98.7%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:7.80(t,j=1.8hz,1h),7.64-7.59(m,1h),7.54(d,j=8.5hz,1h),7.39(t,j=7.9hz,1h),2.73(s,3h).
13
c-nmr(100mhz,cdcl3)δ:148.04,134.13,130.85,126.49,123.62,122.09,44.08.
[0048]
实施例7:
[0049][0050]
将2-甲基四氢呋喃25ml、7a(1g,4.92mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(0.49mmol,0.19g),h2o2水溶液(30%,14.8mmol,1.5ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物7b(产率:96.7%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:7.93(dd,j=7.7,1.6hz,1h),7.67-7.46(m,2h),7.35(td,j=7.8,1.7hz,1h),2.80(s,3h).
13
c-nmr(100mhz,cdcl3)δ:145.40,132.93,132.28,128.75,125.70,118.43,41.92.
[0051]
实施例8:
[0052][0053]
将2-甲基四氢呋喃28ml、8a(1g,5.49mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(0.55mmol,0.21g),h2o2水溶液(30%,16.5mmol,1.68ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物8b(产率:98.3%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:7.67(dd,j=8.7,1.9hz,1h),7.33-7.22(m,1h),2.73(d,j=2.0hz,2h),2.33(d,j=2.0hz,2h).
13
c-nmr(100mhz,cdcl3)δ:152.70,142.87,124.96,122.76,44.11.
[0054]
实施例9:
[0055][0056]
将2-甲基四氢呋喃36ml、9a(1g,7.23mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(0.72mmol,0.27g),h2o2水溶液(30%,21.7mmol,2.22ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物9b(产率:98.4%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:7.76-7.31(m,2h),3.19-2.37(m,1h),1.18(td,j=7.4,1.7hz,1h).
13
c-nmr(100mhz,cdcl3)δ:143.36,130.92,129.14,124.18,50.31,5.97.
[0057]
实施例10:
[0058][0059]
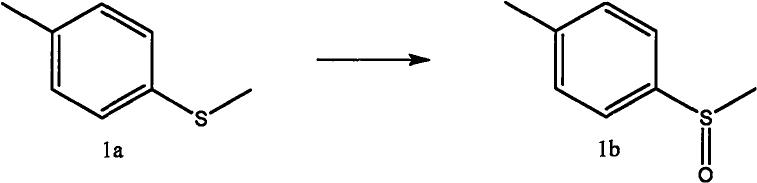
将2-甲基四氢呋喃30ml、10a(1g,6.02mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(0.60mmol,0.23g),h2o2水溶液(30%,18.1mmol,1.84ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物10b(产率:92%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:7.52(d,j=8.3hz,2h),7.31(d,j=7.8hz,2h),2.68(s,3h),2.40(s,3h).
13
c-nmr(100mhz,cdcl3)δ:142.51,141.52,130.04,123.55,44.02,21.41.
[0060]
实施例11:
[0061][0062]
将2-甲基四氢呋喃27ml、11a(1g,5.37mmol)依次加入圆底烧瓶中,搅拌均匀,然后向二者混合物中依次加入cebr3(0.54mmol,0.20g),h2o2水溶液(30%,16.1mmol,1.65ml),在室温下搅拌反应0.5h。反应完成后用na2s2o3溶液(0.1m)淬灭反应,用乙酸乙酯萃取。合并有机相后,无水硫酸钠干燥,过滤,减压浓缩,即可得目标产物11b(产率:81.5%)。该化合物的表征数据如下:1h-nmr(400mhz,cdcl3)δ:7.64(dt,j=7.0,2.6hz,2h),7.54-7.37(m,3h).
13
c-nmr(100mhz,cdcl3)δ:145.65,131.06,129.34,124.80.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1