靶向ANP32A抗白血病的小分子肽及其制备方法和应用
靶向anp32a抗白血病的小分子肽及其制备方法和应用
技术领域
1.本发明属于生物医药技术领域,具体涉及一种靶向anp32a抗白血病的小分子肽h3bp及其制备方法和应用。
背景技术:
2.白血病是血液系统一种恶性肿瘤,主要是起源于骨髓中造血干/祖细胞的恶性克隆性扩增。其中一类以髓系细胞恶性增殖为特征,发病急促,这类白血病被称为为急性髓系白血病(aml);表现为克隆性增殖的、异常分化或低分化的髓系造血细胞在骨髓、血液和其他组织中的广泛浸润(short et al.,2018)。随着人们对白血病认识的不断深入和科技医疗水平的进步,其干预和治疗的效果在本世纪以来有了很大的突破,部分类型白血病5年生存率甚至可以达到90%,但总体治愈率只有30
‑
40%左右。同时,白血病的细胞遗传学有显著异质性,与多种不良预后类型的白血病密切相关,其临床治疗效果依然不容乐观。驱动白血病发生的遗传变异中表观遗传修饰是影响白血病起始、发生和发展的关键因素之一,而组蛋白乙酰化是表观遗传修饰的一个重要内容,在白血病发生、发展和治疗中的作用及意义并未得到充分认识,靶向组蛋白乙酰化干预白血病的策略依然面临诸多挑战(greenblatt and nimer,2014)。
3.酸性核磷蛋白32家族成员a(anp32a)是酸性核磷蛋白32kda(acid nuclear phosphoprotein 32kda)家族成员,抑制组蛋白乙酰化修饰,并且在多种实体瘤中高表达(reilly et al.,2014;brody et al.,2004;zhu et al.,2010)。不久前,我们的研究发现,不仅在实体瘤病人细胞,在急性髓系白血病和急性淋巴细胞白血病病人细胞中anp32a也异常高表达,且anp32a是白血病和一些实体瘤细胞增殖、生存所必需的;anp32a可以通过调控组蛋白h3的乙酰化(acetyl
‑
h3)调控关键通路,维持白血病细胞异常增殖和生存(yang et al.,2018)。我们的研究首次揭示了anp32a在白血病中作为致癌因子发挥功能。其他研究者也对anp32a表达在白血病中的预后意义进行了评估,发现anp32a作为高危因素,与各种预后不良显著相关(huang et al.,2020)。因此,有望通过靶向anp32a来干预白血病和肿瘤的发生发展,为白血病甚至其他癌症的治疗提供新思路。
技术实现要素:
4.有鉴于此,发明目的是针对上述问题,提供一种靶向anp32a抗白血病的小分子肽及其制备方法和应用,即通过一种小分子药物组合物穿膜肽融合组蛋白3结合肽(histone 3
‑
binding peptide,h3bp)的小分子肽的制备方法及其在抗白血病中的应用。通过将穿膜肽与h3bp融合的方式,利用细胞穿膜肽能携带外源蛋白进入细胞的穿膜特性,将h3bp高效的带入细胞内,从而竞争性抑制anp32a对相关白血病甚至肿瘤发生的促进作用,有效干预其发生和进展。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.优选的,本发明提供的抑制白血病细胞生长的功能肽段h3bp能够干预anp32a与组
蛋白结合,包括把所述的氨基酸序列从包括该片段的任意位置截取成的氨基酸组成与所述短肽具有同样生物活性和功能的短肽。
7.本发明提供了一种靶向anp32a抗白血病的小分子多肽h3bp,优选的,该多肽是具有seq id no.1氨基酸序列的多肽,o代表氨基酸k或r;j代表氨基酸d或e或y或k;b代表氨基酸l或y;u代表氨基酸v或m
8.seq id no.1:
9.rddoeapdsdaegbuegljjjjjdjjeejjjedaqvvede。
10.本发明提供了一种涉及编码该多肽的多核苷酸,它包含选自下组的一种核苷酸序列或其变体:(a)编码具有seq id no.1氨基酸序列多肽的多核苷酸;
11.(b)与多核苷酸(a)互补的多核苷酸;
12.(c)与(a)或(b)的多核苷酸序列具有保守性或同源性的多核苷酸,最优的,与所述多核苷酸序列最少50%同源性的多核苷酸,如与本发明所述多肽同源的anp32家族其它成员(anp32b/anp32c/anp32d/anp32e)的编码序列。
13.最优的,该多核苷酸序列是具有如seq id no.2所示编码该多肽的序列b代表核苷酸c、g或t;d代表核苷酸a、g或t;h代表核苷酸a、c或t;k代表核苷酸g或t;m代表核苷酸a或c;n代表核苷酸a、c、g或t;r代表核苷酸a或g;s代表核苷酸c或g;v代表核苷酸a、c或g;w代表核苷酸a或t;y代表核苷酸c或t。
14.seq id no.2:
15.cgngaygaymrngargcnccngaytcngaygcngarggnywnrtngarggnctngaygaygargargargayrargangargargarkangaykangangcncargtngtngargaygan。
16.本发明还涉及上述描述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽或多肽的片段、类似物和衍生物。次或核苷酸的变异体可以使天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知道的,等位变异体是一个或多个核苷酸的取代、缺失或插入,但不会实质上改变其编码的多肽的功能。
17.本发明另外涉及一种含有本发明多核苷酸的载体,特别是表达载体;一种用该载体遗传工程化的宿主细胞,包括转化、转导或转染的宿主细胞;一种包括培养所述宿主细胞和回收表达产物制备本发明所述多肽的方法。
18.本发明提供了一种药物组合物,它含有:
19.(a)上述短肽h3bp或包含该序列的与所述短肽具有同样生物活性及功能的短肽或其模拟物、激活剂、拮抗剂;和
20.(b)药学上可接受的载体或赋形剂。
21.优选的,本发明提供的一种药物组合物为抑制癌细胞生长的小分子融合肽/融合蛋白,所述融合蛋白的结构为:n端
‑
细胞穿膜肽
‑
h3bp
‑
c端。
22.优选的,本发明提供的上述药物组合物穿膜肽
‑
h3bp融合蛋白(cpps
‑
h3bp),所述细胞穿膜肽位于anp32a的组蛋白结合肽段h3bp的n端。所述细胞穿膜肽包括:tat以及其他的功能上与tat穿膜肽功能相似的、靶向性或非靶向性的药物递送载体和工具及其类似物,包括黑腹果蝇触足肽、fhv外壳蛋白、小分子寡聚精氨酸、小分子寡聚赖氨酸、map等。
23.所列举的药物递送工具中:
24.tat氨基酸序列如下所示:tat(ygrkkrrqrrr);
25.黑腹果蝇触足肽氨基酸序列如下所示:antp(rqikiyfqnrrmkwkk);
26.fhv外壳蛋白氨基酸序列如下所示:(rrrrnrtrrnrrrvr);
27.小分子寡聚精氨酸氨基酸序列如下所示:[(r)n];
[0028]
小分子寡聚赖氨酸氨基酸序列如下所示:[(k)n];
[0029]
map氨基酸序列如下所示:(klalklalkalkaalkla)。
[0030]
优选的,本发明提供的上述药物组合小分子多肽的制备方法采用化学合成的方法,即本领域熟知的已经非常成熟的固相肽合成方法,既可以采用boc方法也可以采用fmoc方法。具体做法就是将被保护的氨基酸逐个偶联到惰性固相载体上去,然后利用强酸将肽链从载体上裂解下来,同时去除侧链保护。
[0031]
优选的,本发明提供了所述药物组合小分子多肽依赖其功能肽段h3bp竞争性抑制促癌因子anp32a药物功能的应用。
[0032]
优选的,本发明提供了所述药物组合小分子多肽依赖其功能肽段h3bp在抑制白血病细胞系增殖方面的药物功能的应用。
[0033]
优选的,本发明提供了所述药物组合小分子多肽依赖其功能肽段h3bp在抑制人白血病细胞系thp1的裸鼠皮下移植瘤增殖和恶化方面的药物功能的应用。
[0034]
优选的,本发明提供了所述药物组合小分子多肽依赖其功能肽段h3bp对6133mpl w515l细胞构建小鼠白血病模型中的发病潜能、生存、恶化及死亡等抑制作用的药物功能的应用。
[0035]
优选的,本发明提供了所述药物组合小分子多肽依赖其功能肽段h3bp在抑制白血病病人原代白血病细胞增殖方面的药物功能的应用。
[0036]
本发明的优选例中提供了一种以所述基因药物为有效成分与药学上可接受的载体组成的药物组合。
[0037]
本发明提供了将上述组合用于制备抑制白血病和肿瘤的药物。
[0038]
本发明的研究证明了:在白血病和肿瘤模型中,所述药物组合小分子多肽功能肽段h3bp具有抑制白血病病人细胞和白血病细胞系增殖、白血病发病潜能、白血病恶化和转移、提高白血病存活率的作用。
[0039]
本发明相对于现有技术具有如下优点和有益效果:
[0040]
1、anp32a是白血病及肿瘤中的关键的促癌基因,因此靶向anp32a治疗白血病甚至肿瘤具重要意义。本发明提供了功能肽段h3bp,证明了h3bp能竞争性抑制anp32a的功能,为anp32a相关疾病的干预和治疗提供了新思路。
[0041]
2、本发明提供了一种新型的药物组合,即利用药物递送工具穿膜肽融合功能肽段h3bp,将h3bp带入细胞发挥功能。新型多肽h3bp与细胞穿膜肽tat组成的融合多肽能有效抑制白血病和肿瘤的发展,证明靶向anp32a的小分子肽h3bp具有抑制白血病细胞生长的生物学效应,也说明除了穿膜肽tat外,其他有类似穿膜功能的多肽或者分子也可能用于帮助有生物活性的的h3bp穿透细胞膜。
[0042]
3、由穿膜肽tat和功能肽h3bp组成的融合多肽加入培养细胞和应用于动物,没有观察到明显的毒性,表明其对异常的白血病细胞有明显的杀伤作用,对正常细胞毒副作用低。
[0043]
4、融合多肽能有效抑制人白血病细胞thp1异种移植瘤和小鼠6133细胞amkl白血病模型的进展,证明该融合多肽在白血病甚至肿瘤疾病的治疗方面具有高效、广谱等优点。
[0044]
5、基于肽段h3bp在抑制白血病和肿瘤中的作用,其可以用于制备预防、缓解和/或治疗白血病和肿瘤的药物。
附图说明:
[0045]
图1是本发明通过his
‑
pull
‑
down及蛋白免疫印迹试验,验证tat
‑
h3bp或tat多肽是否可以竞争性抑制anp32a蛋白与组蛋白h3(6xhis
‑
h3)结合的结果图。
[0046]
图2是本发明通过细胞计数,验证tat
‑
h3bp给药组和穿膜肽tat对照组处理白血病细胞是否有效抑制各白血病细胞系增殖而获得的细胞增殖曲线图。
[0047]
图3是本发明通过裸鼠的thp1异种皮下移植瘤以及瘤内注射穿膜肽tat和tat
‑
h3bp融合小分子肽试验,验证tat穿膜肽携带h3bp肽段对thp1异种皮下移植瘤发展的抑制效果图。
[0048]
图4是本发明通过裸鼠的thp1异种皮下移植瘤以及瘤内注射穿膜肽tat和tat
‑
h3bp融合小分子肽试验后,小分子肽tat
‑
h3bp对皮下移植瘤的瘤体体积抑制效果的统计结果图。
[0049]
图5是本发明通过裸鼠的thp1异种皮下移植瘤以及瘤内注射穿膜肽tat和tat
‑
h3bp融合小分子肽试验后,验证小分子肽tat
‑
h3bp对皮下移植瘤的瘤体病理发展的影响而进行的肿瘤恶性标记物ki
‑
67免疫组化染色的结果图。
[0050]
图6是本发明通过穿膜肽tat和融合肽tat
‑
h3bp处理的小鼠白血病细胞系6133mpl w515l细胞构建小鼠急性巨核细胞白血病模型,模型发病后的肝脏和脾脏解剖结果图。
[0051]
图7是本发明通过穿膜肽tat和融合肽tat
‑
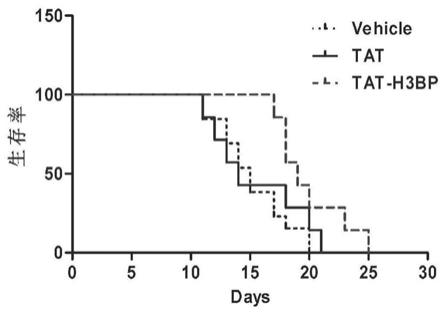
h3bp处理的小鼠白血病细胞系6133mpl w515l细胞构建小鼠急性巨核细胞白血病模型,各组模型小鼠的生存率统计结果图。
[0052]
图8是本发明通过穿膜肽tat和融合肽tat
‑
h3bp处理白血病病人骨髓或外周血单个核细胞后,细胞计数获得的白血病病人骨髓或外周血单个核细胞的细胞增殖曲线结果图。
具体实施方式
[0053]
通过以下详细说明结合附图可以进一步理解本发明的优点和特点,所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。下列所有列举实施例所涉及的所有合成药物组合小分子多肽穿膜肽
‑
靶向anp32a抗白血病的小分子肽h3bp融合多肽(tat
‑
h3bp)都具有本发明涉及的药物功能而不限于所列举功能。
[0054]
实施例1:
[0055]
靶anp32a抗白血病的小分子肽h3bp竞争性抑制anp32a的pull
‑
down试验
[0056]
a.anp32a蛋白的获取,步骤如下:细胞裂解液裂解表达anp32a的细胞,离心,去除细胞膜等沉淀,取上清,即含有anp32a的蛋白液。
[0057]
b.原核表达纯化的6xhis标签标记的组蛋白h3(6xhis
‑
h3)与ni
‑
nta resin镊珠(dp101
‑
01,全式金)共同孵育过夜,得到复合物1。6xhis
‑
h3可以通过his标签与ni
‑
nta resin镊珠的亲和力与镊珠进行偶联。
[0058]
c.将不同浓度的小分子肽tat
‑
h3bp(0、0.25、0.5、1mg/l)、anp32a蛋白液和复合物1共同孵育,tat作为阴性对照。
[0059]
d.孵育之后,通过离心获得复合物。清洗后,用sds
‑
page分离复合物上结合的重组蛋白,银染显现重组蛋白条带分布,观察游离不同浓度的小分子肽tat或tat
‑
h3bp的加入是否会减少与6xhis
‑
h3结合的anp32a蛋白。
[0060]
e.实验结果:随着tat
‑
h3bp加入浓度的提高,与6xhis
‑
h3结合的anp32a蛋白明显减少,而tat的加入无影响,证明h3bp可以与anp32a竞争结合复合物上的组蛋白h3(图1)。
[0061]
通过上述的具体技术措施,验证了tat
‑
h3bp的功能肽段为h3bp,确保了h3bp靶向anp32a结果的可靠性,从而准确地确定h3bp竞争性抑制anp32a功能效应的分子起始事件,为tat
‑
h3bp干预癌症的机理提供深入的解释。
[0062]
实施例2:
[0063]
小分子肽tat
‑
h3bp抑制白血病细胞的试验
[0064]
a.人白血病细胞系thp1、hl60、k562、6133细胞的培养是用含有10%新生牛血清的rpmi 1640培养基来培养,以105/孔的细胞密度种植入24孔细胞板.
[0065]
b.把本实验涉及的融合肽(tat
‑
h3bp)和对照多肽(穿膜肽tat和不融合穿膜肽的h3bp)按照合适的浓度加入到细胞培养板中,以等体积的pbs为空白对照组(vehicle),24、
[0066]
48和72小时后分别进行细胞计数即细胞增殖检测。
[0067]
c.实验结果:tat
‑
h3bp给药组和对照组比较,获得白血病细胞的抑制效果。tat
‑
h3bp有效抑制白血病细胞的增殖,而tat和h3bp对照组则无抑制效果。如图2所示。
[0068]
通过上述的具体技术措施,验证了穿膜肽tat携带融合的h3bp的功能肽段进入细胞,而进入细胞的穿膜肽tat和不能进入细胞的不融合穿膜肽的h3bp对白血病细胞增殖无效,确保了穿膜肽携带h3bp在细胞内发挥抑制白血病增殖结果的可靠性。
[0069]
实施例3:
[0070]
小分子肽tat
‑
h3bp抑制thp1小鼠皮下移植瘤的体内试验
[0071]
a.实验动物:spf级balb/c nude裸小鼠,共17只,由北京维通利华实验动物技术有限公司提供,实验小鼠生产许可证号为:syxk(京)2017
‑
0033。鼠龄6
‑
7周,体重18
‑
20g,用垫料、饮水、全价颗粒饲料及其他与动物接触的物品均经高压灭菌处理。实验和饲养条件严格按照spf级规范要求。所有动物实验均经武汉大学生命科学学院动物关爱与利用委员会批准。
[0072]
b.为了进行皮下实体瘤实验,如前所述,将thp1细胞注射到balb/c裸鼠右侧背部近腋部皮下,压迫伤口,无出血。
[0073]
c.将小鼠放入小鼠ivc系统饲养,大约两周后,当肿瘤约为30mm3时,携带肿瘤的小鼠被随机分为三个实验组:4只;7只;6只,并分别给予pbs(vehicle组)、tat或tat
‑
h3bp融合蛋白(2mg/ml,0.1ml)瘤内注射,每隔三天测量一次肿瘤的体积。10天后,每周注射2次,持续3周后,将裸鼠处死。
[0074]
d.肉眼观察脏器转移情况(包括肝、脾、肺、肾、局部及远处淋巴结)等;解剖移植模型,取皮下移植瘤标本,拍照;皮下瘤标本4%甲醛固定,石蜡包埋,进行免疫组化病理检测(ki67免疫组化)。
[0075]
e.实验结果:
[0076]
1、皮下移植瘤的生长情况:相比于pbs(vehicle组),tat
‑
h3bp融合蛋白瘤内注射明显缩小了thp1皮下移植瘤的体积,而对照多肽tat对肿瘤大小无影响(图3);每周注射2次,持续注射3后,tat
‑
h3bp融合蛋白瘤内注射组的thp1皮下移植瘤的大小明显小于vehicle组,而对照多肽组无影响(图4)。
[0077]
2、皮下移植瘤的免疫组化结果:pbs对照和tat多肽瘤内注射组的thp1皮下移植瘤的肿瘤增殖标记物ki
‑
67的染色较深,肿瘤组织细胞形态完好,与thp1细胞形态一致;而tat
‑
h3bp融合多肽给药组皮下瘤的ki
‑
67的染色减少,出现细胞核皱缩,组织形态和细胞形态异常等凋亡改变(图5)。
[0078]
通过上述的具体技术措施,验证了穿膜肽tat携带融合的h3bp的功能肽段进入thp1异种皮下移植瘤细胞并抑制移植瘤的恶化和发展,而进入细胞的穿膜肽tat和不能进入细胞的未融合穿膜肽的h3bp对thp1异种皮下移植瘤的发展无效,确保了穿膜肽携带h3bp在肿瘤发挥抑制肿瘤细胞增殖结果的可靠性,暗示了小分子肽tat
‑
h3bp的治疗潜能。
[0079]
实施例4:
[0080]
小分子肽tat
‑
h3bp抑制小鼠6133mplw515l细胞白血病模型进展的体内实验
[0081]
a.实验动物:spf级c57bl小鼠,共23只,由北京维通利华实验动物技术有限公司提供,实验小鼠生产许可证号为:syxk(京)2017
‑
0033。鼠龄6
‑
7周,体重18
‑
20g,雌性,用垫料、饮水、全价颗粒饲料及其他与动物接触的物品均经高压灭菌处理。实验和饲养条件严格按照spf级规范要求。所有动物实验均经武汉大学生命科学学院动物关爱与利用委员会批准。
[0082]
b.mpl基因w515l突变永生化的6133小鼠急性巨核细胞白血病细胞系(6133mpl w515l),用含有10%新生牛血清的rpmi 1640培养基来培养。
[0083]
c.把本实验涉及的融合肽(tat
‑
h3bp)、对照多肽穿膜肽tat、等体积的pbs空白对照组(vehicle)按照合适的浓度处理6133mplw515l细胞,处理12小时。
[0084]
d.实验c57bl小鼠亚致死辐射(4.5gy),随机分为4组(辐照组:2只;vehicle组:7只;tat组:7只;tat
‑
h3bp组:7只),通过尾静脉注射的方式,按对应的分组分别注射200ul pbs重悬的vehicle、tat、tat
‑
h3bp处理过的6133mpl w515l细胞(1
×
106个/只),辐照对照组注射200ul pbs。
[0085]
e.将小鼠放入小鼠ivc系统饲养,每日观察发病状况。
[0086]
f.实验结果
[0087]
1.观察小鼠发病状况:发现注射pbs和对照穿膜肽tat处理过的6133mplw515l细胞组小鼠最先发病(约2周左右),表现为巨核系白血病典型的弓背、消瘦、食欲不振、行动迟缓等症状。而tat
‑
h3bp处理组2周时无明显发病表型,且发病时间延迟到约3周以后。
[0088]
2.解剖学观察:注射后2周左右,随机挑取每组小鼠,处死,解剖。发现如图6所示,pbs和tat组小鼠脏器出现明显的发病表型:脾脏肿大且质地不均一、肝脏发白(贫血状),而tat
‑
h3bp处理组小鼠具有较轻的发病表型:脾脏肿大、肝脏略白。
[0089]
3.生存率统计:发现相比于注射pbs和对照穿膜肽tat处理过的6133mplw515l细胞组小鼠组,tat
‑
h3bp处理组的小鼠明显延迟了巨核细胞白血病模型的发病时间,延长了小鼠的生存时间,具有较高的生存率,如图7所示。
[0090]
通过上述的具体技术措施,验证了穿膜肽tat携带融合的h3bp的功能肽段抑制了白血病细胞系6133mplw515l细胞在小鼠体内发展为白血病的潜能,而进入细胞的穿膜肽
tat和不能进入细胞的未融合穿膜肽的h3bp对6133mplw515l细胞在小鼠白血病模型中的发生发展潜能无效,确保了穿膜肽携带h3bp在小鼠白血病模型中发挥抑制白血病进展结果的可靠性。
[0091]
实施例5:
[0092]
小分子肽tat
‑
h3bp抑制白血病病人的原代白血病细胞增殖的试验
[0093]
a.采用ficoll
‑
hypaque密度梯度离心的方法从白血病病人捐赠者的骨髓或外周血样本中分离单核细胞(pbmcs)。所有涉及人体血液样本的实验均通过华中科技大学同济医学院协和医院医学伦理委员会批准。从每位患者和健康供体获得同意书。
[0094]
b.新鲜的骨髓或外周血全血样本,1:2的比例pbs稀释。混匀后,4:1的比例加入0.5%甲基纤维素,充分混匀后,室温静置30
‑
60分钟,待红细胞沉降界限分明。
[0095]
c.取上清液,2000转室温离心10分钟。
[0096]
d.弃上清,加1ml的pbs重悬细胞沉淀。将细胞悬液延管壁缓慢匀速的加入到事先准备好的加入1.2
‑
1.5ml ficoll
‑
hypaque分离液的离心管,2000转室温离心30分钟,关掉离心机的brake功能。
[0097]
e.30分钟后,体系出现分层:上清血浆
‑
中间白色沉淀单个核细胞
‑
下层粒细胞
‑
管底红细胞,弃上层血浆,吸取中间层白色沉淀,即单个核细胞。
[0098]
f.5ml pbs洗单个核细胞,1800转离心10分钟,洗去ficoll
‑
hypaque。
[0099]
g.5ml pbs洗单个核细胞,1200转离心10分钟,洗去血小板。
[0100]
h.用含有10%新生牛血清的rpmi 1640培养基加人源重组细胞因子il
‑
3、il
‑
6、scf(外周血:10ng/ml;骨髓:100ng/ml)来培养分离的白血病病人单个核细胞,活化过夜。
[0101]
i.次日,将活化后的白血病病人骨髓或外周血单个核细胞分别用本实验涉及的融合肽(tat
‑
h3bp)和对照多肽(穿膜肽tat)按照合适的浓度加入到细胞培养板中,以等体积的pbs为空白对照组(vehicle),处理12小时。
[0102]
j.弃多肽,每孔1x105个i中处理的细胞种到24孔板,每组3个复孔,每日进行细胞计数,持续5天以上。
[0103]
k.实验结果:tat
‑
h3bp给药组和对照组比较,获得白血病病人骨髓或外周血单个核细胞的抑制效果。tat
‑
h3bp有效抑制白血病病人骨髓或外周血单个核细胞的增殖,而tat和h3bp对照组则无抑制效果。如图8所示。
[0104]
通过上述的具体实施例,验证了穿膜肽tat携带融合的h3bp的功能肽段进入细胞,而进入细胞的穿膜肽tat和不能进入细胞的融合穿膜肽的h3bp对白血病病人骨髓或外周血单个核细胞的增殖无效,确保了穿膜肽携带h3bp在白血病病人样本发挥抑制白血病增殖结果的可靠性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1