碳酸酐酶SaCA及其编码基因和应用
碳酸酐酶saca及其编码基因和应用
技术领域
1.本发明属于生物技术领域,具体涉碳酸酐酶saca及其编码基因和应用。
背景技术:
2.随着社会经济的飞速发展,二氧化碳的排放问题日趋严重,而大气中二氧化碳含量的逐年增加是导致温室效应的主要原因,全球变暖越来越成为人们关注的焦点,因此,二氧化碳的捕集成为人们亟待解决的问题。研究人员提出了多种方案,不仅用于降低大气中二氧化碳的浓度,还用于二氧化碳的再利用。但是在这些方案中,二氧化碳的水合作用都是过程中的限速步骤。
3.碳酸酐酶(carbonic anhydrase,ec 4.2.1.1)是催化二氧化碳与水、碳酸及氢质子之间可逆反应的金属酶。该酶最早在牛红细胞中被发现,随后,人们陆续从动物、植物、古细菌和真细菌中鉴定出不同种类的碳酸酐酶。到目前为止,人们将碳酸酐酶分为五类(α、β、γ、δ和ε),其中α、β、γ三类酶存在于所有原核生物中,具有重要的生理功能。另外,有研究表明,碳酸酐酶在二氧化碳捕获技术中具有重要的作用,可大幅度提高二氧化碳的水和反应。因此,开发活性更高的碳酸酐酶新来源逐渐成为研究热点。本发明提供了新颖来源的碳酸酐酶saca及其编码基因和应用。
技术实现要素:
4.本发明的目的是提供碳酸酐酶saca及其编码基因和应用。
5.本发明提供的蛋白质,来源于盐螺旋菌(salinispirillum sp.),是一种碳酸酐酶,命名为saca蛋白,氨基酸序列如序列表中序列1所示。由于氨基酸序列的特殊性,任何含有序列表中序列1所示氨基酸序列的肽蛋白的片段或其突变体,只要其与前述氨基酸序列具有99%以上同源性,且具有碳酸酐酶功能,均属于本发明保护范围。具体的,所述改变包括氨基酸序列中一个或几个氨基酸残基的取代和/或缺失和/或添加和 /或替换。
6.saca蛋白的编码基因也属于本发明的保护范围。
7.优选的,所述基因的碱基序列如序列表中序列2所示,该基因序列来源于盐螺旋菌(salinispirillum sp.),由657个碱基组成。由于核苷酸序列的特殊性,任何序列表中序列2所示多核苷酸的变体,只要其与该多核苷酸具有90%以上同源性,均属于本发明保护范围之列。所述多核苷酸的变体是指一种具有一个或多个核苷酸改变的多核苷酸序列。此多核苷酸的变体包括取代变异体、缺失变异体和插入变异体。
8.含有所述基因的重组表达载体、表达盒或重组微生物均属于本发明的保护范围。
9.本发明还保护saca蛋白作为碳酸酐酶的应用。应用saca蛋白作为碳酸酐酶时,采用的温度为20
‑
90℃,采用的ph为3
‑
11。应用saca蛋白作为碳酸酐酶时,采用的温度为55℃,采用的ph为6。
10.本发明提供的碳酸酐酶saca具有较高的酶活力,且反应温度宽泛,反应ph宽泛。
11.盐螺旋菌jh(salinispirillum sp.jh)已于2020年7月29日保藏于中国典型培养
物保藏中心(地址:中国,武汉,武汉大学;邮编:430072),保藏编号为cctcc no: m 2020375。
12.本发明对于相关环境保护、医药领域等,具有重大的应用前景。
附图说明
13.图1为菌株jh的照片。
14.图2为菌株jh的系统发生树。
15.图3为saca蛋白溶液的电泳图。
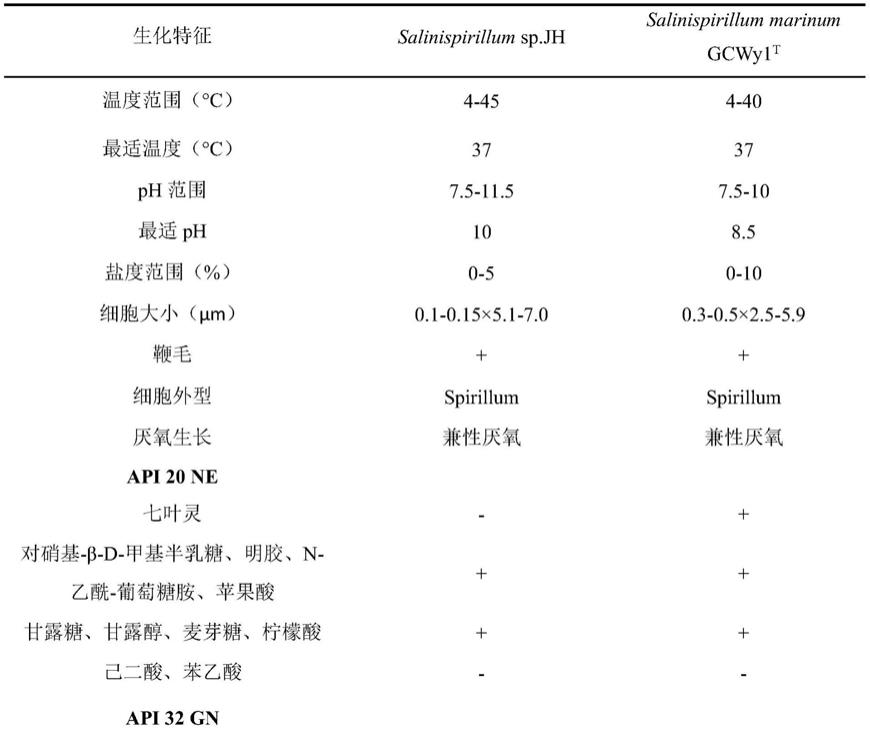
16.图4为检测最适ph时的相对酶活结果。
17.图5为检测最适反应温度时的相对酶活结果。
18.图6为saca蛋白对caco3晶形影响的结果。
具体实施方式
19.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
20.实施例1、盐螺旋菌jh的分离、鉴定和保藏
21.一、分离
22.样品取自内蒙古鄂尔多斯地区的一处碱湖,取碱湖样品50μl,加入碱湖滤液450 μl,吹打混匀得到10
‑1浓度样品,依次稀释得到10
‑1、10
‑2、10
‑3、10
‑4、10
‑5浓度的样品。取碱湖水样原液20μl、40μl及稀释得到的样品,涂布到lbh固体培养基中,在35℃恒温培养箱中培养3
‑
4d后,观察生长情况。
23.二、鉴定
24.将纯化后的菌株接种至lbh固体培养基中,于30℃恒温培养3d后,记录菌株的菌落颜色、凸起情况、边缘规则性、大小及透明度等。利用透射电子显微镜和倒置荧光显微镜观察菌株的形态、大小和胞外附属物等特征。利用革兰氏染色法对菌株进行革兰氏染色处理,使用倒置荧光显微镜观察细菌的革兰氏染色情况。此外,采用穿刺接种法将菌株接种至半固体lbh培养基中,用以观察细菌的运动性和好氧性情况。
25.以lbh液体培养基作为基础培养基,分别添加0
‑
10.0%浓度(以1%为增量,w/v) 的nacl,将菌株接种至上述培养基中,并于30℃下培养7d,空白对照组为不接种菌株的lbh培养基,利用分光光度计在600nm波长下检测菌体密度,从而确定菌株生长的最佳盐度;在ph 3.0
‑
11.0范围内(以1.0单位为间隔),调节lbh液体培养基的ph值,将菌株接种至上述液体培养基中,空白对照组为不接种菌株的lbh培养基,使用分光光度计在600nm波长下检测菌体的生长密度,确定菌株生长的最适ph;将菌株接种至 lbh液体培养基中,分别在4℃、10℃、15℃、20℃、25℃、28℃、30℃、37℃、40℃、 45℃和50℃下培养7d,空白对照组为不接种菌株的lbh培养基,利用分光光度计在600 nm波长下检测菌体的生长密度,从而确定菌株的最适温度及温度生长范围;利用 biolog gen iii鉴定板检测菌株对不同碳源的利用情况。
26.使用api 20ne和api 32gn试剂盒对菌株进行鉴定,如硝酸盐还原试验、亚硝酸盐
还原试验、酶活特性及碳源利用试验等。菌株salinispirillum sp.jh和参考菌株 salinispirillum marinum gcwy1
t
的结果见表1。
27.表1
28.[0029][0030]
利用基因组提取试剂盒提取菌株的基因组dna,并利用pcr技术扩增菌株的16srdna序列。本实验采用的pcr体系为:4μl模板dna、1μl引物27f、1μl引物1492r、 5μl 10
×
taq buffer、4μl dntp、0.8μl taq dna聚合酶、34.2μl灭菌超纯水。利用琼脂糖凝胶电泳对pcr扩增产物进行验证,若条带大小符合预期实验结果,则将pcr扩增产物送商业测序。如果测序结果正确,则对pcr扩增产物进行切胶回收,并利用 pclone007 simple vector kit克隆试剂盒克隆目的条带,再将克隆后的目的基因与质粒 pmd18
‑
t连接,最后将重组质粒转入大肠杆菌e.coli dh5α中,转化过程严格按照感受态细胞e.coli dh5α的使用操作说明进行。将测得的16s rdna序列结果上传至 https://www.ezbiocloud.net/网站进行序列对比分析,确定分离细菌的种属,并下载与菌株亲缘性较高的细菌的16s rdna序列。通过选择合适的外群,并基于分离菌株及其相关菌株的16s rdna基因序列,使用mega 7.0软件构建菌
株的系统发育树。使用近邻连接法(nj)进行细菌的系统发育分析。基于1000次重复,使用bootstrap分析确定系统发生树的拓扑结构。见图2。
[0031]
以上鉴定结果表明,菌株jh属于糖螺旋菌科(saccharospirillaceae),盐螺旋菌属 (salinispirillum)。
[0032]
三、保藏
[0033]
盐螺旋菌jh(salinispirillum sp.jh)已于2020年7月29日保藏于中国典型培养物保藏中心(地址:中国,武汉,武汉大学;邮编:430072),保藏编号为cctcc no:m2020375。
[0034]
实施例2、碳酸酐酶(saca蛋白)的制备
[0035]
经过大量序列分析、比对和功能验证,从盐螺旋菌jh中发现一个新蛋白,将其命名为 saca蛋白,如序列表的序列1所示。将盐螺旋菌jh中编码saca蛋白的基因命名为saca 基因,其编码框如序列表的序列2所示。
[0036]
一、构建重组质粒
[0037]
1、以盐螺旋菌jh的基因组dna为模板,采用ca
‑
f和ca
‑
r组成的引物对进行 pcr扩增,回收pcr扩增产物。
[0038]
ca
‑
f:5
’‑
cggaattcatggacaaccttaac
‑3’
;
[0039]
ca
‑
r:5
’‑
ccctcgagtcagccgcc
‑3’
。
[0040]
2、取步骤1得到的pcr扩增产物,与pet
‑
28a载体连接,得到重组质粒pet
‑
28a
‑
saca。
[0041]
pet
‑
28a载体(pet
‑
28a vector):novagen,产品目录号69864
‑
3。
[0042]
经测序,重组质粒pet
‑
28a
‑
saca中具有序列表的序列2所示的dna分子。
[0043]
二、制备重组菌
[0044]
将重组质粒pet
‑
28a
‑
saca导入大肠杆菌bl21(de3),得到重组菌甲。
[0045]
将pet
‑
28a载体导入大肠杆菌bl21(de3),得到重组菌乙。
[0046]
三、表达蛋白
[0047]
1、将重组菌接种至含50μg/ml卡那霉素的液体lb培养基,37℃、150rpm振荡培养12h,得到种子液。
[0048]
2、将1体积份种子液接种至99体积份含50μg/ml卡那霉素的液体lb培养基中, 37℃、200rpm振荡培养至od
600
值约为0.6,此时加入iptg诱导剂并使其在体系中的浓度为0.5mmol/l,然后25℃、200rpm振荡培养6h(诱导表达),然后4℃、8000
×
g 离心10min,收集菌体沉淀。
[0049]
3、取步骤2得到的沉淀,用tris
‑
hcl缓冲液(0.05m,ph 7.5)洗涤,然后悬浮于tris
‑
hcl缓冲液(0.05m,ph 7.5)并进行超声破碎(超声破碎参数:功率250w,每超声3s,停3s,总时间为30min),然后4℃、10000
×
g离心10min,收集上清液。
[0050]
重组菌甲进行上述步骤得到的上清液,命名为粗酶液甲。
[0051]
重组菌乙进行上述步骤得到的上清液,命名为粗酶液乙。
[0052]
四、纯化蛋白
[0053]
取步骤三得到的粗酶液甲,用孔径为0.22μm的微滤滤膜过滤,收集滤液。取滤液,采用superdex
tm 200 10/60凝胶层析柱进行分离纯化。将superdex
tm 200 10/60凝胶层析柱连接到快速蛋白液相系统,以pbs缓冲液(50mm,ph 6.0)作为流动相,流速为0.05ml/min。
收集保留体积为18
‑
20ml对应洗脱峰的过柱后溶液,即为saca 蛋白溶液。saca蛋白溶液的电泳图见图3,仅一条蛋白带,且符合预估分子量(约 24.3kda)。
[0054]
实施例3、碳酸酐酶(saca蛋白)的酶学性质
[0055]
乙酸对硝基苯酯(p
‑
npa)溶液(实验之前新鲜配制):称取0.04g乙酸对硝基苯酯溶于0.01l乙腈,再将其稀释10倍。
[0056]
pbs缓冲液(100mm,ph 6.0):称取2.88g磷酸二氢钠,0.48g磷酸二氢钾,0.40g 氯化钾,16.00g氯化钠,溶于800ml超纯水中,用hcl调节ph至6.0,定容至1l。
[0057]
一、ph对碳酸酐酶活性的影响
[0058]
取实施例2制备的saca蛋白溶液,用缓冲液稀释至2倍体积,将稀释液作为供试液。
[0059]
检测方法:取石英比色皿,加入供试液200μl、乙酸对硝基苯酯(p
‑
npa)溶液 1ml、缓冲液1.8ml,测量反应起始od
400nm
处吸光度值和反应3min后的吸光度值,整个过程在25℃下完成。
[0060]
分别采用如下缓冲液:ph 3.0的柠檬酸盐缓冲液、ph 4.0的柠檬酸盐缓冲液、ph5.0的柠檬酸盐缓冲液、ph 6.0的柠檬酸盐缓冲液、ph 6.0的磷酸盐缓冲液、ph 7.0的磷酸盐缓冲液、ph 8.0的磷酸盐缓冲液、ph 8.0的碳酸盐缓冲液、ph 9.0的碳酸盐缓冲液、ph 10.0的碳酸盐缓冲液、ph 11.0的碳酸盐缓冲液。柠檬酸盐缓冲液的配方见表2。磷酸盐缓冲液的配方见表3。碳酸盐缓冲液的配方见表4。
[0061]
表2
[0062][0063][0064]
表3
[0065]
ph0.2m磷酸氢二钠水溶液(ml)0.2m磷酸二氢钠水溶液(ml)6.061.5438.57.03051958.0473.526.5
[0066]
表4
[0067]
ph0.1m碳酸钠水溶液(ml)0.1m碳酸氢钠水溶液(ml)8.0504509.015035010.030020011.045050
[0068]
saca蛋白的最适ph为6。将最适ph对应的缓冲液时的od
400nm
值作为100%,计算采用各种缓冲液时的相对值,作为相对酶活,结果见图4。
[0069]
二、温度对碳酸酐酶活性的影响
[0070]
取实施例2制备的saca蛋白溶液,用缓冲液稀释至2倍体积,然后作为供试液。
[0071]
检测方法:取石英比色皿,加入供试液200μl、乙酸对硝基苯酯(p
‑
npa)溶液 1ml、pbs缓冲液1.8ml,测量反应起始od
400nm
处吸光度值和反应3min后的吸光度值,分别在20℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、70℃、80℃、 90℃下测定酶活。
[0072]
最适反应温度为55℃。将最适反应温度时的od
400nm
值作为100%,计算采用各种反应温度时的相对值,作为相对酶活,结果见图5。
[0073]
三、酶活力的测定
[0074]
酶活(1u)定义为:在室温下,每分钟水解1μmol乙酸对硝基苯酯所需的酶量。
[0075]
检测方法:取石英比色皿,加入供试液200μl、乙酸对硝基苯酯(p
‑
npa)溶液 1ml、缓冲液1.8ml,测量反应起始od
400nm
处吸光度值和反应3min后的吸光度值,整个过程在25℃下完成。
[0076]
采用实施例2制备的粗酶液甲作为供试液,酶活为48.3u/ml。
[0077]
采用实施例2制备的粗酶液乙作为供试液,酶活为0u/ml。
[0078]
采用实施例2制备的saca蛋白溶液作为供试液,检测单位体积供试液的酶活。检测实施例2制备的saca蛋白溶液中的蛋白浓度。将单位体积供试液的酶活除以单位体积供试液的蛋白含量,得到蛋白比活力,数值为316u/mg。
[0079]
实施例4、碳酸酐酶(saca蛋白)在碳捕获和储存技术中的应用
[0080]
1、将含有碳酸酐酶的25mm cacl2溶液ph调节至6.5,将硅片置于烧杯底部,抛光表面朝上,将6个针孔(直径约2mm)均匀地铺展在封口膜表面后覆盖烧杯;
[0081]
2、将盖好的烧杯放在干燥器中心位置,将各自含有(nh4)2co3粉末(重量:0.5g) 的三个小玻璃瓶均匀地放置在烧杯周围;
[0082]
3、在caco3生长结束时,将带有沉淀物的硅晶片用超纯水和乙醇冲洗,并在氮气流下室温干燥;
[0083]
4、通过扫描电子显微镜(sem)在jeol jsm
‑
840显微镜上以15kv的加速电压用金溅射来表征caco3沉淀物的尺寸和形态。
[0084]
以未加入供试液碳酸酐酶的作为对照,结果见图6。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1