一种具有碱基突变的同向重复序列及其应用的制作方法
1.本发明涉及基因编辑领域,特别是成簇的规律性间隔的短回文重复序列(crispr/cas)技术领域。具体而言,本发明涉及一种具有碱基突变的同向重复序列及其应用,尤其涉及一种包含具有碱基突变的同向重复序列的适用于cas12蛋白家族的grna及其应用。
背景技术:
2.crispr/cas系统是细菌体内的获得性免疫系统,是用来对抗侵略细菌的外源dna、质粒和噬菌体的。利用crispr/cas系统进行基因编辑,具有精准、廉价、易于使用的特点,现广泛应用于基因工程中。
3.crispr/cas系统分为3类,最常用的是第2类crispr/cas系统,其可编程单效应核酸酶成为基因编辑和核酸检测的便捷工具。第2类crispr/cas系统中的单效应核酸酶-cas蛋白能够在向导rna的引导下对核酸进行切割,切割位点主要位于pam附近。向导rna是指,crrna和tracrrna通过碱基配对形成的双链rna,或者通过人工改造将crrna和tracrrna组合成一个grna,这个向导rna行使引导功能的必要条件是形成茎环结构。茎环结构是向导rna与cas酶结合的骨架区。第2类crispr/cas系统分为ⅱ型、
ⅴ
型和ⅵ型,分别基于cas9蛋白、cas12蛋白、cas13蛋白,其中
ⅴ
型crispr/cas系统的cas12蛋白具有特异性的cis切割活性和非特异性的trans切割活性,这种活性为核酸检测或临床诊断提供了新的研究思路。
4.为了改善cas酶的活性,本技术发明人针对grna,尤其是对grna的同向重复序列的茎环结构进行了优化,获得了可以提高cas酶的trans切割活性与cis切割活性比例的grna。
技术实现要素:
5.本技术的发明人经过大量实验和反复摸索,发现了一种可以改善cas酶活性的grna。
6.一方面,本发明提供了一种相对于亲本同向重复序列具有碱基突变的同向重复序列,所述亲本同向重复序列和具有碱基突变的同向重复序列可形成茎环结构,所述茎环结构能够与cas蛋白结合,亲本同向重复序列和具有碱基突变的同向重复序列包括从5’到3’端依次连接的第一区段、第二区段、第三区段、第四区段,所述第二区段和第四区段可以通过碱基配对形成茎环结构的茎区;
7.所述具有碱基突变的同向重复序列的茎区相对于亲本同向重复序列的茎区存在至少1个不配对的碱基对;优选的,所述具有碱基突变的同向重复序列的茎区相对于亲本同向重复序列的茎区存在1个不配对的碱基对。
8.本发明中,所述同向重复序列是构成grna的重要部分,本领域知晓,grna通常包括同向重复序列(dr)以及靶向靶核酸的引导序列;同向重复序列也称为grna的骨架区,其可以与cas蛋白相互作用或结合,从而将cas蛋白引导至靶核酸的靶向区。
9.在一个实施方式中,所述的亲本同向重复序列和具有碱基突变的同向重复序列的第二区段、第四区段分别包括4-10个碱基;优选的,所述的第二区段、第四区段分别包括5个
碱基。
10.在一个实施方式中,所述同向重复序列形成的茎环结构可以与v型cas蛋白结合;优选的,所述v型cas蛋白选自cas12家族的cas蛋白,例如,cas12a(cpf1)、cas12b、cas12g、cas12i、cas12j等。
11.在一个实施方式中,所述具有碱基突变的同向重复序列的第二区段和第四区段的任意1个碱基相对于亲本同向重复序列产生突变,从而导致所述具有碱基突变的同向重复序列的茎区相对于亲本同向重复序列的茎区存在1个不配对的碱基对。
12.在一个实施方式中,所述亲本同向重复序列的第二区段和第四区段从5’到3’端的序列分别为gugug和cacac;进一步的,所述亲本同向重复序列的第一区段和第三区段从5’到3’端的序列分别为agagaau和cauagu。
13.在优选的实施方式中,所述具有碱基突变的同向重复序列相对于亲本同向重复序列,在对应于seq id no.1的以下位置的核苷酸具有一种或多种突变:g8、u9、g10、u11、g12、c19、a20、c21、a22、c23;优选的,具有碱基突变的同向重复序列相对于亲本同向重复序列,具有在对应于seq id no.1的序列的以下位置的一种或多种碱基突变:c19g、a20u、c21g、a22u、c23g。
14.在优选的实施方式中,所述具有碱基突变的同向重复序列包括seq id no.2-6任一所示的序列;优选的,所述同向重复序列如seq id no.2-6任一所示的序列。
15.另一方面,本发明提供了一种grna,所述grna包括上述具有碱基突变的同向重复序列和与靶核酸杂交的导向序列(或者,称之为引导序列);
16.优选的,所述grna包括从5’到3’端依次连接的上述具有碱基突变的同向重复序列和与靶核酸杂交的导向序列。
17.另一方面,本发明提供了一种核酸,所述核酸编码上述grna,或者编码上述grna的前体,或者编码上述具有碱基突变的同向重复序列。
18.另一方面,本发明提供了一种组合物或crispr系统,所述的组合物或crispr系统包括上述grna和cas蛋白。
19.另一方面,本发明提供了一种活化的crispr复合物,所述复合物包括上述grna、cas蛋白,以及结合在上述grna上的靶核酸。
20.另一方面,本发明提供了一种载体,所述的载体包括上述grna或上述核酸。
21.另一方面,本发明提供了一种载体系统,所述载体系统包括一种或多种载体,所述一种或多种载体包括:
22.(i)第一调控元件,该第一调控元件与上述grna可操作地连接,
23.(ii)第二调控元件,该第二调控元件与cas蛋白可操作地连接;
24.其中组分(i)和(ii)位于相同或不同载体上。
25.另一方面,本发明提供了上述grna在改善cas蛋白的活性中的应用;优选的,所述改善cas蛋白的活性为提高cas蛋白的trans切割活性与cis切割活性的比例。
26.本领域知晓,cas蛋白,尤其是v型cas蛋白(例如,cas12a、cas12b、cas12i、cas12j)在进行基因编辑时,可以表现出cis切割活性,也可以表现出trans切割活性。
27.在优选的实施方式中,所述cas蛋白为v型cas蛋白;优选的,所述v型cas蛋白选自cas12家族的cas蛋白,例如,cas12a(cpf1)、cas12b、cas12g、cas12i、cas12j等。
28.在一个具体的实施方式中,所述cas蛋白为cas12i;优选的,所述cas12i选自下组任意一组:
29.(1)seq id no:14所示的蛋白;
30.(2)将seq id no:14所示氨基酸序或其活性片段经过一个或多个(如2个、3个、4个,5个,6个,7个,8个,9个或10个)氨基酸残基的取代、缺失或添加而形成的,且与seq id no:14具有基本相同功能的蛋白;
31.(3)与seq id no:14具有至少50%,至少55%,至少60%,至少65%,至少70%,至少75%,至少80%,至少85%,至少90%,至少95%,或至少99%的序列同一性的,且与seq id no:14具有基本相同功能的蛋白。
32.上述基本相同功能是指与seq id no:14所示的蛋白具有相同或相似的基因编辑活性,包括cis切割活性和trans切割活性。
33.本发明中,所述提高cas蛋白的trans切割活性与cis切割活性的比例,是指,包含上述具有碱基突变的同向重复序列的grna(简称为,优化的grna)与包含亲本同向重组序列的grna(简称为,野生型grna)相比,优化的grna在与cas蛋白进行基因编辑时cas蛋白所表现的trans切割活性与cis切割活性的比值(trans切割活性/cis切割活性)要高于野生型grna在与cas蛋白进行基因编辑时cas蛋白所表现的trans切割活性与cis切割活性的比值(trans切割活性/cis切割活性)。
34.在具体的实施方式中,本发明具有碱基突变的同向重复序列的grna在与cas蛋白联合使用时,与野生型grna相比:cas蛋白的cis活性显著降低,降低至少60%(例如,至少70%、至少80%、至少90%);cas蛋白的trans活性(尤其是结合单链靶核酸时所表现的trans活性)可保留至少60%(例如,至少70%、至少80%、至少90%)。
35.所述单链核酸优选为单链dna(ssdna),所述双链核酸优选为双链dna(dsdna)。
36.另一方面,本发明提供了一种改善cas蛋白活性或者提高cas蛋白的trans切割活性与cis切割活性的比例的方法,所述方法包括利用cas蛋白和上述grna进行基因编辑或基因切割。
37.另一方面,本发明提供了上述grna、上述核酸、上述组合物或crispr系统、上述活化的crispr复合物、上述载体或上述载体系统在基因编辑、基因靶向或基因切割中的应用;
38.所述基因编辑包括修饰基因、敲除基因、改变基因产物的表达、修复突变、和/或插入多核苷酸、基因突变;
39.所述编辑可以在原核细胞和/或真核细胞中进行编辑。
40.另一方面,本发明提供了一种编辑靶核酸、靶向靶核酸或切割靶核酸的方法,所述方法包括将靶核酸与上述grna、上述核酸、上述组合物或crispr系统、上述载体或上述载体系统进行接触的步骤。
41.另一方面,本发明提供了上述grna、上述核酸、上述组合物或crispr系统、上述活化的crispr复合物、上述载体或上述载体系统在核酸检测或诊断中的应用。
42.另一方面,本发明提供了上述grna、上述核酸、上述组合物或crispr系统、上述活化的crispr复合物、上述载体或上述载体系统在非特异性的切割单链核酸中的应用。
43.另一方面,本发明提供了一种切割单链核酸的方法,所述方法包括,使核酸群体与cas蛋白和上述grna接触,其中所述核酸群体包括靶核酸和非靶单链核酸,所述cas蛋白切
割所述非靶单链核酸;
44.所述接触可以是在体外、离体或体内的细胞内部;
45.优选的,所述切割单链核酸为非特异性的切割。
46.另一方面,本发明提供了一种用于基因编辑的试剂盒,所述试剂盒包括上述grna和cas蛋白。
47.另一方面,本发明提供了一种用于检测样品中的靶核酸的试剂盒,所述试剂盒包括:(i)上述grna,或编码上述grna的核酸,或上述grna的前体rna,或编码上述前体rna的核酸;(
ⅱ
)cas蛋白,或编码所述cas蛋白的核酸;和(
ⅲ
)为单链的且不与所述grna杂交的单链核酸检测器。
48.另一方面,本发明提供了上述grna、上述核酸、上述组合物或crispr系统、上述活化的crispr复合物、上述载体或上述载体系统在制备制剂中的应用,所述制剂用于以下(i)-(v)任一或任意几种:
49.(i)基因或基因组编辑;
50.(ii)靶核酸检测和/或诊断;
51.(iii)编辑靶基因座中的靶序列来修饰生物或非人类生物;
52.(iv)疾病的治疗;
53.(v)靶向靶基因;
54.优选的,上述基因或基因组编辑为在细胞内进行基因或基因组编辑;
55.优选的,所述靶核酸检测和/或诊断为在体外进行靶核酸检测和/或诊断;
56.优选的,所述疾病的治疗为治疗由靶基因座中的靶序列的缺陷引起的病症。
57.在一些实施方案中,所述病症或疾病是癌症或传染病。例如,癌症可选自wilms氏肿瘤,ewing肉瘤,神经内分泌肿瘤,成胶质细胞瘤,神经母细胞瘤,黑色素瘤,皮肤癌,乳腺癌,结肠癌,直肠癌,前列腺癌,肝癌,肾癌,胰腺癌,肺癌,胆道癌,宫颈癌,子宫内膜癌,食管癌,胃癌,头颈部癌,甲状腺髓样癌,卵巢癌,神经胶质瘤,淋巴瘤,白血病,骨髓瘤,急性淋巴细胞白血病,急性骨髓性白血病,慢性淋巴细胞白血病,慢性骨髓性白血病,霍奇金淋巴瘤,非霍奇金淋巴瘤和膀胱癌。
58.另一方面,本发明提供了一种检测样品中靶核酸的方法,所述方法包括将样品与cas蛋白、上述grna和单链核酸检测器接触,上述grna包括与cas蛋白结合的区域和与靶核酸杂交的指导序列;检测由所述cas蛋白切割单链核酸检测器产生的可检测信号,从而检测靶核酸;所述单链核酸检测器不与上述grna杂交;
59.本发明中,所述可检测信号通过以下方式实现:基于视觉的检测,基于荧光信号的检测,基于传感器的检测,颜色检测,基于金纳米颗粒的检测,荧光偏振或荧光信号,胶体相变/分散,电化学检测和基于半导体的检测。
60.在一些实施方式中,本发明的方法还包括测量crispr/cas效应蛋白(cas蛋白)产生的可检测信号的步骤。所述cas蛋白识别所述靶核酸或与所述靶核酸杂交之后可以激发单链核酸的切割活性(trans切割活性),从而切割所述单链核酸检测器进而产生可检测信号。
61.本发明中,所述可检测信号可以是当切割单链核酸检测器时产生的任何信号。例如,基于金纳米颗粒的检测,荧光偏振,胶体相变/分散,电化学检测,基于半导体的传感。所
述可检测信号可通过任何合适的方式读出,包括但不限于:可检测的荧光信号的测量,凝胶电泳检测(通过检测凝胶上的条带的变化),基于视觉或传感器的颜色的存在或不存在的检测、或者颜色存在的差异(例如,基于金纳米颗粒)以及电信号的差异。
62.在优选的实施方式中,所述可检测信号通过以下方式实现:所述单链核酸检测器的5’端和3’端分别设置不同的报告基团,当所述单链核酸检测器被切割后,可以表现出可检测的报告信号;例如,单链核酸检测器的两端分别设置荧光基团和淬灭基团,当所述单链核酸检测器被切割后,可以表现出可检测的荧光信号。
63.在一个实施方式中,所述荧光基团选自fam、fitc、vic、joe、tet、cy3、cy5、rox、texas red或lc red460中的一种或任意几种;所述淬灭基团选自bhq1、bhq2、bhq3、dabcy1或tamra中的一种或任意几种。
64.在其他的实施方式中,所述可检测信号还可以通过以下方式实现:所述单链核酸检测器的5’端和3’端分别设置不同的标记分子,通过胶体金检测的方式检测反应信号。
65.在一个实施方式中,所述的靶核酸包括dna、rna,优选为单链核酸或双链核酸或核酸修饰物。
66.在一个实施方式中,所述靶核酸来源于病毒、细菌、微生物、土壤、水源、人体、动物、植物等样品。优选的,所述靶核酸为pcr、nasba、rpa、sda、lamp、had、near、mda、rca、lcr、ram等方法富集或扩增的产物。
67.在一个实施方式中,所述方法还包括从样品中获得靶核酸的步骤。
68.在一个实施方式中,所述靶核酸为病毒核酸、细菌核酸、与疾病相关的特异核酸,如特定的突变位点或snp位点或与对照有差异的核酸;优选地,所述病毒为植物病毒或动物病毒,例如,乳头瘤病毒,肝dna病毒,疱疹病毒,腺病毒,痘病毒,细小病毒,冠状病毒;优选地,所述病毒为冠状病毒,优选地,sars、sars-cov2(covid-19)、hcov-229e、hcov-oc43、hcov-nl63、hcov-hku1、mers-cov。
69.在一些实施方式中,所述靶核酸来源于细胞,例如,来源于细胞裂解液。
70.在一些实施方式中,所述可检测信号的测量可以是定量的,在其他的实施方式中,所述可检测信号的测量可以是定性的。
71.优选的,所述单链核酸检测器在被所述cas蛋白切割之前产生第一可检测信号,并且在被切割之后产生不同于第一可检测信号的第二可检测信号。
72.在其他的实施方式中,单链核酸检测器包括一个或多个的修饰,例如碱基修饰,骨架修饰,糖修饰等,以向核酸提供新的或增强的特征(例如改进的稳定性)。合适修饰的例子包括修饰的核酸骨架和非天然核苷间连接,具有修饰主链的核酸包括那些在主链中保留磷原子的核酸和那些在主链中不具有磷原子的核酸。合适的其中含有磷原子的修饰的寡核苷酸骨架包括硫代磷酸酯,手性硫代磷酸酯,二硫代磷酸酯,磷酸三酯,氨基烷基磷酸三酯,甲基和其它烷基膦酸酯。在一些实施方式中,单链核酸检测器包含一个或多个硫代磷酸酯和/或杂原子核苷键。在其他的实施方式中,所述单链核酸检测器可以是核酸模拟物;在某些实施方式中,所述核酸模拟物为肽核酸(pna),另一类核酸模拟物是基于具有连接到吗啉环上的杂环碱基的连接吗啉基单元(吗啉基核酸),其他的核酸模拟物还包括环己烯基核酸(cena),还包括核糖或者脱氧核糖链。
73.本发明中的细胞选自由以下组成的组:原核细胞或真核细胞,例如,古细菌细胞、
细菌细胞、真核单细胞生物、体细胞、生殖细胞、干细胞、植物细胞、藻类细胞、动物细胞、无脊椎动物细胞、脊椎动物细胞、鱼细胞、蛙细胞、鸟细胞、哺乳动物细胞、猪细胞、母牛细胞、山羊细胞、绵羊细胞、啮齿动物细胞、大鼠细胞、小鼠细胞、非人灵长类动物细胞以及人细胞。
74.在某些情况下,由本发明的基因编辑方法引入到细胞中,可以对基因或基因组进行修饰,从而可以使得细胞和其子代被改变。优选的,如上所述的方法获得的细胞或其子代,其中所述细胞含有在其野生型中不存在的修饰。
75.在一个实施方式中,所述细胞是原核细胞。
76.在一个实施方式中,所述细胞是真核细胞。
77.在一个实施方式中,所述细胞是哺乳动物细胞。
78.在一个实施方式中,所述细胞是人类细胞。某些实施方案中,所述细胞是非人哺乳动物细胞,例如非人灵长类动物、牛、羊、猪、犬、猴、兔、啮齿类(如大鼠或小鼠)的细胞。
79.在一个实施方式中,所述细胞是非哺乳动物真核细胞,例如家禽鸟类(如鸡)、鱼类或甲壳动物(如蛤蜊、虾)的细胞。
80.在一个实施方式中,所述细胞是植物细胞;优选的,所述植物为单子叶植物或双子叶植物;包括但不限于拟南芥、烟草、水稻、玉米、高粱、大麦、小麦、小米、大豆、番茄、马铃薯、藜麦、生菜、油菜、白菜、草莓。
81.在一个实施方式中,所述细胞是干细胞或干细胞系。
82.一般定义:
83.在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的分子遗传学、核酸化学、化学、分子生物学、生物化学、细胞培养、微生物学、细胞生物学、基因组学和重组dna等操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
84.cas蛋白
85.在本发明中,表述“cas蛋白”是指crispr蛋白,术语“crispr/cas蛋白”、“cas效应蛋白”、“cas蛋白”、“单效应核酸酶”可互换地使用。
86.cas蛋白一旦与待检测特征序列(靶序列)结合(即形成cas蛋白-grna-靶序列的三元复合物),就可以诱发其trans切割活性,即随机切割非靶向单链核苷酸(即本文所述单链核酸检测器,优选单链dna(ssdna)、单链dna-rna杂交体、单链rna)。当cas蛋白与特征序列结合后,其切割或不切割特征序列,均可以诱发其trans切割活性;优选地,其通过切割特征序列诱发其trans切割活性;更优选地,其通过切割单链特征序列诱发其trans活性。所述cas蛋白通过识别与特征序列临近的pam(protospacer adjacent motif)识别特征序列。
87.本发明所述的cas蛋白为至少具有trans切割活性的蛋白,优选地,所述的cas蛋白为具有cis切割活性和trans切割活性的蛋白。所述的cis切割活性是指cas蛋白可在grna的作用下识别pam位点并特异性切割靶序列的活性。
88.本发明所述的cas蛋白选自v型cas家族蛋白的任意一种或任意几种组合;优选的,所述cas家族蛋白选自cas12i、cas12j、cas12a、cas12b、cas12d、cas12e、cas12f、cas12g、cas12h中的一种或任意几种组合;更优选的,所述cas蛋白为cas12i、cas12j、cas12a、cas12b中的一种或任意几种组合物。更优选的,所述cas蛋白为cas12i或cas12j。
89.crispr/cas系统
90.如本文中所使用的,术语“成簇的规律性间隔的短回文重复序列(crispr/cas)”、“crispr系统”、“crispr/cas”可互换地使用并且具有本领域技术人员通常理解的含义,其通常包含与crispr相关(“cas”)基因的表达有关的转录产物或其他元件,或者能够指导所述cas基因活性的转录产物或其他元件。
91.指导rna(guide rna,grna)
92.如本文中所使用的,术语“指导rna(guide rna)”、“向导rna”、“成熟crrna”、“指导序列”可互换地使用并且具有本领域技术人员通常理解的含义。grna可以是crrna和tracrrna通过碱基配对形成的双链rna,也可以是通过人工改造将crrna和tracrrna组合成一个grna。
93.一般而言,指导rna可以包含同向重复序列(direct repeat,dr)和引导序列,或者基本上由或由同向重复序列和引导序列(在内源性crispr系统背景下也称为间隔序列(spacer))组成。
94.同向重复序列又称为“骨架区”、“蛋白质结合区段”、“蛋白质结合序列”;引导序列还可以称为“靶向核酸的靶向序列”或者“靶向核酸的靶向区段”。
95.靶向核酸的靶向序列或靶向核酸的靶向区段包含与靶核酸中的序列互补的核苷酸序列。换言之,靶向核酸的靶向序列或靶向核酸的靶向区段经过杂交(即,碱基配对)以序列特异性方式与靶核酸相互作用。因此,靶向核酸的靶向序列或靶向核酸的靶向区段可改变,或可被修饰以杂交靶核酸内的任何希望的序列。所述核酸选自dna或rna。
96.靶向核酸的靶向序列或靶向核酸的靶向区段与靶核酸的靶序列之间的互补百分比可为至少60%(例如,至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或100%)。
97.grna的“骨架区”、“蛋白质结合区段”、“蛋白质结合序列”、或者“同向重复序列”可以与crispr蛋白(或者,cas蛋白)相互作用。本发明中,同向重复序列可形成茎环结构,所述茎环结构能够与cas蛋白结合,亲本同向重复序列和具有碱基突变的同向重复序列包括从5’到3’端依次连接的第一区段、第二区段、第三区段、第四区段,所述第二区段和第四区段可以通过碱基配对形成茎环结构的茎区。grna经过靶向核酸的靶向序列的作用将其相互作用的cas蛋白引导至靶核酸内的特异性核苷酸序列。
98.优选的,所述指导rna从5’至3’方向包含同向重复序列(direct repeat)和引导序列。
99.本发明中,靶向核酸的靶向序列或靶向核酸的靶向区段优选为靶向dna的靶向序列或靶向dna的靶向区段。
100.在某些情况下,指导序列是与靶序列具有足够互补性从而与所述靶序列杂交并引导crispr/cas复合物与所述靶序列的特异性结合的任何多核苷酸序列。在一个实施方式中,当最佳比对时,指导序列与其相应靶序列之间的互补程度为至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、或至少99%。确定最佳比对在本领域的普通技术人员的能力范围内。例如,存在公开和可商购的比对算法和程序,诸如但不限于clustalw、matlab中的史密斯-沃特曼算法(smith-waterman)、bowtie、geneious、biopython以及seqman。
101.在形成crispr/cas复合物的情况下,“靶序列”是指被设计为具有靶向性的指导序列所靶向的多核苷酸,例如,与引导序列具有互补性的序列,其中靶序列与引导序列之间的杂交将促进crispr/cas复合物的形成。完全互补性不是必需的,只要存在足够互补性以引起杂交并且促进一种crispr/cas复合物的形成即可。靶序列可以包含任何多核苷酸,如dna或rna。在某些情况下,所述靶序列位于细胞内或细胞外。在某些情况下,所述靶序列位于细胞的细胞核或细胞质中。在某些情况下,该靶序列可位于真核细胞的一个细胞器例如线粒体或叶绿体内。可被用于重组到包含该靶序列的靶基因座中的序列或模板被称为“编辑模板”或“编辑多核苷酸”或“编辑序列”。在一个实施方式中,所述编辑模板为外源核酸。在一个实施方式中,该重组是同源重组。
102.单链核酸检测器
103.本发明所述的单链核酸检测器是指含有2-200个核苷酸的序列,优选,具有2-150个核苷酸,优选,3-100个核苷酸,优选,3-30个核苷酸,优选,4-20个核苷酸,更优选,5-15个核苷酸。优选为单链dna分子、单链rna分子或单链dna-rna杂交体。
104.所述的单链核酸检测器两端包括不同的报告基团或标记分子,当其处于初始状态(即未被切割状态时)不呈现报告信号,当该单链核酸检测器被切割后,呈现出可检测的信号,即切割后与切割前表现出可检测的区别。在本发明中,如果能够检测出可检测的区别,则反映靶核酸中含有待检测的特征序列;或者,如果无法检检测出所述的可检测的区别,则反映靶核酸中不含有待检测的特征序列。
105.亲本或野生型
106.如本文中所使用的,术语“亲本”或“野生型”具有本领域技术人员通常理解的含义,其表示生物、菌株、基因的典型形式或者当它在自然界存在时区别于突变体或变体形式的特征,其可从自然中的来源分离并且没有被人为有意地修饰。
107.载体
108.术语“载体”是指一种核酸分子,它能够运送与其连接的另一种核酸分子。载体包括但不限于,单链、双链、或部分双链的核酸分子;包括一个或多个自由端、无自由端(例如环状的)的核酸分子;包括dna、rna、或两者的核酸分子;以及本领域已知的其他多种多样的多核苷酸。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得表达。一种载体可以被引入到宿主细胞中而由此产生转录物、蛋白质、或肽,包括由如本文所述的蛋白、融合蛋白、分离的核酸分子等(例如,crispr转录物,如核酸转录物、蛋白质、或酶)。一种载体可以含有多种控制表达的元件,包括但不限于,启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位点。
109.一种类型的载体是“质粒”,其是指其中可以例如通过标准分子克隆技术插入另外的dna片段的环状双链dna环。
110.另一种类型的载体是病毒载体,其中病毒衍生的dna或rna序列存在于用于包装病毒(例如,逆转录病毒、复制缺陷型逆转录病毒、腺病毒、复制缺陷型腺病毒、以及腺相关病毒)的载体中。病毒载体还包含由用于转染到一种宿主细胞中的病毒携带的多核苷酸。某些载体(例如,具有细菌复制起点的细菌载体和附加型哺乳动物载体)能够在它们被导入的宿主细胞中自主复制。
111.其他载体(例如,非附加型哺乳动物载体)在引入宿主细胞后整合到该宿主细胞的
基因组中,并且由此与该宿主基因组一起复制。而且,某些载体能够指导它们可操作连接的基因的表达。这样的载体在此被称为“表达载体”。
112.宿主细胞
113.如本文中所使用的,术语“宿主细胞”是指,可用于导入载体的细胞,其包括但不限于,如大肠杆菌或枯草菌等的原核细胞,如微生物细胞、真菌细胞、动物细胞和植物细胞的真核细胞。
114.本领域技术人员将理解,表达载体的设计可取决于诸如待转化的宿主细胞的选择、所希望的表达水平等因素。
115.调控元件
116.如本文中所使用的,术语“调控元件”旨在包括启动子、增强子、内部核糖体进入位点(ires)、和其他表达控制元件(例如转录终止信号,如多聚腺苷酸化信号和多聚u序列),其详细描述可参考戈德尔(goeddel),《基因表达技术:酶学方法》(gene expression technology:methods in enzymology)185,学术出版社(academic press),圣地亚哥(san diego),加利福尼亚州(1990)。在某些情况下,调控元件包括指导一个核苷酸序列在许多类型的宿主细胞中的组成型表达的那些序列以及指导该核苷酸序列只在某些宿主细胞中表达的那些序列(例如,组织特异型调节序列)。组织特异型启动子可主要指导在感兴趣的期望组织中的表达,所述组织例如肌肉、神经元、骨、皮肤、血液、特定的器官(例如肝脏、胰腺)、或特殊的细胞类型(例如淋巴细胞)。在某些情况下,调控元件还可以时序依赖性方式(如以细胞周期依赖性或发育阶段依赖性方式)指导表达,该方式可以是或者可以不是组织或细胞类型特异性的。在某些情况下,术语“调控元件”涵盖的是增强子元件,如wpre;cmv增强子;在htlv-i的ltr中的r-u5’片段((mol.cell.biol.,第8(1)卷,第466-472页,1988);sv40增强子;以及在兔β-珠蛋白的外显子2与3之间的内含子序列(proc.natl.acad.sci.usa.,第78(3)卷,第1527-31页,1981)。
117.启动子
118.如本文中所使用的,术语“启动子”具有本领域技术人员公知的含义,其是指一段位于基因的上游能启动下游基因表达的非编码核苷酸序列。组成型(constitutive)启动子是这样的核苷酸序列:当其与编码或者限定基因产物的多核苷酸可操作地相连时,在细胞的大多数或者所有生理条件下,其导致细胞中基因产物的产生。诱导型启动子是这样的核苷酸序列,当可操作地与编码或者限定基因产物的多核苷酸相连时,基本上只有当对应于所述启动子的诱导物在细胞中存在时,其导致所述基因产物在细胞内产生。组织特异性启动子是这样的核苷酸序列:当可操作地与编码或者限定基因产物的多核苷酸相连时,基本上只有当细胞是该启动子对应的组织类型的细胞时,其才导致在细胞中产生基因产物。
119.可操作地连接
120.如本文中所使用的,术语“可操作地连接”旨在表示感兴趣的核苷酸序列以一种允许该核苷酸序列的表达的方式被连接至该一种或多种调控元件(例如,处于一种体外转录/翻译系统中或当该载体被引入到宿主细胞中时,处于该宿主细胞中)。
121.互补性
122.如本文中所使用的,术语“互补性”是指核酸与另一个核酸序列借助于传统的沃森-克里克或其他非传统类型形成一个或多个氢键的能力。互补百分比表示一个核酸分子
中可与一个第二核酸序列形成氢键(例如,沃森-克里克碱基配对)的残基的百分比(例如,10个之中有5、6、7、8、9、10个即为50%、60%、70%、80%、90%、和100%互补)。“完全互补”表示一个核酸序列的所有连续残基与一个第二核酸序列中的相同数目的连续残基形成氢键。如本文使用的“基本上互补”是指在一个具有8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50个或更多个核苷酸的区域上至少为60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%、或100%的互补程度,或者是指在严格条件下杂交的两个核酸。
123.严格条件
124.如本文中所使用的,对于杂交的“严格条件”是指与靶序列具有互补性的一个核酸主要地与该靶序列杂交并且基本上不杂交到非靶序列上的条件。严格条件通常是序列依赖性的,并且取决于许多因素而变化。一般而言,该序列越长,则该序列特异性地杂交到其靶序列上的温度就越高。严格条件的非限制性实例描述于蒂森(tijssen)(1993)的《生物化学和分子生物学中的实验室技术-核酸探针杂交》(laboratory techniques in biochemistryand molecular biology-hybridization with nucleic acid probes),第i部分,第二章,“杂交原理概述和核酸探针分析策略”(“overview of principles of hybridization andthe strategy of nucleic acid probe assay”),爱思唯尔(elsevier),纽约。
125.杂交
126.如本文中所使用的,术语“杂交”是指其中一个或多个多核苷酸反应形成一种复合物的反应,该复合物经由这些核苷酸残基之间的碱基的氢键键合而稳定化。氢键键合可以借助于沃森-克里克碱基配对、hoogstein结合或以任何其他序列特异性方式而发生。该复合物可包含形成一个双链体的两条链、形成多链复合物的三条或多条链、单个自我杂交链、或这些的任何组合。杂交反应可以构成一个更广泛的过程(如pcr的开始、或经由一种酶的多核苷酸的切割)中的一个步骤。能够与一个给定序列杂交的序列被称为该给定序列的“互补物”。
127.表达
128.如本文中所使用的,术语“表达”是指,藉此从dna模板转录成多核苷酸(如转录成mrna或其他rna转录物)的过程和/或转录的mrna随后藉此翻译成肽、多肽或蛋白质的过程。转录物和编码的多肽可以总称为“基因产物”。如果多核苷酸来源于基因组dna,表达可以包括真核细胞中mrna的剪接。
129.接头
130.如本文中所使用的,术语“接头”是指,由多个氨基酸残基通过肽键连接形成的线性多肽。本发明的接头可以为人工合成的氨基酸序列,或天然存在的多肽序列,例如具有铰链区功能的多肽。此类接头多肽是本领域众所周知的(参见例如,holliger,p.等人(1993)proc.natl.acad.sci.usa 90:6444-6448;poljak,r.j.等人(1994)structure2:1121-1123)。
131.动物
132.例如哺乳动物,例如牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、兔科动物、啮齿类动物(例如,小鼠或大鼠)、非人灵长类动物(例如,猕猴或食蟹猴)或
人。在某些实施方式中,所述受试者(例如人)患有病症(例如,疾病相关基因缺陷所导致的病症)。
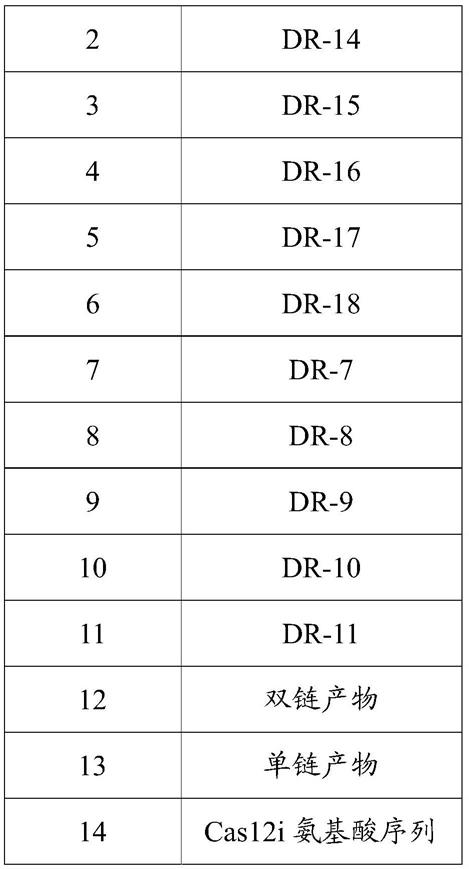
133.植物
134.术语“植物”应理解为能够进行光合作用的任何分化的多细胞生物,在包括处于任何成熟或发育阶段的作物植物,特别是单子叶或双子叶植物,蔬菜作物,包括洋蓟、球茎甘蓝、芝麻菜、韭葱、芦笋、莴苣(例如,结球莴苣、叶莴苣、长叶莴苣)、小白菜(bok choy)、黄肉芋、瓜类(例如,甜瓜、西瓜、克伦肖瓜(crenshaw)、白兰瓜、罗马甜瓜)、油菜作物(例如,球芽甘蓝、卷心菜、花椰菜、西兰花、羽衣甘蓝、无头甘蓝、大白菜、小白菜)、刺菜蓟、胡萝卜、洋白菜(napa)、秋葵、洋葱、芹菜、欧芹、鹰嘴豆、欧洲防风草、菊苣、胡椒、马铃薯、葫芦(例如,西葫芦、黄瓜、小西葫芦、倭瓜、南瓜)、萝卜、干球洋葱、芜菁甘蓝、紫茄子(也称为茄子)、婆罗门参、苣菜、青葱、苦苣、大蒜、菠菜、绿洋葱、倭瓜、绿叶菜类(greens)、甜菜(糖甜菜和饲料甜菜)、甘薯、唐莴苣、山葵、西红柿、芜菁、以及香辛料;水果和/或蔓生作物,如苹果、杏、樱桃、油桃、桃、梨、李子、西梅、樱桃、榅榅、杏仁、栗子、榛子、山核桃、开心果、胡桃、柑橘、蓝莓、博伊增莓(boysenberry)、小红莓、穗醋栗、罗甘莓、树莓、草莓、黑莓、葡萄、鳄梨、香蕉、猕猴桃、柿子、石榴、菠萝、热带水果、梨果、瓜、芒果、木瓜、以及荔枝;大田作物,如三叶草、苜蓿、月见草、白芒花、玉米/玉蜀黍(饲料玉米、甜玉米、爆米花)、啤酒花、荷荷芭、花生、稻、红花、小粒谷类作物(大麦、燕麦、黑麦、小麦等)、高粱、烟草、木棉、豆科植物(豆类、小扁豆、豌豆、大豆)、含油植物(油菜、芥菜、罂粟、橄榄、向日葵、椰子、蓖麻油植物、可可豆、落花生)、拟南芥属、纤维植物(棉花、亚麻、大麻、黄麻)、樟科(肉桂、莰酮)、或一种植物如咖啡、甘蔗、茶、以及天然橡胶植物;和/或花坛植物,如开花植物、仙人掌、肉质植物和/或观赏植物,以及树如森林(阔叶树和常绿树,如针叶树)、果树、观赏树、以及结坚果的树(nut-bearing tree)、以及灌木和其他苗木。
135.发明的有益效果
136.与现有技术相比,本发明提供的包含碱基突变的同向重复序列的grna可以改善cas酶的活性。
137.下面将结合附图和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
138.序列信息
139.本发明涉及的部分序列信息提供如下:
140.141.附图说明
142.图1.cas12i的grna的野生型dr所形成的茎环结构。
143.图2.琼脂糖凝胶电泳法,采用不同的grna检测cas12i的cis切割活性。
144.图3.荧光法,采用不同的grna检测cas12i的trans切割活性。
145.实施方式
146.现参照下列意在举例说明本发明(而非限定本发明)的实施例来描述本发明。
147.除非特别指明,否则基本上按照本领域内熟知的以及在各种参考文献中描述的常规方法进行实施例中描述的实验和方法。例如,本发明中所使用的免疫学、生物化学、化学、分子生物学、微生物学、细胞生物学、基因组学和重组dna等常规技术,可参见萨姆布鲁克(sambrook)、弗里奇(fritsch)和马尼亚蒂斯(maniatis),《分子克隆:实验室手册》(molecular cloning:alaboratory manual),第2次编辑(1989);《当代分子生物学实验手册》(current protocols in molecular biology)(f.m.奥苏贝尔(f.m.ausubel)等人编辑,(1987));《酶学方法》(methods in enzymology)系列(学术出版公司):《pcr 2:实用方法》(pcr 2:apractical approach)(m.j.麦克弗森(m.j.macpherson)、b.d.黑姆斯
(b.d.hames)和g.r.泰勒(g.r.taylor)编辑(1995))、哈洛(harlow)和拉内(lane)编辑(1988)《抗体:实验室手册》(antibodies,alaboratory manual),以及《动物细胞培养》(animal cell culture)(r.i.弗雷谢尼(r.i.freshney)编辑(1987))。
148.另外,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。本领域技术人员知晓,实施例以举例方式描述本发明,且不意欲限制本发明所要求保护的范围。本文中提及的全部公开案和其他参考资料以其全文通过引用合并入本文。
149.实施例1、针对cas12蛋白的grna的优化
150.本实施例,为了改善cas12i(氨基酸序列如seq id no.14所示)的活性,对其grna的同向重复序列进行碱基突变,突变后的不同的grna的同向重复序列如seq id no:2-11所示,不同的同向重复序列突变的位点如下表所示:
151.表1.不同类型grna的direct repeat序列
152.153.野生型的同向重复序列(dr-wt)可以形成如图1所示的茎环结构,其5’到3’端的序列为agagaaugugugcauagucacac;依次包括第一区段agagaau、第二区段gugug、第三区段cauagu和第四区段cacac;其中,第二区段和第四区段可以形成茎环结构的茎区。dr-14、dr-15、dr-16、dr-17、dr-18与dr-wt相比,在第四区段的不同碱基处分别有1个碱基突变,从而导致其形成的茎环结构的茎区部分存在1个不匹配的碱基对。
154.实施例2、琼脂糖凝胶电泳法,检测在不同grna的作用下,cas12i的cis切割活性
155.1.设计靶序列
156.pcr扩增如seq id no.12所示的序列,得到pcr双链产物;并在此pcr产物上选取grna的靶向序列为:augcagaguucacuuuug;采用包含如seq id no:1-11所示的dr区的grna,将其同向重复序列与上述靶向序列连接,得到不同的grna,同向重复序列置于靶向序列的5’端。
157.2.cis切割活性检测
158.按照如下体系加样,不同的是样品中分别添加包含如seq id no.1-11所示的dr区的不同的grna。加样完成后,在37℃反应30min,之后在80℃使蛋白失活20min。
[0159][0160]
反应完成后在2%的page胶上跑胶,结果如图2所示:
[0161]
最上一条带为未被cas蛋白切割的pcr产物,全长613bp,中间条带和最下一条带是pcr产物被cas蛋白切割后的产物,分别为大约400bp和大约210bp,符合设计的靶序列时的预期。最右的泳道为pcr产物的对照,只有最上一条带,并且颜色很深,没有其他杂带,可以证明中间条带和最下条带是pcr产物切割而形成的。
[0162]
对比不同grna所对应的不同泳道,经过相同时间的切割反应,dr-wt(在附图中为i3-wt)和dr-7、dr-8、dr-9、dr-10、dr-11的pcr产物都有三条带,但是dr-14、dr-15、dr-16、dr-17、dr-18只有一条明显的亮带,即全长pcr产物,切割产物带很弱。也就是说,相较于野生型的grna,包含突变的dr-7、dr-8、dr-9、dr-10、dr-11的grna在与cas12i一起使用进行基因编辑时,cas12i的cis切割活性变化不大;包含突变的dr-14、dr-15、dr-16、dr-17、dr-18的grna在与cas12i一起使用进行基因编辑时,cas12i的cis切割活性明显减弱。
[0163]
实施例3、荧光法,检测在不同grna的作用下,cas12i的trans切割活性
[0164]
本实施方式采用如下方案检测在不同grna的作用下,cas12i的trans切割活性的变化。本实施方式基于如下原理,利用grna引导cas12i蛋白识别并结合在靶核酸上;随后,
cas12i蛋白激发trans切割活性,切割体系里的单链核酸检测器;单链核酸检测器的两端分别设置荧光基团和淬灭基团,如果单链核酸检测器被切割,则会激发荧光,通过荧光值反映cas12i的trans切割活性。
[0165]
1.设计靶序列
[0166]
grna的靶向序列为:augcagaguucacuuuug。采用包含如seq id no:1-11所示的dr区的grna,将其同向重复序列与上述靶向序列连接,得到不同的grna,同向重复序列置于靶向序列的5’端。
[0167]
2.trans切割活性检测
[0168]
按照如下体系加样,不同的是样品中分别添加包含如seq id no:1-11所示的dr区的不同的grna。加样完成后,在37℃反应30min,使用荧光pcr仪器,每隔一分钟取一次荧光。
[0169]
本实施方式中,采用dsdna(seq id no.12所示)和ssdna(seq id no.13所示),分别检测不同grna的针对双链靶核酸(dsdna)和针对单链靶核酸(ssdna)的trans切割活性。
[0170][0171][0172]
上述reporter即单链核酸检测器。
[0173]
结果如图3所示:每种grna对应三个荧光条,ntc为空白对照的荧光值,ssdna的荧光值代表cas蛋白以ssdna为靶核酸时的trans活性,dsdna的荧光值代表cas蛋白以dsdna为靶核酸时的trans活性。
[0174]
对比不同grna所对应的荧光值,dr-wt(在附图中为wt)和dr-7、dr-8、dr-9、dr-10、dr-11所对应的dsdna的荧光值和ssdna的荧光值无显著差别;但是,与dr-wt(在附图中为wt)相比,dr-14、dr-15、dr-16、dr-17、dr-18的dsdna的荧光值降低显著,但ssdna的荧光值可保持或略微降低。
[0175]
结合实施例2-3可知,相较于野生型grna,包含突变的dr-7、dr-8、dr-9、dr-10、dr-11的grna在与cas12i一起使用进行基因编辑时,cas12i的cis切割活性和trans切割活性无明显变化。
[0176]
包含突变的dr-14、dr-15、dr-16、dr-17、dr-18的grna在与cas12i一起使用进行基因编辑时,cas12i的cis切割活性显著降低(图2);但是,其trans活性可以大部分的保留,至少trans活性降低的程度要远远低于cis活性降低的程度,尤其在以ssdna为靶核酸时的trans活性至少能够保留60%。从某种程度上而言,包含突变的dr-14、dr-15、dr-16、dr-17、dr-18的grna在与cas12i一起使用进行基因编辑时,cas12i的trans切割活性与cis切割活性的比例(trans切割活性/cis切割活性)明显升高,这可以拓展cas蛋白的应用空间,尤其是对于需要抑制cas蛋白的cis活性同时保留其trans活性时的应用场景。
[0177]
尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公布的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部分为由所附权利要求及其任何等同物给出。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1