OCT4高选择性活化剂的制作方法
oct4高选择性活化剂
技术领域
1.本发明涉及医药领域,具体涉及oct4高选择性活化剂,其药物组合物及制备方法,及其在调控oct4及其关联基因的调控中的应用。
背景技术:
2.再生医学是指利用多种新型技术学科来重建老化或功能损失的组织和器官,并通过多种医学手段来进行相关疾病治疗的新兴科学。再生医学的重要研究方向为正常组织特征与功能的机理,创伤后修复的生物学基础,以及组织器官的再生机制及多种干细胞分化机理,从而最终获得有效的生物治疗方法。其中,胚胎干细胞(embryonic stem cell,escs,简称es、ek或esc细胞)是早期再生医学研究中最受人瞩目的细胞类型。但是这一细胞的获得和使用均具有较大的伦理争议,因为进行胚胎干细胞研究就必须破坏胚胎,而胚胎是人尚未成形时在子宫的生命形式。这一伦理争议大大阻碍了再生医学的推进和应用。
3.2006年,山中伸弥的团队发明了一种由oct4,sox2,klf4和c-myc四种转录因子构成的“鸡尾酒”法,能够成功将终端分化的皮肤成纤维细胞重编程成为具有分化多能性的干细胞,这种干细胞被称为诱导多能干细胞(induced pluripotent cells)(takahashi k,et al.,cell,2006,126(4)pp.663-676;takahashi k and yamanaka s,cell,2007,131(5)pp.861-872)。这些干细胞具有和胚胎干细胞(embryonic stem cells)类似的分化潜能,能够形成人体发育最基本的三个胚层:外胚层,中胚层及内胚层,并最终形成多种成体细胞。这一发明突破了在医学上使用人胚胎干细胞的伦理限制,大大拓展了干细胞技术在临床医学上的应用潜力。
4.在诱导多能干细胞及胚胎干细胞的研究中,oct4已被证明是重编程和诱导细胞可塑性的主要调节基因(malik,v et al.,nat.commun.2019,10,3477)。oct4基因编码的蛋白质在胚胎发育和干细胞多能性中起关键作用,选择性剪接导致多种转录物变体。oct4编码的蛋白质属于转录因子的pou结构域家族,位于chromosome 17:35,825,200-35,829,401。pou转录因子家族的标志性特征是pou域,它由两个结构独立的亚域组成:一个由高度保守75个氨基酸构成的pou特异(pou)区和一个60个氨基酸的羧基末端同源域(pouh)。oct4的表达在转录水平受到oct4基因上游的顺式作用元件和染色质结构甲基化的调控(klemm jd,et al.,cell,1994,77:21-32;brehm a,et al.,mol cell biol 1997;17:154-62)。yeom等人通过分析来自oct4基因组基因座的18kb片段控制下lacz报告基因的表达,确定了两个元素,他们将其命名为可能需要调节的近端增强子(pe)和远端增强子(de),他们在这两个增强子中确定了转录因子的精确结合位点(yeom y,et al.integrated ann indexes 1996;122:881-94)。pou域转录因子与特定的八聚体dna结合并调节细胞类型特异性的分化途径。其中,在ipsc形成过程中,含有pou结构域的oct4和含有hmg结构域的sox2是维持多能细胞多能性至关重要的转录因子(nichols,j.,et al.,cell,1998,95,379
–
391;avilion,a.,et al.,2003,genes dev.17,126
–
140),它们在多能细胞中的至少部分功能是通过两者之间的协同相互作用来驱动靶基因的转录(tomioka,m.,et al.nucleic acids res.2002;30,
3202
–
3213)。这些发现表明发育上的转换可以通过oct4来控制。而目前广泛使用的重编程方法多通过病毒或者其它类型的载体来过表达oct4(takahashi k,et al.,cell,2006,126(4):663-676;takahashi k and yamanaka s,cell,2007,131(5):861-872);yu j,et al.science.2007;318:1917
–
1920)。此类方法在诱导多能干细胞(ipsc)的临床使用上存在潜在的临床风险,例如病毒载体的使用带来的致瘤性隐患;此外,载体的复杂gmp生产工艺也带来了诱导多能干细胞临床监管复杂性,进一步的,此类产品会因为载体的使用带来成本的高昂。
5.基于上述原因,本发明设计并使用苯并咪唑衍生物及氨基吡啶衍生物,通过oct4启动子的化学调节,实现对其下游基因的表达调控。从而避免了使用病毒或者其它载体对oct4的调控,进一步实现安全简便的化学小分子启动生物学表达功能。
技术实现要素:
6.本发明涉及式(i)结构的化合物或其药学上可接受的盐、溶剂化物、活性代谢物、多晶型物、酯、光学异构体或前药,包含式(i)结构的化合物的药物组合物及其作为oct4高选择性活化剂用于细胞的重编程。
7.本发明提供了一种式(i)结构的化合物:
[0008][0009]
其中:
[0010]
a1是
[0011]
m1和m2分别为0或1;
[0012]
a2是c1-c6亚烷基、c2-c6亚烯基、-o(ch2)q-、-nr
1-、-so
2-、-(ch2)vnhs(o)
2-或键,其中,q为1或2或3或4,v为0或1或2,r1选自h或c1-c4烷基;
[0013]
a3是c1-c6烷基;c2-c6烯基;c4-c6环烷基,其中一个碳原子可被n、o、s杂原子取代;z和z1分别为n或cr2,r2选自h、卤素、c1-c4烷基或氰基;z3为n、o、s或c=o,当z4和z5之间的键为单键时,z4为n或ch,z5为ch2或c=o,当z4和z5之间的键为双键时,z4为c,z5为ch;
[0014]
及其药物上可接受的盐、溶剂化物、活性代谢物、多晶型物、酯、光学异构体、前药或其组合。
[0015]
在某些实施方案中,本发明公开的化合物具有式(ii)或式(iii):
[0016][0017]
其中:
[0018]
a2是-ch
2-、-ch=ch-、-c(ch3)=ch-、-o(ch2)-、-o(ch2)
2-、-nh-、-n(ch3)-、-nhs(o)
2-、-(ch2)2nhs(o)
2-或不存在。
[0019]
a3是-ch3、丁烯基、、丁烯基、、丁烯基、
[0020]
在一些实施例中:m1是0,m2是1;
[0021]
a2是-n(ch3)-;
[0022]
a3是
[0023]
在一些实施例中:m1是1,m2是0;
[0024]
a2是-ch
2-、-so
2-、-(ch2)2nhs(o)
2-或键;
[0025]
a3是-ch3、
[0026]
在一些实施例中:m1是1,m2是1;
[0027]
a2是-ch
2-、-nh-、-c(ch3)=ch-或键;
[0028]
a3是-ch3、-c(ch3)=ch-ch3、、
[0029]
在一些实施例中:m1是0,m2是0;
[0030]
a2是-ch
2-、-ch=ch-、-o(ch2)-、-o(ch2)
2-或键;
[0031]
a3是
[0032]
在一些实施例中,化合物为:
[0033][0034]
本发明涉及药物组合物,药物组合物包含上述中任意一项的化合物及其药物上可接受的盐、溶剂化物、活性代谢物、多晶型物、酯、光学异构体、前药或其组合,以及至少一种药学上可接受的载体或赋形剂。
[0035]
本发明涉及上述任意一项的所述的化合物和/或其药物上可接受的盐、溶剂化物、活性代谢物、多晶型物、酯、光学异构体、前药或其组合在制备诱导多能干细胞的oct4高选择性活化剂的药物中的用途。
[0036]
本发明涉及在制备诱导多能干细胞的oct4高选择性活化剂的药物中的用途,其oct4高选择性活化剂诱导多能干细胞治疗的疾病包括癌症、心脏病、中风、糖尿病、肥胖、阿尔茨海默氏病、帕金森氏病、肌萎缩侧索硬化、心肌梗塞、肌营养不良、cmt-1a、脊髓损伤、外伤性脑损伤、缺牙、伤口愈合、骨髓移植、骨关节炎、类风湿性关节炎、脱发、失明、耳聋、克罗恩氏病和遗传疾病及其他相似疾病。
[0037]
本发明涉及一种在患有疾病的受试者中获得诱导多能干细胞的方法,该方法包括向该受试者施用治疗有效量的上述任一项的化合物和/或其药物上可接受的盐、溶剂化物、
活性代谢物、多晶型物、酯、光学异构体、前药或其组合。
[0038]
所述方法中,患有疾病的受试者是指患有癌症、心脏病、中风、糖尿病、肥胖、阿尔茨海默氏病、帕金森氏病、肌萎缩侧索硬化、心肌梗塞、肌营养不良、cmt-1a、脊髓损伤、外伤性脑损伤、缺牙、伤口愈合、骨髓移植、骨关节炎、类风湿性关节炎、脱发、失明、耳聋、克罗恩氏病和遗传疾病及其他相似疾病的人类。
[0039]
本发明涉及一种活化oct4功能的方法,其包括使上述任一项的化合物和/或其药物上可接受的盐、溶剂化物、活性代谢物、多晶型物、酯、光学异构体、前药或其组合与oct4靶标蛋白接触。
具体实施方式
[0040]
在本发明中,以下定义是可适用的:
[0041]
本文的术语“烷基”是指含有1-12个碳原子的直链或支链饱和烃。(c1-c6)烷基的实例包括但不限于甲基、乙基、丙基、丁基、戊基、己基、异丙基、异丁基、仲丁基、叔丁基、异戊基、新戊基和异己基。
[0042]
术语“烯基”是指含有2-12个碳原子的直链或支链不饱和烃,在链中含有至少一个c=c双键。烯基的实例包括乙烯基、丙烯基、正丁烯基、异丁烯基、戊烯基或己烯基。
[0043]
术语“亚烷基”:是指二价烷基。单价烷基中的任一个可通过从烷基中夺取第二氢原子而为亚烷基。如本文所定义,亚烷基还可以是c1-c6亚烷基。亚烷基可进一步是c1-c4亚烷基。典型的亚烷基包括但不限于:-ch
2-、-ch(ch3)-、-c(ch3)
2-、-ch2ch
2-、-ch2ch(ch3)-、-ch2c(ch3)
2-、-ch2ch2ch
2-、-ch2ch2ch2ch
2-等。
[0044]
术语“亚烯基”:是指二价烯基。单价烯基中的任一个可通过从烯基中夺取第二氢原子而为亚烯基。如本文所定义,亚烯基可进一步是c2-c6亚烯基。典型的亚烯基包括但不限于:-ch=ch-、-ch=c(ch3)-、-ch=chch
2-、-ch=chch2ch
2-、-ch=chch2ch2ch
2-、-ch=chch2ch2ch2ch
2-等。
[0045]
术语“环烷基”是指含有3-18个碳原子的单环饱和碳环。环烷基可进一步是c4-c6环烷基。环烷基的实例包括但不限于环丙基、环丁基、环戊基、环己基、环庚基、环辛基等。
[0046]
术语“卤素”是指氟、氯、溴或碘。
[0047]
术语“氰基”是指具有通过三键(即c≡n)与氮原子连接的碳原子的取代基。
[0048]
本文所用的术语“取代”,指的是指定的原子或基团上的任意一个或多个氢原子被选自指定的范围中的基团替换,条件是不超过所述指定原子的正常化合价。
[0049]
本文所述的化合物包括但不限于:它们的光学异构体、外消旋体以及其他混合物。在这些情况下,单个对映异构体或非对映异构体,即光学活性构型,可以通过不对称合成或通过拆分外消旋体或非对映异构体混合物来获得。对于外消旋体或非对映异构体混合物的拆分,可通过常规的方法来完成,例如在拆分剂存在下结晶或使用例如手性高压液相色谱(hplc)柱的色谱法完成。此外,这些化合物包括r-和s-构型的具有手性中心的化合物。这些化合物还包括晶型,包括多晶型物和包合物。类似地,术语“盐”也包括了所述化合物的盐的所有异构体、外消旋体、其他混合物、r-和s-构型、互变异构体和晶型。
[0050]“药物上可接受的盐”,指的是无毒的、生物学上可耐受的或其他方面在生物学上适合于给予治疗个体的式(i)、式(ii)或式(iii)代表的化合物的游离酸或碱的盐。一般参
见:s.m.berge,et al.,“pharmaceutical salts”,j.pharm.sci.,1977,66:1-19,以及handbook ofpharmaceutical salts,properties,selection,and use,stahl and wermuth,eds.,wiley-vch and vhca,zurich,2002。优选地药学上可接受的盐是指那些药理学上有效的并且适合于接触病人组织而无异常毒性、刺激或过敏反应的盐。式(i)、式(ii)或式(iii)的化合物可以具有足够的酸性基团、足够的碱性基团或兼具这两种类型的功能基团,并相应地与一些无机或有机碱、及无机和有机酸反应,形成一种药学上可接受的盐。药学上可接受的盐的实例包括硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、磷酸盐、单氢磷酸盐、二氢磷酸盐、偏磷酸盐、焦磷酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、醋酸盐、丙酸盐、癸酸盐、辛酸盐、丙烯酸盐、甲酸盐、异丁酸盐、己酸盐、庚酸盐、丙炔酸盐、草酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、丁炔-1,4-二酸盐、己炔-1,6-二酸盐、苯甲酸盐、氯代苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、邻苯二甲酸盐、磺酸盐、二甲苯磺酸盐、苯乙酸盐、苯丙酸盐、苯丁酸盐、柠檬酸盐、乳酸盐、γ-羟基丁酸盐、羟乙酸盐、酒石酸盐、甲烷磺酸盐、丙磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐和扁桃酸盐。
[0051]“溶剂化物”例如“水合物”是通过溶剂与化合物的相互作用形成的。术语“化合物”包括化合物的溶剂化物,包括水合物。同样地,“盐”包括盐的溶剂化物,例如水合物。合适的溶剂化物是药学上可接受的溶剂化物,例如水合物,包括一水合物和半水合物。
[0052]“前药”可指指定化合物的前体,它在对受治疗者施用后,在体内经化学或生理学过程(如溶剂分解、酶分解)或在生理条件下(如在生理ph条件下将前药转化为式(i)化合物),得到该化合物。“药学上可接受的前药”是无毒的、生物学上耐受的或其它方面在生物学上适宜对受治疗者施用的前药。示例性的选择和制备合适的前药衍生物的程序在例如h.bundgaard编著的“design of prodrugs”,elsevier,1985中有描述。
[0053]“活性代谢物”指式(i)、式(ii)或式(iii)化合物或其盐在体内代谢的药学活性产物。可用本领域已知的或可获得的常规技术测定化合物的前药和活性代谢物。例如见bertolini等,j.med.chem.1997,40,2011-2016;shan等,j.pharm.sci.1997,86(7),765-767;bagshawe,drug dev.res.1995,34,220-230;bodor,adv.drug res.1984,13,224-331;bundgaard,design of prodrugs(elsevierpress,1985);及larsen,design and application of prodrugs,drug design anddevelopment(krogsgaard-larsen et al.,eds.,harwood academic publishers,1991)
[0054]“治疗有效量”是指当施用于哺乳动物(优选人)时足以实现哺乳动物(优选人)的疾病或病症的治疗(如以下定义)的本文公开的化合物的量。构成“治疗有效量”的公开的化合物的量将随着化合物、病症及其严重性和被治疗的哺乳动物的年龄而变化,但是可以由本领域普通技术人员根据他自己的知识和本文公开内容来常规确定。
[0055]
术语“治疗”,指的是给予个体施用本文所述的至少一种化合物和/或至少一种其药学上可接受的盐,以减缓(减少)不希望发生的生理变化或疾病,例如炎症或癌症的发展或扩散。本发明的目的,有益的或期望的临床结果包括但不限于:减轻症状、减少疾病的严重程度、稳定(即,不恶化)疾病的状态、延迟或延缓疾病进展、改善或缓和病情、以及缓解(无论是部分还是全部)无论是检测到的还是检测不到的疾病。与那些不接受治疗的预计生存期相比,“治疗”也意味着可以延长生存期。需要治疗的个体包括具有这些疾病的症状或
患有这些疾病的个体。
[0056]
药物组合物
[0057]
本发明提供了药物组合物,其包含一种或多种文中所述的化合物或其药学上可接受的盐或酯作为活性成分,以及一种或多种药学上可接受的赋形剂、载体,包括惰性固体稀释剂和填料、稀释剂,包括无菌水溶液和多种有机溶剂、渗透促进剂、增溶剂和助剂。该药物组合物可以单独给药或与其他治疗剂一起给药。此类组合物以药学领域公知的方式制备。
[0058]
该药物组合物可以单剂量或多剂量,通过任一具有类似用途的药剂的可接受的方式给药,例如在此引入作为参考的那些专利和专利申请中所描述的,包括直肠、口含、鼻内和透皮途径、通过动脉内注射、静脉、腹膜内、肠胃外、肌内、皮下、口服、局部、作为吸入剂,或通过植入或包衣设备如支架,例如或者动脉插入柱状聚合物。
[0059]
本发明还提供试剂盒,其包括包含本发明化合物或其药学上可接受的盐的药物组合物,和至少一种药学上可接受的载体。
[0060]“药学上可接受的载体或赋形剂”是指无毒的、生物学上可耐受的并且其他在生物学上适用于给予个体的物质,例如惰性物质,其被加入到药理学组合物中或者用作媒介、载体或稀释以方便活性成分的给药并与之相容。赋形剂的实例包括碳酸钙、磷酸钙、各种类型的糖或淀粉、纤维素衍生物、明胶、植物油和聚乙二醇。
[0061]
化合物及其组合物的用途
[0062]
本发明提供了化合物及其组合物的用途,其主要作为oct4高选择性活化剂,用于活化oct4功能,通过对oct4启动子的化学调节,实现对其下游基因的表达调控,进而在患有疾病的受试者中诱导多能干细胞,实现治疗疾病的目的,所述疾病包括癌症、心脏病、中风、糖尿病、肥胖、阿尔茨海默氏病、帕金森氏病、肌萎缩侧索硬化、心肌梗塞、肌营养不良、cmt-1a、脊髓损伤、外伤性脑损伤、缺牙、伤口愈合、骨髓移植、骨关节炎、类风湿性关节炎、脱发、失明、耳聋、克罗恩氏病和遗传疾病及其他相似疾病。
[0063]
在以下实施例和本文其他地方使用到的缩写列表:
[0064]
atm:气氛;boc:叔丁氧基羰基;(boc)2o:二叔丁基二碳酸酐;ch2cl2:二氯甲烷;cs2co3:碳酸铯;cu(i)br:溴化铜;cu2so4:硫酸亚铜;dcm:二氯甲烷;dmac:n,n-二甲基乙酰胺;dmf:n,n-二甲基甲酰胺;diea:n,n-二异丙基乙胺;diox:1,4-二氧六环;dioxane:二氧六环;ea:乙酸;et3n:三乙胺;etoh:乙醇;etoac:乙酸乙酯;fa:甲酸;g:克;h:小时;h2:氢气;hatu:2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯;hbr:氢溴酸;(hbim)bf4:1-丁基咪唑四氟硼酸盐;h2o:水;hac:乙酸;h2o2:过氧化氢;h2so4:发烟硫酸;kcn:氰化钾;k2co3:碳酸钾;li:锂;mca:氯乙酸;mecn:乙腈;meoh:甲醇;mg:毫克;ml:毫升;mmol:毫摩尔;mol:摩尔;m/z:质荷比;n2:氮气;nabh3cn:氰基硼氢化钠;nano2:亚硝酸钠;naoh:氢氧化钠;naome:甲醇钠;na2so4:硫酸钠;ni(oac)
2 4h2o:四水合二乙酸镍;pd-c:钯碳;ph:酸碱度;tbn:亚硝基叔丁酯;tea:三乙醇胺;thf:四氢呋喃;tlc:薄层色谱;xylene:二甲苯。
[0065]
以下配合图式及本发明的实施例,进一步阐述本发明为达成预定发明目的所采取的技术手段。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的原料、试剂材料等,如无特殊说明,均为市售购买产品。
[0066]
通用合成
[0067]
本技术中所给的描述的通用合成路线可以通过用具有类似结构的其他原料替换
起始原料,从而相应地得到不同的产物而进行变化。下面的合成路线描述给出了起始原料可如何变化得到相应产物的多个实例。
[0068]
通用方法a-1-n
[0069][0070]
其中r为其中q为1或2或3或4,z和z1分别为n或cr2,r2选自h、卤素、c1-c4烷基或氰基。
[0071]
通用方法a-2-n
[0072][0073]
其中r为c2-c6烯基;c6烯基;其中,q为1或2或3或4,z和z1分别为n或cr2,r2选自h、卤素、c1-c4烷基或氰基,r1选自h或c1-c4烷基,z3为n、o、s或c=o。
[0074]
通用方法a-4-n
[0075][0076]
其中r为其中q为1或2或3或4,z和z1分别为n或cr2,r2选自h、卤素、c1-c4烷基或氰基。
[0077]
通用方法a-6-n
[0078][0079]
其中r为c4-c6环烷基,其中一个碳原子可被n、o、s杂原子取代;或r=o为
其中q为1或2或3或4,z和z1分别为n或cr2,r2选自h、卤素、c1-c4烷基或氰基。
[0080]
通用方法b-1-n
[0081][0082]
其中r的定义同通用方法a-1-n中r的定义。
[0083]
通用方法b-3-n
[0084][0085]
其中r的定义同通用方法a-2-n中r的定义。
[0086]
通用方法b-4-n
[0087][0088]
其中r的定义同通用方法a-4-n中r的定义。
[0089]
通用方法b-6-n
[0090][0091]
其中r的定义同通用方法a-6-n中r的定义。
[0092]
中间体合成
[0093]
中间体
ⅰ‑
3:(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯
[0094]
合成路线:
[0095][0096]
步骤1:将6-甲基-5-硝基吡啶-2-胺i-1(15.3g,0.1mol)与二叔丁基二碳酸酐(26.2g,0.12mol)与k2co3(69g,0.5mol)混合,添加四氢呋喃(200ml),室温搅拌3小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用水洗涤,用硫酸钠干燥,减压蒸馏除去溶剂,得到(6-甲基-5-硝基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
2(23.3g,92%)液相质谱m/z=254.1[m+h]+
[0097]
步骤2:将上述(6-甲基-5-硝基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
2(12.7g,0.05mol)与10%pd-c(1g)和meoh(100ml)在氢气氛(1atm)下在室温下搅拌2h。过滤混合物,减压蒸馏
除去溶剂,得到中间体(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
3(11g,98%)液相质谱m/z=224.1[m+h]+
[0098]
中间体ii-3:1h-苯并[d]咪唑-6-醇
[0099][0100]
合成路线:
[0101][0102]
步骤1:中间体1h-苯并[d]咪唑-6-重氮ii-2
[0103]
1h-苯并[d]咪唑-6-胺(67mg,0.5mmol)中添加水(2ml)和20%的h2so4水溶液(1ml)。在冰冷却下向混合物中添加亚硝酸钠水溶液(42mg,0.6mmol)溶液(0.5ml)和乙腈(2ml),并将混合物搅拌30分钟。向获得的反应混合物中添加室温下存于20%hbr水溶液(0.5ml)中的cu2so4(67mg,0.3mmol)溶液,并且在80℃下将混合物搅拌30分钟。向反应混合物中加入乙酸乙酯和水。分离有机层,用盐水冲洗,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(氯仿:甲醇=50:1)纯化得到i
ⅰ‑
2的硫酸氢盐(85mg,70%),液相质谱m/z=145.1[m]+。
[0104]
步骤2:中间体1h-苯并[d]咪唑-6-醇ii-3
[0105]
将1h-苯并[d]咪唑-6-重氮的硫酸氢盐(48mg,0.2mmol)的水溶液(1ml),滴加到100℃的40%硫酸水溶液(5ml)中,并将混合物搅拌10分钟。向获得的反应混合物中添加naoh至ph约为3,向反应混合物中加入乙酸乙酯,分离有机层,用盐水冲洗,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(氯仿:甲醇=50:1)纯化得到i
ⅰ‑
3(19mg,69%),液相质谱m/z=134.1[m+h]+。
[0106]
实施例1:3-(((6-氨基-2-甲基吡啶-3-基)氧基)甲基)苯甲腈a-1-1
[0107][0108]
步骤1:(3-氰基苯基)甲醇锂
ⅰ‑
5-1
[0109]
将(3-氰基苯基)甲醇(20mg,0.15mol)与金属锂(12mg,1.73mmol)混合,添加四氢呋喃(3ml)20℃下搅拌3h.过滤混合物,减压蒸馏除去溶剂,得到(3-氰基苯基)甲醇锂
ⅰ‑
5-1(20mg,96%)。
[0110]
步骤2:3-(((6-氨基-2-甲基吡啶-3-基)氧基)甲基)苯甲腈
[0111]
将(3-氰基苯基)甲醇锂
ⅰ‑
5-1(20mg,0.14mol)与5-溴-6-甲基吡啶-2-胺
ⅰ‑
6(32mg,0.17mol)混合,加入溴化亚铜(28mg,0.2mol),甲醇(1ml),n,n二甲基甲酰胺(3ml),油浴加热110℃下搅拌1h。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(二氯甲烷:甲醇=40:1)纯化得到3-(((6-氨基-2-甲基吡啶-3-基)氧基)甲基)苯甲腈a-1-1(26g,78%)液相质谱m/z=240.1[m+h]+
[0112]
实施例2:6-甲基-5-苯乙氧基吡啶-2-胺a-1-2
[0113][0114]
步骤1:2-苯基乙醇锂
ⅰ‑
5-2
[0115]
将2-苯基乙醇(18mg,0.15mol)与金属锂(12mg,1.73mmol)混合,添加四氢呋喃(3ml)20℃下搅拌3h.过滤混合物,减压蒸馏除去溶剂,得到2-苯基乙醇锂
ⅰ‑
5-2(18mg,94%)。
[0116]
步骤2:6-甲基-5-苯乙氧基吡啶-2-胺a-1-2
[0117]
将2-苯基乙醇锂
ⅰ‑
5-2(18mg,0.14mol)与5-溴-6-甲基吡啶-2-胺(32mg,0.17mol)混合,加入溴化亚铜(28mg,0.2mol),甲醇(1ml),n,n二甲基甲酰胺(3ml),油浴加热110℃下搅拌1h。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(二氯甲烷:甲醇=40:1)纯化得到6-甲基-5-苯乙氧基吡啶-2-胺(22g,69%)液相质谱m/z=228.1[m+h]+
[0118]
实施例3:n-(6-氨基-2-甲基吡啶-3-基)噻吩-3-甲酰胺a-2-1
[0119][0120]
步骤1:(6-甲基-5-(噻吩-3-甲酰胺基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-1
[0121]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与噻吩-2-羧酸(15mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到(6-甲基-5-(噻吩-3-甲酰胺基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-1(16mg,48%)液相质谱m/z=334.1[m+h]+
[0122]
步骤2:n-(6-氨基-2-甲基吡啶-3-基)噻吩-3-甲酰胺
[0123]
向(6-甲基-5-(噻吩-3-甲酰胺基)吡啶-2-基)氨基甲酸叔丁酯(16mg,0.05mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到n-(6-氨基-2-甲基吡啶-3-基)噻吩-3-甲酰胺a-2-1(11mg,94%)液相质谱m/z=234.0[m+h]+
[0124]
实施例4:(e)n-(6-氨基-2-甲基吡啶-3-基)-2-甲基-2-烯酰胺a-2-2
[0125][0126]
步骤1:(e)-(6-甲基-5-(2-甲基-2-烯酰胺基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-2
[0127]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与(e)-2-甲基-2-烯酸(12mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小
时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到(e)-(6-甲基-5-(2-甲基-2-烯酰胺基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-2(19mg,62%)液相质谱m/z=306.1[m+h]+
[0128]
步骤2:(e)n-(6-氨基-2-甲基吡啶-3-基)-2-甲基-2-烯酰胺
[0129]
向(e)-(6-甲基-5-(2-甲基-2-烯酰胺基)吡啶-2-基)氨基甲酸叔丁酯(19mg,0.06mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到(e)n-(6-氨基-2-甲基吡啶-3-基)-2-甲基-2-烯酰胺a-2-2(12mg,97%)液相质谱m/z=206.1[m+h]+
[0130]
实施例5:n-(6-氨基-2-甲基吡啶-3-基)-2,3-二氢苯并呋喃-2-甲酰胺a-2-3
[0131][0132]
步骤1:(5-(2,3-二氢苯并呋喃-2-甲酰胺)-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-3
[0133]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与苯并呋喃-2-羧酸(19mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到(5-(2,3-二氢苯并呋喃-2-甲酰胺)-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-3(20mg,55%)液相质谱m/z=370.2[m+h]+
[0134]
步骤2:n-(6-氨基-2-甲基吡啶-3-基)-2,3-二氢苯并呋喃-2-甲酰胺
[0135]
向(5-(2,3-二氢苯并呋喃-2-甲酰胺)-6-甲基吡啶-2-基)氨基甲酸叔丁酯(20mg,0.055mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到n-(6-氨基-2-甲基吡啶-3-基)-2,3-二氢苯并呋喃-2-甲酰胺a-2-3(11mg,74%)液相质谱m/z=270.1[m+h]+
[0136]
实施例6:n-(6-氨基-2-甲基吡啶-3-基)-3,4-二氯苯甲酰胺a-2-4
[0137][0138]
步骤1:(5-(3,4-二氯苯甲酰胺)-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-4
[0139]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与3,4-二氯苯甲酸(23mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到(5-(3,4-二氯苯甲酰胺)-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-4(20mg,51%)液相质谱m/z=396.1[m+h]+
[0140]
步骤2:n-(6-氨基-2-甲基吡啶-3-基)-3,4-二氯苯甲酰胺a-2-4
[0141]
向(5-(3,4-二氯苯甲酰胺)-6-甲基吡啶-2-基)氨基甲酸叔丁酯(20mg,0.05mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到n-(6-氨基-2-甲基吡啶-3-基)-3,4-二氯苯甲酰胺a-2-4(14mg,86%)液相质谱m/z=295.0[m+h]+
[0142]
实施例7:n-(6-氨基-2-甲基吡啶-3-基)苯并噻吩-2-甲酰胺a-2-5
[0143][0144]
步骤1:(5-(苯并噻吩-2-甲酰胺)-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-5
[0145]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与苯并噻吩-2-羧酸(21mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到(5-(苯并噻吩-2-甲酰胺)-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-5(22mg,57%)液相质谱m/z=384.1[m+h]
[0146]
步骤2:n-(6-氨基-2-甲基吡啶-3-基)苯并噻吩-2-甲酰胺
[0147]
向(5-(苯并噻吩-2-甲酰胺)-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.057mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到n-(6-氨基-2-甲基吡啶-3-基)苯并噻吩-2-甲酰胺a-2-5(11mg,68%)液相质谱m/z=284.1[m+h]+
[0148]
实施例8:n-(6-氨基-2-甲基吡啶-3-基)-2-苯乙酰胺a-2-6
[0149][0150]
步骤1:(6-甲基-5-(2-苯基乙酰胺)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-6
[0151]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与2-苯乙酸(16mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到(6-甲基-5-(2-苯基乙酰胺)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-6(18mg,53%)液相质谱m/z=342.2[m+h]+
[0152]
步骤2:n-(6-氨基-2-甲基吡啶-3-基)-2-苯乙酰胺:
[0153]
向(6-甲基-5-(2-苯基乙酰胺)吡啶-2-基)氨基甲酸叔丁酯(18mg,0.05mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到n-(6-氨基-2-甲基吡啶-3-基)-2-苯乙酰胺a-2-6(12mg,94%)液相质谱m/z
=242.1[m+h]+
[0154]
实施例9:n-(6-氨基-2-甲基吡啶-3-基)苯甲酰胺a-2-7
[0155][0156]
步骤1:中间体(5-苯甲酰胺基-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-7
[0157]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与2-苯甲酸(15mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到(5-苯甲酰胺基-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
8-7(15mg,46%)液相质谱m/z=328.2[m+h]+
[0158]
步骤2:n-(6-氨基-2-甲基吡啶-3-基)苯甲酰胺
[0159]
向(5-苯甲酰胺基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(15mg,0.046mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到n-(6-氨基-2-甲基吡啶-3-基)苯甲酰胺a-2-7(10mg,96%)液相质谱m/z=227.1[m+h]+
[0160]
实施例10:2-(6-氨基-2-甲基吡啶-3-基)异吲哚-1-酮a-3
[0161][0162]
其合成路线为:
[0163][0164]
步骤1:(6-甲基-5-(1-氧异吲哚-2-基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
10
[0165]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与2-甲酰基苯甲酸(18mg,0.12mmol)混合,添加甲酸(0.2ml),三乙胺(1ml),乙醇(1ml),将混合物加热至80℃搅拌60分钟。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(二氯甲烷:乙酸乙酯=20:1)纯化得到(6-甲基-5-(1-氧异吲哚-2-基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
10(20mg,59%)液相质谱m/z=340.4[m+h]+
[0166]
步骤2:2-(6-氨基-2-甲基吡啶-3-基)异吲哚-1-酮
[0167]
向(6-甲基-5-(1-氧异吲哚-2-基)吡啶-2-基)氨基甲酸叔丁酯(20mg,0.059mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到2-(6-氨基-2-甲基吡啶-3-基)异吲哚-1-酮a-3(12mg,85%)液相质谱m/z=240.1[m+h]+
甲基吡啶-2-基)氨基甲酸叔丁酯i-14-2(34mg,81%)液相质谱m/z=421.1[m+h]+
[0182]
步骤3:1-(6-氨基-2-甲基吡啶-3-基)-3-(对甲苯基)脲
[0183]
向(5-(3-(3-溴苯基)脲基)-6-甲基吡啶-2-基)氨基甲酸叔丁酯(34mg,0.08mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到1-(6-氨基-2-甲基吡啶-3-基)-3-(对甲苯基)脲a-4-2(20mg,78%)液相质谱m/z=321.0[m+h]+
[0184]
实施例13:6-氨基-n,2-二甲基-n-苯基烟酰胺a-5
[0185][0186]
其合成路线为:
[0187][0188]
步骤1:(5-溴-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
15
[0189]
将5-溴-6-甲基吡啶-2-胺(37mg,0.2mmol)与二叔丁基二碳酸酐(52mg,0.24mmol)与k2co3(69mg,0.5mmol)混合,添加四氢呋喃(5ml),室温搅拌3小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用水洗涤,用硫酸钠干燥,减压蒸馏除去溶剂,得到(5-溴-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
15(50mg,88%)液相质谱m/z=287.0[m+h]+
[0190]
步骤2:(6-甲基-5-(甲基(苯基)氨甲酰基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
17
[0191]
将(5-溴-6-甲基吡啶-2-基)氨基甲酸叔丁酯(50mg,0.175mmol)与n-甲基-n-苯基甲酰胺(27mg,0.175mmol)与甲醇钠(11mg,0.2mmol),四水合二乙酸镍(25mg,0.1mmol)混合,向其中加入1,4二氧六环(8ml),氦气保护下油浴110℃加热搅拌12h。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到(6-甲基-5-(甲基(苯基)氨甲酰基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
17(50mg,84%)液相质谱m/z=342.2[m+h]+
[0192]
步骤3:6-氨基-n,2-二甲基-n-苯基烟酰胺:
[0193]
向(6-甲基-5-(甲基(苯基)氨甲酰基)吡啶-2-基)氨基甲酸叔丁酯(50mg,0.147mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到6-氨基-n,2-二甲基-n-苯基烟酰胺a-5(27mg,76%)液相质谱m/z=242.1[m+h]+
[0194]
实施例14:6-甲基-n5-(四氢-2h-吡喃-4-基)吡啶-2,5-二胺a-6-1
[0195][0196]
步骤1:叔丁基(6-甲基-5-((四氢-2h-吡喃-4-基)氨基)吡啶-2-基)氨基甲酸酯
ⅰ‑
18-1
[0197]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与四氢-4h-吡喃-4-酮(12mg,0.12mmol)混合,添加甲醇(2ml),室温下搅拌2小时,然后添加氰基硼氢化钠(20mg,0.3mmol),室温下搅拌2小时。然后向混合物中添加naoh水溶液(10ml,0.3mol/l)。所得混合物用dcm(20ml x 3)萃取。合并的有机相在无水na2so4上干燥,过滤并在真空中浓缩。粗品经硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化,减压蒸馏除去溶剂,得到叔丁基(6-甲基-5-((四氢-2h-吡喃-4-基)氨基)吡啶-2-基)氨基甲酸酯
ⅰ‑
18-1(23mg,75%)液相质谱m/z=308.2[m+h]+
[0198]
步骤2:6-甲基-n5-(四氢-2h-吡喃-4-基)吡啶-2,5-二胺
[0199]
向叔丁基(6-甲基-5-((四氢-2h-吡喃-4-基)氨基)吡啶-2-基)氨基甲酸酯(23mg,0.075mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到6-甲基-n5-(四氢-2h-吡喃-4-基)吡啶-2,5-二胺a-6-1(12mg,78%)液相质谱m/z=208.1[m+h]+
[0200]
实施例15:6-甲基-n
5-(吡啶-4-基甲基)吡啶-2,5-二胺a-6-2
[0201][0202]
步骤1:(6-甲基-5-((吡啶-4-基甲基)氨基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
18-2
[0203]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与异烟醛(13mg,0.12mmol)混合,添加甲醇(2ml),室温下搅拌2小时,然后添加氰基硼氢化钠(20mg,0.3mmol),室温下搅拌2小时。然后向混合物中添加naoh水溶液(10ml,0.3mol/l)。所得混合物用dcm(20ml x 3)萃取。合并的有机相在无水na2so4上干燥,过滤并在真空中浓缩。粗品经硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化,减压蒸馏除去溶剂,得到(6-甲基-5-((吡啶-4-基甲基)氨基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
18-2(24mg,76%)液相质谱m/z=314.2[m+h]+
[0204]
步骤2:6-甲基-n
5-(吡啶-4-基甲基)吡啶-2,5-二胺:
[0205]
向叔丁基(6-甲基-5-((四氢-2h-吡喃-4-基)氨基)吡啶-2-基)氨基甲酸酯(23mg,0.075mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到6-甲基-n5-(四氢-2h-吡喃-4-基)吡啶-2,5-二胺a-6-2(12mg,78%)液相质谱m/z=208.1[m+h]+
[0206]
实施例16:n
5-环丁基-6-甲基吡啶-2,5-二胺a-6-3
[0207][0208]
步骤1:(5-(环丁胺基)-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
18-3
[0209]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与环丁酮(8mg,0.12mmol)混合,添加甲醇(2ml),室温下搅拌2小时,然后添加氰基硼氢化钠(20mg,0.3mmol),室温下搅拌2小时。然后向混合物中添加naoh水溶液(10ml,0.3mol/l)。所得混合物用dcm(20ml x 3)萃取。合并的有机相在无水na2so4上干燥,过滤并在真空中浓缩。粗品经硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化,减压蒸馏除去溶剂,得到(5-(环丁胺基)-6-甲
基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
18-3(20mg,72%)液相质谱m/z=278.2[m+h]+
[0210]
步骤2:n
5-环丁基-6-甲基吡啶-2,5-二胺:
[0211]
向(5-(环丁胺基)-6-甲基吡啶-2-基)氨基甲酸叔丁酯(20mg,0.072mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到6-甲基-n5-(四氢-2h-吡喃-4-基)吡啶-2,5-二胺a-6-3(10mg,78%)液相质谱m/z=178.1[m+h]+
[0212]
实施例17:2-(6-氨基-2-甲基吡啶-3-基)异吲哚-1,3-二酮a-7
[0213][0214]
其合成线路为:
[0215][0216]
步骤1:叔丁基(5-(1,3-二氧异辛醇-2-基)-6-甲基吡啶-2-基)氨基甲酸酯
ⅰ‑
20
[0217]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与异苯并呋喃-1,3-二酮(18mg,0.12mmol)混合,添加n,n-二甲基乙酰胺(2ml),室温下搅拌24小时,然后再加入二甲苯(1ml),油浴140℃搅拌48小时。完成后(通过tlc监测),通过过滤分离不溶性催化剂,用丙酮洗涤并干燥。在减压下浓缩有机层以得到所需产物,用水洗涤,并在乙醇中重结晶,粗品经硅胶柱层析(ch2cl2/正己烷=1:1)纯化,减压蒸馏除去溶剂,得到叔丁基(5-(1,3-二氧异辛醇-2-基)-6-甲基吡啶-2-基)氨基甲酸酯
ⅰ‑
20(24mg,68%)液相质谱m/z=354.1[m+h]+
[0218]
步骤2:2-(6-氨基-2-甲基吡啶-3-基)异吲哚-1,3-二酮
[0219]
向叔丁基(5-(1,3-二氧异辛醇-2-基)-6-甲基吡啶-2-基)氨基甲酸酯(24mg,0.068mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到2-(6-氨基-2-甲基吡啶-3-基)异吲哚-1,3-二酮a-7(12mg,70%)液相质谱m/z=254.1[m+h]+
[0220]
实施例18:6-甲基-n
5-苯基吡啶-2,5-二胺a-8
[0221][0222]
其合成线路为:
[0223][0224]
步骤1:(6-甲基-5-(苯胺基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
22
[0225]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与碘苯(24mg,0.12mmol),(n,n-联吡啶基咪唑亚基)二溴化铜(10mg,0.023mmol),碳酸铯(100mg,0.3mmol)混合,添加1,4-二氧六环(5ml),油浴170℃搅拌12小时。然后向混合物中添加naoh水溶液(10ml,0.3mol/l)。所得混合物用dcm(20ml x 3)萃取。合并的有机相在无水na2so4上干燥,过滤并在真空中浓缩。粗品经硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化,减压蒸馏除去溶剂,得到(6-(甲基-5-(苯胺基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
22(25mg,84%)液相质谱m/z=300.2[m+h]+
[0226]
步骤2:6-甲基-n
5-苯基吡啶-2,5-二胺:
[0227]
向(6-(甲基-5-(苯胺基)吡啶-2-基)氨基甲酸叔丁酯(25mg,0.084mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到6-甲基-n
5-苯基吡啶-2,5-二胺a-8(12mg,72%)液相质谱m/z=200.1[m+h]+
[0228]
实施例19:(e)-6-甲基-5-苯乙烯基吡啶-2-胺a-9
[0229][0230]
其合成线路为:
[0231][0232]
步骤1:叔丁基(e)-(6-甲基-5-苯乙烯基吡啶-2-基)氨基甲酸酯
ⅰ‑
24
[0233]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与苯乙烯(13mg,0.12mmol),双(二亚苄基丙酮)-钯(0)(5mg,0.0087mmol)混合,添加亚硝基叔丁酯(0.5ml),氯乙酸(0.5ml),乙酸(3ml)油浴50℃搅拌2小时。然后向混合物中添加naoh水溶液(10ml,0.3mol/l)。所得混合物用dcm(20ml x 3)萃取。合并的有机相在无水na2so4上干燥,过滤并在真空中浓缩。粗品经硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化,减压蒸馏除去溶剂,得到叔丁基(e)-(6-甲基-5-苯乙烯基吡啶-2-基)氨基甲酸酯
ⅰ‑
24(22mg,71%)液相质谱m/z=311.2[m+h]+
[0234]
步骤2:(e)-6-甲基-5-苯乙烯基吡啶-2-胺:
[0235]
向叔丁基(e)-(6-甲基-5-苯乙烯基吡啶-2-基)氨基甲酸酯(22mg,0.071mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到(e)-6-甲基-5-苯乙烯基吡啶-2-胺a-9(13mg,88%)液相质谱m/z=211.1[m+h]+
[0236]
实施例20:n-(6-氨基-2-甲基吡啶-3-基)噻吩-2-磺酰胺a-10
[0237][0238]
其合成线路为:
[0239][0240]
步骤1:(6-甲基-5-(噻吩-2-磺胺基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
26
[0241]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(22mg,0.1mmol)与噻吩-2-磺酰氯(22mg,0.12mmol)混合,添加三乙胺(0.5ml),二氯甲烷(3ml),氮气保护下室温搅拌24小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化,减压蒸馏除去溶剂,得到(6-甲基-5-(噻吩-2-磺胺基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
26(19mg,52%)液相质谱m/z=370.1[m+h]+
[0242]
步骤2:n-(6-氨基-2-甲基吡啶-3-基)噻吩-2-磺酰胺
[0243]
向(6-甲基-5-(噻吩-2-磺胺基)吡啶-2-基)氨基甲酸叔丁酯(19mg,0.052mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到n-(6-氨基-2-甲基吡啶-3-基)噻吩-2-磺酰胺a-10(10mg,72%)液相质谱m/z=270.0[m+h]+
[0244]
实施例21:n-(2-((6-氨基-2-甲基吡啶-3-基)氨基)乙基)甲磺酰胺a-11
[0245][0246]
其合成线路为:
[0247][0248]
步骤1:(5-((2-氨基乙基)氨基)-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
28
[0249]
将(5-氨基-6-甲基吡啶-2-基)氨基甲酸叔丁酯(44mg,0.2mmol)与2-溴乙烷-1-胺(29mg,0.24mmol)混合,加入水(5ml),油浴95℃搅拌18小时。反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。混合物在硅胶(ch2cl2甲醇-氨水)上通过快速色谱纯化得到所需产物。减压蒸馏除去溶剂,得到(5-((2-氨基乙基)氨基)-6-甲基吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
28(38mg,72%)液相质谱m/z=267..2[m+h]+
[0250]
步骤2:(6-甲基-5-((2-(甲基磺胺基)乙基)氨基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
30
[0251]
将(5-((2-氨基乙基)氨基)-6-甲基吡啶-2-基)氨基甲酸叔丁酯(38mg,0.144mmol)与甲磺酰氯(28mg,0.16mmol)混合,加入二氯甲烷(5ml),冰水浴搅拌24小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化,减压蒸馏除去溶剂,得到(6-甲基-5-((2-(甲基磺胺基)乙基)氨基)吡啶-2-基)氨基甲酸叔丁酯
ⅰ‑
30(20mg,40%),液相质谱m/z=255.1[m+h]+
[0252]
步骤3:n-(2-((6-氨基-2-甲基吡啶-3-基)氨基)乙基)甲磺酰胺
[0253]
向(6-甲基-5-((2-(甲基磺胺基)乙基)氨基)吡啶-2-基)氨基甲酸叔丁酯(20mg,0.057mmol)中加入hcl的二氧六环溶液(5%,5ml),70℃加热搅拌3h,向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7),减压蒸馏除去溶剂,得到n-(2-((6-氨基-2-甲基吡啶-3-基)氨基)乙基)甲磺酰胺a-11(11mg,78%)液相质谱m/z=245.1[m+h]+
[0254]
实施例22:3-((1h-苯并[d]咪唑-6-基)氧甲基)苯甲腈b-1-1
[0255][0256]
步骤:将1h-苯并[d]咪唑-6-醇ii-3(9mg,0.07mmol)与3-(溴甲基)苯甲腈(20mg,0.1mmol)与k2co3(138mg,1mmol)混合,添加乙腈(2ml),并将混合物加热至40℃搅拌10分钟。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(二氯甲烷:甲醇=40:1)纯化得到3-((1h-苯并[d]咪唑-6-基)氧甲基)苯甲腈b-1-1(10mg,57%)液相质谱m/z=249.3[m+h]+
[0257]
实施例23:6-苯氧基-1h-苯并[d]咪唑b-1-2
[0258][0259]
步骤:将1h-苯并[d]咪唑-6-醇ii-3(9mg,0.07mmol)与(2-溴乙基)苯(22mg,0.12mmol)与k2co3(138mg,1mmol)混合,添加乙腈(2ml),并将混合物加热至40℃搅拌10分钟。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(二氯甲烷:甲醇=40:1)纯化得到6-苯氧基-1h-苯并[d]咪唑b-1-2(12mg,70%)液相质谱m/z=238.1[m+h]+
[0260]
实施例24:2-(1h-苯并[d]咪唑-6-基)异吲哚-1-酮b-2
[0261][0262]
其合成路线:
[0263][0264]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与2-甲酰基苯甲酸(18mg,0.12mmol)混合,添加甲酸(0.2ml),三乙胺(1ml),乙醇(1ml),将混合物加热至80℃搅拌60分钟。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(二氯甲烷:乙酸乙酯=20:1)纯化得到2-(1h-苯并[d]咪唑-6-基)异吲哚-1-酮b-2(13mg,54%)液相质谱m/z=249.1[m+h]+
[0265]
实施例25:n-(1h-苯并[d]咪唑-6-基)噻吩-3-甲酰胺b-3-1
[0266][0267]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与噻吩-2-羧酸(15mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到n-(1h-苯并[d]咪唑-6-基)噻吩-3-甲酰胺b-3-1(9mg,37%)液相质谱m/z=243.1[m+h]+
[0268]
实施例26:(e)-n-(1h-苯并[d]咪唑-6-基)-2-甲基-2-烯酰胺b-3-2
[0269][0270]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与(e)-2-甲基-2-烯酸(12mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到(e)-n-(1h-苯并[d]咪唑-6-基)-2-甲基-2-烯酰胺b-3-2(10mg,46%)液相质谱m/z=215.1[m+h]+
[0271]
实施例27:n-(1h-苯并[d]咪唑-6-基)-2,3-二氢苯并呋喃-2-甲酰胺b-3-3
[0272][0273]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与苯并呋喃-2-羧酸(19mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到n-(1h-苯并[d]咪唑-6-基)-2,3-二氢苯并呋喃-2-甲酰胺b-3-3(12mg,41%)液相质谱m/z=279.1[m+h]+
[0274]
实施例28:n-(1h-苯并[d]咪唑-6-基)-3,4-二氯苯甲酰胺b-3-4
[0275][0276]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与3,4-二氯苯甲酸(23mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙
酸乙酯:己烷=3:7)纯化得到n-(1h-苯并[d]咪唑-6-基)-3,4-二氯苯甲酰胺b-3-4(12mg,39%)液相质谱m/z=305.0[m+h]+
[0277]
实施例29:n-(1h-苯并[d]咪唑-6-基)苯并[b]噻吩-2-甲酰胺b-3-5
[0278][0279]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与苯并噻吩-2-羧酸(21mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到n-(1h-苯并[d]咪唑-6-基)苯并[b]噻吩-2-甲酰胺b-3-5(13mg,43%)液相质谱m/z=293.1[m+h]+
[0280]
实施例30:n-(1h-苯并[d]咪唑-6-基)-2-苯乙酰胺b-3-6
[0281][0282]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与2-苯乙酸(16mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化得到n-(1h-苯并[d]咪唑-6-基)-2-苯乙酰胺b-3-6(11mg,43%)液相质谱m/z=251.11[m+h]+
[0283]
实施例31:1-(1h-苯并[d]咪唑-6-基)-3-(对甲苯基)脲b-4-1
[0284][0285]
步骤1:对硝基苯基对甲苯氨基碳酸酯ii-9-1
[0286]
将对甲苯胺(21mg,0.2mmol)与4-硝基苯基羰酰氯(48mg,0.24mmol)混合,添加三乙醇胺(0.2ml),二氯甲烷(1ml),四氢呋喃(2ml)室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(二氯甲烷:己烷=5:1)纯化得到对硝基苯基对甲苯氨基碳酸酯ii-9-1(42mg,77%)液相质谱m/z=273.1[m+h]+
[0287]
步骤2:1-(1h-苯并[d]咪唑-6-基)-3-(对甲苯基)脲
[0288]
将对硝基苯基对甲苯氨基甲酸酯(27mg,0.1mmol)与1h-苯并[d]咪唑-6-胺(16mg,0.12mmol)与k2co3(0.2g,1.45mmol)混合,添加乙腈(3ml)加热至40℃搅拌4小时。反应完成后(通过tlc监测),将反应混合物分离在真空中浓缩。这样得到的粗反应混合物用二氯甲烷洗涤,然后用etoac洗涤,最后用meoh(各1ml)洗涤。最后,使用etoac(在温暖条件下)对反应
产物进行重结晶以得到纯形式的1-(1h-苯并[d]咪唑-6-基)-3-(对甲苯基)脲b-4-1(20mg,75%)液相质谱m/z=266.1[m+h]+
[0289]
实施例32:1-(1h-苯并[d]咪唑-6-基)-3-(3-溴苯基)脲b-4-2
[0290][0291]
步骤1:4-硝基苯基(3-溴苯基)氨基碳酸酯ii-9-2
[0292]
将3-溴苯胺(34mg,0.2mmol)与4-硝基苯基羰酰氯(48mg,0.24mmol)混合,添加三乙醇胺(0.2ml),二氯甲烷(1ml),四氢呋喃(2ml)室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(二氯甲烷:己烷=5:1)纯化得到4-硝基苯基(3-溴苯基)氨基碳酸酯ii-9-2(46mg,68%)液相质谱m/z=338.1[m+h]+
[0293]
步骤2:1-(1h-苯并[d]咪唑-6-基)-3-(3-溴苯基)脲
[0294]
将4-硝基苯基(3-溴苯基)氨基碳酸酯(34mg,0.1mmol)与1h-苯并[d]咪唑-6-胺(16mg,0.12mmol)与k2co3(0.2g,1.45mmol)混合,添加乙腈(3ml)加热至40℃搅拌4小时。反应完成后(通过tlc监测),将反应混合物分离在真空中浓缩。这样得到的粗反应混合物用二氯甲烷洗涤,然后用etoac洗涤,最后用meoh(各1ml)洗涤。最后,使用etoac(在温暖条件下)对反应产物进行重结晶以得到纯形式的1-(1h-苯并[d]咪唑-6-基)-3-(3-溴苯基)脲b-4-2(22mg,68%)液相质谱m/z=330.0[m+h]+
[0295]
实施例33:n-甲基-n-苯基-1h-苯并[d]咪唑-6-甲酰胺b-5
[0296][0297]
其合成路线为:
[0298][0299]
步骤1:6-硝基-1h-苯并[d]咪唑ii-10
[0300]
向发烟硫酸(500μl)中的h2o2(240mg,2.2mmol)溶液中逐滴添加1h-苯并[d]咪唑-6-胺(40mg,0.3mmol)的浓硫酸(100μl)溶液,将反应温度保持在0℃。在10-25℃下搅拌3h后,通过在0-5℃下添加40%naoh水溶液使反应混合物达到ph=11-12。所得混合物用乙酸乙酯萃取。用饱和氯化钠水溶液洗涤合并的有机层,在na2so4上干燥并过滤。减压蒸馏除去溶剂,得到所需6-硝基-1h-苯并[d]咪唑i
ⅰ‑
10(35mg,72%)lc-ms m/z=163.0[m+h]+
[0301]
步骤2:1h-苯并[d]咪唑-6-羧酸ii-11
[0302]
将6-硝基-1h-苯并[d]咪唑(39mg,0.24mmol)与kcn(195mg,3mmol)混合添加1-丁基咪唑四氟硼酸盐(3mg,0.014mmol),etoh(2ml),水(2ml)加热至80℃搅拌19小时。然后加入10ml水,用ch2cl2(3
×
5ml)和乙醚(3
×
10ml)萃取混合物。用盐酸酸化至ph1-2,用乙醚(3
×
10ml)萃取。加入硫酸镁(3g)和活性碳(1g)并搅拌5h。过滤掉固体,蒸发滤液,并将残余物从相应溶剂中结晶,得到所需1h-苯并[d]咪唑-6-羧酸ii-11(14mg,40%)lc-ms m/z=162.0[m+h]+
[0303]
步骤3:n-甲基-n-苯基-1h-苯并[d]咪唑-6-甲酰胺
[0304]
将1h-苯并[d]咪唑-6-羧酸(16mg,0.1mmol)与n-甲基苯胺(13mg,0.12mmol)与2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(38mg,0.1mmol)混合,添加n,n-二异丙基乙胺(0.2ml),n,n-二甲基甲酰胺(2ml),室温下搅拌18小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化,减压蒸馏除去溶剂,得到n-甲基-n-苯基-1h-苯并[d]咪唑-6-甲酰胺b-5(16mg,65%)液相质谱m/z=251.1[m+h]+
[0305]
实施例34:n-(四氢-2h-吡喃-4-基)-1h-苯并[d]咪唑-6-胺b-6-1
[0306][0307]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与四氢-4h-吡喃-4-酮(12mg,0.12mmol)混合,添加甲醇(2ml),室温下搅拌2小时,然后添加氰基硼氢化钠(20mg,0.3mmol),室温下搅拌2小时。然后向混合物中添加naoh水溶液(10ml,0.3mol/l)。所得混合物用dcm(20mlx3)萃取。合并的有机相在无水na2so4上干燥,过滤并在真空中浓缩。粗品经硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化,减压蒸馏除去溶剂,得到n-(四氢-2h-吡喃-4-基)-1h-苯并[d]咪唑-6-胺b-6-1(16mg,75%)液相质谱m/z=217.1[m+h]+
[0308]
实施例35:n-(吡啶-4-甲基)-1h-苯并[d]咪唑-6-胺b-6-2
[0309][0310]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与异烟醛(13mg,0.12mmol)混合,添加甲醇(2ml),室温下搅拌2小时,然后添加氰基硼氢化钠(20mg,0.3mmol),室温下搅拌2小时。然后向混合物中添加naoh水溶液(10ml,0.3mol/l)。所得混合物用dcm(20mlx3)萃取。合并的有机相在无水na2so4上干燥,过滤并在真空中浓缩。粗品经硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化,减压蒸馏除去溶剂,得到n-(吡啶-4-甲基)-1h-苯并[d]咪唑-6-胺b-6-2(14mg,64%)液相质谱m/z=224.1[m+h]+
[0311]
实施例36:正环丁基-1h-苯并[d]咪唑-6-胺b-6-3
[0312][0313]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与环丁酮(8mg,0.12mmol)混合,添加甲醇(2ml),室温下搅拌2小时,然后添加氰基硼氢化钠(20mg,0.3mmol),室温下搅拌2小时。然后向混合物中添加naoh水溶液(10ml,0.3mol/l)。所得混合物用dc m(20mlx3)萃取。合并的有机相在无水na2so4上干燥,过滤并在真空中浓缩。粗品经硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化,减压蒸馏除去溶剂,得到正环丁基-1h-苯并[d]咪唑-6-胺b-6-3(13mg,72%)液相质谱m/z=187.1[m+h]+
[0314]
实施例37:2-(1h-苯并[d]咪唑-6-基)异吲哚啉-1,3-二酮b-7
[0315]
[0316]
其合成路线:
[0317][0318]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与异苯并呋喃-1,3-二酮(18mg,0.12mmol)混合,添加n,n-二甲基乙酰胺(2ml),室温下搅拌24小时,然后再加入二甲苯(1ml),油浴140℃搅拌48小时。完成后(通过tlc监测),通过过滤分离不溶性催化剂,用丙酮洗涤并干燥。在减压下浓缩有机层以得到所需产物,用水洗涤,并在乙醇中重结晶,粗品经硅胶柱层析(ch2cl2/正己烷=1:1)纯化,减压蒸馏除去溶剂,得到2-(1h-苯并[d]咪唑-6-基)异吲哚啉-1,3-二酮b-7(18mg,68%)液相质谱m/z=263.1[m+h]+
[0319]
实施例38:n-苯基-1h-苯并[d]咪唑-6-胺b-8
[0320][0321]
其合成路线:
[0322][0323]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与碘苯(24mg,0.12mmol),(n,n-联吡啶基咪唑亚基)二溴化铜(10mg,0.023mmol),碳酸铯(100mg,0.3mmol)混合,添加1,4-二氧六环(5ml),油浴170℃搅拌12小时。然后向混合物中添加naoh水溶液(10ml,0.3mol/l)。所得混合物用dcm(20mlx3)萃取。合并的有机相在无水na2so4上干燥,过滤并在真空中浓缩。粗品经硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化,减压蒸馏除去溶剂,得到n-苯基-1h-苯并[d]咪唑-6-胺b-8(17mg,82%)液相质谱m/z=209.1[m+h]+
[0324]
实施例39:(e)-6-苯乙烯基-1h-苯并[d]咪唑b-9
[0325][0326]
其合成路线:
[0327][0328]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与苯乙烯(13mg,0.12mmol),双(二亚苄基丙酮)-钯(0)(5mg,0.0087mmol)混合,添加亚硝基叔丁酯(0.5ml),氯乙酸(0.5ml),乙酸(3ml)油浴50℃搅拌2小时。然后向混合物中添加naoh水溶液(10ml,0.3mol/l)。所得混合物用dcm(20mlx3)萃取。合并的有机相在无水na2so4上干燥,过滤并在真空中浓缩。粗品经硅胶柱层析(石油醚:乙酸乙酯=5:1)纯化,减压蒸馏除去溶剂,得到(e)-6-苯乙烯基-1h-苯并[d]咪唑b-9(13mg,61%)液相质谱m/z=220.1[m+h]+
[0329]
实施例40:n-(1h-苯并[d]咪唑-6-基)噻吩-2-磺酰胺b-10
[0330][0331]
其合成线路:
[0332][0333]
步骤:将1h-苯并[d]咪唑-6-胺(13mg,0.1mmol)与噻吩-2-磺酰氯(22mg,0.12mmol)混合,添加三乙胺(0.5ml),二氯甲烷(3ml),氮气保护下室温搅拌24小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化,减压蒸馏除去溶剂,得到n-(1h-苯并[d]咪唑-6-基)噻吩-2-磺酰胺b-10(13mg,45%)液相质谱m/z=279.0[m+h]+
[0334]
实施例41:n-(2-(1h苯并[d]咪唑-6-基)氨基乙基)甲基磺酰胺b-11
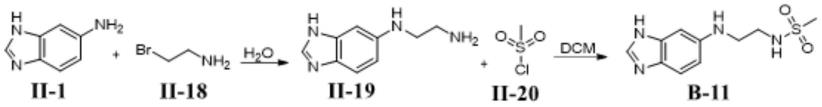
[0335][0336]
其合成线路:
[0337][0338]
步骤1:n1-(1h-苯并[d]咪唑-6-基)乙烷-1,2-二胺ⅰi-19
[0339]
将1h-苯并[d]咪唑-6-胺(27mg,0.2mmol)与2-溴乙烷-1-胺(29mg,0.24mmol)混合,加入水(5ml),油浴95℃搅拌18小时。反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。混合物在硅胶(ch2cl2甲醇-氨水)上通过快速色谱纯化得到所需产物。减压蒸馏除去溶剂,得到n1-(1h-苯并[d]咪唑-6-基)乙烷-1,2-二胺ⅰi-19(22mg,61%)液相质谱m/z=176.1[m+h]+
[0340]
步骤2:n-(2-(1h苯并[d]咪唑-6-基)氨基乙基)甲基磺酰胺
[0341]
将n1-(1h-苯并[d]咪唑-6-基)乙烷-1,2-二胺(23mg,0.13mmol)与甲磺酰氯(28mg,0.16mmol)混合,加入二氯甲烷(5ml),冰水浴搅拌24小时。向反应混合物中加入乙酸乙酯和水,分离有机层,用硫酸钠干燥,减压浓缩。残渣经硅胶柱层析(乙酸乙酯:己烷=3:7)纯化,减压蒸馏除去溶剂,得到n-(2-(1h苯并[d]咪唑-6-基)氨基乙基)甲基磺酰胺b-11(11mg,32%),液相质谱m/z=254.1[m+h]+
[0342]
小分子结合能预测:
[0343]
利用autodock vina和ledock软件分别对实施例1-21中的氨基吡啶衍生物分子、实施例22-41中的苯并咪唑衍生物分子与oct4靶标蛋白进行分子对接,分别生产10个对接构象。计算每一氨基吡啶衍生物分子、每一苯并咪唑衍生物分子与oct4靶标蛋白最优对接结果的结合能与配体效率,综合对接结果进行氨基吡啶衍生物分子、苯并咪唑衍生物分子
筛选,具体对接结果分别如表1、表2所示:表第二、三列分别由autodock vina和ledock分子对接软件计算获得的结合自由能(binding energy),其值越负,小分子配体与靶蛋白结合能力越强。表第四列代表由ledock计算产生的配体效率(ligand efficiency),其绝对值越大表示小分子活性具有更强的潜能。在本发明中根据两个软件的独立算法,预测出本发明涉及化合物的结合能水平,预测值显示本发明中的化合物其结合能均远大于本发明根据靶点特征设定的阈值3。
[0344]
表1.本发明所用氨基吡啶衍生物分子与靶标蛋白的结合预测
[0345][0346]
表2.本发明所用苯并咪唑衍生物分子与靶向序列的结合能预测
[0347]
[0348][0349]
小分子引起的转录表达差异验证:
[0350]
本发明的目的是使用高选择性活化剂达到启动目标基因的作用,此类活化剂的重要功能为启动oct4的表达,从而增加oct4对下游基因的表达丰度。因此,在验证本发明的小分子功能时,除了验证oct4基因自身增加幅度外,oct4基因的下游基因nanog的表达增加也是本发明中化合物的一个功能验证的指标。
[0351]
在t25培养人间充质细胞,按照4x105接种细胞,使用无血清杜氏改良伊格尔培养基(dmem-f12培养基),其中分别添加50nm上述氨基吡啶衍生物小分子及苯并咪唑衍生物小分子进行培养,培养条件为37℃,5%二氧化碳。于第5天分别使用rneasy mini or micro kit(qiagen)进行总rna抽提,1mg rna用superscript iii first-strand synthesis system(invitrogen)合成cdna。用sybr premix ex taq(takara)和thermal cycler dice real time system(takara)来进行quantitative pcr的标记和反应,beta-actin用来作为内参。所有数据用delta-ct method进行分析。每组试验使用三组重复进行试验,并进行方差统计。用于鉴定不同细胞标志物的编码基因的引物序列如表3所示。结果如图1及图2所示,与不使用小分子的对照组相比,以上氨基吡啶衍生物小分子及苯并咪唑衍生物小分子对oct4的基础表达及其下游基因nanog的表达均增加显著。
[0352]
表3.化合物效应基因qpcr引物序列
[0353]
[0354][0355]
小分子引起的早期细胞多能性验证:
[0356]
rex1基因在未分化的胚胎干细胞中高度表达,在多能干细胞的体外培养中最接近体内胚胎干细胞及植入前囊胚天然状态(boroviak,t et al.,nat.cell biol.2014.16,516
–
528;kalkan,t et al.,development.2017,144,1221
–
1234)。rex1基因的表达显示了细胞正处于类似胚胎干细胞活着植入前囊胚的天然多能性状态。因此,本发明将rex1的表达作为小分子功能的终端检测指标。
[0357]
在t25培养人间充质细胞,按照4x105接种细胞,使用无血清杜氏改良伊格尔培养基(dmem-f12培养基),其中分别添加50nm上述氨基吡啶衍生物小分子及苯并咪唑衍生物小分子进行培养,培养条件为37℃,5%二氧化碳。于第5天进行免疫荧光染色鉴定:采用4%多聚甲醛室温固定细胞40分钟,用dpbs缓冲液清洗两遍;然后用0.1%triton x-100透化处理5分钟,用dpbs缓冲液清洗两遍;然后用含10%马血清和0.1%triton x-100的dpbs缓冲液将细胞4℃孵育过夜;然后加入2%马血清和0.1%triton x-100的dpbs缓冲液1:200稀释的抗rex1一抗(abcam,ab28141),37℃孵育2小时,用dpbs缓冲液清洗三遍后,加入2%马血清和0.1%triton x-100的dpbs缓冲液1:1000稀释的羊抗兔igg(h+l),alexa fluor 488(invitrogen a10037)拍照。如图3所示,本发明中化学小分子可以促进间充质细胞表达rex1基因,并让间充质细胞形成多能干细胞克隆样细胞团。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1