一种具有区分癌细胞和正常细胞功能的次氯酸荧光探针、制备方法与应用
1.本发明属于荧光探针领域,具体涉及一种具有区分癌细胞和正常细胞功能 的次氯酸荧光探针及其在测量、检测或筛选次氯酸及活细胞荧光成像方法中的 应用;本发明还提供了制备所述荧光探针的方法。
背景技术:
2.癌症,是威胁人类健康的主要疾病之一,其致死率一直居高不下。癌症早 期诊断的困难大,是癌症致死率高的重要原因之一。早期诊断的困难在于不易 区分癌细胞和正常细胞。因此建立一种新的方法用于区分癌细胞和正常细胞对 癌症的早期诊断以及提高治疗效果有着重要的意义。
3.由于癌细胞和正常细胞的巨大差异性,活性氧物种在癌细胞中的浓度约为 正常细胞的10倍。而次氯酸(hocl)作为活性氧的一种,因其具有极高的反应 活性,在癌细胞中极为活跃而受到广泛关注,它是由氯离子和过氧化氢在髓过 氧化物酶(mpo)的催化作用下产生的。次氯酸在癌细胞中过量表达为区分癌 细胞和正常细胞提供了可能。此外,癌细胞细胞膜表面的蛋白受体也会受细胞 异质性的影响发生相应的变化,比如钠依赖复合维生素转运蛋白(smvt)会在 癌细胞细胞膜表面过量表达。这也为区分癌细胞和正常细胞的提供了支持。
4.由于高灵敏度,高选择性,显著的时空分辨率和能够实时监测等优势,小 分子荧光探针作为一种非侵入性的工具被广泛应用于生物样品中的分析物测定。 近年来,小分子荧光探针应用于区分癌细胞和正常细胞方面的发展极为迅速, 但已报道的此类荧光探针进入细胞的方式比较单一(比如自由扩散的方式), 且大都只是检测一种标志物(比如硫醇类或活性氧类物质),因此该类探针不 能选择性的在癌细胞内富集,且容易造成假阳性的结果。此外,该类探针还存 在着一些局限性,比如合成复杂和响应标志物的时间较长等,不利于推广使用。 因此,探索一种简单的基于次氯酸响应的荧光探针,可以选择性富集在癌细胞 中,为实现荧光可视化区分癌细胞和正常细胞提供新的方法具有重要的意义。
技术实现要素:
5.有鉴于此,本发明的目的是在于提供一类具有区分癌细胞和正常细胞功能 的次氯酸荧光探针,以及它们的制备方法和用途,具有合成简单、特异性好、 灵敏度高、瞬时响应和可以在癌细胞内选择性富集等特点,并且能够在生理水 平条件下对次氯酸进行有效测量、检测或筛选,同时,其具有区分正常细胞和 癌细胞的功能。
6.具体而言,本发明提供了一种化合物,具有式(ⅰ)所示的结构:
[0007][0008]
式(i)中,r1,r2,r3,r4,r5,r6,r7,r8,r9和r
10
为独立地选自由氢原 子、直链或支链烷基、直链或支链烷氧基、磺酸基、酯基和羟基组成的组;且 其中的r1,r2,r3,r4,r5,r6,r7,r8,r9和r
10
可以相同或不同。
[0009]
在本发明的一些具体实施方案中,本发明的化合物是r1,r2,r3,r4,r5, r6,r7,r8,r9和r
10
均为氢原子的式(ⅱ)化合物,其结构式如下:
[0010][0011]
本发明还提供了式(ⅰ)化合物的制备方法,包括如下步骤:
[0012]
步骤(1):使式(ⅲ)化合物与式(ⅳ)化合物反应制备得式(
ⅴ
)化合 物,其反应式如下:
[0013][0014]
步骤(2):使式(
ⅴ
)化合物与式(
ⅵ
)化合物反应制备得式(ⅱ)化合 物,其反应式如下:
[0015][0016]
式(ⅰ)和式(ⅲ)
‑
(ⅳ)中:r1,r2,r3,r4,r5,r6,r7,r8,r9和r
10
为独 立地选自由氢原子、直链或支链烷基、直链或支链烷氧基、磺酸基、酯基和羟 基组成的组;且其中的r1,r2,r3,r4,r5,r6,r7,r8,r9和r
10
可以相同 或不同。
[0017]
具体而言:将式(ⅲ)化合物和式(ⅳ)化合物与碳酸铯在乙腈中加热回 流反应,反应结束后,通过减压抽滤得到固体,用二氯甲烷清洗固体,得到滤 液,通过减压旋蒸,得到式(
ⅴ
)化合物的粗产物。粗产物进一步通过色谱柱 进行分离,二氯甲烷和甲醇的混合体系为洗脱剂,可得到纯净的式(
ⅴ
)化合 物。将式(
ⅴ
)化合物和式(
ⅵ
)化合物、4
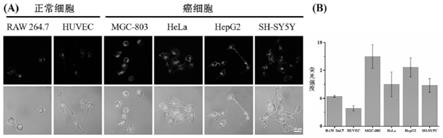
‑
二甲氨基吡啶(dmap)和二环己 基碳二亚胺(dcc)在无水n,n
‑
二甲基甲酰胺(dmf)和无水二氯甲烷体系(v/v: 1:1)中常温反应一段时间,反应结束后,减压旋蒸去除二氯甲烷,然后加水析 出固定,最后抽滤得到固体产物,从而获得含有式(i)化合物的粗产物。粗产 物进一步通过色谱柱进行分离,二氯甲烷和甲醇的混合体系为洗脱剂,可得到 纯净的式(i)化合物。
[0018]
在本发明的一些具体实施方案中,所述式(ⅲ)化合物和式(ⅳ)化合物 的摩尔比为1:1
‑
1:10,所述式(
ⅴ
)化合物和式(
ⅵ
)化合物的摩尔比为1:1
‑
1:10。
[0019]
在本发明的一些具体实施方案中,式(i)化合物制备方法步骤(1)所述反 应时间为3
‑
10小时;步骤(2)所述反应时间为10
‑
20小时。
[0020]
本发明还提供了用于测量、检测或筛选次氯酸的荧光探针组合物,其包含 本发明的所述式(i)化合物。
[0021]
在本发明的一些具体实施方案中,所述式(i)化合物具有以下结构:
[0022][0023]
在本发明的一些具体实施方案中,所述荧光探针组合物进一步包含溶剂、 酸、碱、缓冲溶液或其组合。
[0024]
本发明还提供了用于检测样品中次氯酸的存在或测量样品中的次氯酸含量 的方法,其包括:
[0025]
a)使所述式(i)或式(ⅱ)化合物与样品接触以形成荧光化合物;
[0026]
b)测定所述荧光化合物的荧光性质。
[0027]
在本发明的一些具体实施方案中,所述样品是化学样品或生物样品。
[0028]
在本发明的一些具体实施方案中,所述样品是包括水、血液、微生物或者 动物细胞或组织在内的生物样品。
[0029]
本发明还提供了检测样品中次氯酸的存在或测定样品中的次氯酸含量的试 剂盒,其包含所述式(i)或式(ⅱ)化合物。
[0030]
本发明还提供了所述式(i)或式(ⅱ)化合物在细胞荧光成像中的应用。
[0031]
本发明相对于现有技术具有如下的显著优点及效果:
[0032]
(1)具有区分癌细胞和正常细胞的功能
[0033]
本发明的次氯酸荧光探针可以在癌细胞内选择性富集,为荧光可视化区分 癌细胞和正常细胞提供了一种新途径。
[0034]
(2)瞬时响应
[0035]
本发明的次氯酸荧光探针能够对次氯酸瞬时响应,有利于次氯酸的实施检 测。
[0036]
(3)特异性好
[0037]
本发明的次氯酸荧光探针可选择性的与次氯酸发生特异性反应,生成荧光 变化的产物,相较于常见的其他金属离子及生命体内的其他物质,包括但不限 于空白、钾离子、钙离子、钠离子、镁离子、锌离子、三价铁离子、二价铁离 子、铜离子、氟离子、碘离子、氯离子、溴离子、硝酸根、亚硝酸根、碳酸根、 硫酸根、半胱氨酸(cys)、同型半胱氨酸(hcy)、谷胱甘肽(gsh)、硫离 子、过氧化氢、过氧化叔丁醇、过氧化叔丁醇自由基、羟基自由基、超氧阴离 子、单线态氧、一氧化氮等,本发明荧光探针显示出了较高的选择性。
[0038]
(4)生物毒性低,可生理水平条件下应用
[0039]
本发明荧光探针具有低毒性的特点,有利于将其长时间应用于细胞样品中 次氯酸的检测或成像。
[0040]
(5)灵敏度高
[0041]
本发明的次氯酸荧光探针与次氯酸反应非常灵敏,从而有利于对次氯酸的 检测。
[0042]
(6)合成简单
[0043]
本发明的次氯酸荧光探针合成简单,有利于商业化的推广应用。
附图说明
[0044]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施 例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述 中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付 出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0045]
图1是探针(5μm)加入次氯酸(5μm)前后的响应时间谱图;
[0046]
图2(a)是探针(5μm)加入次氯酸(0
‑
30μm)前后的荧光光谱,(b)是 探针(5μm)在535nm处的荧光强度和次氯酸(0
‑
1μm)的线性关系图;
[0047]
图3是不同离子分析物(除特殊表明外,都为100μm)对探针(5μm)的荧光强 度的影响;
[0048]
图4是各个探针浓度对hela细胞的毒性实验谱图,浓度分别为:0μm,10μm, 20μm;
[0049]
图5(a)是探针(10m)对各种细胞的细胞成像图,(b)探针(10μm) 对各种细胞的荧光强度柱状图;
[0050]
图6是探针(5μm)在hela细胞中检测内源性和外源性次氯酸的细胞成像图 和荧光强度柱状图;
[0051]
图7是探针(10μm)的辅酶r抑制实验细胞成像图和荧光强度柱状图。
具体实施方式
[0052]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行、 清楚完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,不应该 用来限制本发明的保护范围。基于本发明中的实施例,本领域的普通技术人员 在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明的保 护范围。
[0053]
实施例1式(ⅱ)化合物的合成
[0054]
合成路线如下:
[0055][0056]
具体操作步骤如下:
[0057]
实施方案1:将式(
ⅶ
)化合物(822mg,3mmol)和对氨基酚(981mg,9mmol) 和碳酸铯(2931mg,9mmol)溶于60ml乙腈溶液中,加热回流3小时,反应 结束后,通过减压抽滤得到固体,用二氯甲烷清洗固体,得到滤液,通过减压 旋蒸,得到式(
ⅷ
)化合物的粗产物。粗产物进一步通过色谱柱进行分离,二 氯甲烷和甲醇的混合体系(v/v=50:1)为洗脱剂,可得到纯净的式(
ⅷ
)化合 物729mg,产率为70%。
[0058]
实施方案2:将式(
ⅶ
)化合物(822mg,3mmol)和对氨基酚(981mg,9mmol) 和碳酸铯(2931mg,9mmol)溶于120ml乙腈溶液中,加热回流3小时,反应 结束后,通过减压抽滤得到固体,用二氯甲烷清洗固体,得到滤液,通过减压 旋蒸,得到式(
ⅷ
)化合物的粗产物。粗产物进一步通过色谱柱进行分离,二 氯甲烷和甲醇的混合体系(v/v=50:1)为洗脱剂,可得到纯净的式(
ⅷ
)化合 物606mg,产率为58%。
[0059]
实施方案3:将式(
ⅶ
)化合物(822mg,3mmol)和对氨基酚(981mg,9mmol) 和碳酸铯(1956mg,6mmo)溶于60ml乙腈溶液中,加热回流3小时,反应结 束后,通过减压抽滤得到固体,用二氯甲烷清洗固体,得到滤液,通过减压旋 蒸,得到式(
ⅷ
)化合物的粗产物。粗产物进一步通过色谱柱进行分离,二氯 甲烷和甲醇的混合体系(v/v=50:1)为洗脱剂,可得到纯净的式(
ⅷ
)化合物 663mg,产率为64%。
[0060]
实施方案4:将式(
ⅶ
)化合物(822mg,3mmol)和对氨基酚(654mg,6mmol) 和碳酸铯(2931mg,9mmol)溶于120ml乙腈溶液中,加热回流3小时,反应 结束后,通过减压抽滤得到固体,用二氯甲烷清洗固体,得到滤液,通过减压 旋蒸,得到式(
ⅷ
)化合物的粗产物。粗产物进一步通过色谱柱进行分离,二 氯甲烷和甲醇的混合体系(v/v=50:1)为洗脱剂,可得到纯净的式(
ⅷ
)化合 物411mg,产率为39.5%。
[0061][0062]
具体操作步骤如下:
[0063]
实施方案1:将第一步合成的式(
ⅷ
)化合物(347mg,1mmol)溶于15ml无 水二氯甲烷溶液中,再加入式(
ⅸ
)化合物(488mg,2mmol)和4
‑
二甲氨基吡 啶(dmap)(244mg,2mmol)的无水n,n
‑
二甲基甲酰胺(dmf)溶液15ml, 最后加入二环己基碳二亚胺(dcc)(412mg,2mmol),整个反应体系在常温 搅拌条件下进行15个小时。反应结束后,减压旋蒸去除二氯甲烷,然后加水析 出固定,最后抽滤得到固体产物,从而获得含有式(ⅱ)化合物的粗产物。粗 产物进一步通过色谱柱进行分离,二氯甲烷和甲醇的混合体系为洗脱剂,可得 到纯净的暗黄色的344mg,产率约为60%。
[0064]
实施方案2:将第一步合成的式(
ⅷ
)化合物(347mg,1mmol)溶于15ml无 水二氯甲
烷溶液中,再加入式(
ⅸ
)化合物(488mg,2mmol)和4
‑
二甲氨基吡 啶(dmap)(122mg,1mmol)的无水n,n
‑
二甲基甲酰胺(dmf)溶液15ml, 最后加入二环己基碳二亚胺(dcc)(206mg,1mmol),整个反应体系在常温 搅拌条件下进行15个小时。反应结束后,减压旋蒸去除二氯甲烷,然后加水析 出固定,最后抽滤得到固体产物,从而获得含有式(ⅱ)化合物的粗产物。粗 产物进一步通过色谱柱进行分离,二氯甲烷和甲醇的混合体系为洗脱剂,可得 到纯净的暗黄色的302mg,产率约为53%。
[0065]
实施方案3:将第一步合成的式(
ⅷ
)化合物(347mg,1mmol)溶于15ml无 水二氯甲烷溶液中,再加入式(
ⅸ
)化合物(244mg,1mmol)和4
‑
二甲氨基吡 啶(dmap)(122mg,1mmol)的无水n,n
‑
二甲基甲酰胺(dmf)溶液15ml, 最后加入二环己基碳二亚胺(dcc)(206mg,1mmol),整个反应体系在常温 搅拌条件下进行15个小时。反应结束后,减压旋蒸去除二氯甲烷,然后加水析 出固定,最后抽滤得到固体产物,从而获得含有式(ⅱ)化合物的粗产物。粗 产物进一步通过色谱柱进行分离,二氯甲烷和甲醇的混合体系为洗脱剂,可得 到纯净的暗黄色的248mg,产率约为43%。
[0066]
实施方案4:将第一步合成的式(
ⅷ
)化合物(694mg,2mmol)溶于15ml无 水二氯甲烷溶液中,再加入式(
ⅸ
)化合物(488mg,2mmol)和4
‑
二甲氨基吡 啶(dmap)(244mg,2mmol)的无水n,n
‑
二甲基甲酰胺(dmf)溶液15ml, 最后加入二环己基碳二亚胺(dcc)(412mg,2mmol),整个反应体系在常温 搅拌条件下进行15个小时。反应结束后,减压旋蒸去除二氯甲烷,然后加水析 出固定,最后抽滤得到固体产物,从而获得含有式(ⅱ)化合物的粗产物。粗 产物进一步通过色谱柱进行分离,二氯甲烷和甲醇的混合体系为洗脱剂,可得 到纯净的暗黄色的322mg,产率约为28%。
[0067]
实施例2:测试荧光探针的时间动力学
[0068]
配制一个探针浓度为5μm的10ml的测试体系,然后将5μm的次氯酸加 入到测试体系中,摇晃均匀后立即用荧光光谱仪测试其荧光强度变化。上述测 定是在pbs缓冲溶液(10mmpbs,ph7.4)体系中进行的,所使用的探针是实施 例1中所制备的探针,且荧光光谱是在25℃下测得的。
[0069]
由图1可以清楚地看到,当次氯酸加入后,荧光强度瞬间达到最大值并保 持不变,这说明该探针对次氯酸瞬时响应,能够为次氯酸的测定提供快速的分 析方法。
[0070]
实施例3:测试荧光探针对于次氯酸的浓度梯度
[0071]
配置多个探针浓度为5μm的平行样品于10ml比色管中,然后将不同浓度 的次氯酸加入到测试体系中,摇晃均匀后用荧光光谱仪测试其荧光强度变化。 上述测定是在pbs缓冲溶液(10mmpbs,ph7.4)体系中进行的,所使用的探针 是实施例1中所制备的探针,且荧光光谱是在25℃下测得的。
[0072]
从图2(a)可以清晰的看出,随着次氯酸浓度的增加,553nm处的荧光强 度逐渐增强。并且,由图2(b)可以看出探针(5μm)加入次氯酸(0
‑
1μm) 之后,其560nm处的荧光强度的与次氯酸浓度之间呈现了良好的线性关系,这 证明借助于该荧光探针能够对次氯酸进行定量分析。
[0073]
实施例4:测试荧光探针的选择性
[0074]
配置多个探针浓度为5μm的平行样品于10ml比色管中,然后将不同的分 析物(分析物分别是空白、钾离子、钙离子、钠离子、镁离子、锌离子、三价 铁离子、二价铁离子、铜离
子、氟离子、碘离子、氯离子、溴离子、硝酸根、 亚硝酸根、碳酸根、硫酸根、半胱氨酸(cys)、同型半胱氨酸(hcy)、谷胱 甘肽(gsh)、硫离子、过氧化氢、过氧化叔丁醇、过氧化叔丁醇自由基、羟 基自由基、超氧阴离子、单线态氧、一氧化氮和次氯酸;除特殊标明外,其他 分析物浓度均为100μm;cys和hcy的浓度为500μm,次氯酸的浓度为5μm) 加入到测试体系中,摇晃均匀后用荧光光谱仪测试其荧光强度变化。上述测定 是在pbs缓冲溶液(10mmpbs,ph7.4)体系中进行的,所使用的探针是实施例 1中所制备的探针,且荧光光谱是在25℃下测得的。
[0075]
从图3可以清晰的看出,只有次氯酸加入的时候才能引起探针荧光强度的 强烈变化,而其他分析物的影响几乎可以忽略不计。实验证明,该探针对次氯 酸具有较高的选择性,有利于对次氯酸的检测分析。
[0076]
实施例6:荧光探针对hela细胞的毒性测试
[0077]
用细胞计数试剂盒(cck
‑
8)检测不同浓度的探针对hela细胞的细胞毒性。 探针浓度分别为0μm,10μm,20μm,探针孵育细胞的时间为4h。
[0078]
从图5可以清晰的看出,探针具有低毒性的特点,可以将其长时间应用于 细胞样品中次氯酸的实时检测。
[0079]
实施例6:荧光探针细胞筛选实验
[0080]
用探针(10μm)分别对两种正常细胞和四组癌细胞(正常细胞:raw264.7 和huvec;癌细胞:mgc
‑
803,hela,hepg2和sh
‑
sy5y)孵育25min,最 后对六组细胞分别进行共聚焦显微成像。(a)是各种细胞的细胞成像图。(b) 是6种细胞的荧光强度柱状图。
[0081]
从图5可以清晰的看出,经该探针孵育的癌细胞和正常细胞展示出不同的 荧光强度,且癌细胞的荧光强度明显高于正常细胞。实验证明,该探针具有区 分癌细胞和正常细胞的功能。
[0082]
实施例7:荧光探针对hela细胞中外源性和内源性次氯酸的荧光显微成像
[0083]
将hela细胞分成五组,a组作为对照组,不进行任何操作;b组用探针(10μm) 孵育25min;c组,在b组细胞的基础上孵育hocl(10μm)25min;d组,先用lps (1.0μg ml
‑1,lps是一种炎症刺激剂,可以刺激细胞产生hocl)处理2h,再 用探针(10μm)孵育25min;e组先用nac(500μm,nac的作用与lps相反, 是一种ros清除剂可以消除细胞产生的hocl)处理3h,再加探针(10μm)孵 育25min。最后对五组细胞分别进行共聚焦显微成像,其中(f)代表细胞荧光 强度的柱状图。
[0084]
从图6可以清晰的看出,该探针可以检测hela中内源性和外源性的次氯酸。 实验证明,该探针可以应用于生物样品中的次氯酸检测。
[0085]
实施例8:荧光探针的抑制试验
[0086]
将hela细胞分成三组,a组,作为对照组,不进行任何操作;b组,用辅 酶r(50μm)预处理后25分钟后,再用探针(10μm)孵育25分钟;c):用 探针(10μm)孵育25分钟。最后对这三种细胞分别进行共聚焦显微成像,其 中图d为细胞荧光强度的柱状图。
[0087]
从图7可以清晰的看出,由于辅酶r的抑制效果,富集在细胞内的探针浓 度减少。实验证明,生物素的引入可以使该探针更多的富集在癌细胞内,从而 有利于区分癌细胞和正常细胞的功能的实现。
[0088]
虽然用上述实施方式描述了本发明,应当理解的是,在不背离本发明的精 神的前
提下,本发明可进行进一步的修饰和变动,且这些修饰和变动均属于本 发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1