具有吡咯烷酮基的有机化合物及制备方法、有机发光器件与流程
1.本发明涉及显示技术领域,尤其涉及一种具有吡咯烷酮基的有机化合物及制备方法、及具有该有机化合物的有机发光器件。
背景技术:
2.有机发光二极管(organic light-emitting diode,oled)具有响应速度快、对比度高、视角广以及可柔性等优点,此外有机发光二极管是自主发光,使得器件相对于液晶显示器(liquid crystal display,lcd)来说更加轻薄、节能。随着技术的不断发展,oled器件的良品率与生产成本得到有效控制,其市场占有率正逐步提高。
3.oled器件的结构中除了阴阳两电极外,还包含空穴注入层、空穴传输层、发光层、电子传输层与电子注入层。其工作原理是:在两电极间施加电压,电子与空穴分别从阴极与阳极经电子注入及传输层与空穴注入及传输层注入至发光层。电子与空穴因库仑力的作用相互束缚形成激子。激子处于不稳定的高能量的激发态,通过辐射衰减的方式释放能量,回到稳定的基态,并产生光子。
4.由于电子传输层与电子注入层容易被氧化。因此,常采用倒置结构,例如电极/电子注入层/电子传输层/发光层/空穴传输层/空穴注入层/电极的结构进行oled器件的设置。进而发光层、空穴传输层以及空穴注入层会对电子传输层与电子注入层起到一定的保护作用,但是发光层制备于电子传输层上,在制程中电子传输层容易被发光层溶液的溶剂洗掉。目前,常采用交联的电子传输层材料来提高其抗溶剂性。但是,交联的电子传输层材料会存在交联不完全的情况,从而影响器件的性能。
技术实现要素:
5.本发明实施例提供一种具有吡咯烷酮基的有机化合物及制备方法、及具有该有机化合物的有机发光器件,通过在电子传输层加入该有机化合物,以提高电子传输层与电子注入层之间的结合性,能够解决电子传输层材料抗溶剂性不强,在制程中易被溶剂洗掉,进而影响器件性能的技术问题。
6.为解决上述技术问题,本发明实施例提供一种有机化合物,所述有机化合物的结构通式如式(1-1)所示:
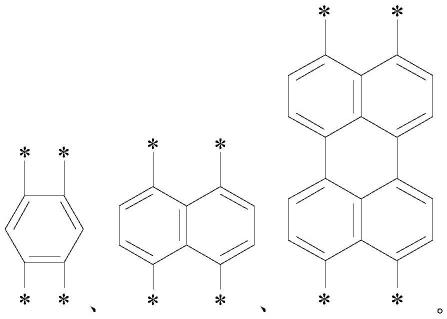
7.8.其中,x为取代或未取代的芳基,y选自氢原子、取代或未取代的烯基以及取代或未取代的芳基中的一者,r1与r2中的一者为吡咯烷酮基团,另一者为吡咯烷酮基团、或烷基链、或含有氮原子的烷基链,且n1为大于或等于1的整数。
9.在本发明的一种实施例中,所述x为以下任意之一:
[0010][0011]
在本发明的一种实施例中,所述吡咯烷酮基团为如下式(2-1)所示结构:
[0012][0013]
其中,n2的取值为1至10的整数。
[0014]
在本发明的一种实施例中,所述含有氮原子的烷基链为如下式(3-1)以及(3-2)所示结构中的任一种:
[0015][0016]
其中,n3与n4的取值为1至10的整数,r3、r4以及r5各自独立地选自碳原子数为1至20的烷基链或氢原子。
[0017]
在本发明的一种实施例中,所述y为氢原子;或
[0018]
如下式(4-1)、(4-2)、(4-3)、(4-4)以及(4-5)所示结构中的任一种:
[0019][0020]
在本发明的一种实施例中,所述有机化合物为结构式如下式(5-1)、(5-2)以及(5-3)所示化合物中的任一种:
[0021][0022]
在本发明的一种实施例中,在式(5-3)所示化合物中所述n1的取值为10至10000的整数。
[0023]
根据本发明的上述目的,提供一种具有吡咯烷酮基的有机化合物的制备方法,包括以下步骤:
[0024]
在保护气体氛围下,将取代或未取代的吡咯烷酮与羧酸酐化合物进行反应,以得到所述有机化合物的卤化物或如式(1-1)所示的所述有机化合物,其中,所述y为氢原子,所述n1为1;
[0025]
所述羧酸酐化合物的结构式为:
[0026]
且z为氢原子或卤原子。
[0027]
在本发明的一种实施例中,所述取代或未取代的吡咯烷酮与所述羧酸酐化合物的摩尔比为21:10。
[0028]
在本发明的一种实施例中,所述取代或未取代的吡咯烷酮与所述羧酸酐化合物的反应温度为120℃,反应时长为12h。
[0029]
在本发明的一种实施例中,所述取代或未取代的吡咯烷酮包括1-(2-氨基-乙基)-吡咯烷-2-酮,所述羧酸酐化合物包括均苯四甲酸二酐、1,4,5,8-萘四甲酸酐或2,6-二溴萘-1,4,5,8-四羧酸二酐。
[0030]
在本发明的一种实施例中,所述得到所述有机化合物的卤化物之后,还包括以下步骤:
[0031]
在保护气体氛围下,将所述有机化合物的卤化物、第一化合物以及催化剂溶于溶剂,经反应得到如式(1-1)所示的所述有机化合物,其中,所述y选自取代或未取代的烯基、取代或未取代的芳基中的一者,所述n1的取值为10至10000的整数;
[0032]
所述第一化合物为取代或未取代的烯烃、取代或未取代的芳烃中的一者,所述催化剂包括钯催化剂,所述溶剂包括四氢呋喃。
[0033]
在本发明的一种实施例中,所述有机化合物的卤化物与所述第一化合物的摩尔比为1:1。
[0034]
在本发明的一种实施例中,第一化合物包括1,4-苯二硼酸频那醇酯。
[0035]
在本发明的一种实施例中,所述有机化合物的卤化物与所述第一化合物的反应温度为70℃,反应时长为24h。
[0036]
根据本发明的上述目的,提供一种有机发光器件,所述有机发光器件包括电子传输层和电子注入层。此外,还可以包括第一电极、第二电极以及设置于所述第一电极与所述第二电极之间的功能层。所述电子传输层的材料包括所述有机化合物。
[0037]
在本发明的一种实施例中,所述电子注入层的材料包括氧化锌。
[0038]
本发明的有益效果:本发明提供一种有机化合物,该有机化合物中具有吡咯烷酮基团,且吡咯烷酮基团与氧化锌之间具有较强的相互作用,其中,吡咯烷酮与锌离子可以配位,且配位能力很强。在应用过程中,将该有机化合物加入到电子传输层的材料中,且电子注入层的材料包括氧化锌,进而使得电子传输层材料可以牢牢的吸附在电子注入层材料表面,不会被溶剂洗掉,进而可以提高电子传输层的抗溶剂性。
附图说明
[0039]
下面结合附图,通过对本发明的具体实施方式详细描述,将使本发明的技术方案及其它有益效果显而易见。
[0040]
图1为本发明实施例提供的有机发光器件的结构示意图;
[0041]
图2为本发明实施例提供的有机发光器件的电流-电压曲线图;
[0042]
图3为本发明实施例提供的有机发光器件的效率-电流曲线图。
具体实施方式
[0043]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0044]
本发明实施例提供一种具有吡咯烷酮基的有机化合物,该有机化合物为结构通式如式((1-1)所示:
[0045][0046]
其中,x为取代或未取代的芳基,y选自氢原子、取代或未取代的烯基以及取代或未取代的芳基中的一者,r1与r2中的一者为吡咯烷酮基团,另一者为吡咯烷酮基团、或烷基链、或含有氮原子的烷基链,且n1为大于或等于1的整数。
[0047]
本发明实施例提供一种有机化合物,该有机化合物中具有吡咯烷酮基团,且吡咯
烷酮基团与氧化锌之间具有较强的相互作用,其中,吡咯烷酮与锌离子可以配位,且配位能力很强。在实施应用过程中,当有机发光器件中的电子传输层中加入该有机化合物,且电子注入材料包括氧化锌,可使得电子传输层材料可以牢牢的吸附在电子注入层材料表面,不会被溶剂洗掉,提高了电子传输层的抗溶剂性。
[0048]
可选的,r1与r2均可为吡咯烷酮基团,以进一步提高有机化合物的抗溶剂性,且r1与r2可为相同基团,也可为不相同基团,在此不作限定。
[0049]
进一步地,x为以下任意之一:
[0050][0051]
需要说明的是,上述x中,其中“*”表示连接位点,且相邻或相近的两个连接位点在有机化合物中连接位于同一侧的碳原子,即如式(1-1)中,其中一对相邻或相近的两个连接位点在有机化合物中连接靠近r1侧的两个碳原子,而另一对相邻或相近的两个连接位点在有机化合物中连接靠近r2侧的两个碳原子。且y连接于x中的苯环上。
[0052]
可选的,有机化合物的结构式包括如下式中的任意之一:
[0053][0054]
其中,y为氢原子、或烯基、或芳基,r1与r2中的一者为吡咯烷酮基团,另一者为吡咯烷酮基团、或烷基链、或含有氮原子的烷基链,且n1为大于或等于1的整数。
[0055]
可选的,吡咯烷酮基团为如下式(2-1)所示结构:
[0056][0057]
其中n2的取值为1至10的整数。
[0058]
可选的,含有氮原子的烷基链为如下式(3-1)或(3-2)所示结构:
[0059][0060]
其中,n3与n4取值为1至10的整数,r3、r4以及r5各自独立地选自碳原子数为1-20的烷基链或氢原子,即r3、r4以及r5可为相同的基团,如氢原子或碳原子数相同且排列相同的烷基链,也可为不同的基团,在此不作限定。
[0061]
可选的,y为氢原子,或y为如下式(4-1)、(4-2)、(4-3)、(4-4)或(4-5)所示结构:
[0062][0063]
需要说明的是,在式(1-1)中,由于x、y、r1以及r2的不同,有机化合物将具有不同的结构式,且各不同结构的有机化合物中,均具有吡咯烷酮基团,即各有机化合物与氧化锌之间均能产生较强的相互作用,因此,在实施应用过程中,电子传输层的材料可包括各种不同结构的有机化合物中的一者或多者以提高电子传输层与电子注入层(氧化锌)之间的结合性,提高电子传输层的抗溶剂性。
[0064]
可选的,有机化合物为结构式如下式(5-1)、(5-2)以及(5-3)所示化合物中的任意一种:
[0065][0066]
其中,在式(5-3)中,n1的取值为10至10000的整数。
[0067]
本发明实施例以有机化合物的上述三种结构式为例进行说明,且后续将以上述三种结构式所示的有机化合物的制备方法进行说明。需要说明的是,有机化合物的其他不同结构所对应的制备过程,皆可参照以下实施例进行实现。
[0068]
本发明实施例提供一种上述有机化合物的制备方法,且所述方法包括以下步骤:
[0069]
在保护气体氛围下,取代或未取代的吡咯烷酮与羧酸酐化合物进行反应,以得到有机化合物的卤化物或如式(1-1)所示的有机化合物,其中,y为氢原子,n1为1。
[0070]
且羧酸酐化合物的结构式为:
[0071]
且z为氢原子或卤原子。
[0072]
优选的,z为溴原子。
[0073]
具体地,将取代或为取代的吡咯烷酮与羧酸酐化合物加入反应器中,并置于氮气氛围中,加入一定的酸,在预设温度下进行反应,得到反应液,然后经过冷却、分离以及提纯得到有机化合物的卤化物或如式(1-1)所示的有机化合物,其中,y为氢原子,n1为1。
[0074]
可选的,酸可为醋酸,反应温度可为120℃,吡咯烷酮衍生物包括1-(2-氨基-乙基)-吡咯烷-2-酮,羧酸酐衍生物包括均苯四甲酸二酐、1,4,5,8-萘四甲酸酐或2,6-二溴萘-1,4,5,8-四羧酸二酐。
[0075]
进一步地,得到有机化合物的卤化物之后,制备方法还包括以下步骤:
[0076]
在保护气体氛围下,将有机化合物的卤化物、第一化合物以及催化剂中溶于溶剂,经反应得到如式(1-1)所示的有机化合物,其中,y选自取代或未取代的烯基、取代或未取代的芳基中的一者,n1的取值为10至10000的整数。
[0077]
具体地,向另一反应器中加入有机化合物的卤化物、第一化合物以及催化剂,并置于氮气氛围下,加入溶剂,在预设温度下进行反应,得到反应液,然后经过冷却、分离以及提纯得到如式(1-1)所示的所述有机化合物,其中,y选自取代或未取代的烯基、取代或未取代的芳基中的一者,所述n1的取值为10至10000的整数。
[0078]
其中,第一化合物为取代或未取代的烯烃、取代或未取代的芳烃中的一者,且在有机化合物的卤化物中,可选的,卤原子z连接于x中的苯环结构上。
[0079]
可选的,反应温度可为70℃,第一化合物包括1,4-苯二硼酸频那醇酯,催化剂包括钯催化剂,溶剂包括四氢呋喃与去离子水的混合溶剂。
[0080]
下面结合具体实施例,以对本发明实施例提供的有机化合物的制备方法进行描述。
[0081]
实施例一
[0082]
有机化合物包括如下所示结构的化合物m1:
[0083][0084]
向一反应器中依次加入21mmol取代或未取代的吡咯烷酮与10mmol羧酸酐化合物,加入搅拌磁子,对反应器进行抽真空换氮气操作,反复三次,以使得反应器内呈氮气氛围。
[0085]
其中,反应器可为100ml两口瓶,取代或未取代的吡咯烷酮为1-(2-氨基-乙基)-吡咯烷-2-酮,其结构式为:
[0086][0087]
羧酸酐化合物为均苯四甲酸二酐,其结构式为:
[0088][0089]
然后,向反应器中加入50ml醋酸,在120℃反应12h,以得到反应液。将反应液冷却至室温,并将反应液加入二氯甲烷中,用水萃取三次。再用饱和碳酸钠水溶液萃取,取有机相,将萃取出的有机相用无水mgso4干燥。干燥后过滤杂质,旋蒸除去溶剂,再用乙酸乙酯重结晶,得到产物m1。m1的产率为53%。产物分子结构鉴定数据如下:
[0090]
1hnmr(500mhz,cdcl3),δ(tms,ppm):8.35(s,2h),3.89-3.85(t,4h),3.53-3.50(t,4h),3.36-3.32(t,4h),2.31-2.21(m,4h)。说明产物为m1。
[0091]
其中,反应过程如下:
[0092][0093]
实施例二
[0094]
有机化合物包括如下所示结构的化合物m2:
[0095][0096]
向一反应器中依次加入21mmol取代或未取代的吡咯烷酮与10mmol羧酸酐化合物,加入搅拌磁子,对反应器进行抽真空换氮气操作,反复三次,以使得反应器内呈氮气氛围。
[0097]
其中,反应器可为100ml两口瓶,取代或未取代的吡咯烷酮包括1-(2-氨基-乙基)-吡咯烷-2-酮,其结构式为:
[0098][0099]
羧酸酐化合物为1,4,5,8-萘四甲酸酐,其结构式为:
[0100][0101]
进一步地,向反应器中加入50ml醋酸,在120℃反应12h,以得到反应液。将反应液冷却至室温,并将反应液加入二氯甲烷中,用水萃取三次。再用饱和碳酸钠水溶液萃取,取有机相,将萃取出的有机相用无水mgso4干燥。干燥后过滤杂质,旋蒸除去溶剂,再用乙酸乙酯重结晶,得到产物m2。m2的产率为63%。产物分子结构鉴定数据如下:
[0102]
1hnmr(500mhz,cdcl3),δ(tms,ppm):8.65-8.63(d,4h),3.51-3.47(t,4h),3.43-3.46(t,4h),3.36-3.32(t,4h),2.31-2.21(m,4h)。说明产物为m2。
[0103]
其中,反应过程如下:
[0104][0105]
实施例三
[0106]
有机化合物包括如下所示结构的化合物m3:
[0107][0108]
向一反应器中依次加入21mmol取代或未取代的吡咯烷酮与10mmol羧酸酐化合物,加入搅拌磁子,对反应器进行抽真空换氮气操作,反复三次,以使得反应器内呈氮气氛围。
[0109]
其中,反应器包括100ml两口瓶,取代或未取代的吡咯烷酮为1-(2-氨基-乙基)-吡咯烷-2-酮,其结构式为:
[0110][0111]
羧酸酐化合物为2,6-二溴萘-1,4,5,8-四羧酸二酐,其结构式为:
[0112][0113]
进一步地,向反应器中加入50ml醋酸,在120℃反应12h,以得到反应液。将反应液冷却至室温,并将反应液加入二氯甲烷中,用水萃取三次。再用饱和碳酸钠水溶液萃取,取有机相,将萃取出的有机相用无水mgso4干燥。干燥后过滤杂质,旋蒸除去溶剂,再用乙酸乙酯重结晶,得到产物m0,m0的产率为83%。且产物m0的结构式如下所示:
[0114][0115]
其中,m0即为有机化合物的卤化物的其中一种结构式,且产物m0鉴定数据如下:
[0116]
1hnmr(500mhz,cdcl3),δ(tms,ppm):8.45(s,2h),3.51-3.47(t,4h),3.43-3.46(t,4h),3.36-3.32(t,4h),2.31-2.21(m,4h)。说明产物为m0。
[0117]
反应过程如下:
[0118][0119]
进一步地,向另一反应器中加入化合物1mmolm0以及1mmol1,4-苯二硼酸频那醇酯,加入搅拌磁子,并对反应器进行抽真空换氮气操作,反复三次,以使得反应器内呈氮气氛围。
[0120]
其中,反应器可为100ml两口瓶,1,4-苯二硼酸频那醇酯的结构式为:
[0121][0122]
向反应器中加入50ml混合溶剂四氢呋喃/去离子水(体积比为v1/v2=3:1),在70℃
下回流反应24h,以得到反应液。将反应液冷却到室温,并将反应液倒入水中,用二氯甲烷萃取3次,然后用无水mgso4干燥。干燥后过滤杂质,旋蒸除去溶剂,依次用乙醇,乙酸乙酯,石油醚,二氯甲烷,取二氯甲烷提取物,旋蒸除去溶剂得到产物m3。m3的产率为45%。gpc(凝胶渗透色谱)结果为:mn=18656,pdi=1.55。
[0123]
需要说明的是,本发明实施例以上述化合物m1、化合物m2以及化合物m3的制备过程为例,进行描述,且对于其他结构的有机化合物的制备过程均可参照上述过程进行。
[0124]
承上,本发明实施例提供的有机化合物包括结构式如通式(1-1)所示结构中的任一种,本发明实施例通过在有机化合物中引入吡咯烷酮基团,且吡咯烷酮基团与氧化锌之间具有较强的相互作用,其中,吡咯烷酮与锌离子可以配位,且配位能力很强,因此,在实施应用时,电子传输层中加入本发明实施例提供的有机化合物,且电子注入层的材料包括氧化锌,由于吡咯烷酮基团与氧化锌之间较强的相互作用,使得电子传输层材料可以牢牢的吸附在电子注入层材料表面,不会被溶剂洗掉,提高了电子传输层的抗溶剂性。
[0125]
另外,本发明实施例还提供一种有机发光器件,请参照图1,图1为本发明实施例提供的有机发光器件的结构示意图,其中,有机发光器件包括第一电极20、第二电极30、以及设置于第一电极20与第二电极30之间的功能层40。且功能层40包括本发明实施例提供的有机化合物。
[0126]
具体地,有机发光器件包括基板10、设置于基板10上的第一电极20、设置于第一电极20上的功能层40以及设置于功能层40上的第二电极30。
[0127]
其中,第一电极20为阴极,第二电极30为阳极。
[0128]
功能层40包括依次层叠设置于第一电极20上的电子注入层41、电子传输层42、发光层43、空穴传输层44以及空穴注入层45,在本发明实施例中,至少电子传输层42包括本发明实施例提供的有机化合物。
[0129]
可选的,空穴注入层45、空穴传输层44、发光层43以及电子注入层41中的至少一层也可以包括本发明实施例提供的有机化合物。
[0130]
在本发明实施例中,电子注入层41的材料包括氧化锌材料,而电子传输层42包括本发明实施例提供的有机化合物。其中,本发明实施例提供的有机化合物中引入了吡咯烷酮基团,吡咯烷酮基团与氧化锌具有较强的相互作用。具体地,吡咯烷酮与锌离子可以配位,且配位能力很强,使得电子传输层42可以牢牢的吸附在电子注入层41的表面,不会被溶剂洗掉,提高了电子传输层的抗溶剂性。进而避免了在制程中电子传输层42被发光层43溶液的溶剂洗掉,提高了有机发光器件的稳定性。
[0131]
另外,本发明实施例还提供一种上述有机发光器件的制作方法,且制作方法包括以下步骤:
[0132]
首先提供ito基板,并对ito基板进行清洗,具体地,清洗次序依次包括:5%koh溶液超声15min、纯水超声15min、异丙醇超声15min,然后采用烘箱干燥1h。
[0133]
再将基板转移至紫外臭氧清洗仪中进行表面处理15min,处理完后立即转移至手套箱中,本发明实施例在涂覆其他部分之前,对基板进行光清洗处理,可以极大的提高基板表面润湿性,增强基体表面的粘合力。
[0134]
在基板上进行蒸镀及旋涂成膜制程,包括依次在基板上制备电子注入层41、电子传输层42、发光层43、空穴传输层44以及空穴注入层45。
[0135]
最后经过紫外光固化封装,并在80℃条件下烘烤60min即可。
[0136]
具体地,在成膜的过程中,将氧化锌纳米粒子分散于乙醇中,并在旋涂成膜后,在120℃下退火10min,以形成电子注入层41,且厚度可为40nm。
[0137]
将本发明实施例提供的有机化合物溶于溶剂,经旋涂成膜后,在100℃下退火10min,以形成电子传输层42,且厚度可为3nm。其中,溶剂可为氯苯。
[0138]
将质量比为1:0.1(1:0.1,wt)的9,9'-(2,6-吡啶二基二-3,1-亚苯)双-9h-咔唑(26dczppy)以及ir(dbi)3溶于溶剂,经旋涂成膜后,在100℃下退火10min,以形成发光层43,且厚度可为30nm。其中,溶剂可为氯苯。
[0139]
进一步地,空穴传输层44的材料包括tapc(4,4'-环己基二[n,n-二(4-甲基苯基)苯胺]),且厚度可为30nm。
[0140]
空穴注入层45的材料包括hat-cn(2,3,6,7,10,11-六氰基-1,4,5,8,9,12-六氮杂苯并菲),且厚度可为10nm。
[0141]
阳极材料包括ag,且厚度可为100nm。
[0142]
在本发明实施例中,采用化合物m1作为电子传输层的有机发光器件记为t1。采用化合物m2作为电子传输层的有机发光器件记为t2。采用化合物m3作为电子传输层的有机发光器件记为t3。对比例中不设置电子传输层,并记为t0。其中,器件t0、t1、t2以及t3中除是否设置有电子传输层具有差异外,其他结构均可相同。
[0143]
对器件t0、t1、t2以及t3的最大外量子效率、及cie坐标进行测试。结果参见表1、图2以及图3。表1是本发明实施例提供的器件性能数据表。图2为本发明实施例提供的有机发光器件的电流-电压曲线图。图3为本发明实施例提供的有机发光器件的效率-电流曲线图。其中,图2中纵坐标表示电流密度,横坐标表示电压。图3中纵坐标表示效率,横坐标表示电流密度。
[0144]
表1器件性能数据表
[0145][0146][0147]
由表1以及图2、图3可以看出,器件t1、t2以及t3的最大外量子效率、最大电流效率以及器件效率均明显大于器件t0。即表明采用本发明实施例提供的有机化合物制得的电子传输层在制程中并未被发光层溶液的溶剂洗掉,具有很好的抗溶剂性,极大程度地提高了电子传输层的稳定性,进而提高了有机发光器件的性能。
[0148]
此外,本发明实施例提供的有机化合物还可用于有机发光二极管、有机场效晶体管以及有机薄膜太阳电池元件等领域。
[0149]
本发明实施例还提供一种显示装置,显示装置包括本发明实施例提供的有机发光器件,且显示装置包括智能手环、智能手表、虚拟现实(virtual reality,vr)等可穿戴设备;显示装置还包括移动电话机、电子书、电子报纸、电视机、个人便携电脑、可折叠以及可
卷曲oled等柔性显示及照明设备。
[0150]
在上述实施例中,对各个实施例的描述都各有侧重,某个实施例中没有详述的部分,可以参见其他实施例的相关描述。
[0151]
以上对本发明实施例所提供的一种具有吡咯烷酮基的有机化合物及制备方法、有机发光器件进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的技术方案及其核心思想;本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例的技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1