ACE2人源化猪的构建方法及应用与流程
ace2人源化猪的构建方法及应用
技术领域
1.本发明涉及基因编辑技术领域,具体涉及一种采用crispr/cas9系统构建的表达人ace2的猪细胞或ace2人源化猪及其在生物医药领域中的应用。
背景技术:
[0002][0003]
人类血管紧张素i转化酶2(hace2)为人类血管紧张素转换酶同源物,是一种锌金属蛋白酶,属于1型跨膜蛋白,其作为sars-2-cov和sars-cov等冠状病毒在人体内的受体蛋白,广泛存在于人体各个组织中,是目前已知导致sars-2-cov进入宿主细胞并造成宿主发病的唯一关键蛋白。
[0004]
目前,尚未有针对sars-2-cov的有效药物,世界各国都在争分夺秒地开展sars-2-cov疫苗的研发。而动物感染模型对于阐明sars-2-cov的感染与发病机制、传播途径以及抗病毒药物和疫苗的评价至关重要。目前,已建立了ace2人源化的转基因小鼠模型和恒河猴模型,例如:专利文献 cn111979273a公开了一种制备人源化ace2小鼠模型的方法,包括针对小鼠ace2基因组序列的 exon2与exon15的序列分别设计上下游两条sgrna引物序列;针对小鼠ace2 exon2与人类ace2编码区域5’端同源序列以及人类ace2编码区域3’端与小鼠ace2 exon15同源序列设计上下游两条 ssodn序列。专利文献cn111621523a公开了一种ace2细胞人源化的小鼠模型,该小鼠模型以免疫缺陷小鼠为母体,且体内含有过表达ace2受体的人源细胞。专利文献cn111549064a公开了应用腺病毒转导制备能够表达人源ace2转基因非人动物的方法,其中该腺病毒由pshuttle-hace2与 padeasy-1重组得到的重组载体在ad293细胞中拯救得到,所述pshuttle-hace2为插入有所述人源 ace2的dna序列的pshuttle;所述腺病毒在转导所述动物后,所述动物的呼吸道细胞表达人源 ace2蛋白。但是小鼠不论从体型、器官大小、生理、病理等方面都与人相差巨大,不能真实地模拟人类正常的生理、病理状态。虽然恒河猴是与人亲缘关系最近的动物,但其体型小、性成熟晚(6-7 岁开始交配),且为单胎动物,群体扩繁速度极慢,饲养成本很高。另外,灵长类动物克隆效率低、难度大、成本高。而猪作为大动物,是人类长期以来主要的肉食供应动物,其体型大小和生理功能与人类近似,易于大规模繁殖饲养,而且在伦理道德及动物保护等方面要求较低,是理想的人类疾病模型动物。
[0005]
同源重组(hdr)是通过序列同源性交换dna序列信息:即外源供体dna中包含所需插入片段即目标片段,供体dna的两端则是与插入位点两侧具有序列同源性的重组臂。通过细胞的同源重组,可将外源供体dna中的目标片段插入细胞的基因组中。
[0006]
基因编辑是近年来不断取得重大发展的一种生物技术,其包括从基于同源重组的基因编辑到基于核酸酶的zfn、talen、crispr/cas9等编辑技术,其中crispr/cas9技术是当前最先进的基因编辑技术。目前,基因编辑技术被越来越多地应用到动物模型的制作上。
[0007]
本技术采用基因编辑及同源重组技术构建了表达人ace2的猪细胞,并以该细胞为核移植供体细胞生产出了ace2人源化克隆猪。
技术实现要素:
[0008]
本发明采用crispr/cas9基因编辑及同源重组技术,将人ace2基因(hace2)定点插入猪安全港位点,制备出人源化的hace2转基因猪重组细胞,为进一步的通过体细胞克隆技术生产人源化hace2转基因克隆猪奠定坚实基础,进而为sars-2-cov和sars-cov等冠状病毒的致病机制及疾病治疗等研究提供有力的实验工具。
[0009]
本发明的第一方面,提供了一种表达人ace2的猪细胞,将人ace2基因插入猪安全港位点,获得表达seqidno:12所示人ace2的猪细胞,所述的猪安全港位点选自猪rosa26、aavs1、h11或col1a1安全港位点。
[0010]
优选的,所述插入的人ace2基因的核苷酸序列为编码seqidno:12的核苷酸序列。
[0011]
优选的,所述插入的人ace2基因的核苷酸序列如seqidno:13所示。
[0012]
优选的,rosa26安全港位点区域及其上下游各500bp的核苷酸序列如seqidno:14所示,aavs1安全港位点区域及其上下游各500bp的核苷酸序列如seqidno:15所示,h11安全港位点区域及其上下游各500bp的核苷酸序列如seqidno:16所示,col1a1安全港位点区域及其上下游各500bp的核苷酸序列如seqidno:17所示。
[0013]
优选的,所述的猪细胞为猪成纤维细胞。所述的猪细胞还可以选自胚胎干细胞、成体干细胞、造血干细胞、骨髓间充质干细胞、神经干细胞、肝干细胞、肌肉卫星细胞、皮肤表皮干细胞、肠上皮干细胞、视网膜干细胞、胰腺干细胞、体细胞、成纤维细胞、肌细胞、胶质细胞、脂肪细胞或生殖细胞等等。
[0014]
优选的,所述猪细胞不能发育为动物个体。
[0015]
本发明的第二方面,提供了一种上述猪细胞的构建方法,使用安全港位点载体将人ace2基因插入猪安全港位点,所述的安全港位点载体包含人ace2基因的核苷酸序列和安全港位点载体骨架,所述的安全港位点载体骨架包含安全港插入位点的5’同源臂和3’同源臂,所述人ace2基因的核苷酸序列位于5’同源臂与3’同源臂之间,所述的安全港位点载体骨架选自下列任一项所示:
[0016]
a)rosa26安全港位点载体骨架,其5’同源臂如seqidno:18所示,3’同源臂如seqidno:19所示;
[0017]
b)aavs1安全港位点载体骨架,其5’同源臂如seqidno:5所示,3’同源臂如seqidno:6所示;
[0018]
c)h11安全港位点载体骨架,其5’同源臂如seqidno:7所示,3’同源臂如seqidno:8所示;
[0019]
或d)col1a1安全港位点载体骨架,其5’同源臂如seqidno:9所示,3’同源臂如seqidno:10所示;
[0020]
优选的,所述的安全港位点载体还包含启动子、信号分子以及编码egfp蛋白、mcherry蛋白和puro抗性蛋白的核苷酸序列。其中,所述的启动子为ef-1α启动子、pgk启动子和/或pcag启动子。所述的信号分子为ef-1αpoly(a)信号、bghpoly(a)信号和/或β-globinpoly(a)信号。进一步优选还包含绝缘子区域。
[0021]
在本发明的一个具体实施方式中,所述的安全港位点载体骨架从5’至3’依次包括5’同源臂、绝缘子区域、ef-1αpoly(a)信号、编码egfp的核苷酸序列、ef-1α启动子、绝缘子
区域、pgk启动子、编码mcherry的核苷酸序列、bghpoly(a)信号、loxp-puro-loxp表达框区域、绝缘子区域、β-globinpoly(a)信号、pcag启动子、绝缘子区域、3’同源臂。
[0022]
在本发明的一个具体实施方式中,所述的rosa26安全港位点载体的核苷酸序列如seqidno:4所示。
[0023]
在本发明的一个具体实施方式中,所述的aavs1安全港位点载体的核苷酸序列如seqidno:20所示。
[0024]
在本发明的一个具体实施方式中,所述的h11安全港位点载体的核苷酸序列如seqidno:21所示。
[0025]
在本发明的一个具体实施方式中,所述的col1a1安全港位点载体的核苷酸序列如seqidno:22所示。
[0026]
优选的,使用sgrna载体进行猪细胞的构建,所述的sgrna载体包含靶向rosa26、aavs1、h11或col1a1安全港位点的sgrna,其中:
[0027]
靶向rosa26的sgrna的核苷酸序列如seqidno:28所示,靶向aavs1的sgrna的核苷酸序列如seqidno:29所示,靶向h11的sgrna的核苷酸序列如seqidno:30所示,靶向col1a1的sgrna的核苷酸序列如seqidno:31所示。
[0028]
进一步优选的,所述的sgrna载体还包含骨架载体,所述的骨架载体的核苷酸序列为seqidno:3。
[0029]
优选的,所述的构建方法包括将安全港位点载体、sgrna载体和cas载体共转染至猪细胞,所述的cas载体包含编码cas蛋白、egfp和puro抗性蛋白的核苷酸序列,所述的cas蛋白选自casl、caslb、cas2、cas3、cas4、cas5、cas5d、cas5t、cas5h、cas5a、cas6、cas7、cas8、cas9、caslo、csyl、csy2、csy3、csy4、csel、cse2、cse3、cse4、cse5e、cscl、csc2、csa5、csnl、csn2、csml、csm2、csm3、csm4、csm5、csm6、cmrl、cmr3、cmr4、cmr5、cmr6、csbl、csb2、csb3、csx17、csx14、csxlo、csx16、csax、csx3、csxl、csxls、csfl、csf2、cso、csf4、csdl、csd2、cstl、cst2、cshl、csh2、csal、csa2、csa3、csa4、csa5、c2cl、c2c2、c2c3、cpfl、carf、ding、其同源物或其修饰形式,优选为cas9(cas9表达载体),优选的,所述的cas载体的核苷酸序列如seqidno:1或2所示。
[0030]
为了增加cas9质粒的基因编辑能力,本发明在购自addgene(plasmid#42230,fromzhangfenglab)px330-u6-chimeric_bb-cbh-hspcas9(简称px330)载体的基础上进行改造得到pu6grna-eef1a-mnls-hspcas9-egfp-puro(简称粒pkg-ge3)。px330的图谱如图1,改造方式如下:
[0031]
1)去除原载体grna骨架中多余无效的序列;
[0032]
2)改造启动子:将原有启动子(chickenβ-actin启动子)改造为具更高表达活性的ef1a启动子,增加cas9基因的蛋白表达能力;
[0033]
3)增加核定位信号:在cas9的n端及c端均增加核定位信号编码序列(nls),增加cas9的核定位能力;
[0034]
4)增加双筛选标记:原载体无任何筛选标记,不利于阳性转化细胞的筛选和富集,在cas9的c端,插入p2a-egfp-t2a-puro,赋予载体荧光和抗性筛选能力;
[0035]
5)插入wpre和3’ltr等调控基因表达的序列:在基因读码框最后插入wpre、3’ltr等序列,可增强cas9基因的蛋白翻译能力。
[0036]
改造后载体pu6grna-eef1a-mnls-hspcas9-egfp-puro(简称pkg-ge3)及改造位点如图2,质粒全序列如seq id no:2所示;pkg-ge3的主要元件有:
[0037]
1)grna表达元件:u6 grna scaffold;
[0038]
2)启动子:ef1a启动子和cmv增强子;
[0039]
3)含多个nls的cas9基因:含n端和c端多核定位信号(nls)的cas9基因;
[0040]
4)筛选标记基因:荧光和抗性双筛选标记元件p2a-egfp-t2a-puro;
[0041]
5)增强翻译的元件:wpre和3’ltr增强cas9及筛选标记基因的翻译效率;
[0042]
6)转录终止信号:bghpolya signal;
[0043]
7)载体骨架:包括amp抗性元件和ori复制子等。
[0044]
质粒pkg-ge3中,具有特异融合基因;所述特异融合基因编码特异融合蛋白;
[0045]
所述特异融合蛋白自n端至c端依次包括如下元件:两个核定位信号(nls)、cas9蛋白、两个核定位信号、自剪切多肽p2a、荧光报告蛋白、自裂解多肽t2a、抗性筛选标记蛋白;
[0046]
质粒pkg-ge3中,由ef1a启动子启动所述特异融合基因的表达;
[0047]
质粒pkg-ge3中,所述特异融合基因下游具有wpre序列元件、3’ltr序列元件和bgh poly(a) signal序列元件。
[0048]
质粒pkg-ge3中,依次具有如下元件:cmv增强子、ef1a启动子、所述特异融合基因、wpre序列元件、3’ltr序列元件、bgh poly(a)signal序列元件。
[0049]
所述特异融合蛋白中,cas9蛋白上游的两个核定位信号为sv40核定位信号,cas9蛋白下游的两个核定位信号为nucleoplasmin核定位信号。
[0050]
所述特异融合蛋白中,荧光报告蛋白具体可为egfp蛋白。
[0051]
所述特异融合蛋白中,抗性筛选标记蛋白具体可为puromycin蛋白。
[0052]
自剪切多肽p2a的氨基酸序列为“atnfsllkqagdveenpgp”(发生自剪切的断裂位置为c端开始第一个氨基酸残基和第二个氨基酸残基之间)。
[0053]
自裂解多肽t2a的氨基酸序列为“egrgslltcgdveenpgp”(发生自裂解的断裂位置为c端开始第一个氨基酸残基和第二个氨基酸残基之间)。
[0054]
特异融合基因具体如seq id no:2中第911-6706位核苷酸所示。
[0055]
cmv增强子如seq id no:2中第395-680位核苷酸所示。
[0056]
ef1a启动子如seq id no:2中第682-890位核苷酸所示。
[0057]
wpre序列元件如seq id no:2第6722-7310位核苷酸所示。
[0058]3’
ltr序列元件如seq id no:2中第7382-7615位核苷酸所示。
[0059]
bgh poly(a)signal序列元件如seq id no:2中第7647-7871位核苷酸所示。
[0060]
优选的,所述的安全港位点载体、sgrna载体或cas载体均为环状质粒。
[0061]
本发明的第三方面,提供了一种表达人ace2的人源化猪的构建方法,将人ace2基因插入猪安全港位点,获得表达seq id no:12所示人ace2的猪,所述的猪安全港位点选自猪rosa26、 aavs1、h11或col1a1安全港位点。
[0062]
优选的,使用安全港位点载体将人ace2基因插入猪安全港位点,所述的安全港位点载体包含人ace2基因的核苷酸序列和安全港位点载体骨架,所述的安全港位点载体骨架包含安全港插入位点的5’同源臂和3’同源臂,所述人ace2基因的核苷酸序列位于5’同源臂与3’同源臂之间,所述的安全港位点载体骨架选自下列任一项所示:
[0063]
a)rosa26安全港位点载体骨架,其5’同源臂如seqidno:18所示,3’同源臂如seqidno:19所示;优选的,所述的rosa26安全港位点载体的核苷酸序列如seqidno:4所示;
[0064]
b)aavs1安全港位点载体骨架,其5’同源臂如seqidno:5所示,3’同源臂如seqidno:6所示;优选的,所述的aavs1安全港位点载体的核苷酸序列如seqidno:20所示;
[0065]
c)h11安全港位点载体骨架,其5’同源臂如seqidno:7所示,3’同源臂如seqidno:8所示;优选的,所述的h11安全港位点载体的核苷酸序列如seqidno:21所示;
[0066]
或d)col1a1安全港位点载体骨架,其5’同源臂如seqidno:9所示,3’同源臂如seqidno:10所示;优选的,所述的col1a1安全港位点载体的核苷酸序列如seqidno:22所示。
[0067]
优选的,使用sgrna载体进行猪细胞的构建,所述的sgrna载体包含靶向rosa26、aavs1、h11或col1a1安全港位点的sgrna,其中:
[0068]
靶向rosa26的sgrna的核苷酸序列如seqidno:28所示,靶向aavs1的sgrna的核苷酸序列如seqidno:29所示,靶向h11的sgrna的核苷酸序列如seqidno:30所示,靶向col1a1的sgrna的核苷酸序列如seqidno:31所示。
[0069]
进一步优选的,所述的sgrna载体还包含骨架载体,所述的骨架载体的核苷酸序列为seqidno:3。
[0070]
在本发明的一个具体实施方式中,所述的构建方法包括将安全港位点载体、sgrna载体和cas载体共转染至猪细胞。
[0071]
优选的,所述的cas载体包含编码cas蛋白、egfp和puro抗性蛋白的核苷酸序列,所述的cas蛋白选自casl、caslb、cas2、cas3、cas4、cas5、cas5d、cas5t、cas5h、cas5a、cas6、cas7、cas8、cas9、caslo、csyl、csy2、csy3、csy4、csel、cse2、cse3、cse4、cse5e、cscl、csc2、csa5、csnl、csn2、csml、csm2、csm3、csm4、csm5、csm6、cmrl、cmr3、cmr4、cmr5、cmr6、csbl、csb2、csb3、csx17、csx14、csxlo、csx16、csax、csx3、csxl、csxls、csfl、csf2、cso、csf4、csdl、csd2、cstl、cst2、cshl、csh2、csal、csa2、csa3、csa4、csa5、c2cl、c2c2、c2c3、cpfl、carf、ding、其同源物或其修饰形式,进一步优选为cas9。
[0072]
优选的,所述的cas载体的核苷酸序列如seqidno:1或2所示。
[0073]
优选的,所述的安全港位点载体、sgrna载体或cas载体均为环状质粒。
[0074]
在本发明的一个具体实施方式中,将制备的猪细胞进行体细胞核移植动物克隆,获得hace2基因纯合敲入的克隆猪。
[0075]
本发明的第四方面,提供一种上述表达人ace2的猪细胞在构建ace2人源化猪中的用途。
[0076]
本发明的第五方面,提供了一种ace2人源化猪的构建方法,所述构建方法包括:
[0077]
a、卵母细胞体外成熟;b、将上述获得的任一表达人ace2的猪细胞进行体细胞核移植(scnt)构建重构胚;c、胚胎移植。
[0078]
优选的,所述步骤a包括:(1)获得卵丘卵母细胞复合体(cumulus-oocytecomplexes,cocs);(2)将cocs在体外成熟培养基中进行培养。
[0079]
更优选的,所述体外成熟培养基包括以tcm-199培养基为基础添加生长因子、猪卵泡液、抗生素及促卵泡成熟的激素等。
[0080]
进一步优选的,所述体外成熟培养基包括以tcm-199培养基为基础添加0.1mg/ml
丙酮酸、0.1mg/ml盐酸半胱氨酸、10ng/ml表皮生长因子、10%(v/v)猪卵泡液、75mg/ml青霉素,50mg/ml链霉素,10iu/mlecg和hcg。
[0081]
优选的,所述步骤b包括:(1)去除卵母细胞周围扩张的卵丘细胞;(2)去除卵母细胞的核和极体;(3)将上述获得的任一表达人ace2的猪细胞作为核供体,注入已去核卵母细胞的卵周隙;(4)将核供体细胞与受体卵母细胞融合获得重构胚,并培养使其进行细胞核重编程;(5)激活重构胚。
[0082]
更优选的,所述步骤(4)中重构胚在pzm-3培养基中培养2h进行细胞核重编程。
[0083]
更优选的,所述步骤(5)先后采用电激活及化学激活的方法进行重构胚的激活。
[0084]
优选的,所述步骤c包括将步骤b获得的重构胚移植到受体母猪输卵管中,每头母猪移植300-350个重构胚。
[0085]
本发明的第六方面,提供了上述任一构建方法获得的表达人ace2的人源化猪。
[0086]
本发明的第七方面,提供了一种安全港位点载体,所述的安全港位点载体包含人ace2基因的核苷酸序列和安全港位点载体骨架,所述的人ace2基因的核苷酸序列如seqidno:13所示,所述的安全港位点载体骨架包含安全港插入位点的5’同源臂和3’同源臂,所述人ace2基因的核苷酸序列位于5’同源臂与3’同源臂之间,所述的安全港位点载体骨架选自下列任一项所示:
[0087]
a)rosa26安全港位点载体骨架,其5’同源臂如seqidno:18所示,3’同源臂如seqidno:19所示;优选的,所述的rosa26安全港位点载体的核苷酸序列如seqidno:4所示;
[0088]
b)aavs1安全港位点载体骨架,其5’同源臂如seqidno:5所示,3’同源臂如seqidno:6所示;优选的,所述的aavs1安全港位点载体的核苷酸序列如seqidno:20所示;
[0089]
c)h11安全港位点载体骨架,其5’同源臂如seqidno:7所示,3’同源臂如seqidno:8所示;优选的,所述的h11安全港位点载体的核苷酸序列如seqidno:21所示;
[0090]
或d)col1a1安全港位点载体骨架,其5’同源臂如seqidno:9所示,3’同源臂如seqidno:10所示;优选的,所述的col1a1安全港位点载体的核苷酸序列如seqidno:22所示。
[0091]
本发明的第八方面,提供了一种上述的安全港位点载体、上述的sgrna或者上述的sgrna载体在制备表达人ace2的猪或猪细胞中的应用。
[0092]
本发明的第九方面,提供了一种上述的ace2人源化猪的猪器官、猪组织或猪细胞,即ace2所介导疾病的器官模型、组织模型或细胞模型。
[0093]
优选的,所述猪器官、猪组织或猪细胞不能发育为动物个体。
[0094]
本发明的第十方面,提供了一种上述的表达人ace2的猪细胞、上述构建方法获得的ace2人源化猪的猪器官、猪组织、猪细胞,或者用上述构建方法获得的人源化猪的应用,所述应用包括
[0095]
(1)筛选治疗ace2所介导疾病的药物;
[0096]
(2)进行ace2所介导疾病药物的药效评价;
[0097]
(3)进行ace2所介导疾病的疫苗效果测试;或,
[0098]
(4)进行ace2所介导的病毒感染机制研究。
[0099]
优选的,所述药物包括化学药,例如化合物、组合物,生物药,例如抗体、基因或者细胞治疗药物等等。
[0100]
优选的,所述动物模型是动物疾病模型,更优选的,所述疾病是ace2所介导疾病。
[0101]
进一步优选的,所述ace2所介导疾病包括在呼吸系统、心血管系统、泌尿系统、消化系统、生殖系统、神经系统、免疫系统等ace2介导的疾病,例如冠状病毒感染、高血压、动脉粥样硬化、心肌梗塞、心力衰竭、肾炎、任何原因导致的肾脏损伤、肾纤维化、胰腺炎、糖尿病、肝炎、胆道纤维化、生殖系统发育、睾丸炎、脑损伤、阿尔茨海默症等等。
[0102]
优选的,所述的冠状病毒选自sars-cov-2或sars-cov。
[0103]
术语“载体”是细胞内能够在自身控制下复制的多核苷酸,或者通过插入到宿主细胞染色体进行复制和/或表达的遗传元件,例如质粒、染色体、病毒、转座子。合适的载体包括但不限于质粒、转座子、细菌噬菌体和粘粒。
[0104]
本发明所述的“grna”,也称指导rna,是由sgrna载体在细胞中转录得到的,对细胞中的靶序列具有特异性并且可与cas蛋白形成复合体的rna。
[0105]
与现有技术相比,本发明至少具有如下有益效果:
[0106]
(1)本发明研究对象(猪)比其他动物(大小鼠、灵长类)具有更好的应用性。
[0107]
大小鼠等啮齿类动物不论从体型、器官大小、生理、病理等方面都与人相差巨大,无法真实地模拟人类正常的生理、病理状态。研究表明,95%以上在大小鼠中验证有效的药物在人类临床试验中是无效的。就大动物而言,灵长类是与人亲缘关系最近的动物,但其体型小、性成熟晚(6-7岁开始交配),且为单胎动物,群体扩繁速度极慢,饲养成本很高。另外,灵长类动物克隆效率低、难度大、成本高。
[0108]
而猪作为模型动物就没有上述缺点,猪是除灵长类外与人亲缘关系最近的动物,其体型、体重、器官大小等与人相近,在解剖学、生理学、免疫学、营养代谢、疾病发病机制等方面与人类极为相似。同时,猪的性成熟早(4-6个月),繁殖力高,一胎多仔,在2-3年内即可形成一个较大群体。另外,猪的克隆技术非常成熟,克隆及饲养成本也较灵长类低得多。
[0109]
(2)本发明针对猪基因组进行了4个安全港位点基因敲入后表达情况的摸索,从中筛选出了最佳的供外源基因插入的猪基因组安全港位点,可有效改善基因敲入后目的基因的表达情况。
[0110]
(3)本发明中经过实验验证改造的pu6grna-eef1a-mnls-hspcas9-egfp-puro(简称pkg
‑ꢀ
ge3)载体相对改造前的px330载体,更换了更强的启动子及添加了增强蛋白翻译的元件,提高了 cas9的表达,并且增加了核定位信号个数,提高了cas9蛋白的核定位能力,具有更高的基因编辑效率。本发明还在载体中加入了荧光标记及抗性标记,使其更方便运用于载体阳性转化细胞的筛选及富集。采用本发明改造的cas9高效表达载体进行基因编辑,编辑效率比原载体提高100%以上。
[0111]
(4)利用本发明所得到的hace2基因纯合敲入单细胞克隆株进行体细胞核移植动物克隆可直接得到hace2基因纯合敲入的克隆猪,并且该纯合插入基因可稳定遗传。
[0112]
在小鼠模型制作中,通常采用受精卵显微注射基因编辑材料后再进行胚胎移植,因其直接获得纯合突变后代的概率非常低(低于5%),需要进行后代的杂交选育,这不太适用于妊娠期较长的大动物(如猪)模型制作。因此,本发明采用技术难度大、挑战性高的原代细胞体外编辑并筛选阳性编辑单细胞克隆的方法,然后通过体细胞核移植动物克隆技术直接获得了ace2人源化猪,大大缩短了模型猪制作周期,并节省人力、物力、财力。
[0113]
(5)本发明利用体细胞核移植技术可以比较稳定,并具有较高成功率地获得hace2
纯合插入的病毒感染模型猪。其中,hace2可以很好的在细胞膜表面表达,例如在肺泡巨噬细胞中表达量可高达管家基因β-actin表达量的0.12倍,而未改造的对照猪几乎不表达(为管家基因β-actin表达量的2
×
10-7
倍)。所述hace2人源化猪可进一步用于制备动物感染模型,为揭示sars-cov-2等冠状病毒的感染及致病机制提供有力的活体研究工具。
[0114]
本发明通过基因编辑及体细胞克隆技术获得了ace2人源化猪,将有助于研究并揭示由hace2 介导引发的sars-cov-2及sars-covs等冠状病毒的感染机制,并可用于进行药物筛选、药效评价、疾病病理、疫苗效果测试等研究,能够为进一步的临床应用提供有效的实验数据,进而为预防和治疗人类sars-cov-2及sars-covs等冠状病毒感染疾病提供有力的实验手段。本发明对于人类sars
‑ꢀ
cov-2及sars-covs治疗药物及疫苗的研发及揭示该类疾病的发病机制具有重大应用价值。
附图说明
[0115]
以下,结合附图来详细说明本发明的实施例,其中:
[0116]
图1为质粒px330的结构示意图。
[0117]
图2为质粒pkg-ge3的结构示意图。
[0118]
图3为pu6grna载体的结构示意图。
[0119]
图4为将20bp左右的dna分子(用于转录形成能结合靶序列的grna)插入质粒pkg-u6grna 的示意图。
[0120]
图5为含rosa26插入位点的荧光donor质粒的结构示意图。
[0121]
图6为含aavs1插入位点的荧光donor质粒的结构示意图。
[0122]
图7为含h11插入位点的荧光donor质粒的结构示意图。
[0123]
图8为含col1a1插入位点的荧光donor质粒的结构示意图。
[0124]
图9为含col1a1插入位点的hace2基因donor质粒的结构示意图。
[0125]
图10为质粒配比优化测试的测序结果。
[0126]
图11为质粒px330和质粒pkg-ge3编辑效果的测序结果。
[0127]
图12为不同安全港位点调控gfp绿色荧光表达图。
[0128]
图13为不同安全港位点调控gfp转录水平荧光定量pcr结果。
[0129]
图14为不同安全港位点调控gfp蛋白表达的facs检测结果。
[0130]
图15为鉴定猪col1a1安全港插入位点5’端hace2表达框是否重组成功的电泳图。
[0131]
图16为鉴定猪col1a1安全港插入位点3’端hace2表达框是否重组成功的电泳图。
[0132]
图17为鉴定hace2表达框是否纯合插入猪col1a1安全港位点的电泳图。
[0133]
图18为猪col1a1安全港位点调控hace2转录水平荧光定量pcr结果。
[0134]
图19为猪col1a1安全港位点调控hace2蛋白表达的facs检测结果。
[0135]
图20为6头hace2人源化小猪图片。
[0136]
图21为hace2基因在hace2人源化猪和野生型猪肺泡巨噬细胞中的转录水平检测结果。
[0137]
图22为hace2人源化猪和野生型猪肺泡巨噬细胞的hace2抗体结合情况检测结果。a、b分别为hace2人源化猪、野生型猪肺泡巨噬细胞的hace2抗体结合情况的共聚焦显微镜照片;c、d分别为hace2人源化猪、野生型猪肺泡巨噬细胞的hace2抗体结合情况的倒置荧光
显微镜照片。
[0138]
图23为质粒pmd2.g-sars-c19的结构示意图。
[0139]
图24为质粒lenti-mcherry的结构示意图。
[0140]
图25为hace2人源化猪原代成纤维细胞与sars-cov-2假病毒结合情况的检测结果。其中图右侧为明场,图左侧为明场相同视野下倒置荧光显微镜的荧光观察结果。
[0141]
图26为野生型猪原代成纤维细胞与sars-cov-2假病毒结合情况的检测结果。其中图右侧为明场,图左侧为明场相同视野下倒置荧光显微镜的荧光观察结果。
具体实施方式
[0142]
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
[0143]
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例中构建的重组质粒,均已进行测序验证。完全培养液(%为体积比):15%胎牛血清 (gibco)+83%dmem培养基(gibco)+1%penicillin-streptomycin(gibco)+1%hepes(solarbio)。细胞培养条件:37℃,5%co2、5%o2的恒温培养箱。
[0144]
制备猪原代成纤维细胞的方法:
①
取猪耳组织0.5g,除毛,然后用75﹪酒精浸泡30-40s,然后用含5%(体积比)penicillin-streptomycin(gibco)的pbs缓冲液洗涤5次,然后用pbs缓冲液洗涤一次;
②
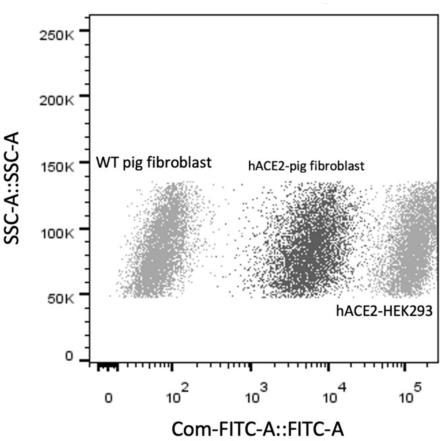
用剪刀将组织剪碎,采用5ml0.1%胶原酶溶液(sigma),37℃消化1h,然后500g离心 5min,弃上清;
③
将沉淀用1ml完全培养液重悬,然后铺入含10ml完全培养基并已用0.2%明胶(vwr) 封盘的直径为10的细胞培养皿中,培养至细胞长满皿底60%左右;
④
完成步骤
③
后,采用胰蛋白酶消化并收集细胞,然后重悬于完全培养液。
[0145]
实施例1、质粒的构建
[0146]
出发商品质粒为:px330-u6-chimeric_bb-cbh-hspcas9,简称质粒px330,如seq id no:1所示。
[0147]
以px330质粒为基础,构建质粒pu6grnaeef1a-mnls-hspcas9-egfp-puro,简称质粒pkg-ge3,如 seq id no:2所示。
[0148]
构建质粒pkg-u6grna,如seq id no:3所示。
[0149]
质粒px330、质粒pkg-ge3、质粒pkg-u6grna均为环形质粒。
[0150]
质粒px330的结构示意图见图1。seq id no:1中,第440-725位核苷酸组成cmv增强子,第727
‑ꢀ
1208位核苷酸组成chickenβ-actin启动子,第1304-1324位核苷酸编码sv40核定位信号(nls),第 1325-5449位核苷酸编码cas9蛋白,第5450-5497位核苷酸编码nucleoplasmin核定位信号(nls)。
[0151]
质粒pkg-ge3的结构示意图见图2。seq id no:2中,第395-680位核苷酸组成cmv增强子,第682
‑ꢀ
890位核苷酸组成ef1a启动子,第986-1006位核苷酸编码核定位信号(nls),第1016-1036位核苷酸编码核定位信号(nls),第1037-5161位核苷酸编码cas9蛋白,第5162-5209位核苷酸编码核定位信号 (nls),第5219-5266位核苷酸编码核定位信号(nls),
第5276-5332位核苷酸编码自剪切多肽p2a (自剪切多肽p2a的氨基酸序列为“atnfsllkqagdveenpgp”,发生自剪切的断裂位置为c端开始第一个氨基酸残基和第二个氨基酸残基之间),第5333-6046位核苷酸编码egfp蛋白,第6056-6109位核苷酸编码自裂解多肽t2a(自裂解多肽t2a的氨基酸序列为“egrgslltcgdveenpgp”,发生自裂解的断裂位置为c端开始第一个氨基酸残基和第二个氨基酸残基之间),第6110-6703位核苷酸编码puromycin蛋白 (简称puro蛋白),第6722-7310位核苷酸组成wpre序列元件,第7382-7615位核苷酸组成3’ltr序列元件,第7647-7871位核苷酸组成bgh poly(a)signal序列元件。seq id no:2中,第911-6706形成融合基因,表达融合蛋白。由于自剪切多肽p2a和自裂解多肽t2a的存在,融合蛋白自发形成如下三个蛋白:具有cas9蛋白的蛋白、具有egfp蛋白的蛋白和具有puro蛋白的蛋白。
[0152]
与质粒px330相比,质粒pkg-ge3主要进行了如下改造:
①
去除残留的grna骨架序列 (gttttagagctagaaatagcaagttaaaataaggctagtccgtttt),降低干扰;
②
将原有chickenβ-actin启动子改造为具更高表达活性的ef1a启动子,增加cas9基因的蛋白表达能力;
③
在cas9基因的上游和下游均增加核定位信号编码基因(nls),增加cas9蛋白的核定位能力;
④
原质粒无任何真核细胞筛选标记,不利于阳性转化细胞的筛选和富集,依次在cas9基因的下游插入p2a-egfp-t2a-puro编码基因,赋予载体荧光和真核细胞抗性筛选能力;
⑤
插入wpre元件和3’ltr序列元件,增强cas9基因的蛋白翻译能力。
[0153]
质粒pkg-u6grna的结构示意图见图3。seq id no:3中,第2280-2539位核苷酸组成hu6启动子,第2558-2637位核苷酸用于转录形成grna骨架。使用时,将20bp左右的dna分子(用于转录形成grna的靶序列结合区)插入质粒pkg-u6grna,形成重组质粒,示意图见图4,在细胞中重组质粒转录得到grna。
[0154]
构建质粒pb-1g 2r 3-puro-rosa26、pb-1g 2r 3-puro-aavs1、pb-1g 2r 3-puro-h11和pb-1g 2r 3-puro-col1a1。
[0155]
质粒pb-1g 2r 3-puro-rosa26结构示意图见图5。seq id no:4中,第1-345位核苷酸组成rosa26 安全港插入位点5’端猪基因组区域(sh1左臂,如seq id no:18所示),第9184-10195位核苷酸组成 rosa26安全港插入位点3’端猪基因组区域(sh1右臂,如seq id no:19所示),第346-546、3132
‑ꢀ
3531、6506-6707、8975-9175位核苷酸分别组成4个不同的绝缘子区域,第1954-3131位核苷酸组成ef
‑ꢀ
1α启动子,第1216-1935位核苷酸编码egfp蛋白,第637-1209位核苷酸组成ef-1αpoly(a)信号,第 3543-4042位核苷酸组成pgk启动子,第4059-4769位核苷酸编码mcherry蛋白,第4791-5015位核苷酸组成bgh poly(a)信号,第5054-6504位核苷酸为loxp-puro-loxp表达框区域,第7259-8974位核苷酸组成pcag启动子,第6969-7233位核苷酸组成β-globin poly(a)信号。
[0156]
质粒pb-1g 2r 3-puro-aavs1结构示意图见图6。仅将seq id no:4中的1-345位核苷酸替换为 aavs1安全港插入位点5’端猪基因组区域(sh2左臂),见seq id no:5;第9184-10195位核苷酸替换为aavs1安全港插入位点3’端猪基因组区域(sh2右臂),见seq id no:6。其他序列与seq id no: 4一致,具体为seq id no:20。
[0157]
质粒pb-1g 2r 3-puro-h11结构示意图见图7。仅将seq id no:4中的1-345位核苷酸替换为h11安全港插入位点5’端猪基因组区域(sh3左臂),见seq id no:7;第9184-10195位核苷酸替换为h11安全港插入位点3’端猪基因组区域(sh3右臂),见seq id no:8。其他序
列与seq id no:4一致,具体为seq id no:21。
[0158]
质粒pb-1g 2r 3-puro-col1a1结构示意图见图8。仅将seq id no:4中的1-345位核苷酸替换为 col1a1安全港插入位点5’端猪基因组区域(sh4左臂),见seq id no:9;第9184-10195位核苷酸替换为col1a1安全港插入位点3’端猪基因组区域(sh4右臂),见seq id no:10。其他序列与seq idno:4一致,具体为seq id no:22。
[0159]
构建质粒pkg-hace2:质粒pkg-hace2的结构示意图见图9。seq id no:11中,第9-880位核苷酸为猪基因组col1a1安全港插入位点5’端同源序列,第887-1286位核苷酸为绝缘子2(insulator 2) 序列,第1287-2464位核苷酸为ef1a启动子序列,第2483-4897位核苷酸为hace2的编码序列,来自于质粒ace2-penter(addgene),第4907-5479位核苷酸为ef1apoly(a)序列,第5588-5917位核苷酸为 sv40启动子序列,第5966-6562位核苷酸为puromycin抗性蛋白(简称puror蛋白)编码序列,第6742
‑ꢀ
6863位核苷酸为sv40 poly(a)序列,第5512-5545及6908-6941位核苷酸分别为同向相同的loxp序列,第6950-7150位核苷酸为绝缘子3(insulator 3)序列,第7153-7879位核苷酸为猪基因组col1a1安全港插入位点3’端同源序列。
[0160]
实施例2、质粒px330和质粒pkg-ge3的效果比较
[0161]
选择位于rag1基因的高效grna靶点:
[0162]
rag1-grna4的靶点:5
’‑
agttatggcagaactcagtg-3’(seq id no:23)。
[0163]
用于扩增包含靶点的片段的引物如下:
[0164]
rag1-nf126:5
’‑
ccccatccaaagtttttaaagga-3’(seq id no:24);
[0165]
rag1-nr525:5
’‑
tgtggcagatgtcacagtttagg-3’(seq id no:25)。
[0166]
初生从江香猪(雌性,血型ao),制备猪原代成纤维细胞。
[0167]
一、制备重组质粒
[0168]
取质粒pkg-u6grna,用限制性内切酶bbsi进行酶切,回收载体骨架(约3kb的线性大片段)。分别合成rag1-4s和rag1-4a,然后混合并进行退火,得到具有粘性末端的双链dna分子。将具有粘性末端的双链dna分子和载体骨架连接,得到质粒pkg-u6grna(rag1-grna4)。
[0169]
rag1-4s:5
’‑
caccgagttatggcagaactcagtg-3’(seq id no:26);
[0170]
rag1-4a:5
’‑
aaaccactgagttctgccataactc-3’(seq id no:27)。
[0171]
rag1-4s和rag1-4a均为单链dna分子。
[0172]
二、质粒配比优化
[0173]
第一组:将质粒pkg-u6grna(rag1-grna4)和质粒pkg-ge3共转染猪原代成纤维细胞。配比:约 20万个猪原代成纤维细胞:0.44μg质粒pkg-u6grna(rag1-grna4):1.56μg质粒pkg-ge3。即质粒 pkg-u6grna(rag1-grna4)和质粒pkg-ge3的摩尔配比为:1:1。
[0174]
第二组:将质粒pkg-u6grna(rag1-grna4)和质粒pkg-ge3共转染猪原代成纤维细胞。配比:约 20万个猪原代成纤维细胞:0.72μg质粒pkg-u6grna(rag1-grna4):1.28μg质粒pkg-ge3。即质粒 pkg-u6grna(rag1-grna4)和质粒pkg-ge3的摩尔配比为:2:1。
[0175]
第三组:将质粒pkg-u6grna(rag1-grna4)和质粒pkg-ge3共转染猪原代成纤维细胞。配比:约 20万个猪原代成纤维细胞:0.92μg质粒pkg-u6grna(rag1-grna4):1.08μg质粒pkg-ge3。即质粒 pkg-u6grna(rag1-grna4)和质粒pkg-ge3的摩尔配比为:3:1。
[0176]
第四组:将质粒pkg-u6grna(rag1-grna4)转染致猪原代成纤维细胞。配比:约20万个猪原代成纤维细胞:1μg质粒pkg-u6grna(rag1-grna4)。
[0177]
共转染采用电击转染的方式,采用哺乳动物核转染试剂盒(neon kit,thermofisher)与neon tmtransfection system电转仪(参数设置为:1450v、10ms、3pulse)。
[0178]
2、完成步骤1后,采用完全培养液培养16-18小时,然后更换新的完全培养液进行培养。培养总时间为48小时。
[0179]
3、完成步骤2后,采用胰蛋白酶消化并收集细胞,提取基因组dna,采用rag1-nf126和rag1
‑ꢀ
nr525组成的引物对进行pcr扩增,然后进行电泳。
[0180]
电泳后回收目的条带并进行测序,测序结果见图10。
[0181]
通过利用synthego ice工具分析测序峰图得出不同靶点的编辑效率。第一组至第三组的基因编辑效率依次为9%、53%、66%。第四组不发生基因编辑。结果表明,第三组编辑效率最高,确定单 grna质粒与cas9质粒最适用量为摩尔比3:1,质粒实际用量为0.92μg:1.08μg。
[0182]
三、质粒px330和质粒pkg-ge3的效果比较
[0183]
1、共转染
[0184]
rag1-b组:将质粒pkg-u6grna(rag1-grna4)转染猪原代成纤维细胞。配比:约20万个猪原代成纤维细胞:0.92μg质粒pkg-u6grna(rag1-grna4)。
[0185]
rag1-330组:将质粒pkg-u6grna(rag1-grna4)和质粒px330共转染猪原代成纤维细胞。配比:约20万个猪原代成纤维细胞:0.92μg质粒pkg-u6grna(rag1-grna4):1.08μg质粒px330。
[0186]
rag1-kg组:将质粒pkg-u6grna(rag1-grna4)和质粒pkg-ge3共转染猪原代成纤维细胞。配比:约20万个猪原代成纤维细胞:0.92μg质粒pkg-u6grna(rag1-grna4):1.08μg质粒pkg-ge3。
[0187]
共转染采用电击转染的方式,采用哺乳动物核转染试剂盒(neon kit,thermofisher)与neon tmtransfection system电转仪(参数设置为:1450v、10ms、3pulse)。
[0188]
2、完成步骤1后,采用完全培养液培养16-18小时,然后更换新的完全培养液进行培养。培养总时间为48小时。
[0189]
3、完成步骤2后,采用胰蛋白酶消化并收集细胞,提取基因组dna,采用rag1-nf126和rag1
‑ꢀ
nr525组成的引物对进行pcr扩增,将产物进行测序。
[0190]
通过利用synthego ice工具分析测序峰图得出不同靶点的编辑效率。rag1-b组不发生基因编辑。 rag1-330组、rag1-kg组的编辑效率依次为28%、68%。测序结果示例性峰图见图11。结果表明,与采用质粒px330相比,采用质粒pkg-ge3使得基因编辑效率显著提高。
[0191]
实施例3、筛选供外源基因定点插入的猪基因组最佳安全港位点
[0192]
一、猪rosa26、aavs1、h11、col1a1基因组安全港位点的高效切割靶点筛选
[0193]
通过前期筛选,rosa26、h11、aavs1、col1a1安全港位点的高效切割靶点分别为sgrna
rosa26-g3
(切割效率38%)、sgrna
aavs1-g4
(切割效率30%)、sgrna
h11-g1
(切割效率60%)、
10ms 3pulse),电击转染后立即在超净台内将电转枪中混合液转入到6孔板中,每孔含3ml15%胎牛血清(gibco)+83% dmem培养基(gibco)+1%p/s(gibco penicillin-streptomycin)+1%hepes(solarbio)的完全培养液;
[0214]
(5)混匀后放置于37℃,5%co2、5%o2的恒温培养箱中进行培养;
[0215]
(6)电转12-24h换液,电转48h使用嘌呤霉素加压,筛选阳性细胞。
[0216]
三、嘌呤霉素加压筛选
[0217]
细胞经质粒电转48h,加入1.5μg/ml嘌呤霉素筛选,每两天更换含有相同浓度嘌呤霉素的培养基,同时进行gfp绿色荧光拍照,连续筛选两周,待细胞内质粒完全降解后再继续加压筛选一周。通过gfp荧光表达的强弱判断安全港位点效率的高低。
[0218]
嘌呤霉素筛选一周后,rosa26、col1a1安全港位点实验组荧光强度明显强于aavs1、h11实验组;嘌呤霉素筛选两周后,荧光强度由强到弱依次为:col1a1》rosa26》h11》aavs1,其中h11组部分荧光弱整体荧光强,rosa26组整体荧光强度较均一,aavs1组细胞荧光表达最弱,col1a1组荧光细胞数最多, 荧光最强;嘌呤霉素继续筛选三周后,荧光强度由强到弱依次为:col1a1》rosa26》h11》aavs1,结果如图12。
[0219]
四、gfp基因转录水平检测
[0220]
为了比较gfp基因整合入四个不同安全港位点后mrna转录水平的差异性,能否参与gfp的表达调控及对表达量的影响。在gfp基因外显子处设计一对引物,取嘌呤霉素筛选三周后的细胞,提取总
[0221]
rna,反转录成cdna,用于检测原代细胞在四个不同安全港位点整合gfp基因后的转录水平,同时用野生型原代细胞作为对照。以gapdh为内参基因按照2-δct
法进行计算。
[0222]
(1)引物信息(表1)
[0223]
表1:荧光定量pcr引物信息
[0224][0225]
(2)细胞总rna提取
[0226]
根据bio flux的simply p总rna提取试剂盒进行细胞总rna提取
[0227]
(3)cdna第一链获得
[0228]
根据vazyme反转录试剂盒ii 1st strand cdna synthesis kit(r211-01/02)说明书合成 cdna第一链,具体步骤和程序如下:
[0229]
1)配制第一链cdna合成反应液
[0230]
在rnase-free离心管中配制如下表2混合液
[0231]
表2
[0232][0233]
用移液枪轻轻吹打混匀。
[0234]
2)按下列条件进行第一链cdna合成反应,反应条件见表3。
[0235]
表3
[0236][0237]
产物立即用于qpcr反应,或存放于-80℃保存,避免反复冻融。
[0238]
(4)荧光定量pcr
[0239]
利用实时荧光定量pcr法检测插入四组不同安全港位点(rosa26、aavs1、h11、col1a1)猪原代成纤维细胞中gfp的表达量,gapdh作为内参基因。操作步骤及程序如下:
[0240]
1)反应体系配制见表4
[0241]
表4
[0242][0243]
2)qpcr反应程序如下表5
[0244]
表5
[0245][0246]
3)统计与分析
[0247]
用spss统计学软件进行数据分析,以(平均数
±
标准差)表示,采用双因素方差分析进行统计学分析。2-δct
值结果显示嘌呤霉素筛选三周后aavs1、h11组gfp表达量较低,rosa26、col1a1组gfp 表达量较高,且col1a1组和rosa26组相对于aavs1和h11组gfp转录水平差异极显著(p《0.01), 2-δct
值(表6),差异显著性分析结果如图13。
[0248]
表6:2-δct
值信息
[0249][0250]
综上,根据培养细胞三周后的荧光信号强度与gfp基因实时荧光定量pcr的结果,可以得出如下结论,在rosa26、aavs1、h11、col1a1这四个基因组安全港位点中,col1a1位点插入基因后表达效果最好。
[0251]
五、gfp基因的蛋白表达水平facs检测
[0252]
为了比较gfp基因整合入四个不同安全港位点后gfp蛋白的表达情况。分别用胰蛋白酶消化细胞, 400g离心4min后,弃上清。以1ml培养基重悬细胞,并将细胞悬液分别转移至流式管内。在bdfacsmelody流式细胞仪的fitc通道内检测gfp信号,并以野生型细胞作为阴性对照,收集5
×
104个细胞进行分析,结果如图14所示。结果显示gfp荧光信号col1a1》rosa26》h11》aavs1。
[0253]
因此,综合上述结果,col1a1位点是rosa26、aavs1、h11、col1a1四个安全港位点中最高效的猪原代细胞安全港位点。
[0254]
实施例4、制备hace2定点插入猪col1a1安全港位点的单细胞克隆
[0255]
人(h)ace2基因(如seq id no:13所示)信息:编码人angiotensin i converting enzyme 2 蛋白;位于人x号染色体;geneid为59272。hace2是目前sars-2-cov及sars-cov等冠状病毒公认的受体蛋白,其编码的蛋白质片段np_975010.1如seq id no:12所示。
[0256]
一、共转染
[0257]
将质粒pkg-u6grna(col1a1-g3)、质粒pkg-ge3和质粒pkg-hace2(如seq id no:11所示)共转染猪原代成纤维细胞。配比:约20万个猪原代成纤维细胞:0.89μg质粒pkg-u6grna(col1a1
‑ꢀ
g3):0.99μg质粒pkg-ge3:1.12μg质粒pkg-hace2。
[0258]
共转染采用电击转染的方式,采用哺乳动物核转染试剂盒(neon kit,thermofisher)与neon tmtransfection system电转仪(参数设置为:1450v、10ms、3pulse)。
[0259]
二、嘌呤霉素加压筛选
[0260]
1.嘌呤霉素筛选hace2基因阳性插入细胞
[0261]
细胞经质粒电转48h后,加入1.5μg/ml嘌呤霉素筛选,每天更换含有相同浓度嘌呤霉素的培养基,连续筛选一周后野生对照孔细胞全部死亡,因电转效率较低,ace2质粒电转孔筛选一周后细胞也出现大量死亡;继续加入嘌呤霉素筛选一周,细胞只有零星死亡,部分阳性克隆开始分裂增殖,细胞数不断增多;继续加压筛选一周使细胞内质粒降解完全以排除假阳性细胞克隆。加压筛选三周后停止加压,培养两代待细胞状态恢复后分选至96孔板继续培养。
[0262]
2.单克隆分选,放大培养
[0263]
(1)将嘌呤霉素筛选三周后的群体细胞,进行单克隆分选,使用胰蛋白酶进行消化,完全培养基中和,500g离心5min,去上清,将沉淀用1ml完全培养基重悬,并适当稀释,用口吸管挑取单克隆转移到含100μl完全培养基的96孔板中,每组细胞挑取一板96个单克隆,放置于37℃,5%co2、5% o2的恒温培养箱中进行培养,每2~3天换一次细胞培养基(含1.5%嘌呤霉素),期间用显微镜观察每孔细胞生长情况,排除无细胞及非单细胞克隆的孔;
[0264]
(2)待96孔板的孔中细胞长满孔底(大约2周左右),使用胰蛋白酶消化并收集细胞,其中2/3 细胞接种到含有完全培养基的6孔板中,剩余的1/3的细胞收集在1.5ml离心管中;
[0265]
(3)待6孔板细胞长至50%丰满度时使用0.25%(gibco)的胰蛋白酶消化并收集细胞,使用细胞冻存液(90%完全培养基+10%dmso,体积比)将细胞冻存。
[0266]
三、猪col1a1安全港位点定点插入hace2的基因组水平鉴定
[0267]
为了检测猪col1a1安全港位点是否成功定点插入了hace2。取嘌呤霉素加压筛选完毕后的单细胞克隆,提取基因组dna,进行pcr扩增(分别采用sh4-ace2-lr-jdf1323和sh4-ace2-lr-jdr5988组成的引物对、sh4-ace2-rr-jdf7997和sh4-ace2-rr-jdr12953组成的引物对、sh4-lwt-jdf1085和sh4
‑ꢀ
rwt-jdr1560组成的引物对),然后进行电泳。将猪原代成纤维细胞作为野生型对照。sh4-ace2-lr
‑ꢀ
jdf1323和sh4-ace2-lr-jdr5988组成的引物对用来鉴定猪col1a1安全港插入位点5’端hace2表达框是否重组成功;sh4-ace2-rr-jdf7997和sh4-ace2-rr-jdr12953组成的引物对用来鉴定猪col1a1安全港插入位点3’端hace2表达框是否重组成功;sh4-lwt-jdf1085和sh4-rwt-jdr1560组成的引物对用来鉴定猪col1a1安全港位点定点插入的为纯合型还是杂合型。
[0268]
sh4-ace2-lr-jdf1323:gctctctctgaccaggatctaac(seq id no:36)
[0269]
sh4-ace2-lr-jdr5988:gacactgggacactttgtttcagg(seq id no:37)
[0270]
sh4-ace2-rr-jdf7997:cagctgaggccattatatgaagag(seq id no:38)
[0271]
sh4-ace2-rr-jdr12953:gagtcaccaaagacggtgtcag(seq id no:39)
[0272]
sh4-lwt-jdf1085:tgctgagttctggcttcctg(seq id no:40)
[0273]
sh4-rwt-jdr1560:tctaccaagagagtgaccagcag(seq id no:41)
[0274]
电泳图分别见图15、图16和图17。通过电泳的结果,我们初步判定编号为2、7、9、23、26、 36、38、39、40、54、58、59的单细胞克隆为成功在猪col1a1安全港位点定点插入hace2的克隆,其中7、36、39、40号单细胞克隆初步判定为纯合定点插入,2、9、23、26、38、40、54、58、59为杂合定点插入。
[0275]
四、hace2基因的转录水平检测
[0276]
为了检测猪col1a1安全港位点定点插入hace2的阳性单细胞克隆能否表达hace2。我们在hace2 基因外显子处设计一对引物,取嘌呤霉素筛选三周后的细胞,提取总rna,反转录成cdna,用于检测猪原代细胞hace2基因的转录水平,同时用猪野生型原代细胞作为对照。以gapdh为内参基因按照2-δct
法进行计算。
[0277]
(1)引物信息(表7)
[0278]
表7荧光定量pcr引物信息
[0279][0280]
(2)细胞总rna提取
[0281]
根据bio flux的simply p总rna提取试剂盒进行细胞总rna提取
[0282]
(3)cdna第一链获得
[0283]
根据vazyme反转录试剂盒ii 1st strand cdna synthesis kit(r211-01/02)说明书合成 cdna第一链,具体步骤和程序如下:
[0284]
3)配制第一链cdna合成反应液
[0285]
在rnase-free离心管中配制如下表8混合液:
[0286]
表8
[0287][0288][0289]
用移液枪轻轻吹打混匀。
[0290]
4)按下列条件进行第一链cdna合成反应,反应条件见表9
[0291]
表9
[0292][0293]
产物立即用于qpcr反应,或存放于-80℃保存,避免反复冻融。
[0294]
(4)荧光定量pcr
[0295]
利用实时荧光定量pcr法检测猪原代成纤维细胞中hace2的表达量,gapdh作为内参基因。操作步骤及程序如下:
[0296]
3)反应体系配制如下表10
[0297]
表10
[0298][0299]
4)qpcr反应程序如下表11
[0300]
表11
[0301]
[0302]
3)统计与分析
[0303]
用spss统计学软件进行数据分析,以(平均数
±
标准差)表示,采用单因素方差分析进行统计学分析。2-δct
值结果显示嘌呤霉素筛选三周后,改造后的猪原代成纤维细胞单克隆的hace2基因表达量在统计学水平显著高于野生型猪原代成纤维细胞的hace2基因的相对表达量(图18)。
[0304]
综上,根据hace2基因实时荧光定量pcr的结果,hace2基因经过改造的猪原代成纤维细胞中有较好的表达。
[0305]
五、hace2基因的蛋白表达水平facs检测
[0306]
为了比较hace2基因在编辑后的猪原代细胞中的表达情况。分别用胰蛋白酶消化人hace2转染的人hek293细胞(发明人之前构建)、猪野生型成纤维细胞和猪col1a1安全位点定点插入hace2的成纤维细胞,400g离心4min后,弃上清。加入pbs洗涤细胞,离心后,弃上清。加入90%的-20℃预冷甲醇充分重悬细胞,固定20min。固定结束后,离心,弃去固定液。加入3%bsa封闭1h。封闭结束后,离心,弃去封闭液。并用完全培养基洗涤。洗涤结束,以人特异性的ace2抗体(novus biologicals, nbp2-80038)稀释液重悬细胞,室温孵育2h。抗体孵育结束后,用完全培养基充分洗涤后,加入 500μl完全培养基重悬细胞,并将细胞悬液转移至流式管内。在bd facsmelody流式细胞仪的fitc 通道内检测hace2抗体荧光信号,收集5
×
104个细胞进行分析,改造的猪成纤维细胞hace2-2号单克隆的结果示例如图19。结果显示在hace2转染的人hek293细胞(hace2-hek293)和猪col1a1安全港位点定点插入hace2的成纤维细胞(hace2-pig fibroblast)中均检测到hace2的抗体荧光信号,并发现hace2-pig fibroblast的hace2抗体荧光信号强度低于hace2-hek293的抗体荧光信号强度;在猪野生型成纤维细胞(wtpig fibroblast)中没有检测到hace2抗体荧光信号。
[0307]
实施例5、利用体细胞核移植技术克隆生产ace2人源化猪
[0308]
1、卵母细胞体外成熟
[0309]
从屠宰场采集新鲜的离体猪卵巢,卵巢在含75mg/ml青霉素和50mg/ml链霉素的0.9%(w/v)氯化钠溶液中保存,于25
–
30℃温度下运输至实验室。从直径3~6mm的卵泡中抽取卵丘卵母细胞复合体(cumulus-oocyte complexes,cocs),选择至少具有三层致密卵丘细胞的cocs,接种至4孔板中,每孔装有200μl猪卵母细胞体外成熟(ivm)培养基(即以tcm-199培养基为基础,内含 0.1mg/ml丙酮酸、0.1mg/ml盐酸半胱氨酸、10ng/ml表皮生长因子、10%(v/v)猪卵泡液、75mg/ml 青霉素,50mg/ml链霉素,10iu/mlecg和hcg),每孔接种50个,每次移植需培养300-400个cocs。将含cocs的培养板在38.5℃、5%co2和饱和湿度的培养箱中培养42-44小时。
[0310]
2、体细胞核移植(scnt)与胚胎移植
[0311]
(1)体细胞核移植
[0312]
体外成熟42小时后,用0.1%(w/v)透明质酸酶反复吹打去除cocs的扩张卵丘细胞。将具有完整膜且含排出的第一极体的卵母细胞在含有0.1mg/ml地美可辛、0.05m蔗糖和4mg/ml牛血清白蛋白 (bsa)的ncsu23培养基中培养0.5-1h,促使卵母细胞核突起,然后使用尖部倾斜的显微注射针(直径约20μm)在含有10μm hepes、0.3%(w/v)聚乙烯吡咯烷酮、10%fbs,0.1mg/ml地美可辛和 5mg/ml细胞松弛素b的tyrode乳酸培养基中去除突起的细胞核和极体。以纯合插入hace2的单细胞克隆株作为核供体,将单个供体细胞注入去核卵母
细胞的卵周隙。使用胚胎细胞融合仪(et3, fujihira industry)在含有0.25m d-山梨醇、0.05mm mg(c2h3o2)2、20mg/ml bsa和0.5mm hepes (acid-free)的融合培养基中用200v/mm的直流脉冲将供体细胞与受体卵母细胞融合20μs。将重构胚在pzm-3溶液(配方见下表12)中培养2h以允许细胞核重编程,然后在含有0.25m d-山梨醇、 0.01mm ca(c2h3o2)2、0.05mm mg(c2h3o2)2和0.1mg/ml bsa的激活培养基中用150v/mm的单脉冲激活 100μs。然后将激活的胚胎在含5μg/ml细胞松弛素b的pzm-3中,于38.5℃、5%co2、5%o2、90%n2和饱和湿度的培养箱中培养2小时,以进一步激活胚胎。最后将小部分重构胚移入pzm-3培养基中,在 38.5℃、5%co2、5%o2、90%n2和饱和湿度的培养箱中培养2d和7d,分别检测胚胎卵裂率和囊胚发育率。大部分重构胚在激活后培养6h即可用于后续的胚胎移植。
[0313]
pzm-3溶液配方见表12:
[0314]
表12
[0315][0316][0317]
*使用前添加
[0318]
(2)胚胎移植
[0319]
选择5头处于发情期的杂交母猪(大白猪/长白猪)作为重构胚的代孕母猪,将激活后培养6h的重构胚移植到受体母猪的输卵管中,每头母猪移植300-350个重构胚,每次移植1-2头母猪。在胚胎移植后约28天,使用超声波扫描仪(hs-101v,日本本田电子)检查妊娠情况,确认受体母猪是否怀孕,克隆猪在胚胎移植后第116-117天左右出生。
[0320]
5头代孕母猪中,3头成功怀孕的母猪共生产6头克隆猪(参见图20),该克隆猪即为hace2纯合插入的hace2人源化猪。
[0321]
实施例6从猪肺脏中分离肺泡巨噬细胞
[0322]
(1)分离hace2人源化猪和野生型猪完整气管和肺脏,并用含0.3%链霉素/青霉素的pbs进行清洗数次,最后一次用pbs洗涤,然后往气管中灌入50ml无菌pbs,轻轻拍打肺后倒出液体,1500g 离心4分钟。重复上述步骤2次。
[0323]
(2)加入10ml红细胞裂解液重悬细胞沉淀以去除溶液中的红细胞,静置4分钟,加入2倍体积pbs,1500g离心10分钟,弃上清,沉淀即为肺泡巨噬细胞。
[0324]
实施例7、hace2人源化猪hace2基因的转录水平检测
[0325]
为了检测猪col1a1安全港位点定点插入的hace2的表达情况。针对hace2基因设计了一对特异引物,对hace2人源化克隆猪和未改造的对照克隆猪(相同细胞来源)分别分离肺泡巨噬细胞,提取总rna,反转录成cdna,用于检测猪肺泡巨噬细胞中hace2基因的转录水平,同时用野生型猪肺泡巨噬细胞作为对照。以β-actin基因为内参基因按照2-δct
法进行计算。
[0326]
引物信息见表13:
[0327]
表13荧光定量pcr引物信息
[0328][0329][0330]
用spss统计学软件进行数据分析,以(平均数
±
标准差)表示,采用单因素方差分析进行统计学分析。结果如图21显示,改造后的克隆猪(hace2-pig)肺泡巨噬细胞的hace2基因的表达量高达管家基因β-actin表达量的0.12倍,显著高于未改造克隆猪(wt-pig)肺泡巨噬细胞的hace2基因的表达量(为管家基因β-actin表达量的2
×
10-7
倍)。
[0331]
综上,根据hace2基因实时荧光定量pcr的结果,hace2基因在经过改造后的hace2人源化猪的肺泡巨噬细胞中有较强的表达。
[0332]
实施例8、hace2人源化猪的hace2抗体结合情况检测
[0333]
(1)使用无菌pbs重悬猪肺泡巨噬细胞沉淀,以60%-80%密度接种于细胞爬片上,于37℃培养箱中静置2小时后取出。
[0334]
(2)使用预温的1
×
pbs清洗3次,每次10分钟。
[0335]
(3)以4%的多聚甲醛室温固定20分钟后。
[0336]
(4)用1
×
pbs清洗3次,每次10分钟。
[0337]
(5)5%bsa室温封闭30分钟。
[0338]
(6)加入1:200稀释的一抗(hace2抗体,novus biologicals,nbp2-80038),稀释液为含 1%bsa的pbs溶液,4℃孵育过夜。
[0339]
(7)使用1
×
pbs清洗3次,每次10分钟。
[0340]
(8)加入1:1000稀释的二抗(abcam,ab150113)),稀释液为含1%bsa的pbs溶液,4
℃闭光孵育30分钟。
[0341]
(9)用1
×
pbs清洗3次,每次10分钟。
[0342]
(10)加入hoechst 33342(用含1%bsa的pbs进行1:2000稀释),室温闭光孵育10分钟。
[0343]
(11)用1
×
pbs清洗3次,每次10分钟。
[0344]
(12)95%甘油封片,分别于倒置荧光显微镜和共聚焦显微镜下观察,并拍照。
[0345]
结果显示,hace2人源化猪肺泡巨噬细胞(图22a,22c)相较于野生型猪肺泡巨噬细胞(图 22b,22d),其细胞膜表面有更加显著的hace2抗体荧光信号。
[0346]
实施例9、sars-cov-2-spike假病毒感染hace2人源化猪成纤维细胞
[0347]
假病毒不具备复制能力,可以最大程度降低sars病毒研究过程中的各种风险。另外,由于假病毒的感染过程与真病毒相同,因此可以模拟病毒感染的早期过程,且假病毒内携带有报告基因,可以方便地进行各种检测分析。
[0348]
9.1sars-cov-2-spike假病毒的制备
[0349]
9.1.1sars-cov-2-spike假病毒制备所需质粒的构建
[0350]
质粒pmd2.g-sars-c19的结构示意图见图23。初始质粒为pmd2.g商品质粒,将pmd2.g质粒的 vsv-g区域删除,并将sars-cov-2病毒的刺突蛋白(spike,为sars-cov-2的膜蛋白)进行胞内c端 19个氨基酸缺失突变,然后插入已删除vsv-g区域的pmd2.g载体中。改造后的载体序列如seq idno:50所示,其中第161-540位核苷酸为cmv增强子,第541-744位核苷酸为cmv启动子序列,第 878-1353位核苷酸为β-globin内含子序列,第1415-5188位核苷酸为sars-cov-2刺突蛋白(spike) 的编码序列。第5264-5648位核苷酸为β-globin poly(a)signal序列。
[0351]
质粒lenti-mcherry的结构示意图见图24。初始质粒为商品质粒lenti-crispr v2,去除该质粒中的grna骨架与cas9蛋白区域,并将报告基因mcherry插入相应区域,同时保留原质粒所携带的嘌呤霉素抗性基因。这将使利用该质粒联合配套质粒所构建的假病毒的基因组带有mcherry荧光标签及嘌呤霉素抗性标签。改造后的载体序列如seq id no:51所示,其中第2602-2813位核苷酸为ef1a 核心启动子元件序列,第2844-3551位核苷酸编码mcherry荧光蛋白,第3567-3623位核苷酸编码自剪切多肽p2a(自剪切多肽p2a的氨基酸序列为“atnfsllkqagdveenpgp”,发生自剪切的断裂位置为 c端开始第一个氨基酸残基和第二个氨基酸残基之间),第3624-4220位核苷酸编码puromycin抗性蛋白(简称puror蛋白),第5161-5385位核苷酸为bgh poly(a)signal序列。
[0352]
9.1.2sars-cov-2-spike假病毒的制备
[0353]
(1)将质粒pmd2.g-sars-c19、lenti-mcherry与pspax2慢病毒包装质粒按6μg:4μg:5μg比例混合。
[0354]
(2)加入750μl medium,轻柔混合。
[0355]
(3)加入24μl lipo8000
tm
(碧云天,st483)转染试剂,轻柔混合。
[0356]
(4)滴入10cm的hek293t细胞培养盘中,细胞密度在70%-80%。
[0357]
(5)转染后6小时换液(含10%fbs的完全培养基)。
[0358]
(6)转染后48小时收集细胞上清液,用0.45μm滤头过滤,去除细胞碎片。
[0359]
(7)每10ml病毒过滤液加入3.3ml的lenti-x concentrator(clontech,631231),
轻柔混合, 4℃放置过夜。
[0360]
(8)4℃,1500g离心45分钟,弃上清,加入100μl dmem溶解沉淀,即为浓缩后的sars-cov
‑ꢀ
2假病毒。
[0361]
9.2假病毒感染猪成纤维细胞
[0362]
(1)于感染实验24小时前,取同等数量hace2人源化猪和未改造猪的原代成纤维细胞接种于96 孔板中,使接种密度为30%-50%。
[0363]
(2)向96孔板细胞中加入500μl浓缩病毒原液,同时加入0.8μl polybrene助感染试剂。
[0364]
(3)感染后6小时换液(含10%fbs的完全培养基)。
[0365]
(4)感染后48小时进行8μg/ml嘌呤霉素抗性筛选,连续筛选两天后,在倒置荧光显微镜下分别观察hace2人源化猪和野生型猪原代成纤维细胞的mcherry荧光信号。
[0366]
结果显示,在hace2人源化猪原代成纤维细胞中观察到了带荧光的合胞体细胞(图25),表明病毒能够感染细胞,而且促使被感染的细胞与邻近细胞形成合胞体,而未改造猪原代成纤维细胞中则未见有带荧光的合胞体细胞(图26)。
[0367]
进一步的,本技术制备的hace2人源化猪可用于下一步的药物筛选、药效评价、疫苗效果测试及病毒感染机制等生物医药领域研究。
[0368]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
[0369]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1