一种合成β-硫烯胺酮类化合物的方法
一种合成
β-硫烯胺酮类化合物的方法
技术领域
1.本发明属于化学合成技术领域,具体涉及一种β-硫烯胺酮类化合物的制备方法及其产品。
背景技术:
2.吲哚酮和茚酮主链广泛存在于生物活性天然产物和药物中。重要代表包括天然产物保罗洛尔f、新木质素、优普立克汀、多奈哌齐和吲哚替康(lmp400)。此外,还发现3-磺酰茚酮具有聚集诱导发射(aie)aie的作用。近年来,对1-茚满酮的2-/3-衍生化反应进行了大量的研究。2017年,bencivenni团队成功开发了取代茚酮和萘酚之间的对映选择性f-c型烷基化反应,可对c(sp3)-c(sp2)立体轴构象进行热力学控制,实现ap构象非对映异构体的选择性合成。之后,朱和同事报道了3-羟基吲哚酮通过烯丙基烷氧基化、磺胺化、乙酰胺化和硫醚化反应的结构修饰。最近,feng的小组揭示了苯乙烯衍生物和吲哚甲酰胺/酯通过结合手性n,n
’‑
二氧化物/niii与ag2o的复合催化剂。所得产物产率高,非对映选择性和对映选择性好。此外,1-茚满酮的2-/3-衍生方法还有其他几种,如c(sp3)-h胺化、6-杂二烯-alder反应和后续氧化,suzuki交叉偶联反应、不对称mannich/环化反应、9β-烯基化反应等。值得注意的是,本研究的产物也具有α-烯胺酮结构。greenhill提出的烯胺酮一词用于表示含有共轭体系n-c=c-c=o的任何化合物。烯胺酮是多用途的合成中间体,因为它们具有双电子态(与亲核烯胺和亲电烯酮反应)。α-烯胺酮存在于多种天然产物和生物活性分子中。例如,放线菌素d,从链霉菌菌株的培养基中分离出来,是一种临床抗肿瘤药物,它已被实验用作原核和真核细胞rna合成的抑制剂。麦卢卡霉素和阿苏霉素是麦卢卡霉素类抗生素的两个成员,对革兰氏阳性细菌、真菌等具有抑制活性。因此,开发同时具有1-茚满酮和α-烯胺酮骨架的结构是非常有意义的。
技术实现要素:
3.本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
4.鉴于上述和/或现有制备β-硫烯胺酮类化合物的技术空白,提出了本发明。
5.因此,本发明其中的一个目的是解决现有技术中的不足,提供一种条件温和操作方便的β-硫烯胺类化合物的制备方法。
6.为解决上述技术问题,本发明提供了如下技术方案:向预先干燥的圆底烧瓶中依次加入三氟甲磺酸铜、1-茚酮肟酯、碳酸钠、二甲基亚砜然后加入硫酚。以300~600rpm室温搅拌3~6h后,用乙酸乙酯萃取,合并有机相,旋蒸浓缩后利用柱层析分离,得到目标产品。
7.作为所述β-硫烯胺酮类化合物的制备方法的一种优选方案,其中:所述1-茚酮肟酯类化合物包括各种取代的1-茚酮肟酯中的一种或几种,其结构式如下:
[0008][0009]
式中r1为取代基团,包括:卤素,甲氧基,烷基等
[0010]
作为本发明所述β-硫烯胺酮类化合物的制备方法的一种优选方案,其中:所述硫酚包括包括式ii所示硫酚类化合物::
[0011]r2-sh
[0012]
ii
[0013]
式中r2包括苯基,取代苯基(包括单取代苯基以及多取代苯基,取代基包括卤素,烷基,甲氧基等)。
[0014]
作为本发明所述β-硫烯胺酮类化合物的制备方法的一种优选方案,其中:所述硫酚类化合物与所述1-茚酮肟酯类化合物的摩尔比为1~2∶1。
[0015]
作为本发明所述β-硫烯胺酮类化合物的制备方法的一种优选方案,其中:所述三氟甲磺酸铜与所述1-茚酮肟酯类化合物的摩尔比为0.04~0.3∶1。
[0016]
作为本发明所述β-硫烯胺酮类化合物的制备方法的一种优选方案,其中:所述碳酸钠与所述1-茚酮肟酯类化合物的摩尔比为1~2∶1。
[0017]
作为本发明所述β-硫烯胺酮类化合物的制备方法的一种优选方案,其中:所述二甲亚砜的用量为每毫摩尔1-茚酮肟酯对应5~10ml。
[0018]
作为本发明所述β-硫烯胺酮类化合物的制备方法的一种优选方案,其中:所述旋蒸,其转速为100~200rpm,温度为36~40℃,真空为0.08~0.12mpa,处理时间为3~5min。
[0019]
作为本发明所述β-硫烯胺酮类化合物的制备方法的一种优选方案,其中:所述层析,其是采用200目柱层析硅胶,展开剂为石油醚∶乙酸乙酯=80~100∶1~20。
[0020]
本发明的有益效果:
[0021]
(1)该方法反应条件比较温和方便。
[0022]
(2)烯胺产物稳定、官能团耐受性好、操作简单
[0023]
(3)在没有任何碱基或配体控制的情况下,表现出良好的选择性和良好的官能团相容性。
[0024]
(5)产品都有1-茚满酮和α-烯胺酮骨架,非常独特和有用。
附图说明
[0025]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
[0026]
图1为化合物1a的核磁谱图h谱;
[0027]
图2为化合物1a的核磁谱图c谱,图1和图2表明化合物1a结构正确;
[0028]
图3为化合物1b的核磁谱图h谱;
[0029]
图4为化合物1b的核磁谱图c谱,图3和图4表明化合物1b结构正确;
[0030]
图5为化合物1c的核磁谱图h谱;
[0031]
图6为化合物1c的核磁谱图c谱,图5和图6表明化合物1c结构正确。
[0032]
图7为化合物1d的核磁谱图h谱;
[0033]
图8为化合物1d的核磁谱图c谱,图7和图8表明化合物1d结构正确。
[0034]
图9为化合物1e的核磁谱图h谱;
[0035]
图10为化合物1e的核磁谱图c谱,图9和图10表明化合物1e结构正确。
[0036]
图11为化合物1f的核磁谱图h谱;
[0037]
图12为化合物1f的核磁谱图c谱,图11和图12表明化合物1f结构正确;
[0038]
图13为化合物1g的核磁谱图h谱;
[0039]
图14为化合物1g的核磁谱图c谱,图13和图14表明化合物1g结构正确;
具体实施方式
[0040]
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
[0041]
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
[0042]
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
[0043]
实施例1:
[0044][0045]
在预先干燥25ml圆底烧瓶中,氮气保护条件下,向预先干燥的圆底烧瓶中依次加入三氟甲磺酸铜(3.7mg,0.01mmol)、1-茚酮肟酯(41.9mg,0.2mmol)、碳酸钠(32.1mg,0.3mmol)、二甲基亚砜(2ml,0.1m)后加入对氯苯硫酚(44.3mg,0.3mmol)。反应液搅拌结束后,使用乙酸乙酯萃取三次,将几次萃取的有机相合并至100ml茄形瓶内,使用heidolph旋转蒸发仪,转速为100~200rpm,温度为38~40℃,真空度为0.08~0.12mpa,处理3~5min,再使用200目柱层析硅胶进行柱层析,其展开剂为石油醚∶乙酸乙酯=80~99∶1~20,分离得目标化合物2a。(57.4mg,产率为99%,经hplc分析纯度为98%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度极高)。
[0046]1h nmr(600mhz,cdcl3)δ7.27(d,j=7.2hz,1h),7.23(s,4h),7.16(t,j=7.5hz,1h),6.90(t,j=7.4hz,1h),6.65(d,j=7.3hz,1h),4.45(s,2h).
[0047]
13
c nmr(150mhz,cdcl3)δ192.1,148.3,144.9,136.0,132.8,132.5,129.8,129.3,
128.5,125.5,123.2,118.5,108.7.
[0048]
实施例2:
[0049][0050]
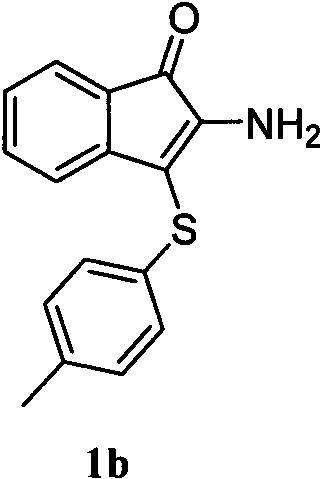
在预先干燥25ml圆底烧瓶中,氮气保护条件下,向预先干燥的圆底烧瓶中依次加入三氟甲磺酸铜(3.7mg,0.01mmol)、1-茚酮肟酯(41.9mg,0.2mmol)、碳酸钠(32.1mg,0.3mmol)、二甲基亚砜(2ml,0.1m)后加入对甲基苯硫酚(38.1mg,0.3mmol)。反应液搅拌结束后,使用乙酸乙酯萃取三次,将几次萃取的有机相合并至100ml茄形瓶内,使用heidolph旋转蒸发仪,转速为100~200rpm,温度为38~40℃,真空度为0.08~0.12mpa,处理3~5min,再使用200目柱层析硅胶进行柱层析,其展开剂为石油醚∶乙酸乙酯=80~99∶1~20,分离得目标化合物1a。(54.2mg,产率为99%,经hplc分析纯度为98%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度极高)
[0051]1h nmr(600mhz,cdcl3)δ7.26-7.22(m,3h),7.15(td,j=7.6,1.1hz,1h),7.09(d,j=8.0hz,2h),6.90-6.86(m,1h),6.68(d,j=7.3hz,1h),4.27(s,2h),2.31(s,3h).
[0052]
13
c nmr(150mhz,cdcl3)δ192.3,148.5,143.8,137.0,135.8,130.5,129.9,129.0,128.7,125.4,122.8,118.5,111.5,20.8.
[0053]
实施例3:
[0054][0055]
在预先干燥25ml圆底烧瓶中,氮气保护条件下,向预先干燥的圆底烧瓶中依次加入三氟甲磺酸铜(3.7mg,0.01mmol)、1-茚酮肟酯(41.9mg,0.2mmol)、碳酸钠(32.1mg,0.3mmol)、二甲基亚砜(2ml,0.1m)后加入邻二甲基苯硫酚(42.3mg,0.3mmol)。反应液搅拌结束后,使用乙酸乙酯萃取三次,将几次萃取的有机相合并至100ml茄形瓶内,使用heidolph旋转蒸发仪,转速为100~200rpm,温度为38~40℃,真空度为0.08~0.12mpa,处理3~5min,再使用200目柱层析硅胶进行柱层析,其展开剂为石油醚∶乙酸乙酯=80~99∶1~20,分离得目标化合物1a。(43.7mg,产率为78%,经hplc分析纯度为98%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度极高)
[0056]1h nmr(600mhz,cdcl3)δ7.22-7.18(m,1h),7.18-7.16(d,j=7.0hz,1h),7.15-7.11(m,3h),6.90-6.86(m,1h),6.60(d,j=7.2hz,1h),3.48(s,2h),2.52(s,6h).
[0057]
13
c nmr(150mhz,cdcl3)δ192.1,147.8,144.0,139.0,135.6,130.1,129.7,129.4,
128.8,126.3,122.4,118.3,117.6,22.4.
[0058]
实施例4:
[0059][0060]
在预先干燥25ml圆底烧瓶中,氮气保护条件下,向预先干燥的圆底烧瓶中依次加入三氟甲磺酸铜(3.7mg,0.01mmol)、1-茚酮肟酯(41.9mg,0.2mmol)、碳酸钠(32.1mg,0.3mmol)、二甲基亚砜(2ml,0.1m)后加入4-三氟甲基苯硫酚(54.5mg,0.3mmol)。反应液搅拌结束后,使用乙酸乙酯萃取三次,将几次萃取的有机相合并至100ml茄形瓶内,使用heidolph旋转蒸发仪,转速为100~200rpm,温度为38~40℃,真空度为0.08~0.12mpa,处理3~5min,再使用200目柱层析硅胶进行柱层析,其展开剂为石油醚∶乙酸乙酯=80~99∶1~20,分离得目标化合物1a。(65.5mg,产率为99%,经hplc分析纯度为99%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度极高)
[0061]1h nmr(600mhz,cdcl3)δ7.50(d,j=8.3hz,2h),7.36(d,j=8.3hz,2h),7.31(d,j=7.1hz,1h),7.19(t,j=7.5hz,1h),6.92(t,j=7.4hz,1h),6.68(d,j=7.3hz,1h),4.54(s,2h).
[0062]
13
c nmr(150mhz,cdcl3)δ192.0,148.4,145.8,140.0,136.3,δ128.4(q,j=32.7hz),128.3,127.2,126.5(q,j=3.7hz),125.6,δ124.5(q,j=272.0hz).123.6,118.5,106.5.
[0063]
实施例5:
[0064][0065]
在预先干燥25ml圆底烧瓶中,氮气保护条件下,向预先干燥的圆底烧瓶中依次加入三氟甲磺酸铜(3.7mg,0.01mmol)、(e)-2-(乙酰亚氨基)-6-甲基-2,3-二氢-1h-茚酮(44.8mg,0.2mmol)、碳酸钠(32.1mg,0.3mmol)、二甲基亚砜(2ml,0.1m)后加入对氯苯硫酚(44.3mg,0.3mmol)。反应液搅拌结束后,使用乙酸乙酯萃取三次,将几次萃取的有机相合并至100ml茄形瓶内,使用heidolph旋转蒸发仪,转速为100~200rpm,温度为38~40℃,真空度为0.08~0.12mpa,处理3~5min,再使用200目柱层析硅胶进行柱层析,其展开剂为石油醚∶乙酸乙酯=80~99∶1~20,分离得目标化合物1a。(62.6mg,产率为99%,经hplc分析纯度为98%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度极高)
[0066]1h nmr(600mhz,cdcl3)δ7.22(s,4h),7.11(s,1h),6.95(d,j=7.3hz,1h),6.52(d,j=7.4hz,1h),4.35(s,2h),2.22(s,3h).
[0067]
13
c nmr(150mhz,cdcl3)δ192.3,145.2,144.4,135.8,135.4,132.8,132.5,129.7,129.4,128.8,124.4,118.3,109.4,20.7.
[0068]
实施例6:
[0069][0070]
在预先干燥25ml圆底烧瓶中,氮气保护条件下,向预先干燥的圆底烧瓶中依次加入三氟甲磺酸铜(3.7mg,0.01mmol)、(e)-2-(乙酰亚氨基)-6-甲氧基-2,3-二氢-1h-茚酮(48.1mg,0.2mmol)、碳酸钠(32.1mg,0.3mmol)、二甲基亚砜(2ml,0.1m)后加入对氯苯硫酚(44.3mg,0.3mmol)。反应液搅拌结束后,使用乙酸乙酯萃取三次,将几次萃取的有机相合并至100ml茄形瓶内,使用heidolph旋转蒸发仪,转速为100~200rpm,温度为38~40℃,真空度为0.08~0.12mpa,处理3~5min,再使用200目柱层析硅胶进行柱层析,其展开剂为石油醚∶乙酸乙酯=80~99∶1~20,分离得目标化合物1a。(57.3mg,产率为90%,经hplc分析纯度为98%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度极高)
[0071]1h nmr(400mhz,cdcl3)δ7.23(s,4h),6.92(s,1h),6.60(dd,j=7.9,1.9hz,1h),6.49(d,j=8.0hz,1h),4.25(s,2h),3.74(s,3h).
[0072]
13
c nmr(100mhz,cdcl3)δ191.9,158.9,143.9,139.4,132.6,132.5,130.2,129.8,129.6,119.0,118.0,111.6,110.9,55.7.
[0073]
实施例7:
[0074][0075]
在预先干燥25ml圆底烧瓶中,氮气保护条件下,向预先干燥的圆底烧瓶中依次加入三氟甲磺酸铜(3.7mg,0.01mmol)、(e)-2-(乙酰亚氨基)-5,6-二甲氧基-2,3-二氢-1h-茚酮(54.3mg,0.2mmol)、碳酸钠(32.1mg,0.3mmol)、二甲基亚砜(2ml,0.1m)后加入4-氯苯硫酚(44.3mg,0.3mmol)。反应液搅拌结束后,使用乙酸乙酯萃取三次,将几次萃取的有机相合并至100ml茄形瓶内,使用heidolph旋转蒸发仪,转速为100~200rpm,温度为38~40℃,真
空度为0.08~0.12mpa,处理3~5min,再使用200目柱层析硅胶进行柱层析,其展开剂为石油醚∶乙酸乙酯=80~99∶1~20,分离得目标化合物1a。(40.4mg,产率为58%,经hplc分析纯度为98%,从核磁图谱外形、信号、噪声等方面也可以反映出产品纯度极高)
[0076]1h nmr(400mhz,cdcl3)δ7.22(s,4h),6.94(s,1h),6.30(s,1h),4.43(s,2h),3.81(s,3h),3.78(s,3h).
[0077]
13
c nmr(100mhz,cdcl3)δ191.2,155.8,146.6,145.4,145.0,133.6,132.3,129.7,128.8,119.3,108.9,104.3,103.4,56.5,56.2.
[0078]
综上所述,我们开发了一种新的合成1-吲哚酮衍生物的方法,通过铜催化偶联肟酯与硫酚,各种1-茚酮肟酯和硫酚适合于这种转化。整个反应作简单,产率高,纯度高,条件温和,底物范围广,反应条件比较温和方便,烯胺产物稳定、官能团耐受性好、操作简单,在没有任何碱基或配体控制的情况下,表现出良好的选择性和良好的官能团相容性。这些独特的结构可能在后续合成中有潜在的应用。
[0079]
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1