一种由联苯烯酮制备菲衍生物的方法
1.本发明属于完全或部分氢化菲衍生物技术领域,涉及一种由联苯烯酮制备菲衍生物的方法。
背景技术:
2.菲(phenanthrene)是一种含三个苯环的稠环芳烃,存在于煤焦油中。菲的三个环的中心不在一条直线上,是蒽的同分异构体,为白色有光泽并发荧光的片状晶体。菲具有广泛的用途,在造纸工业上,菲可作纸浆防雾剂;在军工上,菲还可用于硝化甘油炸药和硝化纤维稳定剂及制造烟幕弹;在医药上,菲可合成生物碱、吗啡和咖啡因、二甲基吗啡和许多生殖器官具有特殊生理作用的医药。在染料工业上,菲可制取2
‑
氨基菲酮,苯绕蒽酮,硫化还原染料(蓝bo,黑bb及棕色)等。在塑料工业中,用菲作耐高温的聚酰亚胺树脂的主要中间体糅合剂。此外,菲在高温高压下加氢可得过氢菲,是高级喷气式飞机的燃料。菲的固体氧化物可制耐焰性好的电气绝缘材料和填充剂。在农药上,菲经氧化制得的菲醌,则用于生产高效、低毒合成农药。近年来又开发出用菲生产的树脂眼镜片。
3.由于菲制法困难,过去国内很多企业停留在制取粗菲的水平上,产品仅用作制炭黑或作为一般燃料,部分粗菲被用作混凝土添加剂,效益低下。因此,关注附加值高的菲的下游产品的研究、开发、生产,对国内相关企业十分重要。
4.构建菲核的典型方法包括从芳烃,邻炔基
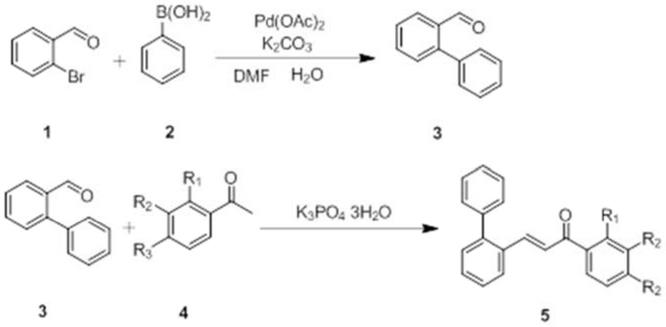
‑
联芳基或取代的n
‑
甲苯磺酰基开始的过渡金属催化的环异构化。namrata rastogi团队提出了可见光催化氧化α
‑
溴代查耳酮的分子内环化过程,在无水n,n
‑
二甲基甲酰胺(dmf)中反应3小时即可得到菲化合物,具有广泛的底物范围和良好的区域选择性。但是该反应所使用的α
‑
溴代查耳酮底物需要在制备的查耳酮底物上使用有毒且易挥发的溴进行溴化反应,操作繁琐困难,并且该反应使用的重金属催化剂,对环境危害较大。
5.本发明提供一种由联苯烯酮制备菲的衍生物的新方法,该方法采用光催化进行分子内环化反应得到高收率的菲类衍生物,操作简单,绿色环保。
技术实现要素:
6.本发明所要解决的技术问题是针对现有技术中存在的上述不足,提供一种以联苯烯酮化合物作为原料合成分子内环化菲类化合物的方法,该方法简便、反应步骤少、易操作,有机溶剂消耗量小,后处理简单,产品纯度高,环保压力小,适合工业化生产。
7.为解决上述技术问题,本发明提供的技术方案是:
8.提供一种由联苯烯酮制备菲衍生物的方法,以式1所示的联苯烯酮为原料,将联苯烯酮溶于溶剂中,在有机碱存在及紫外辐射条件下进行分子内环化反应合成
9.式2所示的菲衍生物,其反应式如下:
[0010][0011]
其中r1、r2、r3分别独立选自氢,甲基,三氟甲基,氯,溴,碘,亚硝酸根(
‑
no2)。
[0012]
按上述方案,所述溶剂为甲苯,氯苯,乙醇,苯甲醚中的一种或几种。
[0013]
优选的是,分子内环化反应过程中向反应体系中通入空气。空气中的氧气能够提高反应转化率。
[0014]
优选的是,所述式1所示的联苯烯酮在溶剂中的浓度为0.1~0.25mmol/ml。
[0015]
按上述方案,所述有机碱为1,8
‑
二氮杂二环十一碳
‑7‑
烯(dbu),三乙胺,koh中的一种,有机碱加入量为式1所示的联苯烯酮摩尔量的2~4倍。
[0016]
优选的是,所述紫外辐射条件为20~40w的紫外灯辐射4~8h。
[0017]
上述由联苯烯酮制备菲衍生物的方法,具体步骤如下:将式1所示的联苯烯酮加入反应瓶中,加入溶剂和有机碱,在紫外辐射条件下进行分子内环化反应,以tlc点板追踪反应完全后,向反应液中加入二氯甲烷溶解产物,随后用水萃取收集有机相,向有机相中加入硅胶粉(起干燥作用)并减压旋蒸除去溶剂得到粗产物,将所得粗产物以柱层析方法分离并干燥得到式2所示的菲衍生物。
[0018]
按上述方案,式1所示的联苯烯酮的制备方法为:
[0019]
1)2
‑
溴苯甲醛与苯硼酸suzuki偶联反应:将2
‑
溴苯甲醛(化合物1)与苯硼酸(化合物2)溶于n,n
‑
二甲基甲酰胺(dmf)与水的混合液中,加入k2co3和醋酸钯,在冰水浴条件下进行反应,提纯得到联苯
‑2‑
甲醛(化合物3);
[0020]
2)醛酮缩合反应:将步骤1)制备得到的联苯
‑2‑
甲醛与r1、r2、r3取代的苯乙酮(化合物4)溶于乙醇中,加入k3po4·
3h2o,室温搅拌反应,分离提纯得到式1所示的联苯烯酮(化合物5)。
[0021]
具体反应式如下:
[0022][0023]
优选的是,步骤1)所述反应时间为30~60min。
[0024]
优选的是,步骤2)所述反应时间为10~14h。
[0025]
本发明以式1所示的联苯烯酮为原料,在紫外光激发下,联苯烯酮双键上的氢电子发生跃迁变成活跃态与苯环发生环化反应,生成脂肪环,同时,在有机碱的作用下,拔掉脂
肪环上的氢,生成菲类化合物。
[0026]
本发明的有益效果在于:本发明提供的由联苯烯酮制备菲衍生物的方法反应步骤简单,不使用过渡金属催化剂,以紫外光催化分子内环化反应,转化率高,绿色环保。
附图说明
[0027]
图1为本发明实施例1化合物5a的1h nmr图;
[0028]
图2为实施例1化合物5a的
13
c nmr图;
[0029]
图3为实施例1化合物6a的1h nmr图;
[0030]
图4为实施例1化合物6a的
13
c nmr图;
[0031]
图5为实施例2化合物5b的1h nmr图;
[0032]
图6为实施例2化合物5b的
13
c nmr图;
[0033]
图7为实施例2化合物6b的1h nmr图;
[0034]
图8为实施例2化合物6b的
13
c nmr图;
[0035]
图9为实施例3化合物5c的1h nmr图;
[0036]
图10为实施例3化合物5c的
13
c nmr图;
[0037]
图11为实施例3化合物6c的1h nmr图;
[0038]
图12为实施例3化合物6c的
13
c nmr图;
[0039]
图13为实施例4化合物5d的1h nmr图;
[0040]
图14为实施例4化合物5d的
13
c nmr图;
[0041]
图15为实施例4化合物6d的1h nmr图;
[0042]
图16为实施例4化合物6d的
13
c nmr图。
[0043]
图17为实施例5化合物5e的1h nmr图;
[0044]
图18为实施例5化合物5e的
13
c nmr图;
[0045]
图19为实施例5化合物6e的1h nmr图;
[0046]
图20为实施例5化合物6e的
13
c nmr图;
[0047]
图21为实施例6化合物5f的1h nmr图;
[0048]
图22为实施例6化合物5f的
13
c nmr图;
[0049]
图23为实施例6化合物6f的1h nmr图;
[0050]
图24为实施例6化合物6f的
13
c nmr图;
[0051]
图25为实施例7化合物5g的1h nmr图;
[0052]
图26为实施例7化合物5g的
13
c nmr图;
[0053]
图27为实施例7化合物6g的1h nmr图;
[0054]
图28为实施例7化合物6g的
13
c nmr图。
具体实施方式
[0055]
为使本领域技术人员更好地理解本发明的技术方案,下面结合实施例对本发明作进一步详细描述。
[0056]
实施例1
[0057]
一种菲衍生物的制备方法,具体步骤如下:
[0058]
1)将2.0mmol 2
‑
溴苯甲醛(化合物1)、2.1mmol苯硼酸(化合物2),2.0mmol k2co3放入100ml烧瓶中,随后倒入20ml n,n
‑
二甲基甲酰胺(dmf)和10ml水的混合液,将烧瓶放在冰水混合液中并搅拌,称取0.1mmol醋酸钯加入烧瓶中,反应30min,向反应液中加入适量二氯甲烷溶解产物后用水萃取收集有机相,减压蒸馏除去溶剂,将所得粗产物以柱色谱法分离、干燥得到化合物3;
[0059]
2)称取1.0mmol化合物3、2.2mmol 2
‑
氯苯乙酮(化合物4a)、0.2mmol k3po4·
3h2o放入25ml烧瓶中,随后倒入10ml乙醇,室温下搅拌反应12小时,随后向反应液中加入适量二氯甲烷溶解产物,用水萃取收集有机相,减压蒸馏除去溶剂,将所得粗产物以柱色谱法分离、干燥得化合物5a;
[0060][0061]
3)将318mg化合物5a(1.0mmol)加入到敞口反应瓶中,向反应瓶中加入10ml氯苯,加入dbu(2.5mmol),将反应瓶置于40w紫光灯下室温搅拌8h,tlc点板追踪反应完全,随后向反应液中加入30ml二氯甲烷溶解产物,将混合液用水萃取收集有机相,向有机相中加入硅胶粉并减压旋蒸除去溶剂得到粗产物,将所得粗产物以柱层析方法分离并通过旋转蒸发仪35℃悬干得到化合物6a(288mg,产率88%)。
[0062]
反应式如下:
[0063][0064]
化合物5a的表征数据如下:
[0065]1h nmr(500mhz,cdcl3):δ7.82(d,j=7.7hz,1h),7.48(t,j=9.0hz,2h),7.44(d,j=12.1hz,2h),7.41
–
7.38(m,3h),7.38
–
7.35(m,2h),7.33(d,j=8.0hz,1h),7.30(d,j=7.7hz,2h),7.28(d,j=7.3hz,1h),7.08(d,j=16.1hz,1h)。1h nmr谱图见图1。
[0066]
13
c nmr(126mhz,cdcl3):δ194.37,146.27,143.52,139.56,138.96,132.56,131.08,131.02,130.52,130.48,130.08,129.84,129.01,128.22,127.80,127.56,127.47,126.99,126.68。
13
c nmr谱图见图2。
[0067]
化合物6a的表征数据如下:
[0068]1h nmr(500mhz,cdcl3):δ8.84(t,1h),8.73(t,1h),8.67(d,j=8.4hz,1h),7.84(s,1h),7.79(d,j=7.9hz,1h),7.73(t,j=5.8hz,1h),7.72
–
7.66(m,2h),7.57(t,j=
7.8hz,2h),7.47(d,j=3.5hz,2h),7.41
–
7.34(m,1h)。1h nmr谱图见图3。
[0069]
13
c nmr(126mhz,cdcl3):δ196.99,139.77,133.85,132.37,132.34,131.79,130.91,130.49,130.47,130.17,129.87,129.39,128.89,127.82,127.38,127.12,126.88,126.82,122.88,122.79。
13
c nmr谱图见图4。
[0070]
将本实施例步骤3)中dbu用等摩尔量的三乙胺代替,其余条件不变,得到产物为化合物6a(238mg,产率75%)。
[0071]
将本实施例步骤3)中dbu用等摩尔量的koh代替,其余条件不变,得到产物为化合物6a(219mg,产率69%)。
[0072]
实施例2
[0073]
一种菲衍生物的制备方法,具体步骤如下:
[0074]
1)称取1.0mmol化合物3(制备方法同实施例1)、2.2mmol 2
’‑
溴苯乙酮(化合物4b)、0.2mmol k3po4·
3h2o放入25ml烧瓶中,随后倒入10ml乙醇,室温下搅拌反应12小时,随后向反应液中加入适量二氯甲烷溶解产物,用水萃取收集有机相,减压蒸馏除去溶剂,将所得粗产物以柱色谱法分离、干燥得化合物5b;
[0075][0076]
2)将362mg化合物5b(1.0mmol)加入到敞口反应瓶中,向反应瓶中加入10ml氯苯,加入381mg dbu(2.5mmol),通入空气,将反应瓶置于20w紫光灯下室温搅拌8h,tlc点板追踪反应完全,随后向反应液中加入30ml二氯甲烷溶解产物,将混合液用水萃取收集有机相,向有机相中加入硅胶粉并减压旋蒸除去溶剂得到粗产物,将所得粗产物以柱层析方法分离、干燥得到化合物6b(318mg,产率75%)。
[0077]
反应式如下:
[0078][0079]
化合物5b的表征数据如下:
[0080]1h nmr(500mhz,cdcl3):δ7.81(d,j=7.6hz,1h),7.56(t,j=10.3hz,1h),7.53
–
7.47(m,1h),7.44(ddd,j=10.4,6.0,1.4hz,2h),7.41
–
7.27(m,8h),7.27
–
7.21(m,1h),7.04(t,j=11.3hz,1h),谱图见图5。
[0081]
13
c nmr(126mhz,cdcl3):δ189.37,144.67,143.63,139.99,136.85,133.01,131.87,130.75,130.29,130.10,129.86,128.45,127.82,127.76,127.74,127.21,122.93,谱图见图6。
[0082]
化合物6b的表征数据如下:
[0083]1h nmr(500mhz,cdcl3):δ8.76(d,j=8.4hz,1h),8.73(d,j=8.4hz,1h),8.07(d,j=8.2hz,1h),7.89(d,j=7.9hz,1h),7.82(s,1h),7.80(d,j=8.2hz,2h),7.76(t,j=7.7hz,1h),7.70(t,j=7.6hz,1h),7.65(d,j=7.4hz,1h),7.61(d,j=8.4hz,2h),7.58(d,j=7.5hz,1h),谱图见图7。
[0084]
13
c nmr(126mhz,cdcl3):δ196.84,136.99,134.81,131.92,131.89,131.42,130.67,129.98,129.59,129.38,129.15,128.70,128.56,127.34,127.28,126.51,123.05,122.77,谱图见图8。
[0085]
实施例3
[0086]
一种菲衍生物的制备方法,具体步骤如下:
[0087]
1)称取1.0mmol化合物3(制备方法同实施例1)、2.2mmol 3
’‑
碘苯乙酮(化合物4c)、0.2mmol k3po4·
3h2o放入25ml烧瓶中,随后倒入10ml乙醇,室温下搅拌反应12小时,随后向反应液中加入适量二氯甲烷溶解产物,用水萃取收集有机相,减压蒸馏除去溶剂,将所得粗产物以柱色谱法分离、干燥得化合物5c;
[0088][0089]
2)将412mg化合物5c(1.0mmol)加入到敞口反应瓶中,向反应瓶中加入10ml氯苯,加入dbu(2.5mmol),通入空气,将反应瓶置于40w紫光灯下室温搅拌8h,tlc点板追踪反应完全,随后向反应液中加入适量二氯甲烷溶解产物,将混合溶液以水萃取收集有机相,向有机相中加入硅胶粉并减压旋蒸除去溶剂得到粗产物,将所得粗产物以柱色谱层析方法分离、干燥得到化合物6c(340mg,产率83%)。
[0090]
反应式如下:
[0091][0092]
化合物5c的表征数据如下:
[0093]1h nmr(500mhz,cdcl3):δ8.27(s,1h),7.88(dt,j=7.2,5.2hz,4h),7.56
–
7.42(m,
6h),7.39
–
7.32(m,3h),7.21(t,j=7.8hz,1h),谱图见说明书附图9。
[0094]
13
c nmr(126mhz,cdcl3):δ189.08,144.91,143.67,141.42,139.99,139.96,137.38,132.91,130.78,130.35,130.28,129.83,128.49,127.79,127.78,127.65,127.33,122.94,94.47,谱图见图10。
[0095]
化合物6c的表征数据如下:
[0096]1h nmr(500mhz,cdcl3):δ8.80(d,j=8.4hz,1h),8.76(d,j=8.4hz,1h),8.14(d,j=8.2hz,1h),7.92(d,j=7.9hz,1h),7.87(s,1h),7.83(s,1h),7.78(t,j=7.7hz,1h),7.73(t,j=7.8hz,2h),7.67(t,j=7.4hz,1h),7.61(t,j=7.6hz,1h),7.46(d,j=7.5hz,1h),7.37(t,j=7.6hz,1h),2.42(s,3h),谱图见图11。
[0097]
13
c nmr(126mhz,cdcl3):δ200.09(s),139.30(s),138.63(s),135.73(s),131.91(s),131.82(s),131.52(s),131.34(s),130.81(s),130.03(s),129.85(s),129.22(s),128.80(s),127.52(s),127.21(s),127.09(s),126.74(s),125.53(s),122.91(s),122.73(s),20.86(s),谱图见图12。
[0098]
实施例4
[0099]
一种菲衍生物的制备方法,具体步骤如下:
[0100]
1)称取1.0mmol化合物3(制备方法同实施例1)、2.2mmol 4
‑
硝基苯乙酮(化合物4d)、0.2mmol k3po4·
3h2o放入25ml烧瓶中,随后倒入10ml乙醇,室温下搅拌反应12小时,随后向反应液中加入适量二氯甲烷溶解产物,用水萃取收集有机相,减压蒸馏除去溶剂,将所得粗产物以柱色谱法分离、干燥得化合物5d;
[0101][0102]
2)将329mg化合物5d(1.0mmol)加入到敞口反应瓶中,向反应瓶中加入10ml氯苯,加入381mg dbu(2.5mmol),通入空气,将反应瓶置于40w紫光灯下室温搅拌8h,tlc点板追踪反应完全,随后向反应液中加入适量二氯甲烷溶解产物,将混合液以水萃取收集有机相,向有机相中加入硅胶粉并减压旋蒸除去溶剂得到粗产物,将所得粗产物以柱层析方法分离、干燥得到化合物6d(230mg,产率70%)。
[0103]
反应式如下:
[0104]
[0105]
化合物5d的表征数据如下:
[0106]1h nmr(500mhz,cdcl3):δ7.82(d,j=7.7hz,1h),7.48(dd,j=15.9,9.4hz,2h),7.44(d,j=12.1hz,2h),7.41
–
7.38(m,3h),7.38
–
7.35(m,2h),7.33(d,j=8.0hz,1h),7.30(d,j=7.7hz,2h),7.29
–
7.25(m,1h),7.08(d,j=16.1hz,1h),谱图见图13。
[0107]
13
c nmr(126mhz,cdcl3):δ189.28,149.94,146.22,143.87,142.98,139.82,132.58,130.79,130.68,129.80,129.42,129.32,128.45,127.83,127.21,123.89,123.75,122.85,谱图见图14。
[0108]
化合物6d的表征数据如下:
[0109]1h nmr(500mhz,cdcl3):δ8.82(d,j=8.4hz,1h),8.77(d,j=8.4hz,1h),8.35(d,j=8.5hz,2h),8.19(d,j=8.3hz,1h),8.10(d,j=8.4hz,2h),7.92(d,j=7.9hz,1h),7.88(s,1h),7.82(t,j=7.7hz,1h),7.77(t,j=7.6hz,1h),7.69(t,j=7.5hz,1h),7.65(t,j=7.6hz,1h),谱图见图15。
[0110]
13
c nmr(126mhz,cdcl3):δ195.97,150.38,143.24,133.86,131.77,131.23,130.81,130.78,129.80,129.73,129.11,128.87,127.60,127.58,127.45,126.39,123.77,123.17,122.85,谱图见图16。
[0111]
实施例5
[0112]
一种菲衍生物的制备方法,具体步骤如下:
[0113]
1)称取1.0mmol化合物3(制备方法同实施例1)、2.2mmol 4
‑
溴苯乙酮(化合物4e)、0.2mmol k3po4·
3h2o放入25ml烧瓶中,随后倒入10ml乙醇,室温下搅拌反应12小时,随后向反应液中加入适量二氯甲烷溶解产物,用水萃取收集有机相,减压蒸馏除去溶剂,将所得粗产物以柱色谱法分离、干燥得化合物5e;
[0114][0115]
2)将363mg化合物5e(1.0mmol)加入到敞口反应瓶中,向反应瓶中加入10ml氯苯,加入381mg dbu(2.5mmol),通入空气,将反应瓶置于40w紫光灯下室温搅拌8h,tlc点板追踪反应完全,随后向反应液中加入适量二氯甲烷溶解产物,将混合液以水萃取收集有机相,向有机相中加入硅胶粉并减压旋蒸除去溶剂得到粗产物,将所得粗产物以柱层析方法分离、干燥得到化合物6e(218mg,产率60%)。
[0116]
反应式如下:
[0117][0118]
化合物5e的表征数据如下:
[0119]1h nmr(500mhz,cdcl3):δ7.83(ddd,j=10.0,9.0,5.2hz,4h),7.66
–
7.59(m,2h),7.53
–
7.40(m,6h),7.40
–
7.33(m,3h),图谱见图17。
[0120]
13
c nmr(126mhz,cdcl3):δ189.39,144.67,143.61,139.97,136.83,133.00,131.85,130.73,130.26,130.07,129.83,128.42,127.79,127.73,127.72,127.18,122.94,图谱见图18。
[0121]
化合物6e的表征数据如下:
[0122]1h nmr(500mhz,cdcl3):δ8.79(d,j=8.4hz,1h),8.75(d,j=8.4hz,1h),8.12(d,j=8.2hz,1h),7.91(d,j=7.9hz,1h),7.86(s,1h),7.83(d,j=8.1hz,2h),7.78(t,j=7.7hz,1h),7.73(t,j=7.6hz,1h),7.68(d,j=7.5hz,1h),7.64(d,j=7.4hz,2h),7.61(d,j=7.4hz,1h),图谱见图19。
[0123]
13
c nmr(126mhz,cdcl3):δ196.78,137.00,134.81,131.91,131.88,131.41,130.67,129.98,129.59,129.39,129.16,128.69,128.55,127.34,127.27,126.52,123.06,122.77,图谱见图20。
[0124]
实施例6
[0125]
一种菲衍生物的制备方法,具体步骤如下:
[0126]
1)称取1.0mmol化合物3(制备方法同实施例1)、2.2mmol 4
‑
氟苯乙酮(化合物4f)、0.2mmol k3po4·
3h2o放入25ml烧瓶中,随后倒入10ml乙醇,室温下搅拌反应12小时,随后向反应液中加入适量二氯甲烷溶解产物,用水萃取收集有机相,减压蒸馏除去溶剂,将所得粗产物以柱色谱法分离、干燥得化合物5f;
[0127][0128]
2)将302mg化合物5f(1.0mmol)加入到敞口反应瓶中,向反应瓶中加入10ml氯苯,加入dbu(2.5mmol),通入空气,将反应瓶置于20w紫光灯下室温搅拌4h,tlc点板追踪反应完全,随后向反应液中加入适量二氯甲烷溶解产物,将混合液以水萃取收集有机相,向有机相中加入硅胶粉并减压旋蒸除去溶剂得到粗产物,将所得粗产物以柱层析方法分离、干燥得到化合物6f(250mg,产率73%)。
[0129][0130]
化合物5f的表征数据如下:
[0131]1h nmr(500mhz,cdcl3):δ7.96(dd,j=7.2,5.6hz,2h),7.82(d,j=7.9hz,1h),7.80(s,1h),7.46(dd,j=14.4,7.1hz,2h),7.41(d,j=8.9hz,3h),7.39
–
7.35(m,2h),7.33(d,j=7.7hz,2h),7.17
–
7.08(m,2h),图谱见图21。
[0132]
13
c nmr(126mhz,cdcl3):δ188.93,166.54,164.52,144.33,143.56,140.01,134.45,134.43,133.08,131.15,131.08,130.71,130.15,129.83,128.40,127.71,127.68,127.13,123.11,115.74,115.57,图谱见图22。
[0133]
化合物6f的表征数据如下:
[0134]1h nmr(500mhz,cdcl3):δ8.80(d,j=8.4hz,1h),8.76(d,j=8.4hz,1h),8.09(d,j=8.3hz,1h),8.01(d,j=5.8hz,1h),8.00(d,j=5.7hz,1h),7.93(d,j=7.9hz,1h),7.85(d,j=12.5hz,1h),7.79(t,j=7.7hz,1h),7.74(t,j=7.6hz,1h),7.68(t,j=7.4hz,1h),7.62(t,j=7.6hz,1h),7.17(t,j=8.1hz,2h),图谱见图23。
[0135]
13
c nmr(126mhz,cdcl3):δ196.34(s),167.02(s),164.98(s),135.16(s),134.57(s),134.55(s),133.10(s),133.03(s),131.32(s),130.65(s),130.05(s),129.51(s),129.22(s),128.93(s),128.41(s),127.28(s),127.23(s),126.52(s),123.03(s),122.75(s),115.83(s),115.65(s),图谱见图24。
[0136]
实施例7
[0137]
一种菲衍生物的制备方法,具体步骤如下:
[0138]
1)称取1.0mmol化合物3(制备方法同实施例1)、2.2mmol对三氟甲基苯乙酮(化合物4g)、0.2mmol k3po4·
3h2o放入25ml烧瓶中,随后倒入10ml乙醇,室温下搅拌反应12小时,随后向反应液中加入适量二氯甲烷溶解产物,用水萃取收集有机相,减压蒸馏除去溶剂,将所得粗产物以柱色谱法分离、干燥得化合物5g;
[0139][0140]
2)将352mg化合物5g(1.0mmol)加入到敞口反应瓶中,向反应瓶中加入10 ml氯苯,加入381 mg dbu(2.5 mmol),通入空气,将反应瓶置于40w紫光灯下室温搅拌8h,tlc点板追
踪反应完全,随后向反应液中加入适量二氯甲烷溶解产物,将混合液以水萃取收集有机相,向有机相中加入硅胶粉并减压旋蒸除去溶剂得到粗产物,将所得粗产物以柱层析方法分离、干燥得到化合物6g(275mg,产率78%)。
[0141][0142]
化合物5g的表征数据如下:
[0143]1h nmr(500mhz,cdcl3):δ8.04(t,j=11.9hz,2h),7.90(dd,j=23.4,8.5hz,1h),7.85(s,1h),7.74(d,j=7.9hz,2h),7.52(t,j=7.4hz,1h),7.49(s,1h),7.48
–
7.44(m,3h),7.43(d,j=8.6hz,1h),7.39(d,j=16.9hz,1h),7.37
–
7.31(m,2h),图谱见图25。
[0144]
13
c nmr(126mhz,cdcl3):δ189.81,145.48,143.76,140.99,139.91,132.81,130.76,130.46,129.82,128.79,128.43,127.79,127.76,127.18,125.63,125.60,125.57,125.54,123.05,图谱见图26。
[0145]
化合物6g的表征数据如下:
[0146]1h nmr(500mhz,cdcl3):δ8.81(d,j=8.4hz,1h),8.77(d,j=8.4hz,1h),8.17(d,j=8.2hz,1h),8.07(d,j=8.0hz,2h),7.93(d,j=7.9hz,1h),7.88(s,1h),7.83
–
7.79(m,1h),7.78(d,j=7.7hz,2h),7.75(d,j=8.1hz,1h),7.69(t,j=7.4hz,1h),7.64(t,j=7.6hz,1h),图谱见图27。
[0147]
13
c nmr(126mhz,cdcl3):δ196.69,141.21,134.38,131.61,130.73,130.63,130.20,129.87,129.70,129.06,128.81,127.46,127.33,126.47,125.63,125.60,123.09,122.80,图谱见图28。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1