两种甲基取代的2-氧代-3-环戊烯-1-羧酸酯化合物的制法及制备用二羧酸酯化合物的制作方法
1.本发明涉及分别由3,3-二甲基-1-丁烯-1,4-二羧酸酯化合物和1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物制备5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物的方法。本发明还涉及1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物。
背景技术:
2.5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物是合成具有5元环的生物活性物质和信息素的有用中间体。例如,α-食尸醇基(necrodyl)化合物,即具有(3,4,5,5-四甲基-2-环戊烯基)甲基基团的一组化合物,和γ-食尸醇基化合物,即具有(2,2,3,4-四甲基-3-环戊烯基)甲基基团的一组化合物作为生物活性物质自然存在。这些化合物可源自3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物。具体而言,3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物是用于合成以下物质的有用的中间体:(1rs,4rs)-(3,4,5,5-四甲基-2-环戊烯基)异丁酸甲酯,其是葡萄粉蚧(学名:葡萄粉虱(pseudococcus maritimus))的性信息素,和(2,2,3,4-四甲基-3-环戊烯基)异丁酸甲酯,其是球状粉蚧(学名:柑橘堆蜡粉蚧(nipaecoccus viridis))的性信息素(以下列出的非专利文献1和2)。
3.为制备5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物,报道了4,4-二甲基环戊烯-2-烯-1-酮与碱反应生成烯醇化物,再与氰甲酸甲酯反应得到5,5-二甲基-2-氧代-3-环戊烯-1-羧酸甲酯(以下列出的非专利文献3)。
4.现有技术列表
5.[非专利文献1]j.g.millar et al.,j.agric.foodchem.,2010,58,4977-4982。
[0006]
[非专利文献2]a.levi-zada et al.,j.chem.ecol.,2019,45,455-463。
[0007]
[非专利文献3]j.richers et al.,chem.eur.j.,2017,23,3178-3183。
技术实现要素:
[0008]
如上所述,如richers等人在非专利文献3中所述,已知制备5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物的方法。然而,在非专利文献3中,4,4-二甲基-2-环戊烯-1-酮的甲氧基羰基化在-78℃进行,因此需要用于低温反应的特殊设备。在该方法中,所制备的烯醇化物与氰甲酸甲酯的反应中所需的c-甲氧基羰基化与不需要的o-甲氧基羰基化竞争,因此可能无法以高收率获得目标化合物。此外,有害的氰化物离子由等量的氰甲酸甲酯形成,因此需要仔细的后处理。因此,考虑到安全性,该方法是不利的。
[0009]
在这些情况下完成了本发明,目的是在不使用低温反应设备的条件下,安全且高收率地提供5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物。
[0010]
经过深入研究,本发明人发现,3,3-二甲基-1-丁烯-1,4-二羧酸酯化合物与碱的狄克曼缩合以高收率得到5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物,并从而完成本发明。
[0011]
作为深入研究的另一个结果,本发明人还发现1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物与碱的狄克曼缩合以高收率得到3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物,并从而完成本发明。
[0012]
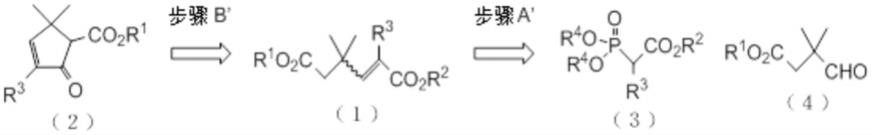
根据本发明的一个方面,提供一种用于制备以下通式(2)的化合物的方法:
[0013][0014]
其中r1表示具有1至10个碳原子的一价烃基,且r3表示氢原子或甲基基团,
[0015]
所述方法包括:
[0016]
使以下通式(1)的化合物:
[0017][0018]
其中r1表示具有1至10个碳原子的一价烃基,r2表示具有1至10个碳原子的一价烃基,r3如上限定,并且波浪键表示e-构型、z-构型或其混合物,
[0019]
在碱的存在下进行狄克曼缩合反应以形成化合物(2)。
[0020]
根据本发明的另一个方面,前述用于制备化合物(2)的方法还包括:
[0021]
使由以下通式(3)的膦酸酯化合物生成的膦酸根阴离子:
[0022][0023]
其中r2和r3如上限定,且r4表示具有1至10个碳原子的一价烃基或卤代烷基基团,
[0024]
与以下通式(4)的醛化合物进行霍纳尔-沃兹沃思-埃蒙斯反应:
[0025][0026]
其中r1如上限定,
[0027]
以形成化合物(1)。
[0028]
根据本发明的另一个方面,还提供一种以下通式(5)的1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物:
[0029]
[0030]
其中r1和r2彼此独立地表示具有1至10个碳原子的一价烃基,r3表示氢原子或甲基基团,且波浪键表示e-构型、z-构型或其混合物。
[0031]
本发明提供3,3-二甲基-1-丁烯-1,4-二羧酸酯化合物和1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物,它们分别用作制备5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物的中间体。根据本发明,5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物以高收率制备,不形成有害副产物并且不需要低温反应设备。令人惊讶的是,目标化合物可由(e)-3,3-二甲基-1-丁烯-1,4-二羧酸酯化合物和(e)-1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物聚敛性(convergently)生产,从而以高收率获得5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物。
具体实施方式
[0032]
下面将详细描述本发明的实施方式。应当理解,本发明不限于这些实施方式或者不受这些实施方式的限制。在本说明书中由化学式表示的中间体、试剂和目标化合物可具有一些立体异构体。除非另有说明,每个化学式应解释为代表所有可能的异构体。异构体可以单独使用,或组合使用。
[0033]
a.下文将首先描述在根据本发明的方法中制备的5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物。
[0034]
5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物由以下通式(2)综合表示,且5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物可以在下文中简称为“化合物(2)”。
[0035][0036]
通式(2)中的r1表示具有1至10个碳原子、优选1至4个碳原子的一价烃基。
[0037]
r1的一价烃基的实例包括直链饱和烃基,如甲基基团、乙基基团、正丙基基团、正丁基基团、正戊基基团、正己基基团、正庚基基团、正辛基基团、正壬基基团和正癸基基团;支链饱和烃基,如异丙基基团、2-甲基丁基基团和叔丁基基团;环状饱和烃基,如环丙基基团、环丁基基团、环戊基基团、环己基基团和环戊基甲基基团;直链不饱和烃基,如乙烯基基团、烯丙基基团和乙炔基基团;支链不饱和烃基,如异丙烯基基团和2-甲基-2-丙烯基基团;环状不饱和烃基,如苯基基团、甲苯基基团、二甲基苯基基团、苄基基团和苯乙基基团;及其异构体。烃基中的一部分氢原子可被具有1至9个碳原子的一价烃基取代。
[0038]
通式(2)中的r3表示氢原子或甲基基团。r3是氢原子时,通式(2)表示5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物。r3是甲基基团时,通式(2)表示3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物。
[0039]
化合物(2)的具体实例包括5,5-二甲基-2-氧代-3-环戊烯-1羧酸酯化合物,如5,5-二甲基-2-氧代-3-环戊烯-1-羧酸甲酯、5,5-二甲基-2-氧代-3-环戊烯-1-羧酸乙酯、5,
5-二甲基-2-氧代-3-环戊烯-1-羧酸叔丁酯和5,5-二甲基-2-氧代-3-环戊烯-1-羧酸苯酯;以及3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物,如3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸甲酯、3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸乙酯、3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸叔丁酯和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸苯酯。
[0040]
b.接下来,下文将描述根据本发明的用于制备化合物(2)的方法。
[0041]
本发明人已考虑了化合物(2)的合成计划,如下所述。
[0042][0043]
在逆合成分析的反应式中,开放箭头表示逆合成分析中的转化。除非本文另有特别说明,化学结构中的波浪键表示e-构型、z-构型或其混合物。
[0044]
步骤b’本发明的目标化合物,化合物(2),即5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物,据认为是通过使化合物(1),即3,3-二甲基-1-丁烯-1,4-二羧酸酯化合物和1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物在碱的存在下进行狄克曼缩合反应而合成。5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物以下简称为“化合物(1)”。化合物(1)的优选几何异构体被认为是z-构型,因为z-构型适合于成环,也就是,在双键的同一侧存在两个将在成环时键合的碳原子。
[0045][0046]
在上面的公式中,箭头表示两个碳原子将新键合的位置。
[0047]
步骤a’目标化合物,化合物(1)被认为是在由上述反应式中所示的通式(3)的膦酸酯化合物生成的膦酸根阴离子与上述反应式中所示的通式(4)的醛化合物之间的霍纳尔-沃兹沃思-埃蒙斯反应(以下也称为“hwe反应”)中合成的。
[0048]
考虑到上述逆合成分析,本发明实施方式的反应式如下。
(5)的(z)-1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物、以下通式(e)-(5)的(e)-1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物,以及两者。
[0060][0061]
1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物(5)可通过下述hwe反应合成。
[0062]
化合物(2)可通过在溶剂中碱的存在下使化合物(1)反应来合成。
[0063]
用于制备化合物(2)的碱的实例包括金属醇盐,例如叔丁醇钠、叔丁醇钾、甲醇钠、甲醇钾、乙醇钠和乙醇钾;烷基锂,如正丁基锂和叔丁基锂;金属氢化物,如氢化锂、氢化钠和氢化钾;金属乙酰化物,如乙酰化锂和乙酰化钠;金属氨基化合物,如二异丙基氨基锂和双(三甲基甲硅烷基)氨基钠;以及胺类,如1,8-二氮杂二环[5.4.0]-7-十一烯、1,5-二氮杂二环[4.3.0]-5-壬烯和n,n-二异丙基乙胺。考虑到反应性,优选金属醇盐,如叔丁醇钠、叔丁醇钾、甲醇钠和乙醇钠。
[0064]
考虑到反应性,相对于每mol的化合物(1),所用碱的量优选为1.0至5.0mol,更优选1.0至3.0mol。
[0065]
制备化合物(2)时所用溶剂的实例包括醚溶剂,如四氢呋喃、4-甲基四氢吡喃、乙醚和叔丁基甲醚;烃溶剂,如甲苯、二甲苯和己烷;以及极性溶剂,如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、乙腈、二氯甲烷和氯仿。考虑到反应性,优选醚溶剂如四氢呋喃等和烃溶剂如甲苯。
[0066]
如有必要,溶剂可以单独使用或组合使用。考虑到反应性和溶解度,优选四氢呋喃和甲苯的混合溶剂。溶剂可以是市售品。
[0067]
所用溶剂的量根据生产规模而变化,考虑到反应速率,相对于每mol的化合物(1),优选为200g至4,000g。
[0068]
制备化合物(2)的反应温度根据所用溶剂的不同而变化,考虑到反应性和异构化速率,反应温度优选为0℃至150℃,更优选30℃至80℃。
[0069]
制备化合物(2)的反应时间根据要使用的溶剂和/或反应规模而变化,优选为0.1至20小时。
[0070]
在制备化合物(2)的实施方式中,如以下化学反应式所示,以下通式(6)的3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物(即r3是甲基基团的化合物(2))可以通过使以下通式(5)的1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物(5)(z/e=94:6)(即r3是甲基基团的化合物(1))在碱的存在下进行狄克曼缩合来合成。1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物(5)通过下述z-选择性hwe反应来合成。
[0071]
[0072]
预计狄克曼缩合不会以e-构型(e)-1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物((e)-(5))进行。令人惊讶的是,已发现e-构型经历狄克曼缩合以聚敛性提供目标化合物3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物(6)。为了验证这一现象,使富含e-构型的1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物(5)(z/e=33:67)进行缩合反应从而发现目标化合物3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物(6)是由e-构型产生的。由于这一发现,不必以z-选择性方式进行hwe反应,并且可以更有效地合成3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物(6)。
[0073]
在制备化合物(2)的另一个实施方式中,如以下化学反应式所示,以下通式(9)的5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物(即r3是氢原子的化合物(2))可通过使以下通式(8)的4,4-二甲基-2-己烯二羧酸酯化合物(r3是氢原子的化合物)在碱的存在下进行狄克曼缩合来合成。
[0074][0075]
在前述缩合反应中,除目标化合物5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物外,还可形成以下通式(11)的不是目标化合物的3,3-二甲基-5-氧代-1-环戊烯-1-羧酸酯化合物。
[0076][0077]
这可能是因为发生了以下反应方案。
[0078][0079]
在该方案中,向右鱼叉在向左鱼叉上表示可逆平衡;r1和r2如化合物(1)中所限定;r表示烷基基团;且m
+
表示阳离子部分。
[0080]
在该方案中,碱ro-m
+
连接于3,3-二甲基-1-丁烯-1,4-二羧酸酯化合物(8)的共轭双键并从其离开,从而使该双键异构化以促进z-构型的狄克曼缩合,因此形成目标化合物5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物(9)(路线a)。
[0081]
同时,当碱ro-m
+
连接至3,3-二甲基-1-丁烯-1,4-二羧酸酯化合物(8)的共轭双键后,所得烯醇化物中的羰基碳原子被攻击以形成环戊酮化合物(路线b);该环戊酮化合物中
的or基团被消除从而形成不是目标化合物的3,3-二甲基-5-氧代-1-环戊烯-1-羧酸酯化合物(11)。
[0082]
如上所述,当通式(1)中的r3是氢原子(即,3,3-二甲基-1-丁烯-1,4-二羧酸酯化合物(8)的情况)时,除了路线a中设想的反应外,还发生了副反应路线b。
[0083]
另一方面,当通式(1)中的r3是甲基基团(即,1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物(5)的情况)时,所得环戊酮化合物在夹在酮基和酯基之间的碳原子上没有氢原子,因此,or基团不会离去,也不会发生平衡,这与上述方案中所示的平衡z不同。根据上述推测理论,出现路径a主要是为了提供其产物。
[0084]
因此,根据本发明的方法特别适用于通式(1)的化合物,其中r3是甲基基团(即,1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物(5))。当3,3-二甲基-1-丁烯-1,4-二羧酸酯化合物(8)以较大比例包含它的e构型时,不需要的3,3-二甲基-5-氧基-1-环戊烯-1-羧酸酯化合物(11)出现的比例较大,反之亦然。因此,当通式(1)中的r3是氢原子时,优选使用富z构型的3,3-二甲基-1-丁烯-1,4-二羧酸酯化合物(8)。
[0085]
[2]步骤a
[0086]
接下来,将描述其中合成化合物(1)的步骤a。如以下化学反应式所示,化合物(1)通过源自膦酸酯化合物(3)的膦酸根阴离子与醛化合物(4)之间的hwe反应获得。
[0087][0088]
通式(3)中的r2如通式(1)中限定。
[0089]
通式(3)中的r3如通式(2)中限定。通式(3)中的r4表示具有1至10、优选1至6个碳原子的一价烃基或卤代烷基基团。
[0090]
r4的一价烃基的实例包括直链饱和烃基,如甲基基团、乙基基团、正丙基基团、正丁基基团、正戊基基团、正己基基团、正庚基基团、正辛基基团、正壬基基团和正癸基基团;支链饱和烃基,如异丙基基团、2-甲基丁基基团和叔丁基基团;环状饱和烃基,如环丙基基团、环丁基基团、环戊基基团、环己基基团和环戊基甲基基团;直链不饱和烃基,如乙烯基基团、烯丙基基团和乙炔基基团;支链不饱和烃基,如异丙烯基基团和2-甲基-2-丙烯基基团;环状不饱和烃基,如苯基基团、甲苯基基团、二甲基苯基基团、苄基基团和苯乙基基团;及其异构体。烃基中的一部分氢原子可被具有1至9个碳原子的一价烃基取代。
[0091]
r4的一价卤代烷基基团的实例包括卤代烷基基团,如三氟乙基基团,其用于still-gennari法和其他能够进行z-选择性hwe反应的方法。
[0092]
膦酸酯化合物(3)的实例包括2-膦酰基丙酸酯化合物,如2-膦酰基丙酸三乙酯和2-(二苯基膦酰基)丙酸乙酯;膦酰基乙酸酯化合物,如膦酰基乙酸三乙酯和二苯基膦酰基乙酸乙酯;以及用于still-gennari法的膦酸酯化合物,如双(2,2,2-三氟乙基)(甲氧基羰基甲基)膦酸酯。
[0093]
膦酸酯化合物(3)可以是市售品或可内部合成。例如,可通过使卤代烷基和亚磷酸
酯进行arbuzov反应来合成该化合物。
[0094]
醛化合物(4)中的r1与通式(1)中限定的r1相同。
[0095]
醛化合物(4)的实例包括3,3-二甲基-4-氧代丁酸酯化合物,如3,3-二甲基-4-氧代丁酸甲酯、3,3-二甲基-4-氧代丁酸乙酯、3,3-二甲基-4-氧代丁酸叔丁酯和3,3-二甲基-4-氧代丁酸苯酯。
[0096]
醛化合物(4)可以是市售品或可内部合成。该化合物可在任何已知方法中合成或通过使源自异丁醛的烯胺与卤乙酸酯反应来合成。
[0097]
化合物(1)可通过使膦酸酯化合物(3)在碱的存在下在溶剂中反应形成膦酸根阴离子,膦酸根阴离子与醛化合物(4)进行霍纳尔-沃兹沃思-埃蒙斯反应来合成。
[0098]
形成膦酸根阴离子中使用的碱的实例包括金属醇盐,例如叔丁醇钠、叔丁醇钾、甲醇钠、甲醇钾、乙醇钠和乙醇钾;烷基锂,如正丁基锂和叔丁基锂;金属氢化物,如氢化锂、氢化钠和氢化钾;金属乙酰化物,如乙酰化锂和乙酰化钠;金属氨基化合物,如二异丙基氨基锂和双(三甲基甲硅烷基)氨基钠;以及胺类,如1,8-二氮杂二环[5.4.0]-7-十一烯、1,5-二氮杂二环[4.3.0]-5-壬烯和n,n-二异丙基乙胺。考虑到抑制副产物形成,优选金属氢化物,如氢化钠,和金属乙酰化物,如乙酰化锂和乙酰化钠。
[0099]
如有必要,碱可以单独使用或组合使用。碱可以是市售品。
[0100]
考虑到反应性和抑制副产物形成,相对于每mol的膦酸酯化合物(3),使用的碱的量优选为0.8mol至1.3mol。
[0101]
如有必要,制备膦酸根阴离子中可以加入碱金属卤化物如氯化锂或碘化钠。
[0102]
考虑到反应性和成本,相对于每mol的膦酸酯化合物(3),使用的碱金属卤化物的量优选为0.01mol至1.3mol。
[0103]
形成膦酸根阴离子的溶剂的实例包括醚溶剂,如四氢呋喃、4-甲基四氢呋喃、乙醚和甲基叔丁基醚;烃溶剂,如甲苯、二甲苯和己烷;极性溶剂,如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、乙腈、二氯甲烷和氯仿。特别优选在hwe反应中广泛使用的四氢呋喃、乙腈、n,n-二甲基甲酰胺和n,n-二甲基乙酰胺。烃溶剂也是优选的,因为用作碱的乙炔钠溶解在二甲苯中。
[0104]
如有必要,溶剂可单独使用或组合使用。考虑到反应性和溶解度,优选四氢呋喃和二甲苯的混合溶剂。溶剂可以是市售品。
[0105]
所用溶剂的量根据生产规模而变化,考虑到反应速率,相对于每mol的膦酸酯化合物(3),优选为200g至4,000g。
[0106]
膦酸根阴离子形成的反应温度根据要使用的溶剂而变化,考虑到反应性和抑制副产物的形成,优选为-78℃至150℃、更优选0℃至80℃。
[0107]
膦酸根阴离子形成的反应时间根据要使用的溶剂和/或反应规模而变化,且优选为0.1小时至20小时。
[0108]
考虑到反应性和成本,相对于每mol的膦酸酯化合物(3),hwe反应中使用的醛化合物(4)的量优选为0.7mol至1.3mol。
[0109]
hwe反应中使用的溶剂和溶剂的量可与形成膦酸根阴离子中使用的溶剂和溶剂的量相同或不同。
[0110]
hwe反应的反应温度根据要使用的溶剂而变化,考虑到反应性和抑制副产物的形
成,优选为-78℃至150℃、更优选0℃至80℃。
[0111]
hwe反应的反应时间根据要使用的溶剂和/或反应规模而变化,且优选为0.1小时至20小时。
[0112]
如果由于hwe反应产物与起始膦酸酯化合物(3)或醛化合物(4)之间的极性或沸点相似而难以纯化hwe反应产物,可在反应后添加与反应中使用的不同的另一或其他膦酸酯化合物和/或另一或其他醛化合物以消耗过量起始材料。
[0113]
用于消耗过量起始材料的另一或其他膦酸酯化合物的实例包括膦酰基乙酸酯,例如2-膦酰基丙酸三乙酯和膦酰基乙酸三乙酯。用于消耗过量起始材料的另一或其它醛化合物的实例包括低级醛,例如甲醛、乙醛、丙酰醛、丁醛和异丁醛;以及高级醛,如癸醛、十一醛和十二醛。
[0114]
考虑到反应性和成本,相对于每mol的膦酸酯化合物(3),所使用的另一或其他膦酸酯化合物和另一或其他醛化合物的量优选为0.01mol至0.5mol。
[0115]
z-选择性hwe反应的一个具体实例是下述情况:其中通式(3)中r2是乙基基团,r3是甲基基团,且r4是苯基基团,通式(4)中r1是乙基基团,如以下化学反应式所示。
[0116][0117]
产生z-构型和e-构型混合物的hwe反应的一个具体实例是下述情况:其中通式(3)中r2和r4是乙基基团,r3是甲基基团,通式(4)中r1是乙基基团,如以下化学反应式所示。
[0118][0119]
作为用于制备3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物的化合物(1)的1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物(5),例如可通过由2-膦酰基丙酸酯化合物形成的膦酸根阴离子与3,3-二甲基-4-氧代丁酸酯化合物之间的hwe反应来合成。
[0120]
因此,提供了制备3,3-二甲基-1-丁烯-1,4-二羧酸酯和1,3,3-三甲基-1-丁烯-1,4-二羧酸酯化合物的方法,它们是用于合成5,5-二甲基-2-氧代-3-环戊烯-1-羧酸酯化合物和3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸酯化合物的有用中间体,每种都有很高的收率。
[0121]
实施例
[0122]
将参考以下实施例来描述本发明。应当理解,本发明不限于这些实施例或者不受这些实施例的限制。
[0123]
除非另有规定,本文中使用的术语“纯度”是指气相色谱法(以下也称为“gc”)确定的面积百分比。术语“产量比”是指通过gc确定的面积百分比的相对比率。
[0124]
收率由通过gc确定的面积百分比计算。
[0125]
考虑到起始材料和产品的纯度(%gc),根据以下等式计算收率。
[0126]
收率(%)={[(反应所得产物的质量
×
%gc)/产物的分子量]
÷
[(起始材料的质量
×
%gc)/起始材料的分子量]}
×
100。
[0127]
术语“粗收率”是指未经纯化获得的粗产物的收率。
[0128]
在实施例中,反应的监测和收率的计算在以下gc条件下进行。
[0129]
gc条件:毛细管气相色谱仪gc-2014(shimadzu corporation);柱:db-5,0.25μm
×
0.25mmφ
×
30m;载气:he(1.55ml/min),检测器:fid;柱温:100℃,以10℃/min的速率升高,最高至230℃。
[0130]
实施例1:制备1,3,3-三甲基-1-丁烯-1,4-二羧酸二乙酯(5:r1=r2=et;1:r1=r2=et,r3=me)
[0131][0132]
其中ph表示苯基基团,并且et表示乙基基团。
[0133]
将2-(二苯氧基氧膦基)丙酸乙酯(139g,0.415mol)(3:r2=et;r3=me;r4=ph)和四氢呋喃(thf)(1,452g)置于反应器中并在搅拌的同时冷却至4℃至6℃。然后加入碘化钠(nai)(99.5g,0.664mol),随后在4℃至9℃滴加1,8-二氮杂二环[5.4.0]-7-十一烯(dbu)(94.8g,0.622mol)。滴加完成后,将混合物在4℃至9℃搅拌30分钟,然后在4℃至9℃向其中滴加3,3-二甲基-4-氧代丁酸乙酯(4:r1=et)(140g,0.887mol)。滴加完成后,将混合物在57℃至62℃搅拌8小时,冷却至4℃至6℃。加入氯化铵水溶液(804g:由氯化铵(78g)和水(871g)制备)以淬灭反应,随后加入乙酸乙酯(871g)。对所得反应混合物进行相分离。然后将所得有机层用盐水(1,260g:由氯化钠(60g)和水(1,200g)制备)洗涤。将有机层在减压条件下浓缩,并将浓缩物在减压条件下蒸馏以获得1,3,3-三甲基-1-丁烯-1,4-二羧酸二乙酯(5:r1=r2=et)(70.5g,0.291mol;z/e=94:6),收率为70.2%。
[0134]
以下是由此制备的(z)-1,3,3-三甲基-1-丁烯-1,4-二羧酸二乙酯(5:r1=r2=et)的谱数据。
[0135]
核磁共振波谱:1h-nmr(500mhz,cdcl3):δ1.19(s,6h),1.23(t,j=7.3hz,3h),1.30(t,j=7.3hz,3h),1.90(d,j=1.5hz,3h),2.46(s,2h),4.10(q,j=7.3hz,2h),4.19(q,j=7.3hz,2h),5.62(q,j=1.5hz,1h);
13
c-nmr(75.6mhz,cdcl3):δ14.07,14.24,22.58,27.73(2c),35.37,47.02,59.98,60.52,127.43,141.39,170.33,171.74。
[0136]
质谱:ei-质谱(70ev):m/z 242(m
+
),227,196,181,168,155,139,127,109,95,81,67,55,41,29。
[0137]
红外吸收光谱(nacl):νmax 2980,1731,1452,1369,1342,1322,1246,1204,1100,1036,919,866,775。
[0138]
以下是由此制备的(e)-1,3,3-三甲基-1-丁烯-1,4-二羧酸二乙酯的谱数据。
[0139]
核磁共振波谱:1h-nmr(500mhz,cdcl3):δ1.21(t,j=7.3hz,3h),1.27(t,j=7.3hz,3h),1.28(s,6h),1.94(d,j=1.5hz,3h),2.45(s,2h),4.09(q,j=7.3hz,2h),4.16(q,j=7.3hz,2h),6.83(q,j=1.5hz,1h);
13
c-nmr(75.6mhz,cdcl3):δ13.44,14.21(2c),27.93(2c),35.26,46.93,60.11,60.62,127.42,148.29,168.88,171.27。
[0140]
质谱:ei-质谱(70ev):m/z 242(m
+
),227,196,181,168,155,139,127,109,95,81,67,55,41,29。
[0141]
红外吸收光谱(nacl):νmax 2980,1731,1452,1369,1342,1322,1246,1204,1100,1036,919,866,775。
[0142]
实施例2:制备1,3,3-三甲基-1-丁烯-1,4-二羧酸二乙酯(5:r1=r2=et;1:r1=r2=et,r3=me)
[0143][0144]
其中et表示乙基基团。
[0145]
将0.00476mol/g乙炔钠在二甲苯(214g,1.02mol)中的溶液和thf(1,325g)置于反应器中,并在搅拌的同时冷却至4℃至6℃。然后在4℃至9℃滴加2-膦酰基丙酸三乙酯(3:r2=r4=et;r3=me)(242g,1.02mol)。滴加完成后,将混合物加热至62℃至67℃。随后,在62℃至67℃滴加3,3-二甲基-4-氧代丁酸乙酯(4:r1=et)(140g,0.887mol)。滴加完成后,将混合物在62℃至67℃搅拌1.5小时。然后将混合物冷却至37℃至42℃,随后向其中加入异丁醛(25.5g,0.353mol)、碘化钠(66.2g,0.441mol)和1,8-二氮杂二环[5.4.0]-7-十一烯(53.8g,0.353mol),并在37℃至42℃搅拌1.5小时。然后将混合物冷却至4℃至6℃,加入氯化铵水溶液(939g:由氯化铵(85g)和水(854g)制备)以淬灭反应。随后加入己烷(887g)。对所得反应混合物进行相分离。然后,将所得有机层用氯化铵水溶液(1,450g,由氯化铵(85g)、氯化钠(33g)和水(1,332g)制备)洗涤,然后用盐水(1,399g:由氯化钠(67g)和水(1,332g)制备)洗涤。将有机层在减压条件下浓缩,并将浓缩物在减压条件下蒸馏以获得1,3,3-三甲基-1-丁烯-1,4-二羧酸二乙酯(5:r1=r2=et)(177g,0.731mol;z/e=39:61),收率为82.4%。
[0146]
由此制备的1,3,3-三甲基-1-丁烯-1,4-二羧酸二乙酯(5:r1=r2=et)的各种谱数据与实施例1中获得的相同。
[0147]
实施例3:制备3,3-二甲基-1-丁烯-1,4-二羧酸二乙酯(8:r1=r2=et;1:r1=r2=et,r3=h)
[0148][0149]
其中ph和et如上限定。
[0150]
将二苯基膦酰基乙酸乙酯(3:r2=et;r3=h;r4=ph)(52.1g,0.163mol)和thf(455g)置于反应器中,并在搅拌的同时冷却至4℃至6℃。然后加入碘化钠(39.0g,
0.260mol),随后在4℃至9℃滴加1,8-二氮杂二环[5.4.0]-7-十一烯(37.1g,0.244mol)。滴加完成后,将混合物在4℃至9℃搅拌30分钟,然后在4℃至9℃滴加3,3-二甲基-4-氧代丁酸乙酯(4:r1=et)(28.3g,0.179mol)。滴加完成后,将混合物在室温搅拌4小时,并冷却至4℃至6℃。然后加入氯化铵水溶液(358g:由氯化铵(31g)和水(327g)制备)以淬灭反应,然后加入己烷(365g)。对所得反应混合物进行相分离。然后将所得有机层用盐水(414g:由氯化钠(20g)和水(394g)制备)洗涤。将有机层在减压条件下浓缩,并将浓缩物在减压条件下蒸馏以获得3,3-二甲基-1-丁烯-1,4-二羧酸二乙酯(8:r1=r2=et)(31.9g,0.140mol;z/e=78:22),收率为86.0%。
[0151]
以下是由此制备的(z)-3,3-三甲基-1-丁烯-1,4-二羧酸二乙酯(8:r1=r2=et)的谱数据。
[0152]
核磁共振波谱:1h-nmr(500mhz,cdcl3):δ1.23(t,j=7.3hz,3h),1.28(t,j=7.3hz,3h),1.30(s,6h),2.72(s,2h),4.09(q,j=7.3hz,2h),4.15(q,j=7.3hz,2h),5.71(d,j=13.0hz,1h),6.16(d,j=13.0hz,1h);
13
c-nmr(75.6mhz,cdcl3):δ14.13,14.21,27.89(2c),35.60,46.01,60.00,60.16,119.41,154.29,166.23,171.97。
[0153]
质谱:ei-质谱(70ev):m/z 228(m
+
),213,199,183,167,154,141,126,109,95,81,67,55,41,29。
[0154]
红外吸收光谱(nacl):νmax 2980,2875,1731,1650,1466,1368,1305,1178,1035,982,864,722。
[0155]
以下是由此制备的(e)-3,3-三甲基-1-丁烯-1,4-二羧酸二乙酯的谱数据。
[0156]
核磁共振波谱:1h-nmr(500mhz,cdcl3):δ1.18(s,6h),1.23(t,j=7.3hz,3h),1.28(t,j=7.3hz,3h),2.35(s,2h),4.10(q,j=7.3hz,2h),4.18(q,j=7.3hz,2h),5.76(d,j=16.1hz,1h),7.00(d,j=16.1hz,1h);
13
c-nmr(75.6mhz,cdcl3):δ14.19,14.21,26.53(2c),35.99,46.17,60.23,60.29,118.11,156.06,166.89,170.95。
[0157]
质谱:ei-质谱(70ev):m/z 228(m
+
),213,199,183,167,154,141,126,109,95,81,67,55,41,29。
[0158]
红外吸收光谱(nacl):νmax 2980,2875,1731,1650,1466,1368,1305,1178,1035,982,864,722。
[0159]
实施例4:制备(e)5-乙氧基羰基-4,4-二甲基-2-戊烯酸叔丁酯(8:r1=et,r2=
t
bu;1:r1=et,r2=
t
bu,r3=h)
[0160][0161]
其中
t
bu表示叔丁基基团,et表示乙基基团。
[0162]
将0.00476mol/g乙炔钠在二甲苯(43.5g,0.207mol)中的溶液和thf(270g)置于反应器中并在搅拌的同时冷却至4℃至6℃。然后在4℃至9℃滴加二乙基膦酰基乙酸叔丁酯(3:r2=
t
bu;r3=h;r4=et)(46.4g,0.207mol)。滴加完成后,将混合物加热至62℃至67℃,然后在62℃至67℃滴加3,3-二甲基-4-氧代丁酸乙酯(4:r1=et)(28.5g,0.180mol)。滴加完成后,将混合物在62℃至67℃搅拌5小时。然后将混合物冷却至4℃至6℃,加入氯化铵水
溶液(190g:
[0163]
由氯化铵(17g)和水(173g)制备)以淬灭反应。对所得反应混合物进行相分离。将所得有机层用氯化铵水溶液(294g:由氯化铵(17g)、氯化钠(7g)和水(270g)制备)洗涤,然后用盐水(284g:由氯化钠(14g)和水(270g)制备)洗涤。将有机层在减压条件下浓缩,并将浓缩物在减压条件下蒸馏以获得(e)5-乙氧基羰基-4,4-二甲基-2-戊烯酸叔丁酯(8:r1=et;r2=
t
bu)(29.4g,0.115mol),收率为63.7%。
[0164]
以下是由此制备的(e)5-乙氧基羰基-4,4-二甲基-2-戊烯酸叔丁酯(8:r1=et;r2=
t
bu)的谱数据。
[0165]
核磁共振波谱:1h-nmr(500mhz,cdcl3):δ1.16(s,6h),1.21(t,j=7.3hz,3h),1.46(s,9h),2.32(s,2h),4.08(q,j=7.3hz,2h),5.66(d,j=15.7hz,1h),6.87(d,j=15.7hz,1h);
13
c-nmr(75.6mhz,cdcl3):δ14.17,26.55(2c),28.09(3c),35.83,46.17,60.14,80.14,119.72,154.82,166.19,170.97。
[0166]
质谱:ei-质谱(70ev):m/z 256(m
+
),200,183,169,154,137,113,95,81,57,41,27。
[0167]
红外吸收光谱(nacl):νmax 2977,1734,1715,1651,1466,1392,1368,1318,1152,1036,977,865,768,723。
[0168]
实施例5:制备3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸乙酯(6:r1=et;2:r1=et,r3=me)
[0169][0170]
其中et表示乙基基团。
[0171]
将叔丁醇钾(231g,2.00mol)、甲苯(1,000g)和thf(500g)置于反应器中并在室温搅拌20分钟。接下来,在40℃或低于40℃滴加根据实施例2中所述步骤获得的1,3,3-三甲基-1-丁烯-1,4-二羧酸二乙酯(5:r1=r2=et)(242g,1.00mol;z/e=33:67)。滴加完成后,将混合物在65℃至70℃搅拌2小时,并冷却至4℃至10℃。然后,加入3.34重量%的盐酸(2,296g)以淬灭反应,然后对所得反应混合物进行相分离。然后,将所得有机层用水(2,000g)洗涤两次,再用盐水(2,200g:由氯化钠(200g)和水(2,000g)制备)洗涤。将所得有机层在减压条件下浓缩,并将浓缩物在减压条件下蒸馏以获得3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸乙酯(6:r1=et)(171g,0.871mol),收率为87.1%。
[0172]
以下是由此制备的3,5,5-三甲基-2-氧代-3-环戊烯-1-羧酸乙酯(6:r1=et)的谱数据。
[0173]
核磁共振波谱:1h-nmr(500mhz,cdcl3):δ1.15(s,3h),1.27(t,j=7.3hz,3h),1.31(s,3h),1.76(d,j=1.6hz,3h),3.14(s,1h),4.19(q,j=7.3hz,2h),7.04(q,j=1.6hz,1h);
13
c-nmr(75.6mhz,cdcl3):δ9.86,14.22,23.90,29.15,42.44,60.93,62.67,138.34,166.33,169.22,203.61。
[0174]
质谱:ei-质谱(70ev):m/z 196(m
+
),181,168,151,135,123,109,95,79,67,55,39,29。
[0175]
红外吸收光谱(nacl):νmax 2965,2928,2872,1741,1708,1644,1563,1465,1447,1367,1312,1149,1030,997,953,898,641,529。
[0176]
实施例6:制备5,5-二甲基-2-氧代-3-环戊烯-1-羧酸乙酯(9:r1=et;2:r1=et,r3=h)
[0177][0178]
其中et表示乙基基团。
[0179]
将叔丁醇钾(18.2g,0.162mol)、甲苯(80.9g)和thf(40.5g)置于反应器中并在室温搅拌10分钟。接下来,在35℃或低于35℃滴加通过进一步蒸馏根据实施例3中所述步骤获得的3,3-二甲基-1-丁烯-1,4-二羧酸二乙酯的一部分而获得的3,3-二甲基-1-丁烯-1,4-二羧酸二乙酯(8:r1=r2=et)(18.5g,0.0809mol;z/e=81:19)。滴加完成后,将混合物在室温搅拌30分钟,并冷却至4℃至10℃。然后,加入3.34重量%的盐酸(186g)以淬灭反应,对所得反应混合物进行相分离。然后,将所得有机层用水(150g)洗涤两次,再用饱和盐水(150ml)洗涤。将所得有机层在减压条件下浓缩。浓缩物通过硅胶柱色谱法(洗脱剂:正己烷:乙酸乙酯的梯度=20:1至4:1)纯化以获得目标化合物5,5-二甲基-2-氧代-3-环戊烯-1-羧酸乙酯(9:r1=et)(10.4g,0.0573mol),收率为70.8%,和副产物3,3-二甲基-5-氧代-1-环戊烯-1-羧酸乙酯(11:r1=et)(1.27g,0.00698mol),收率为8.6%。
[0180]
以下是由此制备的5,5-二甲基-2-氧代-3-环戊烯-1-羧酸乙酯(9:r1=et)的谱数据。
[0181]
核磁共振波谱:1h-nmr(500mhz,cdcl3):δ1.19(s,3h),1.26(t,j=7.3hz,3h),1.35(s,3h),3.12(s,1h),4.19(q,j=7.3hz,2h),6.05(d,j=5.8hz,1h),7.43(d,j=5.8hz,1h);
13
c-nmr(75.6mhz,cdcl3):δ14.17,23.59,28.86,45.03,61.04,62.48,130.37,168.89,172.50,203.65。
[0182]
在nmr谱中,部分观察到对应于5,5-二甲基-2-氧代-3-环戊烯-1-羧酸乙酯的烯醇形式(酮-烯醇互变异构体)的峰。该谱是针对5,5-二甲基-2-氧代-3-环戊烯-1-羧酸乙酯的酮形式,但也可以看到烯醇形式(即酮-烯醇互变异构体)的一些峰。
[0183]
质谱:ei-质谱(70ev):m/z 182(m
+
),167,154,137,121,109,95,81,65,53,39,29。
[0184]
红外吸收光谱(nacl):νmax 3400,2968,2938,2874,1742,1707,1594,1469,1368,1316,1252,1229,1145,1036,917,814,754,694,517。
[0185]
在红外吸收光谱中还可以看到5,5-二甲基-2-氧代-3-环戊烯-1-羧酸乙酯的烯醇形式的一些吸收。
[0186]
以下是由此制备的3,3-二甲基-5-氧代-1-环戊烯-1-羧酸乙酯(11:r1=et)的谱数据。
[0187]
核磁共振波谱:1h-nmr(500mhz,cdcl3):δ1.26(s,6h),1.32(t,j=7.3hz,3h),2.39(s,2h),4.27(q,j=7.3hz,2h),8.08(s,1h);
13
c-nmr(75.6mhz,cdcl3):δ14.12,27.42(2c),38.82,51.12,60.94,134.03,161.87,179.68,202.47。
[0188]
质谱:ei-质谱(70ev):m/z 182(m
+
),167,154,136,121,110,95,80,69,53,41,29。
[0189]
红外吸收光谱(nacl):νmax 2963,2871,1751,1722,1621,1466,1411,1368,1333,1301,1232,1214,1192,1034,928,767,725,592。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1