一株昆虫蜚蠊肠道内生链霉菌WA5-1-7及其应用
一株昆虫蜚蠊肠道内生链霉菌wa5
‑1‑
7及其应用
技术领域
1.本发明属于微生物技术领域,具体涉及一株昆虫蜚蠊肠道内生链霉菌 wa5
‑1‑
7及其应用。
背景技术:
2.放线菌是发现天然产物和多种活性先导化合物的资源宝库。在放线菌中链 霉菌数量占大部分,从放线菌中发现链霉素等多种抗生素约80%以上来源于链 霉菌。但近年来,陆生和海洋放线菌候选药物的命中率不断下降,这使科学家 的注意力转移到内生放线菌,它们处于特殊的生态位,这可能会成为天然生物 活性物质丰富的资源。昆虫内生菌是栖息在昆虫体内的一类特境微生物,目前 尚未发现无内生菌栖息的昆虫,因此昆虫体内蕴藏着庞大的微生物资源。
3.美洲大蠊(periplaneta americana)俗称“蟑螂”,属节肢动物门昆虫纲有翅 亚纲蜚蠊目,是地球上已知的生命力最顽强、最古老的昆虫类群之一。其在《神 农本草经》、《本草纲目》、《新修本草》等均有入药的记载,性寒、味咸、 归肝、脾、肾经,具有活血散瘀、健脾消疳、利水消肿生肌等功效。现代研究 表明美洲大蠊具有抗菌、抗炎、抗肿瘤、组织修复和增强机体免疫能力等药理 作用。美洲大蠊长期生活在厨房、下水道、垃圾堆等黑暗潮湿存在大量病原微 生物环境中,仍具有极强生命力和繁殖能力,提示美洲大蠊的药理作用以及其 较强的环境适应能力、防御外来病原菌侵染的能力,与其肠道内丰富的微生物 菌群可能存在密切的关系。
技术实现要素:
4.本发明旨在提供一株从美洲大蠊肠道中分离筛选出的内生链霉菌wa5
‑1‑
7 及其应用。
5.为了达到上述目的,本发明采用以下技术方案:
6.本发明的第一个目的是提供了一株昆虫蜚蠊肠道内生链霉菌wa5
‑1‑
7,所 述链霉菌wa5
‑1‑
7为从美洲大蠊肠道中分离、筛选获得的内生菌,保藏于广东 省微生物菌种保藏中心,地址为中国,广东,广东省微生物研究所,保藏菌种 名称为streptomvces sp.wa5
‑1‑
7,分类学名称为streptomvces sp.,保藏编号为 gdmcc no.61630,保藏日期为2021年4月26日,保藏年限为30年。
7.本技术的另一目的是提供一种如上述方案所述链霉菌wa5
‑1‑
7的鉴定方法, 包括以下过程:
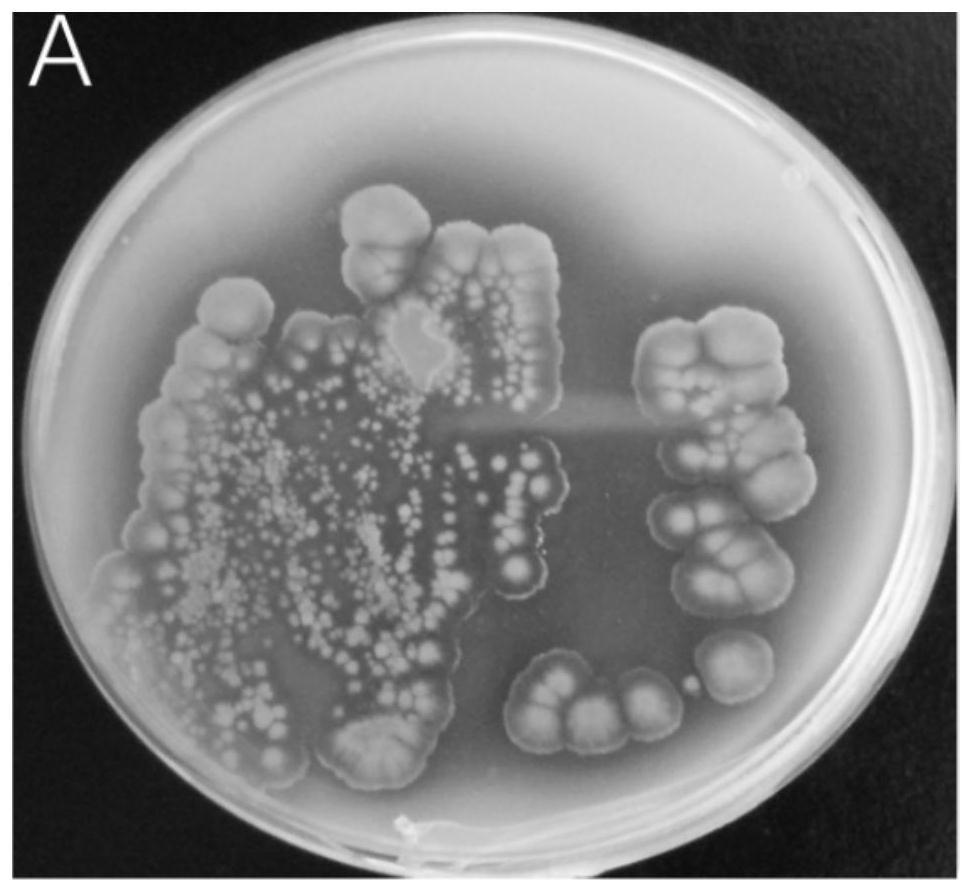
8.(1)从美洲大蠊肠道中分离得到159株放线菌,筛选出具有良好抗白色念 珠菌活性的菌株15株,进一步筛选出抗菌性好的菌株wa5
‑1‑
7;
9.(2)对步骤(1)筛选出的抗菌性好的菌株wa5
‑1‑
7进行形态学观察、分 子生物学鉴定和系统发育树分析方法进行生物学分类鉴定,即可。
10.优选的,步骤(2)中所述形态学观察为对菌株wa5
‑1‑
7在高氏1号培养基 上的生长
形态进行观察,通过革兰氏染色法观察菌株wa5
‑1‑
7的形态,通过扫 描电子显微镜观察菌株wa5
‑1‑
7的形态。
11.优选的,步骤(2)中所述分子生物学鉴定和系统发育树分析过程为:
12.s1、对菌株wa5
‑1‑
7的dna进行提取,选择细菌16s rrna通用引物27f 和引物1492r将所提取的dna进行pcr扩增,获得pcr扩增产物;
13.s2、将步骤s1所得pcr扩增产物进行琼脂糖凝胶电泳检测后,进行测序, 将测序得到的序列提交至ncbi中进行blast同源性比对,同时将序列信息提 交至genbank数据库中,获取菌株wa5
‑1‑
7 16s rrna的登录编号;
14.s3、将菌株wa5
‑1‑
7的16s rrna序列与ncbi中的数据库序列进行blast 同源性比对,选取有效发表的不同种属中的代表性菌株,利用mega5.0软件中 的邻接法对多序列比对结果进行系统发育树分析,判断出菌株wa5
‑1‑
7所属的 种属。
15.优选的,步骤s1中所述引物27f的序列信息如seq id no.1所示,引物1492r的序列信息如seq id no.2所示。
16.27f:5
′‑
agagtttgatcctggctcag
‑3′
(seq id no.1);
17.1492r:5
′‑
tacggctaccttgttacgactt
‑3′
(seq id no.2)。
18.优选的,步骤s2中所述菌株wa5
‑1‑
7 16s rrna测序得到的16s rrna序列 信息如seq id no.3所示。
19.gcttgtccgacgttgcttaccatgcgagtcgtaacatggtagccgtaa ggtggtggattagtggcgaacgggtgagtaacacgtgggcaatctgccct tcactctgggacaagccctggaaacggggtctaataccggataacactct gtcccgcatgggacggggttgaaagctccggcggtgaaggatgagcccgc ggcctatcagcttgttggtggggtaatggcctaccaaggcgacgacgggt agccggcctgagagggcgaccggccacactgggactgagacacggccca gactcctacgggaggcagcagtggggaatattgcacaatgggcgaaagcc tgatgcagcgacgccgcgtgagggatgacggccttcgggttgtaaacctc tttcagcagggaagaagcgaaagtgacggtacctgcagaagaagcgccg gctaactacgtgccagcagccgcggtaatacgtagggcgcaagcgttgtc cggaattattgggcgtaaagagctcgtaggcggcttgtcacgtcggatgtg aaagcccggggcttaaccccgggtctgcattcgatacgggctagctagagt gtggtaggggagatcggaattcctggtgtagcggtgaaatgcgcagatatc aggaggaacaccggtggcgaaggcggatctctgggccattactgacgctg aggagcgaaagcgtggggagcgaacaggattagataccctggtagtccac gccgtaaacgttgggaactaggtgttggcgacattccacgtcgtcggtgc cgcagctaacgcattaagttccccgcctggggagtacggccgcaaggcta aaactcaaaggaattgacgggggcccgcacaagcagcggagcatgtggc ttaattcgacgcaacgcgaagaaccttaccaaggcttgacatataccggaa agcatcagagatggtgccccccttgtggtcggtatacaggtggtgcatggc tgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgc aacccttgttctgtgttgccagcatgcccttcggggtgatggggactcaca ggagactgccggggtcaactcggaggaaggtggggacgacgtcaagtca tcatgccccttatgtcttgggctgcacacgtgctacaatggccggtacaat gagctgcgatgccgcgaggcggagcgaatctcaaaaagccggtctcagtt cggattggggtctgcaactcgaccccatgaagtcggagttgctagtaatcg cagatcagcattgctgcggtgaatacgttcccgggccttgtcacaccgccc gtctcgtctacgtaatag(seq id no.3)。
20.优选的,步骤s3经分析后得出所述菌株wa5
‑1‑
7所属的种属为链霉菌属, 且同源性达到99%。
21.本发明的第三个目的是提供一种所述的链霉菌wa5
‑1‑
7的次级代谢产物在 制备
抑菌组合物中的应用。
22.优选地,所述抗菌组合物可以强效抑制耐甲氧西林金黄色葡萄球菌mrsa、 金黄色葡萄球菌、白色念珠菌、肺炎克雷伯杆菌、铜绿假单胞菌生长。
23.本发明人前期从美洲大蠊肠道中分离得到的159株放线菌,其中有15株具有 良好抗白色念珠菌活性的菌株,选取具有良好抗白色念珠菌活性的菌株 wa5
‑1‑
7。通过形态学观察,分子生物学鉴定,系统发育树分析等方法对菌株 wa5
‑1‑
7进行生物学分类,初步确定该菌株为链霉菌属(streptomyces sp),保 藏编号为gdmcc no.61630。此种子菌悬液以5%的接种量接种于装有300mlph7.2 isp2发酵培养基的500ml锥形瓶中,于160rpm、28℃液体摇瓶发酵。牛津 杯法进行抑菌实验发现,发酵上清液以及发酵液乙酸乙酯粗提物对耐甲氧西林 金黄色葡萄球菌mrsa、金黄色葡萄球菌、白色念珠菌具有较强的抑制作用,对 肺炎克雷伯杆菌、铜绿假单胞菌具有一定抑菌活性;最后通过高效液相外标法 检测菌株发酵粗提物中的放线菌素含量,发液粗提物中放线菌素含量高达80%, 放线菌素d和放线菌素x2产量分别达到138.36mg/l和227.21mg/l。
24.与现有技术相比,本发明具有以下有益效果:
25.本发明提供的昆虫蜚蠊肠道内生链霉菌,其次级代谢产物抗菌活性强,对 耐甲氧西林金黄色葡萄球菌mrsa、金黄色葡萄球菌、白色念珠菌具有较强的抑 制作用,对肺炎克雷伯杆菌、铜绿假单胞菌具有一定抑菌活性;放线菌素含量 和产量高,发酵粗提物中放线菌素含量高达80%,放线菌素d和放线菌素x2产量 分别达到138.36mg/l和227.21mg/l,具有广阔的发展空间和很好的开发应用前 景。
附图说明
26.图1为菌株wa5
‑1‑
7在高氏1号平板上的生长状态图;
27.图2为菌株wa5
‑1‑
7在革兰氏染色在油镜100x下的形态图;
28.图3为菌株wa5
‑1‑
7在扫描电镜2kx下形态图;
29.图4为菌株wa5
‑1‑
7在扫描电镜10kx下形态图;
30.图5为菌株wa5
‑1‑
7的16s rrna扩增产物的琼脂糖凝胶电泳图;
31.图6为菌株wa5
‑1‑
7的16s rrna扩增产物的系统发育树的构建图;
32.图7为不同发酵天数发酵液抗mrsa活性图;
33.图8为不同发酵天数发酵液抗mrsa活性统计图;
34.图9为发酵液粗提物抗菌谱分析图;
35.图10为wa5
‑1‑
7发酵液上清粗提物色谱分析结果图。
具体实施方式
36.以下通过实施例形式的具体实施方式,对本发明的上述内容作进一步的详 细说明。但不应将此理解为本发明上述主题的范围仅限于以下实施例。
37.所述革兰氏染色试剂盒购自广东环凯微生物科技有限公司,型号为029010; 所述ezup柱式细菌基因组dna抽提试剂盒购自上海生工生物工程技术股份有 限公司,型号为no.b518255;所述放线菌素d、放线菌素x2由本课题组分离 纯化鉴定;所述氨苄青霉素购自广州齐云生物技术有限公司,型号为k0020; 所述两性霉素b购自上海阿拉丁生化科技股份
有限公司,型号为 a105482
‑
250mg;所述环丙沙星购自上海麦克林生化科技有限公司,型号为 c824343
‑
25g;所述ymc
‑
pack ods
‑
aq(4.6
×
250mm)色谱柱购自日本ymc 公司,型号为aq12s05
‑
2546wt;所述甲醇、乙酸乙酯、正丁醇、二氯甲烷、 无水乙醇购自广东光华科技股份有限公司,均为分析纯;所述试剂或生物材料, 如无特殊说明,均可从商业途径获得。
38.实施例1菌株wa5
‑1‑
7形态学鉴定
39.1.1菌株wa5
‑1‑
7在高氏1号培养基上的生长形态
40.从保存在
‑
20℃冰箱菌库中找出菌株wa5
‑1‑
7的保种管,吸取100μl菌液至 高氏1号琼脂的平板上,玻璃棒均匀涂布,此操作在超净台中进行,置于恒温 培养箱中,28℃倒置培养5d,待菌株wa5
‑1‑
7在平板中菌落的状态平稳后,用 已经火焰灭菌的接种环挑选单菌落的孢子分区划线接种于高氏1号琼脂平板中, 28℃培养箱中倒置培养5d,封口膜密封,置于4℃冰箱保存备用。采用涂片法 将菌株wa5
‑1‑
7接种于高氏1号平板中,于28℃培养箱中倒置培养5d,待菌株 的孢子成熟后,观察菌落的生长形态及气生菌丝、基内菌丝和可溶性色素产生 等情况;
41.所述高氏1号琼脂的配制方法:将可溶性淀粉20.0g、氯化钠0.5g、磷酸氢 二钾0.05g、硫酸亚铁0.01g、硫酸镁0.05g、硝酸钾1.0g、琼脂15.0g溶于蒸馏 水中,并定容至1000ml,调节ph值至7.3,分装,于121℃高压蒸汽灭菌20min。
42.实验结果:菌株wa5
‑1‑
7接种至高氏1号平板上在28℃恒温培养箱培养5d 后观察菌落形态特征,如图1所示,该菌株在高氏1号平板上生长良好,菌落 圆形,干燥不透明,呈现出内外两个圆环,菌丝向四周伸展,基内菌丝淡黄色, 气生菌丝白色。
43.1.2革兰氏染色法观察菌株wa5
‑1‑
7的形态
44.经酒精灯火焰灭菌的接种环从高氏1号平板上挑取单克隆菌体置于含有 0.5ml无菌dh2o的离心管中重悬,吸取1滴菌液滴加至洁净的载玻片上,酒精 灯上烤干之后根据革兰氏染色试剂盒的说明书进行革兰氏染色,然后将其置于 光学显微镜下观察。首先在低倍镜下寻找到样品的视野区,使用粗准焦螺旋调 高物镜,在样品区域上滴加1
‑
2滴香柏油,物镜切换到100倍(油镜),将聚光 器上升至最高位置并把光圈开到最大,在侧面水平注视下慢慢将镜筒降下,使 油镜浸没在油中但不能压破载玻片,慢慢调节细调节器至视野中出现物象并清 晰准焦为止,观察并记录菌株的菌体颜色与形态特征。
45.实验结果如图2所示,经革兰染色呈紫色,确定菌株wa5
‑1‑
7为革兰氏阳 性菌。
46.1.3扫描电子显微镜观察菌株wa5
‑1‑
7的形态
47.2.5%戊二醛溶液的配制:称取na2hpo4·
12h2o 7晶体1.64g,去离子水溶解 并定容至1l,为a液。称取31.21g nah2po4·
2h2o,去离子水溶解并定容至1l, 为b液。将50ml的50%戊二醛加入到0.2mol磷酸盐缓冲液(由a液360ml 和b液140ml配置而成,ph值7.2)中,去离子水定容至1l,再加入活性炭 20.0g。封口避光置于4℃冰箱中备用。
48.取上述已配制好的2.5%戊二醛溶液1.0ml置于1.5ml已高压灭菌的ep管 中,接种环加入在高氏1号平板上生长的菌株wa5
‑1‑
7菌体,置于4℃冰箱, 固定12h左右,2000rpm离心5min,弃上清;然后加入1.0ml磷酸缓冲液(pbs) 反复吹打,2000rpm离心5min,弃上清,重复3次,每次10min;紧接着使用 不同浓度的乙醇(30%、50%、70%、80%、90%、100%)进行梯度脱水,相同 条件下离心弃上清,每次脱水6min;然后把样品滴加到载玻片上,室温条件下 自然干燥;最后将处理好的样品置于离子溅射仪(hitachi mc1000)喷金键膜后, 扫描
电子显微镜(hitachi s
‑
3400n)观察菌丝特征以及孢子形状。实验结果如图 3和图4所示,扫描电镜结果显示,菌株的基内菌丝和气生菌丝较为丰富,孢子 成熟后脱落呈柱状形,证明该菌株形态特征与链霉菌基本相符。
49.实施例2菌株wa5
‑1‑
7的分子生物学鉴定
50.2.1 16s rrna基因序列的提取及比对
51.使用ezup柱式细菌基因组dna抽提试剂盒,对菌株wa5
‑1‑
7的dna进 行提取,选细菌通用引物27f和引物1492r将所提取的基因序列进行pcr扩增, 引物信息如seq id no.1和seq id no.2所示;
52.pcr反应体系如下:
53.表1 pcr反应体系
54.试剂体积(μl)primer star max premix(2
×
)12.5100μm上游引物27f1.0100μm下游引物1492r1.0dna模板1.5灭菌水9.0
55.扩增条件:预热94℃、3min,变性95℃、30s,退火55℃、30s,延伸72℃、 1min,共进行35个循环,再72℃后延伸10min,4℃保存)。
56.pcr扩增产物经1%琼脂糖凝胶电泳(恒压120v,15min)检测,在 1000~2000bp处出现明亮的条带,符合放线菌特征,如图5所示,送至华大基因 公司测序,将测序得到的序列提交至ncbi中进行blast同源性比对,同时将 序列信息提交至genbank数据库中,获取菌株wa5
‑1‑
7 16s rrna的登录编号 mn759381。
57.2.2 16s rrna系统发育树分析
58.将菌株wa5
‑1‑
7的16s rrna序列与ncbi中的数据库序列进行blast同 源性比对,选取有效发表的不同种属中的代表性菌株,利用mega5.0软件中的 邻接法(neighbor
‑
joining)对多序列比对结果进行系统发育树分析,判断出菌 株wa5
‑1‑
7所属的种属。
59.菌株wa5
‑1‑
7的同源性比较及系统发育树分析结果:
60.菌株wa5
‑1‑
7的pcr扩增产物经测序为1371bp的16s rrna序列,将序列 上传至genbank数据库中进行blast同源性比对,选取不同种的代表性菌株, 如图6所示为多序列比对进行系统发育树分析,结果表明该菌株与链霉菌 (streptomyces sp.cp010833.1)处于同一分支,同源性达到99%,鉴定菌株 wa5
‑1‑
7为链霉菌(streptomyces sp.)。将菌株序列提交至ncbi的genbank 数据库中,获得菌株wa5
‑1‑
7序列登录编号mn759381,经过测序后得菌株 wa5
‑1‑
7的16s rrna基因序列如seq id no.3所示。
61.实施例3菌株的发酵及不同天数发酵液抗mrsa活性测定
62.取高氏1号平板上单菌落接种到含有50ml的isp
‑
1种子液体培养基中,并 置于恒温摇床中28℃、160rpm培养2~3天,直至种子液浑浊后,按5%的接种 量接种到装有300ml isp
‑
2培养基的500ml锥形瓶中,并置于恒温摇床中28℃、 160rpm进行发酵,在开始发酵第4天起,隔天取发酵液1ml,于4℃冰箱保存 备用。使用牛津杯法检测发酵液的抗mrsa活性:将取得的发酵液样品于 12000rpm下离心5min备用。将高压蒸汽灭菌的tsa培养基于微波炉中
融化, 待培养基温度下降至43℃时,加入适量新鲜培养的终浓度为4
×
106cfu/ml的 mrsa菌液,并将其混匀,采用双层倒板法倒入适量混匀后的培养基于培养皿 中,待培养基凝固,在培养基上放置牛津杯,往其中加入200μl的发酵上清液, 将加好样的平板放置在37℃的恒温培养箱中培养12h,并观察和记录结果。其 中每株菌作3个重复,使用甲醇溶解的128μg/ml放线菌素d、128μg/ml放线 菌素x2作为阳性对照,使用甲醇作为阴性对照。
63.所述种子液体培养基的制备过程为:将葡萄糖10.0g、酵母提取物2.0g、胰 蛋白胨12.0g溶解于蒸馏水中,并定容1000ml,调节ph值至7.3,分装,于121℃ 高压蒸汽灭菌20min;
64.所述isp
‑
2培养基的制备过程为将葡萄糖4.0g、酵母提取物4.0g、麦芽糖提 取物10.0g溶解于蒸馏水中,并定容1000ml,调节ph值至7.3,分装,于121℃ 高压蒸汽灭菌20min;
65.所述大豆酪蛋白琼脂(tsa)培养基的配制过程为:将酪蛋白胰酶消化物 15.0g、大豆粉木瓜蛋白酶消化物5.0g、氯化钠5.0g、琼脂15.0g溶解于蒸馏水 中,并定容1000ml,调节ph值至7.3,分装,于121℃高压蒸汽灭菌20min。
66.不同天数发酵液抗mrsa活性结果:
67.如图7和图8所示,其中,图7中1为放线菌素d,2为放线菌素x2,3 为阴性对照甲醇溶剂,4为wa5
‑1‑
7;菌株wa5
‑1‑
7发酵4天上清液就具有很 强的抗mrsa活性,在发酵第10天发酵液上清抗mrsa活性达到高峰,随后 发酵时间延长抗mrsa活性有所回落。
68.实施例4发酵液粗提取制备及抗菌谱分析
69.菌株发酵15天将发酵液于高速冷冻离心机中转速8000rpm离心15min,收 集发酵液上清250ml,使用乙酸乙酯按体积比1:1重复萃取3次,使用旋转蒸 发仪于40℃将萃取相蒸发浓缩至干,往旋蒸瓶内加入少量甲醇,转移到带有克 重的西林瓶内,并放置于40℃恒温干燥箱内挥发多余甲醇,最终获得发酵液固 体粗提物,称重待用。
70.取一定量的的粗提物溶解于甲醇,配成1mg/ml的粗提物甲醇溶液。使用 牛津杯法检测粗提物的抗菌活性:将高压蒸汽灭菌的tsa培养基、pda培养基 于微波炉中融化,待培养基温度下降至43℃时,按体积比例5%加入新鲜培养的 终浓度为4
×
106cfu/ml的菌液,其中,白色念珠菌(candida albicans atcc 10231) 使用pda培养基,耐甲氧西林金黄色葡萄球菌(mrsa,atcc 25213),金黄 色葡萄球菌(atcc 25923),大肠埃希氏菌(atcc 25922),铜绿假单胞菌(atcc27853),肺炎克雷伯杆菌(atcc 13883)等使用tsa培养基,并将培养基与 菌液混匀,采用双层倒板法倒入适量混匀后的培养基于培养皿中,待培养基凝 固,在培养基上放置牛津杯,往其中加入100μl的粗提物甲醇溶液,将加好样 的tsa培养基平板放置在37℃的恒温培养箱中培养12h,pda培养基平板放置 在28℃的恒温培养箱中培养36h,并观察和记录结果。其中,每株菌作3个重 复,抗mrsa使用甲醇溶解的128μg/ml放线菌素d作为阳性对照,抗金黄色 葡萄球菌和抗大肠埃希氏菌使用64μg/ml氨苄青霉素作为阳性对照,抗白色念 珠菌使用64μg/ml两性霉素b作为阳性对照,抗铜绿假单胞菌和抗肺炎克雷伯 杆菌使用64μg/ml环丙沙星作为阳性对照,甲醇作为阴性对照。
71.所述pda培养基的制备过程为:马铃薯葡萄糖琼脂(pda)培养基:将马 铃薯(从中提取浸出粉)300.0g、葡萄糖20.0g、琼脂15.0g、氯霉素0.1g溶解 于蒸馏水中,并定容1000ml,调节ph值至7.3,分装,于121℃高压蒸汽灭菌 20min。
72.发酵液粗提物抗菌谱分析结果:
73.将发酵液上清萃取干燥后称重,获得发酵液粗提物0.1145g。将发酵液粗提 物溶于甲醇,配成1mg/ml粗提物甲醇溶液进一步通过牛津杯法对其进行抗菌 谱分析,抑菌圈结果如表2和图9所示:
74.表2发酵液粗提物抗菌谱统计表(抑菌圈直径mm,n=3)
[0075][0076][0077]
其中,图9中a为mrsa,b为金黄色葡萄球菌,c为大肠埃希氏菌,d 为白色念珠菌,e为肺炎克雷伯杆菌,f为铜绿假单胞菌,1为阳性对照,2为 阴性对照甲醇溶剂,3为wa5
‑1‑
7;如图9所示粗提物对耐甲氧西林金黄色葡萄 球菌mrsa、金黄色葡萄球菌、大肠埃希氏菌、白色念珠菌具有较强的抑制作 用,对肺炎克雷伯杆菌、铜绿假单胞菌具有一定抑菌活性。
[0078]
实施例5粗提物中放线菌素含量测定
[0079]
使用外标法对粗提物中的放线菌素含量进行测定,其中色谱条件为:使用 ymc
‑
pack ods
‑
aq(4.6
×
250mm)色谱柱,进样量10μl,流动相为甲醇:水(80: 20),检测波长为254nm。准确称量对照品放线菌素d、放线菌素x2配置成 1.0、0.5、0.25、0.1、0.05、0.025、0.01mg/ml浓度的标准甲醇溶液,按照上述 色谱条件进样分析,重复进样三次,记录峰面积,以浓度为横坐标,峰面积为 纵坐标拟合直线方程,得到外标工作曲线。
[0080]
将粗提物配成0.5mg/ml的甲醇溶液,按照同样的色谱条件进样分析,重复 进样三次,记录放线菌素峰面积,通过上述求得的对照品外标工作曲线得到粗 提物中放线菌素含度。
[0081]
粗提物放线菌素含量测定结果:
[0082]
将不同浓度的对照品放线菌素d、放线菌素x2和粗提物甲醇溶液进行色谱 分离,获得不同溶液的峰面积。以对照品的浓度为横坐标,峰面积为纵坐标拟 合直线得到回归方程,获得放线菌素d的工作曲线(y=6766334.53x
‑
424127.78, r2=0.9980)和放线菌素x2的工作曲线(y=1761112.43x
‑
5741.18,r2=0.9999)。 将粗提物的峰面积代入工作曲线得到粗提物中放线菌素d和放线菌素x2的含 量和百分比,并根据发酵体积推算出放线菌素产量,结果如图10和表2所示。
[0083]
表2放线菌素含量测定结果
[0084][0085]
wa5
‑1‑
7菌株粗提物中放线菌素x2含量最高,约达到50%,产量为 227.21mg/l;放线菌素d含量可达到30%,产量为138.36mg/l。
[0086]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。 任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进 行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所 揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利 要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1