一种双烷氧基聚芳香醚及其制备方法
1.本发明涉及聚芳香醚合成领域,具体涉及一种双烷氧基聚芳香醚及其制备方法。
技术背景
2.聚芳香醚是一类重要的高性能高分子材料,其不仅具有较高的热稳定性、化学稳定 性及机械强度,而且结构多样、来源广泛,在国防军工、航空航天、高端制造等领域发 挥了不可替代的作用。这些高分子材料的制备主要通过活化的二卤化物与双酚的芳香亲 核取代缩聚反应来实现。
3.木质素是自然界中总储量第二丰富、芳香类化合物储量第一丰富的天然高分子,实 现其高效利用可大大缓解当今人类对化石资源的依赖及随之带来的能源和环境危机。木 质素经有效的化学降解可转化为各种小分子物质,其中硝基苯氧化降解法可以高收率地 得到一系列芳香醛,包括香草醛、丁香醛和对羟基苯甲醛等。这些芳香醛又可以高效转 化成双酚类化合物,例如对苯二酚、2
‑
甲氧基对苯二酚、2,6
‑
二甲氧基对苯二酚等。双 酚类化合物是合成聚芳香醚高分子材料的重要单体,实现这些物质的可再生、生物基来 源化,将为高性能材料的发展提供保障。对苯二酚已应用于聚醚醚酮、聚芳醚腈和液晶 聚合物的制备中,且已实现了产业化,聚芳香醚中采用双酚a、双酚s以及联苯二酚为 单体的品种聚砜、聚醚砜和聚苯砜也已实现了批量化生产,而以对苯二酚为单体的聚芳 香醚尚无商品上市,原因可能包括对苯二酚极易氧化而导致聚合产品颜色较深以及聚合 中间产物溶解度较差而导致反应过程中物料析出、聚合度无法达到应用要求。采用2
‑ꢀ
甲氧基对苯二酚与二卤单体聚合可以制备聚芳香醚高分子,但颜色较深,且易被氧化而 导致聚合反应无法得到高分子量的产物。由于双甲氧基更强的给电子作用,以2,6
‑
二甲 氧基对苯二酚为双酚单体合成聚芳香醚材料比起无取代的对苯二酚单体以及单甲氧基 取代的对苯二酚单体更加的困难。
技术实现要素:
4.针对现有技术的问题,本发明提供了一种双烷氧基聚芳香醚及其制备方法。本发明 以含双烷氧基的醛为原料,首先制备醌,再经还原制备含有双烷氧基的双酚单体,能够 高纯度及高收率地得到双酚单体。本发明制备的含有双烷氧基的双酚单体与二卤单体进 行聚合得到的双烷氧基聚芳香醚高分子具有较高的粘度和热稳定性。
5.在第一方面,本发明提供了一种双烷氧基聚芳香醚,其具有如式i所示结构单元:
[0006][0007]
式i中,r1和r2相同或不同,各自独立地选自c1
‑
c6的烷氧基;r3和r4相同或 不同,
各自独立选自h和c1
‑
c6的烷基。
[0008]
根据本发明的一些实施方式,所述聚芳香醚还具有衍生自多卤单体的结构单元和任 选地衍生自不含双烷氧基的双酚单体的结构单元。
[0009]
根据本发明的一些实施方式,所述聚芳香醚为聚醚砜。
[0010]
根据本发明的一些实施方式,在热重分析中,所述双烷氧基聚芳香醚的5%热失重 温度≥410℃。在本发明的一些实施例中,所述热重分析在氮气氛围下进行,测试温度 为30℃至900℃,升温速率为10℃/min。
[0011]
根据本发明的一些实施方式,所述双烷氧基聚芳香醚的n
‑
甲基吡咯烷酮(nmp) 溶液的特性粘度≥0.80dl/g,优选为0.85dl/g至0.95dl/g。
[0012]
根据本发明的一些实施方式,式i中,r1和r2相同或不同,各自独立选自c1
‑
c4 烷氧基,例如选自甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基或叔丁 氧基。在一些实施例中,r1和r2相同均为甲氧基。
[0013]
根据本发明的一些实施方式,式i中,r3和r4相同或不同,各自独立选自氢和c1
‑
c4 烷基,例如选自氢、甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基等。在一 些实施中,r3和r4相同均为氢。
[0014]
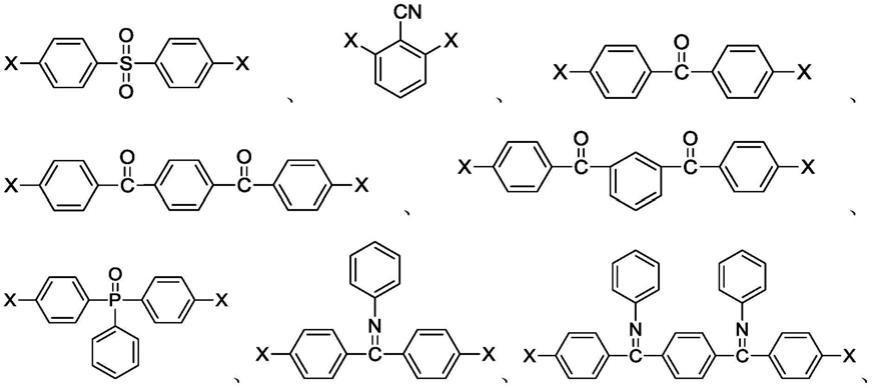
根据本发明的一些实施方式,所述多卤单体选自如下物质中的一种或多种:
[0015]
[0016]
[0017][0017]
其中,x为卤素或羟基,优选为氟、 氯、溴或碘。
[0018]
根据本发明的一些实施方式,所述多卤单体选自如下物质中的一种或多种:
[0019]
[0020]
[0021][0022]
根据本发明的一些实施方式,所述不含双烷氧基的双酚单体选自如下物质中的一种 或多种:
[0023]
[0024][0025]
在第二方面,本发明提供了第一方面所述的双烷氧基聚芳香醚的制备方法,其包括 将多卤单体和双酚单体在碱、溶剂和分水剂存在下在惰性气氛中进行聚合反应,其中, 所述双酚单体包括如下式ii所示的双烷氧基双酚单体,
[0026][0027]
式ii中,r1和r2相同或不同,各自独立地选自c1
‑
c6的烷氧基;r3和r4相同或 不同,各自独立选自h和c1
‑
c6的烷基。
[0028]
根据本发明的一些实施方式,所述双酚单体还包括第一方面所述的不含烷氧基的双 酚单体。
[0029]
根据本发明的一些实施方式,式ii中,r1和r2相同或不同,各自独立选自c1
‑
c4 烷氧基,例如选自甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基或叔丁 氧基。在一些实施例中,r1和r2相同均为甲氧基。
[0030]
根据本发明的一些实施方式,式ii中,r3和r4相同或不同,各自独立选自氢和 c1
‑
c4烷基,例如选自氢、甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基等。 在一些实施中,r3和r4相同均为氢。
[0031]
根据本发明的一些实施方式,所述双烷氧基双酚单体为2,6
‑
二甲氧基对苯二酚。
[0032]
根据本发明的一些实施方式,所述双烷氧基双酚单体的制备包括:
[0033]
步骤s1:使式iii所示的醛类化合物发生氧化反应,生成式iv所示的对苯二醌;
[0034]
步骤s2:使s1中所得的式iv所示的对苯二醌发生还原反应,得到所述双烷氧基 双酚单体,
[0035][0036]
其中,r1和r2相同或不同,各自独立地选自c1
‑
c6的烷氧基;r3和r4相同或不 同,各自独立选自h和c1
‑
c6的烷基。
[0037]
根据本发明的一些实施方式,步骤s1中,将式iii所示的醛类化合物与碱性溶液、 氧化剂溶液混合,
‑
10℃至0℃下使所述醛类化合物完全反应,得到第一反应液;将第 一反应液与卤化钾溶液、氧化剂溶液混合,10℃至30℃下反应10h
‑
20h。
[0038]
根据本发明的一些实施方式,所述碱性溶液选自氢氧化钠溶液、氢氧化钾溶液或碳 酸钠溶液中的一种或多种。
[0039]
根据本发明的一些实施方式,所述氧化剂溶液选自过氧化氢溶液。在一些实施例中, 所述过氧化氢溶液中的过氧化氢质量含量为25%至35%。
[0040]
根据本发明的一些实施方式,所述卤化钾溶液选自碘化钾溶液。在一些实施例中, 碘化钾溶液的摩尔浓度为0.1mol/l
‑
0.3mol/l。
[0041]
根据本发明的一些实施方式,步骤s2中,使s1中所得的式iv所示的对苯二醌与 还原剂溶液混合,100℃至120℃下反应1h
‑
5h。
[0042]
根据本发明的一些实施方式,所述还原剂溶液选自连二亚硫酸钠(保险粉)的水溶 液和/或二氧化硫脲的水溶液。根据本发明的一些实施方式,所述保险粉的水溶液的质 量浓度为5%
‑
15%,例如10%。
[0043]
根据本发明的一些实施方式,式iii中,r1和r2相同或不同,各自独立选自c1
‑
c4 烷氧基,例如选自甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基或叔丁 氧基。在一些实施例中,r1和r2相同均为甲氧基。
[0044]
根据本发明的一些实施方式,式iii中,r3和r4相同或不同,各自独立选自氢和 c1
‑
c4烷基,例如选自氢、甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基等。 在一些实施中,r3和r4相同均为氢。
[0045]
根据本发明的一些实施方式,式iv中,r1和r2相同或不同,各自独立选自c1
‑
c4 烷氧基,例如选自甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基或叔丁 氧基。在一些实施例中,r1和r2相同均为甲氧基。
[0046]
根据本发明的一些实施方式,式iv中,r3和r4相同或不同,各自独立选自氢和 c1
‑
c4烷基,例如选自氢、甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基等。 在一些实施中,r3和r4相同均为氢。
[0047]
根据本发明的一些实施方式,式iii所示的醛类化合物为丁香醛。在一些实施例中, 所述丁香醛选自以木质素为原料制备的丁香醛。
[0048]
在本发明的一些实施方式中,所述丁香醛为木质素经硝基苯氧化降解法制备得到的 丁香醛。
[0049]
现有技术中,多利用以下几种反应由本质素制备能够进行聚合的双酚类单体:
[0050][0051]
由以上的制备流程可以看出,现有技术中从醛氧化成双酚单体时,不可避免地会生成醌 类杂质。为了解决这一问题,目前大多数采用溶剂溶解性差别将醌类杂质(例如方法1) 除去。此方法不可避免的也会溶解一部分双酚单体,必然会影响总体收率。而本发明的 发明人经过大量的实验研究发现,在较强的氧化条件下,先将醛氧化成醌,再将醌经还 原得到双酚单体(例如方法2),能够使得所制备的双酚单体纯度以及收率都很高、将 其用于聚芳香醚制备时,得到的聚芳香醚产物具有较高的粘度和热稳定性。
[0052][0053]
根据本发明的一些实施方式,所述碱包括碱金属氢氧化物、碱金属碳酸盐、碱金属 碳酸氢盐或碱金属磷酸盐中的一种或多种,优选包括氢氧化锂、氢氧化钠、氢氧化钾、 碳酸锂、碳酸铯、碳酸钾、碳酸钠、碳酸氢钾、碳酸氢钠或磷酸钾中的一种或多种。
[0054]
根据本发明的一些实施方式,所述分水剂包括甲苯、邻二甲苯、间二甲苯、对二甲 苯、氯苯或均三甲苯中的一种或多种。
[0055]
根据本发明的一些实施方式,所述溶剂包括n,n
‑
二甲基甲酰胺、n,n
’‑
二甲基乙酰 胺、n
‑
甲基吡咯烷酮、n
‑
乙基吡咯烷酮、n
‑
丁基吡咯烷酮、1,3
‑
二甲基
‑2‑
咪唑啉酮、环 丁砜、二苯砜、二甲基亚砜、二甲砜、乙二醇二甲醚、二乙二醇二甲醚、三乙二醇二甲 醚、四乙二醇二甲醚或聚乙二醇二甲醚中的一种或多种。
[0056]
与现有技术相比,本发明具有以下有益效果:
[0057]
1、合成的新型聚芳香醚高分子具有很高的热稳定性,5%热失重温度均超过410℃, 属于特种工程塑料或者高性能高分子材料的范畴;
[0058]
2、采用先合成醌再还原的策略高纯度地合成了二酚单体,保证了聚合反应的成功; 3、为木质素在高分子材料领域的应用提供了新的方向。
附图说明
[0059]
图1为本发明合成例1制备得到的产物的1h
‑
nmr(dmso
‑
d6)谱图。
[0060]
图2为本发明合成例2制备得到的产物的1h
‑
nmr(dmso
‑
d6)谱图。图3为本发明的聚芳香醚的合成路线示意图。
具体实施方式
[0061]
下面将通过具体实施例对本发明作进一步地说明,但本发明的范围并不限于此。
[0062]
粘度测定方法:
[0063]
1、取0.2g聚合物产品,加入20ml nmp(或98%或95%浓硫酸)于锥形瓶中,室 温搅拌,观察其溶解度,完全溶解后进行过滤测试。
[0064]
2、将清洁干燥的粘度计垂直地放入恒温水槽内使水面完全浸没小球。用移液管吸 10ml过滤后的溶液(浓度为c1)。从管2注入b球中,于25℃恒温槽中恒温3分钟, 然后进行测定。在管1套一橡皮管,用夹子夹住,使之不通气。在管3用吸耳球将溶液 从球b经毛细管、球a吸入球c,然后同时松开吸耳球和管1橡皮管,让管1通大气。 此时液体即开始流回球b。用眼睛水平地注视着正在下降的液面,用秒表准确地测定液 面流经刻度线1与刻度线2之间所需的时间,并记录。重复上述操作两次,每次测定相 差不大于0.1秒。取两次的平均值为t1,即为溶液的流出时间。
[0065]
3、用移液管加入5ml的nmp(或98%或95%浓硫酸)对上述溶液进行稀释,稀 释后的溶液的浓度c2为起始浓度c1的2/3,按上面的步骤,测定溶液(浓度为c2)的流 出时间为t2。同样,依次加入nmp(或98%或95%浓硫酸)5ml、10ml,使溶液浓度成 为起始浓度的1/2、1/3(注意每次加入纯溶剂后,一定要混合均匀,且要等恒温后测定), 分别测定其流出时间,记录之。
[0066]
4、将粘度计中的溶液倒入回收瓶、洗涤烘干,用干净的移液管吸取纯nmp(或 98%或95%浓硫酸)溶液10ml,移入粘度计(注意尽量不要将溶液沾在管壁上),恒 温2分钟,按上面的步骤,测定溶液的流出时间t0。
[0067]
5、根据测得的各项时间计算其粘度。
[0068]
热重分析测试:
[0069]
氮气保护下,测试温度范围30
‑
900℃,升温速率10℃/min。
[0070][0071][0072][0073]
表1
[0074]
[0075]
[0076]
[0077][0078]
表2
[0079][0080]
表3
[0081]
[0082]
[0083][0084]
表4
[0085]
代号结构lihliohnahnaohkhkohlicli2co3csccs2co3kck2co3khckhco3nacna2co3nahcnahco3kpk3po4[0086]
表5
[0087]
[0088][0089]
表6
[0090]
[0091][0092]
合成例1
[0093]
2,6
‑
二甲氧基
‑
1,4
‑
对苯醌的制备
[0094][0095]
向连有恒压滴液漏斗的1l四口圆底烧瓶中依次加入丁香醛(30.00g,0.164mol) 和150.0ml去离子水,置于冰盐浴中冷却。然后向反应体系中依次加入82.0ml的氢 氧化钠溶液(2.00m,0.164mol)和41.0ml过氧化氢溶液(30%,0.394mol,2.4eq), 搅拌反应5h。反应过程中使用tlc进行监测至丁香醛反应完毕。然后,向反应体系中 依次滴加45.0ml碘化钾溶液(0.16m,0.007mol)和21.0ml过氧化氢溶液(30%,0.196 mol),室温下反应16h。将生成的黄色沉淀经抽滤、水洗及60℃真空干燥箱干燥得到 20.80g 2,6
‑
二甲氧基
‑
1,4
‑
对苯醌。产物熔点为253
‑
253.4℃,纯度>99%,产率为75.1%。 1h
‑
nmr(dmso
‑
d6)谱图见图1。
[0096]
合成例2
[0097]
2,6
‑
二甲氧基对苯二酚的制备
[0098][0099]
在1l的圆底烧瓶中依次加入合成例1中制备的2,6
‑
二甲氧基
‑
1,4
‑
对苯醌(23.00g, 0.137mol)和429.0ml质量分数为10%的保险粉水溶液(47.50g,0.273mol),搅拌, 加热回流至得到均一的溶液后,100℃至120℃下继续加热回流3h,停止反应。反应液 自然冷却至室温,析出无色针状晶体。抽滤、洗涤、室温真空干燥得到19.00g 2,6
‑
二 甲氧基对苯二酚晶体。熔点为158
‑
158.3℃,纯度>99%,产率为81.6%。1h
‑
nmr (dmso
‑
d6)谱图见图2。
[0100]
对比合成例1
[0101]
取丁香醛(12g,0.0656mol)于500ml三口瓶中,加入60ml四氢呋喃,室温下电 磁搅拌,待丁香醛全部溶解后。在冰水浴条件下,通过恒压滴液漏斗向体系中分批滴入 125ml的过氧碳酸钠(11.45g,0.0939mol)溶液。滴加完毕后,在氮气氛围,室温条件 下继续反应大约3h,过程中tlc检测直到原料丁香醛点全部消失。再通过恒压滴液漏 斗向体系中滴入2mol/l的盐酸溶液进行猝灭,用ph试纸检测至反应液ph为1
‑
3停止 滴加。抽滤,将滤液用乙酸乙酯进行萃取,有机相无水硫酸镁过夜干燥。过滤,将滤液 减压移走溶剂,得到棕色固体。氮气保护下,用二氯甲烷洗涤3
‑
4次,抽滤,室温真空 干燥。得到棕色粉末状产品4.855g,收率43.0%。
[0102]
实施例1
[0103][0104]
氮气氛围下,依次将dfdps(26.15g,0.103mol)和合成例2制备的dmhq(17.50 g,0.103mol)按照等摩尔比加入500ml的直四口圆底烧瓶中,然后加入146.0ml n,n
‑ꢀ
二甲基乙酰胺(dmac)搅拌至固体全部溶解,再依次加入无水碳酸钾(16.35g,0.118 mol)、73.0ml甲苯(tol)。将油浴温度缓慢升至165℃,甲苯回流分水12h。分水 完成后,通过分水器移出体系中的甲苯,再将油浴温度升至185℃,反应2.5h,得到 深棕色粘稠状反应液,停止反应。将反应液缓慢倒入盛有500.0ml去离子水中。将聚合 物用100℃水煮12h,抽滤、换水,重复操作3
‑
4次,然后真空干燥。最后得到淡粉 色粉末状聚合物36.09g,产率:99.9%,特性粘度(nmp):0.89dl/g。聚合物开始失 重温度为389℃,5%失重温度为413℃。
[0105]
实施例2
[0106][0107]
氮气氛围下,依次将dfdps(5.98g,0.024mol)、合成例2制备的dmhq(2.00 g,0.012mol)和bp(2.19g,0.012mmol)加入100ml的直四口圆底烧瓶中,然后, 加入,34.0ml n,n
‑
二甲基乙酰胺(dmac)搅拌至固体全部溶解,再依次加入无水碳 酸钾(3.74g,0.027mol)、17.0ml甲苯(tol)。将油浴温度缓慢升至165℃,甲苯 回流分水12h。分水完成后,通过分水器移出体系中的甲苯,再将油浴温度升至185℃, 反应10h,得到深棕色粘稠状反应液,停止反应。将反应液缓慢倒入盛有200.0ml去离 子水中。将聚合物用100℃水煮12h,抽滤、换水,重复操作3
‑
4次,然后真空干燥。 最后得到淡粉色粉末状聚合物8.25g,产率:98.0%,特性粘度(nmp):0.92dl/g。 聚合物开始失重温度为379℃,5%失重温度为413℃。
[0108]
实施例3
[0109][0110]
氮气氛围下,依次将dfdps(4.27g,0.017mol)、合成例2制备的dmhq(2.00 g,
0.012mol)和bp(0.94g,0.005mol)加入100ml的直四口圆底烧瓶中,然后, 加入25.0ml n,n
‑
二甲基乙酰胺(dmac)搅拌至固体全部溶解,再依次加入无水碳酸 钾(2.67g,0.019mol)、13.0ml甲苯(tol)。将油浴温度缓慢升至165℃,甲苯回 流分水12h。分水完成后,通过分水器移出体系中的甲苯,再将油浴温度升至185℃, 反应8h,得到深棕色粘稠状反应液,停止反应。将反应液缓慢倒入盛有200.0ml去离 子水中。将聚合物用100℃水煮12h,抽滤、换水,重复操作3
‑
4次,然后真空干燥。 最后得到淡粉色粉末状聚合物5.75g,产率:96.3%,特性粘度(nmp):0.87dl/g。 聚合物开始失重温度为395℃,5%失重温度为429℃。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1