一种定向酶切技术制备小分子乳清蛋白活性肽的方法与流程
1.本发明涉及食品生物技术领域,具体涉及一种定向酶切技术制备小分子乳清蛋白活性肽的方法。
背景技术:
2.乳清是生产干酪、干酪素时从牛乳中分离出来的液体部分,其中乳清蛋白含量约为干重13%左右,乳清蛋白中必需氨基酸组成全完全符合或超出fao/who的要求,与其它蛋白质相比,具有较高的生物利用价值。
3.乳清蛋白富含丰富的必需氨基酸,特别是含硫氨基酸含量高,占乳总蛋白的20%。乳清蛋白在体内或体外水解后可以释放出含有2
‑
50个氨基酸残基活性肽,这些活性物质能作用于免疫系统、心血管系统、神经系统和消化系统,具有增强免疫活力、抗肿瘤、抗氧化、抗细菌、抗病毒、抗真菌、降低胆固醇、降血脂等生物活性,是一种良好的生物效应调节剂。随着国内干酪及酪蛋白工业的迅速发展,加工过程中产生的大量乳清,利用乳清蛋白提取生物活性肽已经成为研究的热门话题,并引起消费者和科学家的广泛关注。
4.近年来,研究较多的主要是乳源性生物活性肽的序列结构及生物学功效,并对其在乳品和医药业中的应用前景和需要解决的问题进行探讨。中国发明专利cn101928742b公开了一种具有抗氧化活性的乳清蛋白活性肽及其制备方法。该制备方法包括以下步骤:(1)将蛋白酶加入乳清蛋白溶液中进行酶解,其中酶解温度为40~60℃,ph6.0~8.0;(2)酶解完成后,灭活蛋白酶;(3)将酶解液中未水解的乳清蛋白沉淀去除,取上清液;(4)上清液用截留分子量≤10,000道尔顿的超滤膜进行超滤,收集分子量≤10,000道尔顿的肽的滤液;(5)滤液浓缩;(6)浓缩液脱盐;(7)浓缩脱盐后的溶液,然后冷冻干燥。该方法所述蛋白酶选自胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶和木瓜蛋白酶。
5.小分子乳清蛋白活性肽具有较高的营养和药用价值,对人体无害并且价格较低廉,可被作为功能因子用于食品加工、添加剂生产、保健品和化妆品等领域,满足消费者的需求。
6.因此,有必要提供更多种类、功能多元的乳清蛋白小分子肽。
技术实现要素:
7.本发明主要目的在于提供一种定向酶切技术制备小分子乳清蛋白活性肽的方法,本发明采用疏水性氨基酸特异性蛋白酶、内肽酶、氨肽酶和风味蛋白酶对乳清蛋白进行定向酶切,所得活性肽具有较高的抗氧化活性和ace抑制活性,可用于食品加工、添加剂生产、保健品和化妆品等领域。
8.为实现上述目的,本发明采用以下技术方案:
9.本发明提供一种定向酶切技术制备小分子乳清蛋白活性肽的方法,其包括以下步骤:
10.将乳清蛋白水溶液进行蛋白质变性处理;将变性处理后乳清蛋白水溶液降温至40
~50℃,加入疏水性氨基酸特异性蛋白酶、内肽酶、氨肽酶和风味蛋白酶,控制溶液ph值为8.0~9.0,进行酶解;酶解后进行灭酶、冷却处理;离心取上清液进行分离、纯化,得到小分子乳清蛋白肽。
11.进一步地,所述乳清蛋白水溶液由乳清蛋白粉与水按质量比为1:8~12混合而成;乳清蛋白粉中蛋白质含量>80g/100g。
12.进一步地,蛋白质变性处理的条件:将乳清蛋白水溶液加热至55~95℃;加入naoh,至溶液中naoh质量浓度为0.8~1.5%;处理10
‑
25min。
13.进一步地,疏水性氨基酸特异性蛋白酶添加量为1000
‑
3000u/g、内肽酶添加量为5
‑
25u/g、氨肽酶添加量为50
‑
250u/g、风味蛋白酶添加量为100
‑
500u/g。
14.进一步地,酶解3.0~6.0h。
15.进一步地,90~100℃灭酶10~20min。
16.进一步地,所述分离、纯化方法为:将上清液进行超滤膜过滤,收集分子量≤3000da的滤液,然后采用凝胶过滤色谱法进一步分离纯化。
17.更进一步地,采用tskgelg2000
swxl
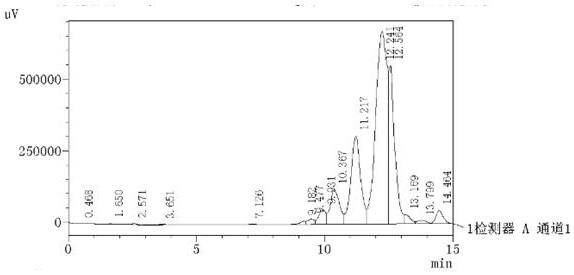
色谱柱进行分离纯化,采用0.1%(v/v)三氟乙酸乙腈溶液进行洗脱,收集洗脱时间为9.5
‑
9.9min、10.0
‑
10.4min、10.5
‑
11.3min、11.4
‑
12.5min四个时间段的洗脱液。
18.本发明还提供以上所述方法制备得到的小分子乳清蛋白活性肽。
19.与现有技术相比,本发明具有以下优势:
20.本发明采用疏水性氨基酸特异性蛋白酶、内肽酶、氨肽酶和风味蛋白酶对乳清蛋白中丙氨酸(ala,a)、苯丙氨酸(phe,f)、缬氨酸(val,v)、亮氨酸(leu,l)、异亮氨酸(ile,i)、精氨酸(arg,r)、赖氨酸(lys,k)、脯氨酸(pro,p)等氨基酸进行定向酶切,并分离纯化得到了100
‑
300da、300
‑
700da、700
‑
1000da、1000
‑
1500da四个分子量段的活性肽。本发明所得活性肽均具有较高的抗氧化活性和ace抑制活性,分离所得300
‑
700da的活性肽的dpph自由基清除率、羟自由基清除率、超氧阴离子自由基清除率分别高达18.6%、35.60%、15.32%,ace抑制率高达89.32%。本发明所得活性肽可较好地用于食品加工、添加剂生产、保健品和化妆品等领域。
21.本发明在酶解前采用加热协同加碱方法进行蛋白质变性处理,缩短预处理时间,提高后续酶解反应的效率和提取率,蛋白质回收率达90%以上。
附图说明
22.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
23.图1为本发明所得活性肽hplc色谱图。
具体实施方式
24.应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
25.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根
据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作和/或它们的组合。
26.为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
27.实施例中所用实验材料:疏水性氨基酸特异性蛋白酶,酶活力500000u/g,货号:gl0012;内肽酶,酶活力2000u/g,货号:gl0003;氨肽酶,酶活力4000000u/g,货号:gl0018;风味蛋白酶,酶活力100000u/g,货号:gl0004;生产厂家为:山东国力生物科技有限公司。
28.实施例1
29.所述定向酶切技术制备小分子乳清蛋白活性肽的方法,包括以下步骤:
30.s1.浓缩乳清蛋白粉与水按质量比1:10混合制备得到乳清蛋白水溶液,将溶液加热至85℃,加入naoh,至溶液中naoh质量浓度为1.0%,处理20min。
31.s2.将步骤s1变性处理后的乳清蛋白水液降温至45℃,加入疏水性氨基酸特异性蛋白酶1000u/g、内肽酶5u/g、氨肽酶50u/g、风味蛋白酶100u/g,控制溶液ph值为8.0,恒温酶解5.0h;
32.s3.酶解反应后,95℃灭酶10min,冷却;
33.s4.进行分离纯化,获得小分子乳清蛋白肽:
34.先采用膜分离技术分离得到分子量3000da以内的肽,采用tskgelg2000
swxl
色谱柱进行分离纯化,分离柱多孔填料为固定相,依据样品组分分子体积大小的差别进行分离;0.1%(v/v)三氟乙酸乙腈溶液进行洗脱。通过液相色谱仪对标准品gbw(e)100149、100150、100152、100153、nim
‑
rm3622做相对分子质量分布校正曲线,根据保留时间不同,收集9.5
‑
9.9min、9.9min~10.4min、10.4min~11.3min、11.3
‑
12.5min四个时间段肽液,依据标品分子量与保留时间对应的关系得到四个分子量活性肽:活性肽a(1000
‑
1500da)、活性肽b(700
‑
1000da)、活性肽c(300
‑
700da)、活性肽d(100
‑
300da),再分别根据相对分子质量分布测定的专用数据软件处理,计算得到小分子肽的相对分子质量大小和分布范围。最终根据gpc数据处理获得分子量分布在100
‑
1500da的小分子乳清蛋白肽,占比达96.25%,其中活性肽a(1000
‑
1500da)占2.53%、活性肽b(700
‑
1000da)占9.24%、活性肽c(300
‑
700da),占18.40%、活性肽d(100
‑
300da)占66.08%。
35.进行液相色谱的分析条件为:色谱柱:tskgelg2000
swxl 300mm
×
7.8mm(内径);流动相:乙腈+水=30+70(含0.1%tfa);检测波长:220nm;流速:0.8ml/min;检测时间:15min;进样体积:20ul;柱温:室温。相对分子质量分布校正曲线所用标准品为:gbw(e)100149、100150、100152、100153、nim
‑
rm3622。
36.实施例2
37.所述定向酶切技术制备小分子乳清蛋白活性肽的方法,包括以下步骤:
38.s1.浓缩乳清蛋白粉与水按质量比1:8混合制备得到乳清蛋白水溶液,将溶液加热至55℃,加入naoh,至溶液中naoh质量浓度为1.5%,处理25min。
39.s2.将步骤s1变性处理后的乳清蛋白水液降温至45℃,加入疏水性氨基酸特异性蛋白酶1500u/g、内肽酶10u/g、氨肽酶100u/g、风味蛋白酶200u/g,控制溶液ph值为8.0,恒温酶解5.0h;
40.s3.酶解反应后,90℃灭酶15min,冷却;
41.s4.进行分离纯化,获得小分子乳清蛋白肽:
42.先采用膜分离技术分离得到分子量3000da以内的肽,采用tskgelg2000
swxl
色谱柱进行分离纯化,分离柱多孔填料为固定相,依据样品组分分子体积大小的差别进行分离;0.1%(v/v)三氟乙酸乙腈溶液进行洗脱。通过液相色谱仪对标准品gbw(e)100149、100150、100152、100153、nim
‑
rm3622做相对分子质量分布校正曲线,根据保留时间不同,收集9.5
‑
9.9min、9.9min~10.4min、10.4min~11.3min、11.3
‑
12.5min四个时间段肽液,依据标品分子量与保留时间对应的关系得到四个分子量活性肽:活性肽a(1000
‑
1500da)、活性肽b(700
‑
1000da)、活性肽c(300
‑
700da)、活性肽d(100
‑
300da),再分别根据相对分子质量分布测定的专用数据软件处理,计算得到小分子肽的相对分子质量大小和分布范围。最终根据gpc数据处理获得分子量分布在100
‑
1500da的小分子乳清蛋白肽,占比达96.39%,其中活性肽a(1000
‑
1500da)占2.25%、活性肽b(700
‑
1000da)占8.96%、活性肽c(300
‑
700da),占18.39%、活性肽d(100
‑
300da)占66.79%。
43.实施例3
44.所述定向酶切技术制备小分子乳清蛋白活性肽的方法,包括以下步骤:
45.s1.浓缩乳清蛋白粉与水按质量比1:9混合制备得到乳清蛋白水溶液,将溶液加热至65℃,加入naoh,至溶液中naoh质量浓度为1.3%,处理20min。
46.s2.将步骤s1变性处理后的乳清蛋白水液降温至45℃,加入疏水性氨基酸特异性蛋白酶2000u/g、内肽酶15u/g、氨肽酶150u/g、风味蛋白酶300u/g,控制溶液ph值为8.0,恒温酶解5.0h;s3.酶解反应后,95℃灭酶15min,冷却;
47.s4.进行分离纯化,获得小分子乳清蛋白肽:
48.先采用膜分离技术分离得到分子量3000da以内的肽,采用tskgelg2000
swxl
色谱柱进行分离纯化,分离柱多孔填料为固定相,依据样品组分分子体积大小的差别进行分离;0.1%(v/v)三氟乙酸乙腈溶液进行洗脱。通过液相色谱仪对标准品gbw(e)100149、100150、100152、100153、nim
‑
rm3622做相对分子质量分布校正曲线,根据保留时间不同,收集9.5
‑
9.9min、9.9min~10.4min、10.4min~11.3min、11.3
‑
12.5min四个时间段肽液,依据标品分子量与保留时间对应的关系得到四个分子量活性肽:活性肽a(1000
‑
1500da)、活性肽b(700
‑
1000da)、活性肽c(300
‑
700da)、活性肽d(100
‑
300da),再分别根据相对分子质量分布测定的专用数据软件处理,计算得到小分子肽的相对分子质量大小和分布范围。最终根据gpc数据处理获得分子量分布在100
‑
1500da的小分子乳清蛋白肽,占比达96.53%,其中活性肽a(1000
‑
1500da)占2.19%、活性肽b(700
‑
1000da)占9.18%、活性肽c(300
‑
700da),占18.56%、活性肽d(100
‑
300da)占66.60%。
49.实施例4
50.所述定向酶切技术制备小分子乳清蛋白活性肽的方法,包括以下步骤:
51.s1.浓缩乳清蛋白粉与水按质量比1:11混合制备得到乳清蛋白水溶液,将溶液加热至75℃,加入naoh,至溶液中naoh质量浓度为1.1%,处理15min。
52.s2.将步骤s1变性处理后的乳清蛋白水液降温至40℃,加入疏水性氨基酸特异性蛋白酶2500u/g、内肽酶20u/g、氨肽酶200u/g、风味蛋白酶400u/g,控制溶液ph值为8.5,恒温酶解3.0h;
53.s3.酶解反应后,100℃灭酶10min,冷却;
54.s4.进行分离纯化,获得小分子乳清蛋白肽:
55.先采用膜分离技术分离得到分子量3000da以内的肽,采用tskgelg2000
swxl
色谱柱进行分离纯化,分离柱多孔填料为固定相,依据样品组分分子体积大小的差别进行分离;0.1%(v/v)三氟乙酸乙腈溶液进行洗脱。通过液相色谱仪对标准品gbw(e)100149、100150、100152、100153、nim
‑
rm3622做相对分子质量分布校正曲线,根据保留时间不同,收集9.5
‑
9.9min、9.9min~10.4min、10.4min~11.3min、11.3
‑
12.5min四个时间段肽液,依据标品分子量与保留时间对应的关系得到四个分子量活性肽:活性肽a(1000
‑
1500da)、活性肽b(700
‑
1000da)、活性肽c(300
‑
700da)、活性肽d(100
‑
300da),再分别根据相对分子质量分布测定的专用数据软件处理,计算得到小分子肽的相对分子质量大小和分布范围。最终根据gpc数据处理获得分子量分布在100
‑
1500da的小分子乳清蛋白肽,占比达96.58%,其中活性肽a(1000
‑
1500da)占2.25%、活性肽b(700
‑
1000da)占9.17%、活性肽c(300
‑
700da),占18.48%、活性肽d(100
‑
300da)占66.68%。
56.实施例5
57.所述定向酶切技术制备小分子乳清蛋白活性肽的方法,包括以下步骤:
58.s1.浓缩乳清蛋白粉与水按质量比1:12混合制备得到乳清蛋白水溶液,将溶液加热至95℃,加入naoh,至溶液中naoh质量浓度为0.8%,处理10min。
59.s2.将步骤s1变性处理后的乳清蛋白水液降温至50℃,加入疏水性氨基酸特异性蛋白酶3000u/g、内肽酶25u/g、氨肽酶250u/g、风味蛋白酶500u/g,控制溶液ph值为9.0,恒温酶解6.0h;
60.s3.酶解反应后,95℃灭酶20min,冷却;
61.s4.进行分离纯化,获得小分子乳清蛋白肽:
62.先采用膜分离技术分离得到分子量3000da以内的肽,采用tskgelg2000
swxl
色谱柱进行分离纯化,分离柱多孔填料为固定相,依据样品组分分子体积大小的差别进行分离;乙腈(0.1%tfa)进行洗脱。通过液相色谱仪对标准品gbw(e)100149、100150、100152、100153、nim
‑
rm3622做相对分子质量分布校正曲线,根据保留时间不同,收集9.5
‑
9.9min、9.9min~10.4min、10.4min~11.3min、11.3
‑
12.5min四个时间段肽液,依据标品分子量与保留时间对应的关系得到四个分子量活性肽:活性肽a(1000
‑
1500da)、活性肽b(700
‑
1000da)、活性肽c(300
‑
700da)、活性肽d(100
‑
300da),再分别根据相对分子质量分布测定的专用数据软件处理,计算得到小分子肽的相对分子质量大小和分布范围。最终根据gpc数据处理获得分子量分布在100
‑
1500da的小分子乳清蛋白肽,占比达96.85%,其中,活性肽a(1000
‑
1500da)占2.21%、活性肽b(700
‑
1000da)占9.10%、活性肽c(300
‑
700da)占18.37%、活性肽d(100
‑
300da)占67.17%。
63.本发明所得小分子乳清蛋白活性肽具有清除自由基、供氢/供电子、螯合金属离子、分解过氧化物、抑制脂肪氧合酶活力和抑制脂质过氧化等抗氧化功效;还能和靶组织底物竞争性地与ace的活性位点结合,有效地抑制ace的活性,使直接引起高血压的有活性的血管紧张素ⅱ合成受抑制,从而降低血压,并且所得小肽易消化吸收,无毒副作用,生物利用率高,营养和加工特性良好。
64.本发明所得不同分子量乳清蛋白肽的抗氧化活性和ace抑制活性,如下表1所示。
65.表1不同分子量乳清蛋白肽的抗氧化活性和ace抑制活性
[0066][0067]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1