一种利用植物细胞发酵技术生产高丽槐素的方法与流程
1.本发明涉及生物技术领域,特别涉及利用牛大力悬浮细胞诱导生产高丽槐素的方法。
背景技术:
2.牛大力,别名金钟根、猪脚笠、倒吊金钟、山莲藕、大力薯。为豆科蝶形花亚科崖豆藤属植物美丽崖豆藤(milttia specisoa champ)的干燥根茎。牛大力药用历史悠久,传统中医中以根入药。在《生草药性备要》中已有记载:“壮筋活络,补虚润肺。治腰腿痛,风湿痹痛,慢性肝炎,肺结核”。《陆川本草》也记载其:“清肺止咳,清凉解毒。治咳血,痢疾,温病身热口渴,头晕”。而临床上已证明其对诸多慢性疾病有治疗作用,主治腰痛、肾虚带下、风湿性关节炎、腰肌劳损、慢性肝炎、病后体虚等。
3.高丽槐素又称朝鲜槐英、山槐素,天然存在于植物牛大力、高丽槐、红车轴草等植物中,高丽槐素具有很强的抗真菌作用,同时具有抗肿瘤活性,对芳烃羟化酶具有显著抑制作用,可用于参与对高发病肺癌的治疗;对诱导白血病细胞凋亡具有促进作用,对治疗白血病也有一定的辅佐作用;同时该物质对雌激素受体无明显活性,对脂代谢诱导的一氧化氮生成具有抑制作用和强效杀菌作用。
4.现有的牛大力高丽槐素的获取方法主要是通过从牛大力中进行提取的方法,但是从牛大力根茎中的提取得率只有0.01%,从根茎中获取要受到地域以及季节的影响。通过植物细胞培养技术生产目的次级代谢产物,是提高天然植物中目标成分含量的有效手段之一。细胞悬浮培养具有繁殖速度快、培养规模大和提供大量均匀一致植物细胞培养物的特点。因此,通过植物细胞培养技术培养生产牛大力高丽槐素,能有效提高牛大力高丽槐素的含量和降低生产成本,有利于牛大力高丽槐素的进一步市场化。
5.另一方面,在植物次生代谢过程中,诱导物作为一种特殊的生化分子能够快速、专一并有选择地诱导某些特定基因的表达,从而提高代谢途径中相关酶的活性,进而促进或抑制受该酶调控的次生产物的产量。茉莉酸甲酯(methyljasmonate,meja)是激发次生代谢物积累的非生物类诱导因子,不同植物悬浮培养体系中加入茉莉酸甲酯后能够诱导细胞中次生代谢物积累增加。目前尚无以茉莉酸甲酯、苯丙氨酸和壳聚糖谷氨酸盐处理牛大力悬浮细胞培养体系的报告。
6.目前关于牛大力细胞悬浮培养的研究报道较少,且目前的许多研究成果只停留在摇瓶水平,在反应器水平的牛大力细胞悬浮培养一直没有相关报道,而且如何更大限度的促进产物的快速合成一直是悬浮细胞培养需要解决的难题。
技术实现要素:
7.有鉴于此,本发明提供了一种牛大力悬浮细胞放大培养的方法,在牛大力细胞的悬浮液体培养过程中,通过添加茉莉酸甲酯、苯丙氨酸和壳聚糖谷氨酸盐中的两种或两种以上,大幅度促进产物牛大力高丽槐素的合成积累,可以应用于大规模工业化生产工艺。克
服了现有的牛大力悬浮培养停留在摇瓶水平,细胞产量较低,无法进行规模化培养等问题。
8.为了实现上述发明目的,本发明提供以下技术方案:
9.本发明提供了茉莉酸甲酯、苯丙氨酸和/或壳聚糖谷氨酸盐在牛大力悬浮细胞诱导生产高丽槐素中的应用。在本发明的一些具体实施方案中,所述苯丙氨酸的添加量为250~1000mg/l,所述茉莉酸甲酯的添加量为5~50mm,所述壳聚糖谷氨酸盐的添加量为0.5~10g/l。在本发明的一些具体实施方案中,所述苯丙氨酸的添加量为450~550mg/l,所述茉莉酸甲酯的添加量为15~25mm,所述壳聚糖谷氨酸盐的添加量为1~5g/l。
10.本发明还提供了利用牛大力悬浮细胞诱导生产高丽槐素的诱导剂,包括茉莉酸甲酯、苯丙氨酸或壳聚糖谷氨酸盐中的两种或两者以上的组合物。在本发明的一些具体实施方案中,所述苯丙氨酸的添加量为250~1000mg/l,所述茉莉酸甲酯的添加量为5~50mm,所述壳聚糖谷氨酸盐的添加量为0.5~10g/l。在本发明的一些具体实施方案中,所述苯丙氨酸的添加量为450~550mg/l,所述茉莉酸甲酯的添加量为15~25mm,所述壳聚糖谷氨酸盐的添加量为1~5g/l。
11.本发明还提供了牛大力悬浮细胞放大培养的方法,在牛大力悬浮细胞放大培养的过程中,添加所述的诱导剂。
12.本发明还提供了利用牛大力悬浮细胞诱导生产高丽槐素的方法,在牛大力悬浮细胞放大培养的过程中,添加所述的诱导剂,获得高丽槐素。
13.在本发明的一些具体实施方案中,所述牛大力悬浮细胞放大培养的条件为:20~30℃、通气量100~800l/h、罐压0.01~0.03mpa、转速20~50rpm,培养时间为10~30天。
14.在本发明的一些具体实施方案中,添加所述的诱导剂的时间为放大培养的第15~20天。
15.在本发明的一些具体实施方案中,所述牛大力悬浮细胞放大培养的条件为:23~28℃、通气量150~600l/h、罐压0.01~0.03mpa、转速25~40rpm,培养时间为15~25天。
16.在本发明的一些具体实施方案中,所述牛大力悬浮细胞的制备方法包括如下步骤:
17.步骤1:选取牛大力种胚进行消毒处理,消毒后冲洗干净,将种胚切出伤口加入含有激素的固体ms培养基中,所述固体ms培养基成分为ms培养基添加0.2~5mg/l6
‑
ba,0.5~4mg/l picloram,10~50g/l蔗糖,5~10g/l琼脂,ph 5.55~5.95,诱导20~30天后选择愈伤组织进行继代培养;所述继代的次数为8~12次;
18.步骤2:将所述愈伤组织接入到液体培养基(所述液体培养基即为步骤1所述固体ms培养基除琼脂外的组分,成分及配比完全相同)中,接种量为湿重25~100g/l,在初期培养5~15天内采用摇瓶,将细胞充分打散后采用35目网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入液体培养基形成液体悬浮培养体系,继代培养;所述继代的次数为4~6次。
19.本发明的有益效果包括但不限于:
20.1.本发明克服了现有的牛大力悬浮培养停留在摇瓶水平,细胞产量较低,无法进行规模化培养的缺点,为之后更大规模的牛大力细胞悬浮培养提供一定的技术方法和基础。
21.2.本发明通过控制茉莉酸甲酯、苯丙氨酸和壳聚糖谷氨酸盐的添加量,解决了牛
大力悬浮细胞放大培养中茉莉酸甲酯、苯丙氨酸对牛大力细胞的生长的抑制问题,充分利用茉莉酸甲酯、苯丙氨酸促进牛大力高丽槐素的合成。
22.3.本发明方法以人工方式调节牛大力悬浮细胞生物量和牛大力高丽槐素的生产过程,有利于产品的质量控制管理。
具体实施方式
23.本发明公开了利用牛大力悬浮细胞诱导生产高丽槐素的方法。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
24.一种牛大力悬浮细胞放大培养的方法,其特征在于,在牛大力悬浮细胞放大培养的过程中,加入茉莉酸甲酯、苯丙氨酸和壳聚糖谷氨酸盐中的两种或两种以上;
25.优选的,在所述牛大力悬浮细胞放大培养的过程中,添加250~1000mg/l的苯丙氨酸,5~50mm茉莉酸甲酯,0.5~10g/l的壳聚糖谷氨酸盐;
26.优选的,在所述牛大力悬浮细胞放大培养的过程中,添加450~550mg/l的苯丙氨酸,15~25mm茉莉酸甲酯,1~5g/l的壳聚糖谷氨酸盐;
27.优选的,所述牛大力悬浮细胞放大培养的条件为:20~30℃、通气量100~800l/h、罐压0.01~0.03mpa、转速20~50rpm,培养时间为10~30天;
28.优选的,所述牛大力悬浮细胞放大培养的条件为:24~28℃、通气量150~600l/h、罐压0.01~0.03mpa、转速25~40rpm,培养时间为15~25天;
29.优选的,加入所述茉莉酸甲酯、苯丙氨酸和壳聚糖谷氨酸盐中的两种或两种以上的时间为放大培养的第15~20天;
30.优选的,所述牛大力悬浮细胞放大培养前期的液体悬浮培养体系通过以下步骤获得:
31.步骤一:选取牛大力种胚进行消毒处理,消毒后冲洗干净,将种胚切出伤口加入含有激素的固体ms培养基中。固体培养基成分为ms培养基添加0.2~5mg/l6
‑
ba,0.1~4mg/l picloram,10~50g/l蔗糖,5~10g/l琼脂,ph 5.55~5.95,诱导20~30天后选择愈伤组织进行继代培养;
32.步骤二:将胚性愈伤组织接入到液体培养基中,接种量为湿重25~100g/l。在初期培养5~15天内采用摇瓶,将细胞充分打散后采用网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入液体培养基形成液体悬浮培养体系,继代培养;
33.优选的,所述步骤一的继代次数为8~12次;
34.优选的,所述步骤二的继代次数为4~6次。
35.本发明的优点:
36.1.本发明克服了现有的牛大力悬浮培养停留在摇瓶水平,细胞产量较低,无法进行规模化培养的缺点,为之后更大规模的牛大力细胞悬浮培养提供一定的技术方法和基础。
37.2.本发明通过控制茉莉酸甲酯、苯丙氨酸和壳聚糖谷氨酸盐的添加量,解决了牛
大力悬浮细胞放大培养中茉莉酸甲酯、苯丙氨酸对牛大力细胞的生长的抑制问题,充分利用茉莉酸甲酯、苯丙氨酸促进牛大力高丽槐素的合成。
38.3.本发明方法以人工方式调节牛大力悬浮细胞生物量和牛大力高丽槐素的生产过程,有利于产品的质量控制管理。
39.本发明提供的利用牛大力悬浮细胞诱导生产高丽槐素的方法中,所用原料与试剂均可由市场购得。
40.下面结合实施例,进一步阐述本发明:
41.实施例1
42.步骤一:牛大力细胞液体悬浮培养体系的建立
43.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗5次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基成分为ms培养基添加0.5mg/l6
‑
ba,0.5mg/l picloram,10g/l蔗糖,6g/l琼脂,培养基ph值5.95,诱导20天后选择胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
44.将继代8次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重25g/l。在初期培养5天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代4次后就可以作为实验细胞系进行发酵罐接种扩大培养。
45.步骤二:5l搅拌式反应器的放大培养
46.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量培养基后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:24℃、通气量150l/h、罐压0.01mpa、转速30rpm,培养到第15天,添加250mg/l的苯丙氨酸,15mm茉莉酸甲酯,0.5g/l的壳聚糖谷氨酸盐,继续诱导培养到20天。
47.实施例2
48.步骤一:牛大力细胞液体悬浮培养体系的建立
49.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗6次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基成分为ms培养基添加1.5mg/l6
‑
ba,4mg/l picloram,30g/l蔗糖,10g/l琼脂,培养基ph值5.55,诱导30天后选择胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
50.将继代12次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重100g/l。在初期培养15天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代6次后就可以作为实验细胞系进行发酵罐接种扩大培养。
51.步骤二:5l搅拌式反应器的放大培养
52.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量培养基后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:25℃、通气量180l/h、罐压0.03mpa、转速30rpm,培养到第20天,添加1000mg/l的苯丙氨酸,25mm茉莉酸甲酯,5mg/l的壳聚糖谷氨酸盐,继续诱导培养到30天。
53.实施例3
54.步骤一:牛大力细胞液体悬浮培养体系的建立
55.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗5~6次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基成分为ms培养基添加1.0mg/l6
‑
ba,1.0mg/l picloram,30g/l蔗糖,5g/l琼脂,培养基ph值5.85。诱导25天胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
56.将继代10次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重50g/l。在初期培养10天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代6次后就可以作为实验细胞系进行发酵罐接种扩大培养。
57.步骤二:5l搅拌式反应器的放大培养
58.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量培养基后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:26℃、通气量200l/h、罐压0.02mpa、转速30rpm,培养到第15天,添加500mg/l的苯丙氨酸,40mm茉莉酸甲酯,3g/l的壳聚糖谷氨酸盐,继续诱导培养到30天。
59.实施例4
60.步骤一:牛大力细胞液体悬浮培养体系的建立
61.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗5次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基成分为ms培养基添加0.7mg/l6
‑
ba,0.7mg/l picloram,25g/l蔗糖,7.5g/l琼脂,培养基ph值5.75,诱导23天后选择愈伤组织进行继代培养。诱导23天后选择胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
62.将继代8次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重40g/l。在初期培养7天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代4次后就可以作为实验细胞系进行发酵罐接种扩大培养。
63.步骤二:5l搅拌式反应器的放大培养
64.发酵罐上分别配备ph电极、溶氧电极和温控系统。并利用尾气质谱进行气体组分分析,对细胞的生理呼吸代谢参数进行实时测定。使用前,先将反应器加入适量培养基后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:26℃、通气量250l/h、罐压0.01mpa、转速30rpm,培养到第15天,添加450mg/l的苯丙氨酸,15mm茉莉酸甲酯,4g/l的壳聚糖谷氨酸盐,继续诱导培养到25天。
65.实施例5
66.步骤一:牛大力细胞液体悬浮培养体系的建立
67.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗6次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基
成分为ms培养基添加1.2mg/l6
‑
ba,1.2mg/l picloram,40g/l蔗糖,6g/l琼脂,培养基ph值5.75,诱导28天后选择胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
68.将继代12次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重75g/l。在初期培养12天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代6次后就可以作为实验细胞系进行发酵罐接种扩大培养。
69.步骤二:5l搅拌式反应器的放大培养
70.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量培养基后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:27℃、通气量250l/h、罐压0.03mpa、转速30rpm,培养到第18天,添加750mg/l的苯丙氨酸,25mm茉莉酸甲酯,7g/l的壳聚糖谷氨酸盐,继续诱导培养到30天。
71.实施例6
72.步骤一:牛大力细胞液体悬浮培养体系的建立
73.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗6次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基成分为ms培养基添加1mg/l6
‑
ba,1.2mg/l picloram,35g/l蔗糖,5g/l琼脂,培养基ph值5.65,诱导20天后选择胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
74.将继代8次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重58g/l。在初期培养9天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代6次后就可以作为实验细胞系进行发酵罐接种扩大培养。
75.步骤二:5l搅拌式反应器的放大培养
76.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量培养基后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:26℃、通气量300l/h、罐压0.02mpa、转速30rpm,培养到第20天,添加350mg/l的苯丙氨酸,25mm茉莉酸甲酯,5g/l的壳聚糖谷氨酸盐,继续诱导培养到30天。
77.实施例7
78.步骤一:牛大力细胞液体悬浮培养体系的建立
79.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗5次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基成分为ms培养基添加0.7mg/l6
‑
ba,0.7mg/l picloram,20g/l蔗糖,8g/l琼脂,培养基ph值5.75,诱导23天后选择胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
80.将继代9次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重40g/l。在初期培养7天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代4次后就可以作为实验细胞系进行发酵罐接种扩大培养。
81.步骤二:5l搅拌式反应器的放大培养
82.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量培养基后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:27℃、通气量300l/h、罐压0.01mpa、转速25rpm,培养到第18天,添加350mg/l的苯丙氨酸,4g/l的壳聚糖谷氨酸盐,继续诱导培养到25天。
83.实施例8
84.步骤一:牛大力细胞液体悬浮培养体系的建立
85.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗6次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基成分为ms培养基添加1.2mg/l6
‑
ba,2.25mg/l picloram,40g/l蔗糖,7.5g/l琼脂,培养基ph值5.85,诱导28天后选择胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
86.将继代12次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重75g/l。在初期培养12天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代6次后就可以作为实验细胞系进行发酵罐接种扩大培养。
87.步骤二:5l搅拌式反应器的放大培养
88.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量培养基后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:27℃、通气量350l/h、罐压0.03mpa、转速25rpm,培养到第20天,添加50mm茉莉酸甲酯,7g/l的壳聚糖谷氨酸盐,继续诱导培养到30天。
89.实施例9
90.步骤一:牛大力细胞液体悬浮培养体系的建立
91.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗6次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基成分为ms培养基添加1mg/l6
‑
ba,1.2mg/l picloram,25g/l蔗糖,7g/l琼脂,培养基ph值5.55,诱导20天后选择胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
92.将继代12次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重58g/l。在初期培养9天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代6次后就可以作为实验细胞系进行发酵罐接种扩大培养。
93.步骤二:5l搅拌式反应器的放大培养
94.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量水后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:26℃、通气量400l/h、罐压0.02mpa、转速20rpm,培养到15天,添加350mg/l的苯丙氨酸,40mm茉莉酸甲酯,继续诱导培养到30天。
95.对比例1~4用于评价苯丙氨酸对牛大力悬浮细胞增殖及产高丽槐素的影响
96.对比例1:采用100mg/l苯丙氨酸取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
97.对比例2:采用250mg/l苯丙氨酸取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
98.对比例3:采用500mg/l苯丙氨酸取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
99.对比例4:采用1000mg/l苯丙氨酸取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
100.例如:对比例3具体操作如下:
101.步骤一:牛大力细胞液体悬浮培养体系的建立
102.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗5~6次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基成分为ms培养基添加1.0mg/l6
‑
ba,1.0mg/l picloram,30g/l蔗糖,5g/l琼脂,培养基ph值5.85,诱导25天胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
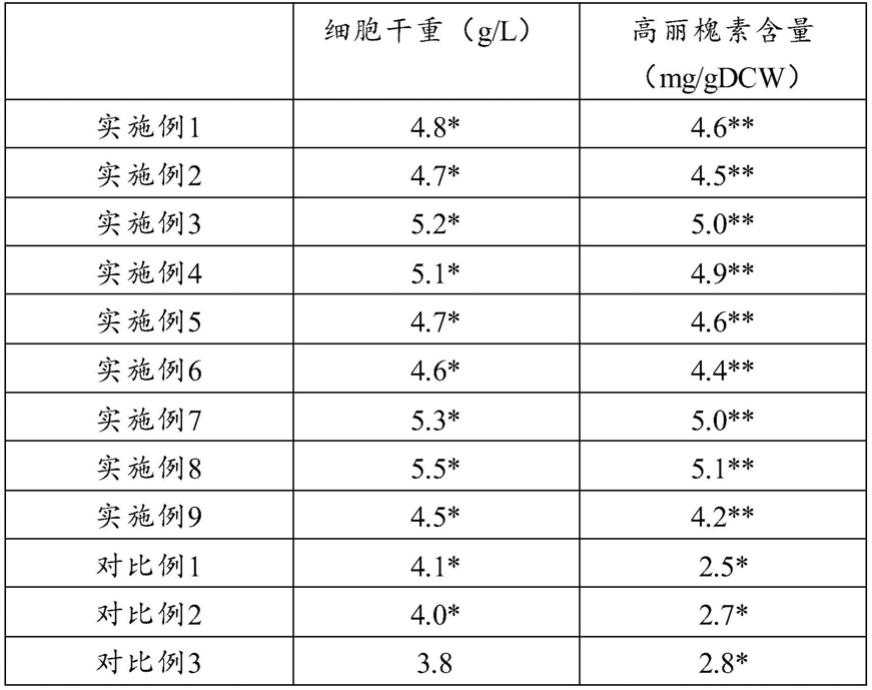
103.将继代8次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重50g/l。在初期培养10天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代5次后就可以作为实验细胞系进行发酵罐接种扩大培养。
104.步骤二:5l搅拌式反应器的放大培养
105.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量培养基后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:26℃、通气量400l/h、罐压0.02mpa、转速20rpm,培养到第15天,添加500mg/l苯丙氨酸,继续诱导培养到30天。
106.对比例5~8用于评价茉莉酸甲酯对牛大力悬浮细胞增殖及产高丽槐素的影响
107.对比例5:采用1μmol/l茉莉酸甲酯取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
108.对比例6:采用20μmol/l茉莉酸甲酯取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
109.对比例7:采用50μmol/l茉莉酸甲酯取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
110.对比例8:采用100μmol/l茉莉酸甲酯取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
111.例如对比例5具体操作如下:
112.步骤一:牛大力细胞液体悬浮培养体系的建立
113.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗5~6次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基成分为ms培养基添加1.0mg/l6
‑
ba,1.0mg/l picloram,30g/l蔗糖,5g/l琼脂,培养基ph值5.85,诱导25天胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
114.将继代8次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重
50g/l。在初期培养10天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代5次后就可以作为实验细胞系进行发酵罐接种扩大培养。
115.步骤二:5l搅拌式反应器的放大培养
116.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量培养基后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:26℃、通气量400l/h、罐压0.02mpa、转速20rpm,培养到第15天,添加1μmol/l茉莉酸甲酯,继续诱导培养到30天。
117.对比例9~12用于评价壳聚糖谷氨酸盐对牛大力悬浮细胞增殖及产高丽槐素的影响
118.对比例9:采用0.1g/l壳聚糖谷氨酸盐取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
119.对比例10:采用2g/l壳聚糖谷氨酸盐取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
120.对比例11:采用5g/l壳聚糖谷氨酸盐取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
121.对比例12:采用20g/l壳聚糖谷氨酸盐取代实施例3中的苯丙氨酸、茉莉酸甲酯、壳聚糖谷氨酸盐,其它步骤同实施例3。
122.例如:对比例11具体操作如下:
123.步骤一:牛大力细胞液体悬浮培养体系的建立
124.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗5~6次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培养基成分为ms培养基添加1.0mg/l6
‑
ba,1.0mg/l picloram,30g/l蔗糖,5g/l琼脂,培养基ph值5.85,诱导25天胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
125.将继代8次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重50g/l。在初期培养10天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代5次后就可以作为实验细胞系进行发酵罐接种扩大培养。
126.步骤二:5l搅拌式反应器的放大培养
127.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量培养基后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:26℃、通气量400l/h、罐压0.02mpa、转速20rpm,培养到第15天,添加5g/l壳聚糖谷氨酸盐,继续诱导培养到30天。
128.空白对照例
129.步骤一:牛大力细胞液体悬浮培养体系的建立
130.选取牛大力成熟的种胚在无菌条件下采用70%的酒精和含有2.5%有效氯的次氯酸钠溶液进行消毒处理,消毒后用蒸馏水冲洗5~6次将消毒剂清洗干净。将种胚剥去外部硬种壳后,切出伤口加入含有激素的固体ms培养基中诱导出胚性松散的愈伤组织。固体培
养基成分为ms培养基添加1.0mg/l6
‑
ba,1.0mg/l picloram,30g/l蔗糖,5g/l琼脂,培养基ph值5.85,诱导25天胚性松散的、生长旺盛、状态较为均一的愈伤组织进行继代培养。
131.将继代8次,状态较稳定的胚性松散愈伤组织接入到液体培养基中,接种量为湿重50g/l。在初期培养10天内采用带挡板的摇瓶,将细胞充分打散后采用35目的网筛,筛掉大的细胞团,将过滤的小细胞团和单细胞悬液补入适量的液体培养基形成均一的液体悬浮培养体系。将此培养体系继代5次后就可以作为实验细胞系进行发酵罐接种扩大培养。
132.步骤二:5l搅拌式反应器的放大培养
133.发酵罐上分别配备ph电极、溶氧电极和温控系统。使用前,先将反应器加入适量培养基水后,121℃下灭菌30min,待冷却后,接入摇瓶悬浮细胞种子和培养基。培养条件为:26℃、通气量400l/h、罐压0.02mpa、转速20rpm,培养到30天。
134.效果例取实施例1~9、对比例1~12及空白对照例所得悬浮细胞进行细胞干重、牛大力高丽槐素的含量的测定
135.具体结果如下:
136.表1牛大力悬浮细胞增殖情况及高丽槐素的产量
137.[0138][0139]
与空白对照例对比,
*
p<0.05,
**
p<0.01;n=3
[0140]
单独使用苯丙氨酸的效果:
[0141]
从表1实验结果可以看出添加一定量的苯丙氨酸(100、250、500、1000mg/l),随着苯丙氨酸添加浓度的升高,高丽槐素的含量也随之升高,在500g/l时达到最高,继续增加浓度则抑制高丽槐素的产生,实验结果得出当向培养基中添加500mg/l的苯丙氨酸可以最大限度提高高丽槐素的合成的产量。但是随着苯丙氨酸添加浓度的增加,苯丙氨酸对悬浮细胞的生长抑制作用也越大,当苯丙氨酸的添加浓度增加时,细胞干重明显下降,菌体的生长和产物的合成速率都会显著受到抑制。
[0142]
单独使用茉莉酸甲酯的效果:
[0143]
从表1可以看出,当茉莉酸甲酯添加浓度在20和50μmol/l的浓度下,能够促进产物牛大力高丽槐素的合成,当浓度增加到100μmol/l时,牛大力高丽槐素的合成量及细胞的增长速率受到抑制,在浓度为50μmol/l条件下,单位细胞的合成速率比对照增加。
[0144]
单独使用壳聚糖谷氨酸盐的效果:
[0145]
从表1可以看出,壳聚糖谷氨酸盐(0.1、2、5、10g/l)的考察实验结果显示,壳聚糖谷氨酸盐能够显著促进牛大力高丽槐素的合成,同时对细胞体的生长也有较好的促进作用。
[0146]
本发明通过控制茉莉酸甲酯、苯丙氨酸和壳聚糖谷氨酸盐三者的添加量,解决了牛大力悬浮细胞放大培养中茉莉酸甲酯、苯丙氨酸对牛大力细胞的生长的抑制问题,充分茉莉酸甲酯、苯丙氨酸促进牛大力高丽槐素合成的作用,同时通过添加壳聚糖谷氨酸盐,进一步的促进牛大力高丽槐素的合成及对悬浮细胞的生长。本发明实施1~9的牛大力悬浮细胞细胞干重、牛大力高丽槐素的含量的数据均显著优于对比例1~12,悬浮细胞生长没有受到抑制,牛大力高丽槐素合成明显提高,且显著高于空白对照例。
[0147]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1