一株植物乳杆菌SHY130及其缓解糖尿病的应用的制作方法
一株植物乳杆菌shy130及其缓解糖尿病的应用
技术领域
1.本发明涉及微生物技术领域,具体涉及一株植物乳杆菌shy130及其缓解糖尿病的应用。
背景技术:
2.糖尿病已成为21世纪全球面临的最严重、最危急的公共健康问题之一。2019年国际糖尿病联合会统计数据显示,全球约有4.63亿成年人患有糖尿病,预计到2045年,糖尿病患病人数将达到7亿。ⅱ型糖尿病占糖尿病患者的90%以上,主要表现为胰岛素抵抗和胰岛β细胞功能受损导致的胰岛素相对缺乏。ⅱ型糖尿病患者患心血管疾病(cvd)、视网膜病变、神经病变和肾衰竭等病发症的风险显著增加,严重者甚至会危及生命。研究发现,患有胰腺疾病的病人更容易患糖尿病,胰腺β细胞面积减少约65%会增加患糖尿病的风险。因此,保护β细胞功能对预防和治疗糖尿病至关重要。
3.糖尿病的发病机制复杂。一些体内和体外的研究表明,肠岛轴可以作为增强胰腺β细胞功能和改善葡萄糖稳态的靶点。在肠道中,短链脂肪酸(scfa)产生菌能够发酵不可消化的膳食纤维,产生短链脂肪酸。短链脂肪酸已经被证实对哺乳动物的能量代谢有多种有益作用。scfas激活g蛋白偶联受体gpr41和gpr43,这些受体在肠道内分泌l细胞上表达。gpr41和gpr43促进胰高血糖素样肽
‑
1(glp
‑
1)的分泌。glp
‑
1是肠岛轴中关键的肠促胰岛素激素,能够激活胰岛素分泌,改善胰岛素抵抗,促进胰腺β细胞增殖。因此,肠岛轴可能是有效的ⅱ型糖尿病治疗策略。
4.益生菌被定义为给予足够的剂量对宿主的健康有益的活的微生物。益生菌在食品中的安全使用历史以及临床试验中的观察结果表明,人体补充益生菌通常被认为是安全的,一般没有严重的副作用。在众多动物研究及临床实验中已经证实,lactobacillus(l.)casei、l.paracasei、l.plantarum、l.acidophilus和bifidobacterium infantis等益生菌可以调节血糖水平,保护胰岛,提高糖耐量,改善胰岛素抵抗并重塑肠道菌群。益生菌具有菌种特异性甚至菌株特异性,并通过多种机制发挥作用。然而,关于糖尿病中益生菌对肠岛轴的作用机制的研究较少。
5.因此,探寻益生菌在肠岛轴中的调节作用机制,并将具有降低高血糖的益生菌开发为功能性制剂具有广阔的前景,值得进行深入探究。
技术实现要素:
6.本发明的目的是针对上述问题,提供一种植物乳杆菌shy130及其应用。
7.本发明为了实现其目的,采用的技术方案是:
8.一株植物乳杆菌(lactobacillus plantarum)shy130,在中国典型培养物保藏中心进行保藏,保藏编号为cctcc no:m 2021372。
9.一种菌剂,其活性成分包含上述的植物乳杆菌(lactobacillus plantarum)shy130。
10.所述菌剂为冷冻干燥粉剂。
11.上述的植物乳杆菌(lactobacillus plantarum)shy130或菌剂,在制备用于预防和/或缓解和/或治疗糖尿病产品中的应用。
12.在上述应用中,所述糖尿病为ii型糖尿病。
13.在上述应用中,所述产品为食品、保健品或药品。
14.本发明还提供上述的植物乳杆菌(lactobacillus plantarum)shy130作为功能性益生菌在制备食品、食品添加剂、保健品或药品中的应用。
15.本发明还提供了一种产品,其活性成分为上述的植物乳杆菌(lactobacillus plantarum)shy130,或上述的任意一种菌剂,所述产品的用途为如下任意一种:
16.(1)预防和/或缓解和/或治疗糖尿病;
17.(2)作为功能性益生菌应用到食品、食品添加剂、保健品或药品中。
18.所述产品为食品、食品添加剂、保健品或药品,所述糖尿病为ii型糖尿病。
19.本发明的有益效果是:
20.本发明通过实验发现:高脂饲料联合链脲佐菌素(stz)诱导ⅱ型糖尿病模型小鼠结果显示:植物乳杆菌shy130能够显著缓解小鼠的体重下降;能够显著降低其空腹血糖(fbg);能够显著改善其口服葡萄糖耐量;能够显著改善胰岛素抵抗和血清中胰高血糖素的含量,显著增加胰岛β细胞阳性面积,显著减少胰岛α细胞面积,使胰腺损伤得到改善;能够显著提高gpr43和gpr41在结肠的表达,显著增加血清中glp
‑
1含量,改善结肠的受损;并且可以调节肠道菌群结构,显著降低firmicutes/bacteroidetes比值,增加了faecalibaculum、odoribacter、alistipes等scfa产生菌的相对丰度,因而能够显著增加小鼠粪便中的scfa含量,降低其粪便ph值。综上,植物乳杆菌shy130能够通过调节肠岛轴缓解ⅱ型糖尿病所导致的高血糖,改善ⅱ型糖尿病的发生与发展,图13为本发明中益生菌对肠岛轴的作用机制分析图。因此,植物乳杆菌shy130可用于制备缓解ⅱ型糖尿病的保健食品和药品。
21.本发明提供了保藏编号为cctcc no:m2021372的植物乳杆菌shy130(lactobacillus plantarumshy130)在制备缓解ⅱ型糖尿病的保健食品和药品中的应用,不仅探究了益生菌在调节肠岛轴上的作用机制,还扩大了植物乳杆菌shy130的应用范围,提高了其利用价值,给治疗ⅱ型糖尿病带来了新的希望。
附图说明
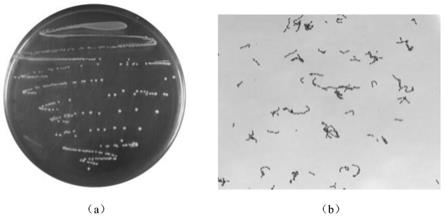
22.图1为分离菌株菌落形态(a)及革兰氏染结果(b);
23.图2为植物乳杆菌shy130的系统发育树的构建结果;
24.图3为植物乳杆菌shy130的api 50ch反应结果;
25.图4为植物乳杆菌shy130对人工胃酸、胆盐的耐受性结果;
26.图5为小鼠体重变化趋势(a)、最终体重(b)以及治疗期间小鼠每只每日平均摄食量(c);
27.图6为植物乳杆菌shy130对ⅱ型糖尿病小鼠fbg水平(a)、ogtt(b)及其下曲线面积(c)的影响;
28.图7为植物乳杆菌shy130对ⅱ型糖尿病小鼠血清胰岛素、homa
‑
ir和胰高血糖素水
平的影响;
29.图8为植物乳杆菌shy130对ⅱ型糖尿病小鼠胰腺的组织病理学的影响;
30.图9为植物乳杆菌shy130对ⅱ型糖尿病小鼠结肠组织病理学(a)和gpr43和gpr41表达(b,c,d)和血清glp
‑
1水平(e)的影响;
31.图10为植物乳杆菌shy130对ⅱ型糖尿病小鼠粪便中短链脂肪酸含量和ph值的影响;
32.图11为小鼠肠道菌群的物种venn图(a)、chao 1指数(b)和shannon(c)指数和pcoa图(d);
33.图12为植物乳杆菌shy130对ⅱ型糖尿病小鼠肠道菌群组成的影响;
34.图13为本发明中益生菌对肠岛轴的作用机制分析图;
35.上述图中,*表示与正常组相比存在显著性差异p<0.05;#表示与模型组相比存在显著性差异p<0.05。
具体实施方式
36.下面结合实施例对本发明作进一步说明,但并不因此而限制本发明。
37.下述实施例中的实验方法,如无特别说明,均为常规方法;所用化学、生物试剂如无特殊说明,均为本领域常规试剂,均可通过商购获得。
38.植物乳杆菌shy130的保藏信息
39.将菌株shy130于2021年4月送中国典型培养物保藏中心(简称cctcc)进行保藏,地址为湖北省武汉市武昌区八一路299号武汉大学校内,保藏日期:2021年4月14日;保藏编号:cctcc no:m2021372;分类命名:植物乳杆菌shy130(lactobacillus plantarumshy130)。
40.实施例1、植物乳杆菌shy130的分离与鉴定
41.1实验材料
42.四川红原传统发酵牦牛酸奶。
43.2 实验方法
44.2.1 乳酸菌的分离纯化
45.将取回的牦牛酸奶进行10倍梯度稀释,依次稀释至10
‑6。选择4个适宜稀释度(稀释度为10
‑3、10
‑4、10
‑5、10
‑6)分别取100μl涂布在mrs固体平板培养基上,37℃培养48h后,选取形态各异的单菌落采用平板划线法分离菌株。重复上述步骤直至得到纯化菌株,通过革兰氏染色进行形态学观察。
46.2.2pcr扩增16s rdna序列
47.采用细菌基因组dna提取试剂盒提取纯化菌株的dna。采用25μl反应体系进行pcr扩增:模板dna 1μl、上游引物(10μm)1μl、下游引物(10μm)1μl、2
×
taq pcr master mix 12.5μl,用无菌超纯水补足至25μl。pcr扩增条件:94℃预变性5min;94℃变性1.5min,55℃退火1min,72℃延伸1.5min,共30个循环;72℃末端延伸10min。最后委托华大基因科技有限公司对检测合格的pcr扩增产物进行双向测序,测序结果通过ncbi中的blast程序进行同源性比对分析。
48.2.3系统发育树的构建
49.从genebank中选取与所得乳酸菌16s rdna基因序列同源性大于98%的乳酸菌以及genome中的标准菌株作为参考的序列,然后使用mega5.05程序中的neighbor
‑
joining方法构建所获菌株的系统发育树。
50.2.4api 50ch试剂盒鉴定
51.分离菌株在37℃培养18h,于3000r/min、15min的条件下离心收集菌体,用无菌生理盐水洗涤菌体后重悬为菌悬液。参考梅里埃(法国)api 50ch试剂盒说明书进行操作。
52.2.5模拟胃肠液耐受能力的测定
53.菌株37℃培养18h后,取10ml于3000r/min离心15min收集菌体沉淀,用等体积无菌生理盐水洗涤2次,并重悬于等体积无菌生理盐水中,即为菌悬液。将制备好的菌悬液与人工胃液(0.2%nacl、0.35%胃蛋白酶1:10000)按1:9比例混合,混匀后置于水浴恒温振荡器中37℃、100r/min培养3h,采用平板涂布法分别测定0h、3h的活菌数,重复3次,结果以平均值表示。
54.菌株37℃培养18h后,按2%的接种量分别接种于含0.0、0.3%牛胆盐(cas no 8008
‑
63
‑
7)的mrs
‑
thio培养基中,混匀后置于水浴振荡器中37℃、100r/min培养24h。以未接种不含牛胆盐的mrs
‑
thio培养基(高胆固醇培养基)为空白对照,测定含0.0、0.3%牛胆盐培养液的od
600 nm值,重复3次,结果以平均值表示。
55.3结果与分析
56.3.1分离菌株的菌落形态和细胞形态
57.菌株纯化后在mrs培养基中形成单菌落,菌落形态几乎一致,大多数呈圆形,白色,表面光滑湿润。革兰氏染色后在显微镜下观察到紫色细胞形态,判定为革兰氏阳性菌(g
+
)。菌株的菌落形态和革兰氏染色结果见图1。
58.3.2菌株16s rdna序列分析
59.16s rdna同源性分析结果显示,与gene bank数据库中已知植物乳杆菌(lactobacillus plantarum)的同源性达100%,。
60.将分离得到的植物乳杆菌命名为shy130,shy130的16s rdna基因扩增产物的双向序列如seq id no.1所示。
61.3.3菌株系统发育树的构建结果
62.将shy130的dna序列与blast程序进行比对后通过neighbor
‑
joining法构建系统发育树,如图2所示,shy130与l.plantarum strain sn13t andl.plantarum strain heal19同源性100%,说明shy130为植物乳杆菌。
63.3.4菌株生化特性鉴定结果
64.乳酸杆菌种水平的表型鉴定主要依据碳水化合物发酵试验。api 50ch试剂盒是通过菌株对49种不同碳水化合物的利用情况来进行鉴定。
65.图3示出了实验菌株的api 50ch反应结果(阳性呈黄色、阴性呈蓝色)。表1示出了该菌株对49种碳水化合物发酵试验结果。由图3和表1可知,在供试的49种碳源中,该菌株可以利用其中25种碳水化合物。经api lab plus系统最终鉴定,实验菌株为植物乳杆菌(lactobacillus plantarum),其id值为99.90%,t值为0.71,达到鉴定要求(id值≥99.0%,且t值≥0.5)。
66.表1 lactobacillus plantarumshy130对49种碳水化合物发酵试验结果
[0067][0068]
注:“+”代表反应阳性;
“‑”
代表反应阴性。
[0069]
3.5菌株对人工胃酸、胆盐的耐受性
[0070]
胃肠道内的胃液和胆盐可以抑制和终止微生物的生长。在本实验中,植物乳杆菌shy130对ph值为3的胃液和0.3%的胆盐具有良好的耐受性,具有潜在的对人体有益功能(图4)。
[0071]
实施例2、植物乳杆菌shy130通过肠岛轴对小鼠ⅱ型糖尿病的缓解作用
[0072]
1实验材料
[0073]
实验菌株为植物乳杆菌shy130(lactobacillus plantarumshy130),保藏编号
cctcc no:m2021372。
[0074]
实验动物为4周龄雄性c57bl/6j小鼠,购自重庆医科大学实验动物中心。饲养于室温22
±
2℃、相对湿度50
±
5%、12h光照/12h黑暗的标准化实验室中,适应性喂养一周后开始实验。
[0075]
2 实验方法
[0076]
2.1 实验动物分组及处理
[0077]
将小鼠随机分成正常组(nc)、糖尿病组(d)、植物乳杆菌shy130(shy130)三组,每组8只。实验周期16周,实验期间各组动物均自由饮水。nc组摄入标准饲料(脂肪12.79%,碳水化合物66.67%,蛋白质20.54%),其余小鼠饲喂高脂饲料(脂肪60.65%、碳水化合物21.22%、蛋白质18.14%)5周。将40mg/kg
·
bw的新鲜链脲佐菌素(streptozotocin,stz)溶于柠檬酸钠缓冲液中,连续5天腹腔注射诱导小鼠ⅱ型糖尿病,nc组小鼠注射柠檬酸钠缓冲液。1周后测定小鼠fbg水平,fbg水平超过11.1mmol/l的小鼠被认为是糖尿病小鼠。随后将糖尿病小鼠随机分为d组和shy130组,shy130组每天灌胃10
10
cfu/kg
·
bw的植物乳杆菌shy130菌液(菌液采用实施例1中分离纯化得到的shy130菌株按常规方法制备发酵菌液),nc组和d组每天灌胃10ml/kg
·
bw生理盐水,持续10周。
[0078]
实验期间每7天测量一次体重,在处理期间每两天记录一次食物和水的摄入量。于第16周末收集小鼠粪便。在实验的最后一天禁食一夜后,测定小鼠fbg。动物实验规程已由西南大学动物护理与使用委员会批准,批准编号为:20210118
‑
01。
[0079]
实验结束时,禁食12h,处死小鼠。采集血样,于4℃、3000rpm离心10min分离血清,保存于
‑
80℃待进一步分析。组织样本(胰腺和结肠)迅速取出、冲洗,取部分组织于4%聚甲醛中固定48h,其余组织置于液氮中冷冻,随后放置于
‑
80℃保存。
[0080]
2.2口服葡萄糖耐量试验(ogtt)
[0081]
16周时对小鼠进行ogtt,实验前测量体重以确定葡萄糖灌胃量。小鼠禁食12h,自由饮水,随即测定血糖。然后小鼠灌胃2g/kg
·
bw葡萄糖,分别于30、60、90、120min测定血糖水平,绘制血糖曲线,使用graph pad计算葡萄糖下面积(auc)。
[0082]
2.3血清指标的测定
[0083]
采用酶联免疫吸附测定试剂盒检测血清胰岛素、胰高血糖素和glp
‑
1水平。胰岛素抵抗的稳态模型评估(homa
‑
ir)计算公式如下:homa
‑
ir=空腹血糖(mmol/l)
×
空腹血清胰岛素(m iu/l)/22.5。
[0084]
2.4组织学分析
[0085]
小鼠肝脏和胰腺组织在一系列乙醇溶液中脱水,石蜡包埋,切成4μm厚的切片。脱蜡脱水后,切片用苏木精和伊红染色进行形态学检查。用光学显微镜观察染色组织,并取图像进行组织病理学分析。
[0086]
对石蜡包埋的胰腺和结肠切片脱蜡后,进行抗原恢复、加热、封闭。一抗4℃孵育过夜,随后与二抗恒温孵育50分钟,最后再用dapi染色10分钟,pbs洗涤3次。荧光显微镜下观察图像,并使用image
‑
j软件定量阳性细胞面积。
[0087]
2.5粪便中scfas和ph值的测定
[0088]
通过气相色谱法测定小鼠粪便中的短链脂肪酸(乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸)。将粪便样本迅速放入冰水浴中的离心管中,加入离子水,涡旋混合2分钟。随后将
其置于冰水浴中静置20分钟,再于4℃、4800g离心20min。取2ml上清液转入另一离心管中,加入0.2ml 50%h2so4和2ml乙醚,混匀后在4℃下静置30min,通过0.22μm膜过滤上清液,然后进行气相色谱测定。
[0089]
气相色谱条件:agilent db
‑
wax柱子(30m
×
0.32mm i.d.,0.25μm),进样口温度220℃,检测器温度275℃。载气采用高纯氮气,流速为2ml/min,分流比为40:1。氢气和空气的流速分别为30和300ml/min。烘箱温度(80℃)保持1min,然后以15℃/min的速度升至170℃,然后以30℃/min的速度升至220℃。进样量为1μl。
[0090]
取另一部分粪便样品用蒸馏水按1:9的比例稀释,用ph计测定ph值。
[0091]
2.6粪便中肠道菌群的高通量测序
[0092]
使用粪便dna提取试剂盒从样品中提取样品中细菌总dna,dna的质量通过检测核酸的od值a260/a280和a260/a230的比值进行评估。用带有barcode的特异引物341f(seq id no.2:5'
‑
cctacgggnggcwgcag
‑
3')和806r(seq id no.3:5'
‑
ggactachvgggtatctaat
‑
3')扩增细菌16s rrna基因v3
‑
v4区。pcr扩增总体积为50μl,第一轮扩增程序为94℃预变性2min,然后在98℃变性10s,55℃退火30s,68℃延伸30s循环30次,最终在68℃延伸5min,随即利用agencourt ampure xp磁珠(购自贝克曼库尔特商贸(中国)有限公司,货号:311303)进行pcr产物纯化,纯化后用qubit3.0定量。第二轮扩增程序为在94℃预变性2min,然后在98℃变性10s,65℃退火30s,68℃延伸30s循环12次,最终在68℃延伸5min。使用agencourt ampure xp磁珠对第二轮扩增产物进行纯化,用abi steponeplus realtime pcr system进行定量,根据novaseq 6000的pe250模式pooling上机测序。
[0093]
3实验结果与分析
[0094]
3.1植物乳杆菌shy130对ⅱ型糖尿病小鼠体重、摄食量的影响
[0095]
如图5(a)所示,前5周,三组小鼠体重持续增加,组间无明显差异。在第6周注射stz,从第7周到第8周,所有hfd(高脂饲料)喂养组的体重显著下降。植物乳杆菌shy130干预后,shy130组小鼠体重下降得到缓解。16周末的最终体重值更直观的展现了各组小鼠的体重情况,如图5(b),d组小鼠体重(24.45
±
0.85g)显著低于nc组(26.38
±
1.28g),而shy130组小鼠(25.97
±
1.28g)与d组小鼠体重相比显著增加(p<0.05)。而在整个治疗过程中,三组小鼠的平均每日摄食量没有显著差异,如图5(c)。结果表明,植物乳杆菌shy130缓解了ⅱ型糖尿病小鼠的糖尿病特征。
[0096]
3.2植物乳杆菌shy130对ⅱ型糖尿病小鼠的血糖和糖耐量的影响
[0097]
如图6(a)所示,与nc组相比,其他两组小鼠在第6周时的fbg水平均显著高于nc组(p<0.05),表明糖尿病模型建立成功。经过10周处理后,d组小鼠fbg(17.69
±
2.46mmol/l)仍显著高于nc组(5.63
±
0.51mmol/l),同时,与d组相比,植物乳杆菌shy130灌胃10周后血糖水平(11.98
±
2.57mmol/l)显著下降(p<0.05)。
[0098]
为了检测葡萄糖稳态,我们测定了小鼠的ogtt。第16周结束时,研究发现ⅱ型糖尿病小鼠的葡萄糖耐量受损,d组小鼠的ogtt的auc是nc组的3倍以上,如图6(b,c)。植物乳杆菌shy130处理后,葡萄糖耐量水平显著地改善(p<0.05)。上述结果表明,植物乳杆菌shy130具有改善ⅱ型糖尿病小鼠高血糖和糖耐量的潜力。
[0099]
3.3植物乳杆菌shy130对ⅱ型糖尿病小鼠血清胰岛素、homa
‑
ir和胰高血糖素水平的影响
[0100]
胰岛素抵抗是ⅱ型糖尿病的主要发病机制之一,可以通过homa
‑
ir进行评估,改善胰岛素抵抗是治疗糖尿病的良好途径。如图7所示,d组小鼠的血清胰岛素、胰高血糖素、homa
‑
ir水平显著高于nc组(p<0.05)。与d组小鼠相比,shy130组小鼠显著降低了胰岛素、胰高血糖素和homa
‑
ir水平(p<0.05)。
[0101]
3.4植物乳杆菌shy130对ⅱ型糖尿病小鼠胰腺组织病理学的影响
[0102]
胰腺切片进行h&e染色来评价植物乳杆菌shy130对糖尿病小鼠胰岛β细胞损伤的保护作用,如图8(a)所示。nc组小鼠胰岛呈圆形或椭圆形细胞簇,分散于边界清晰的健康腺泡细胞内。与nc组相比,d组胰岛数量明显减少且胰岛形态不规则、萎缩。此外,d组小鼠胰岛细胞表现为核萎缩或核溶解、细胞坏死、空泡化等退行性改变,表明了高脂饮食结合stz对胰腺结构的损害。植物乳杆菌shy130改善了胰腺组织异常,胰岛数量明显增加,形状改善,细胞损伤减轻。
[0103]
为了进一步评价植物乳杆菌shy130对ⅱ型糖尿病小鼠胰岛的影响,我们对胰腺组织切片进行了胰岛素和胰高血糖素双免疫荧光染色,如图8(b)。与nc组相比,d组的β细胞(胰岛素阳性)面积显著减少(p<0.05)(图8(c)),α细胞(胰高血糖素阳性)的面积显著增加(p<0.05)(图8(d))。我们还观察到d组小鼠的胰岛形状不规则,与图8(a)中胰腺的h&e染色结果一致。与d组相比,shy130组小鼠β细胞面积显著增加(p<0.05),α细胞面积显著减少(p<0.05),表明植物乳杆菌shy130对胰腺损伤具有保护作用。
[0104]
3.5植物乳杆菌shy130对ⅱ型糖尿病小鼠结肠病理学和gpr43、gpr41表达的影响
[0105]
根据图9(a)所示结肠组织的h&e染色结果,nc组小鼠结肠黏膜上皮细胞连接紧密,黏膜结构完整,肌层较厚,组织致密。与nc组相比,d组小鼠结肠组织出现连接损伤并伴有炎症细胞浸润。而经植物乳杆菌shy130处理后,结肠损伤状态明显改善。
[0106]
此外,通过检测结肠组织中gpr43和gpr41的表达水平,进一步探讨植物乳杆菌shy130改善t2dm小鼠高血糖的机制。如图9(b,c,d)免疫荧光结果显示,与nc组相比,d组小鼠的gpr43、gpr41的表达明显减弱(p<0.05)。与d组相比,植物乳杆菌shy130显著增强了gpr43、gpr41的表达(p<0.05)。
[0107]
3.6植物乳杆菌shy130对ⅱ型糖尿病小鼠血清glp
‑
1水平的影响
[0108]
glp
‑
1是一种由肠道释放的肠促胰激素,可刺激葡萄糖依赖的内源性胰岛素分泌,抑制胰高血糖素分泌。如图9(e)所示,与nc组相比,d组小鼠血清glp
‑
1水平显著降低(p<0.05)。而植物乳杆菌shy130显著提高了glp
‑
1水平(p<0.05)。
[0109]
3.7植物乳杆菌shy130对ⅱ型糖尿病小鼠粪便scfas含量和ph值的影响
[0110]
肠道微生物群在调节宿主健康中起着关键作用,其机制之一是scfas的产生,scfas对宿主代谢和肠道免疫产生重要影响,而scfas的降低与ⅱ型糖尿病密切相关。如图10所示,d组小鼠粪便的总scfas水平显著低于nc组小鼠(p<0.001)。与d组相比,植物乳杆菌shy130处理显著提高了scfas水平(p<0.05)。其中植物乳杆菌shy130处理显著提高了粪便中乙酸、丁酸和异戊酸水平(p<0.05),而丙酸、异丁酸和戊酸的粪便水平并没有显著提高(p>0.05)。
[0111]
d组小鼠的粪便ph值显著高于nc组(p<0.001),而与d组相比,植物乳杆菌shy130组小鼠的ph值显著降低(p<0.01)。粪便ph值降低同时也意味着scfas产量的增加。
[0112]
3.8植物乳杆菌shy130对ⅱ型糖尿病小鼠的肠道菌群整体结构的影响
[0113]
经过质量过滤,在97%的相似度水平下,我们识别出737个otu。如图11(a)所示,三组之间共有的otu有307个。值得注意的是,nc组存在159个特有的otu,shy130组存在68个特有的otu,而d组仅发现37个。
[0114]
采用chao 1指数和shannon多样性指数作为α多样性的度量指标对肠道菌群的总体结构进行分析。如图11(b和c)所示,与d组相比,植物乳杆菌shy130处理后shannon多样性指数无明显变化(p>0.05),三组间chao1指数均无显著差异(p>0.05)。
[0115]
如图11(d)所示,使用未加权unifrac的pcoa图分析肠道菌群的总体结构变化,结果表明,nc组和d组的结构出现了明显的分离。d组与shy130组的肠道菌群结构也存在明显的变化,说明植物乳杆菌shy130改变了对ⅱ型糖尿病小鼠肠道菌群的整体结构。
[0116]
3.9植物乳杆菌shy130对ⅱ型糖尿病小鼠的肠道菌群组成的影响
[0117]
图12(a)展示了三组小鼠的肠道微生物在门水平上的构成。我们的数据显示,与nc组相比,d组小鼠的门水平上的微生物构成发生了急剧地变化,拟杆菌门(bacteroidetes)的相对丰度减少了89.63%,厚壁菌门(firmicutes)的相对丰度水平增加了40.28%,firmicutes/bacteroidetes的比值也显著升高(p<0.01)。如图12(b)所示,植物乳杆菌shy130对firmicutes/bacteroidetes的比值进行了调节(p<0.05),使bacteroidetes的丰度提高了95.30%,而厚壁菌门firmicutes的丰度降低了19.05%。
[0118]
此外,图12(c)展现了三组小鼠的肠道菌群在属水平上的变化。如图12(d)所示,与d组小鼠相比,植物乳杆菌shy130处理的小鼠中faecalibaculum、odoribacter、alistipes、bacteroidetes的丰度显著增加。以往研究显示,上述4种属的大多数细菌都是scfa的产生菌,而scfa对肠道屏障和代谢功能存在有益影响。有趣的是,d组小鼠的肠道菌群中的dubosiella属比nc组小鼠增加了4.7倍(p<0.05),而植物乳杆菌shy130使其完全恢复正常。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1