一种耐高温餐厨垃圾腐熟复合菌剂及其制备方法和应用与流程
1.本发明属于有机质垃圾处理技术领域,具体涉及一种耐高温餐厨垃圾腐熟复合菌剂及其制备方法和应用。
背景技术:
2.餐厨垃圾是一种典型的固体废弃物,其具有较高含水率,较差脱水性,在高温下极易腐烂进而滋长病菌及蚊蝇,但同时餐厨垃圾中也因含有淀粉及纤维素等有机质,而具有全面丰富的营养物质,所以具有很强的生物可降解性,鉴于此,利用生物法处理餐厨垃圾己经逐渐成为资源化处理餐厨垃圾的主要发展方向之一,有效及时地处理餐厨垃圾也能够极大程度上缓解环境污染,改善人们的生活环境。现在,对于如何成功的利用生物质资源作为日常的能源,己经是世界各国纷纷关注的研究热点。
3.目前,餐厨垃圾的常规处置方式有:(1)填埋;填埋产生的渗滤液极易污染土壤和空气环境(2)粉碎直排,较为污染环境且可以直排的空间在减少;(3)厌氧消化产沼气,沼渣依然需要处理,且产生的沼气因数量较少而不能持续使用;(4)好氧堆肥,可资源化利用是一种较为理想的处理方式;本发明即依赖好氧堆肥工艺而产生。
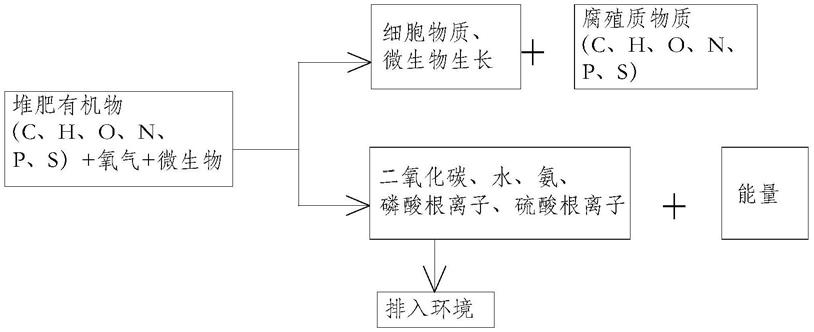
4.好氧堆肥的机理如下所示:微生物通过自身的代谢活动,使一部分有机物质被氧化成简单的无机物并释放能量,使另一部分有机物用于合成微生物自身的细胞物质,提供微生物各种生理活动斤需的能量,使机体能进行正常的生长繁殖。好氧堆肥反应过程如下表一所示。
5.表1
[0006][0007]
一般情况下,堆肥的过程可以分为两个主要阶段:生物氧化阶段和腐熟阶段,腐熟阶段又称为固定化阶段。生物氧化阶段通过三个步骤发生:(1)初始温度阶段持续1
‑
3d,其中的嗜温细菌和真菌对结构简单的化合物,如糖、氨基酸、蛋白质等进行降解,从而使得堆肥温度迅速上升;(2)高温阶段由嗜热微生物降解脂肪、纤维素、半纤维素和一些木质素,在此阶段最大限度的降解有机物并杀死病原菌;(3)腐熟降温阶段,温度的下降是由于可利用的有机物质的减少,导致微生物活动减弱,堆肥的质量可以通过检测能被嗜热微生物降解的残余的糖、纤维素和半纤维素的含量来判断,在腐熟降温阶段和有机物腐殖化发生过程
中,产生了含有腐殖质的成熟堆肥。
[0008]
微生物是参与堆肥化过程的主体,堆肥中微生物主要来源于两方面。一是固体废弃物中的土著微生物种群,例如城市垃圾中细菌数量达到10
14
‑
10
16
个/kg;二是人为加入的外源菌种,这些菌种是针对堆肥中某些物质进行分解的,其活性强、繁殖速度快、分解彻底等特点,加速了堆肥进程,缩短了堆肥时间。
[0009]
因此,微生物复合菌剂具有很大优势:(1)成本较低,只需要前期投入少量菌种即可,后期不需要添加或者添加量不多,因为腐熟料中残留很多数量的微生物菌株;(2)缩短发酵周期;(3)从源头减少臭味量,具有部分除臭效果;(4)菌种适应性强,能以餐厨垃圾为养分快速繁殖代谢。
[0010]
但目前的微生物复合菌剂研究现状,还存在以下主要问题:
[0011]
(1)餐厨垃圾组分复杂,微生物复合菌剂存在功能单一,限制了使用范围,导致处理效果不佳。
[0012]
(2)微生物复合菌剂的复配,对于菌种间合适比例和菌种间的拮抗作用考虑不全,导致产品质量和使用效果上不稳定,相关问题层出不穷。
[0013]
(3)餐厨垃圾好氧堆肥工艺存在高温阶段,温度能达到60
‑
70℃,这样才能杀死有害病菌和虫卵,无法耐受高温的菌种则无法生存和繁殖,最终影响降解效果。
[0014]
(4)微生物复合菌剂实际使用过程中,大部分人会忽视菌床培育过程,也很少添加菌剂引诱剂。
技术实现要素:
[0015]
为了解决上述问题,本发明提供了一种耐高温餐厨垃圾腐熟复合菌剂及其制备方法和应用,本发明的耐高温餐厨垃圾腐熟复合菌剂可耐高温,将该复合菌剂接种至餐厨垃圾内可对餐厨垃圾产生的臭味进行除臭,将该复合菌剂混合至出仓后的堆肥中时也可促进堆肥发酵和除臭。
[0016]
本发明中,tris
‑
saturated phenol表示tris饱和酚,rnasea表示核糖核酸酶,ddh2o表示双蒸水,kac表示醋酸钾,sds溶液表示十二烷基硫酸钠、ste buffer表示ste缓冲液,10mm tris
‑
hcl表示三羟甲基氨基甲烷盐酸盐、edta表示乙二胺四乙酸、te buffer表示te缓冲液、rnase表示核糖核酸酶、sds溶液表示十二烷基硫酸钠、kac表示醋酸钾。
[0017]
本发明所述耐高温餐厨垃圾腐熟复合菌剂的成分和体积比为:苏云金芽胞杆菌6份、地衣芽孢杆菌2份、嗜热脂肪地芽孢杆菌1份、枯草芽胞杆菌6份、放线菌1份、灰戴氏霉菌2份、热带假丝酵母菌6份。
[0018]
本发明提供的一种耐高温餐厨垃圾腐熟复合菌剂的制备方法,包括如下s1~s7的步骤:
[0019]
s1:由餐厨垃圾生化样品中制备出样品稀释液并制备相应基础培养基;s2:将样品稀释液进行涂布载体恒温恒湿培养;s3:对样品的菌落经过分离纯化,分离纯化后分别得到耐高温细菌、耐高温霉菌、耐高温放线菌和耐高温酵母菌;s4:对耐高温降解菌进行筛选;s5:对筛选后的耐高温降解菌进行菌种鉴定,并将鉴定后的菌种进行拮抗情况鉴定;s6:将上述相互不拮抗的菌种进行多组比菌剂复配,得到发酵效果最好的一组;s7:将发酵效果最好的菌剂制作成固态菌剂;
[0020]
在步骤s1中制备出样品稀释液的分离培养温度是60℃及以上,在此条件筛选到的微生物即耐高温降解菌;
[0021]
在s7中制作固态菌剂的方法包括如下(s7
‑
1)~(s7
‑
3)的步骤:
[0022]
s7
‑
1:制备载体;
[0023]
选择质量比例为(10
±
0.5):(3
±
0.5):(1
±
0.25):(1
±
0.25)的麦麸、麦壳、锯末、活性炭作为混合载体,研磨后灭菌烘干备用;
[0024]
s7
‑
2:制备供试菌菌液;
[0025]
种子培养:挑取斜面培养基中的单菌落至装有液体培养基的瓶中,(30
±
2)℃恒温培养箱培养(24
±
1)h;其中液体培养基与瓶的体积比例为(7.5:100)。
[0026]
发酵培养:将种子液以体积浓度0.5%
‑
1%的接种量至装有液体培养基的瓶中培养;细菌的培养条件是(30
±
2)℃200rpm(18
±
0.5)h;霉菌的培养条件是(35
±
2)℃200rpm(18
±
0.5)h;放线菌的培养条件是(35
±
2)℃180rpm(18
±
0.5)h;酵母菌的培养条件是(28
±
0.5)℃200rpm(16
±
0.5)h;
[0027]
s7
‑
3:固态供试菌菌液制备;
[0028]
复合微生物菌液与载体按照2:1的比例,葡糖糖的含量0.2
‑
0.5g/ml,海藻糖含量(0.15
‑
0.18)g/ml,丙三醇为复合微生物菌液体积的(3
±
0.5)%的含量;所述的苏云金芽胞杆菌、地衣芽孢杆菌、嗜热脂肪地芽孢杆菌、枯草芽胞杆菌、放线菌、灰戴氏霉菌、热带假丝酵母菌共七种菌液各400ml,有效活菌数>1
×
109cfu/ml,混合载体添加量为1400g,葡糖糖添加量为500g,海藻糖420g,丙三醇84ml;所述七种菌种的混合液与混合载体搅拌均匀,再依次加入丙三醇、葡糖糖和海藻糖;混匀后,放在(35
±
5)℃烘箱中烘至含水率为25%,固态剂型制备完成。
[0029]
进一步地,所述s7
‑
1中的具体操作步骤为:
[0030]
研磨后的混合载体,过30目筛网,(121
±
0.5)℃灭菌(30
±
5)min后,再放在(105
±
5)℃烘箱或烤箱中烘干。
[0031]
进一步地,所述s7
‑
2中的具体步骤为:
[0032]
挑取斜面培养基中的单菌落至装有液体培养基占瓶体体积7.5%的小口瓶体中,小口瓶体可以选择三角瓶等;其中,lb培养基用于筛选细菌;pda培养基用于筛选霉菌;高氏一号培养基用于筛选放线菌;mea培养基用于筛选酵母菌;
[0033]
进一步地,所述s7
‑
2中步骤中,将种子液以体积浓度0.5%
‑
1%的接种量至装有200ml液体培养基的500ml小口瓶中培养,小口瓶如三角瓶等。
[0034]
进一步地,所述s4中对耐高温降解菌进行筛选的方法包括如下(s4
‑
1)~(s4
‑
4)所示的步骤:
[0035]
s4
‑
1:淀粉分解菌的筛选;
[0036]
在平板上滴加卢卡氏碘液,淀粉分解菌附近会出现无色的透明圈;以d作为透明圈的直径,以d作为所得菌落的直径,以d/d之比作为标准以判断产淀粉酶菌对淀粉的分解能力的强弱,所述d/d之比也直接反映了淀粉酶浓度的相对值;将分离纯化得到的菌株点接在降解淀粉培养基上,倒置培养(24
±
1)h后,滴加卢卡氏碘液,测定d及d值,每个菌重复至少3个作为对照;
[0037]
s4
‑
2:蛋白质分解菌的筛选
[0038]
利用蛋白质分解菌能分泌蛋白酶,将蛋白质分解为多肤及氨基酸的特性,使蛋白质分解菌的菌落周围出现透明圈,以d作为透明圈的直径,以d作为菌落直径,以d/d之比作为标准以判断产蛋白酶菌对蛋白质的分解能力的强弱,所述d/d之比也直接反映了蛋白酶浓度的相对值;将分离纯化得到的菌株点接在降解蛋白质培养基上,倒置培养(24
±
1)h后,测定d及d值,每个菌重复至少3个作为对照;
[0039]
s4
‑
3:油脂分解菌的筛选;
[0040]
利用油脂分解菌能分泌脂肪酶,将脂肪分解为甘油和脂肪酸小分子的特性,使油脂分解菌的菌落周围出现被分解后朦胧的晕圈;以d作为晕圈的直径,以d作为菌落直径,以d/d之比作为标准以判断产脂肪酶菌对油脂的分解能力的强弱,所述d/d之比也直接反映了脂肪酶浓度的相对值;将分离纯化得到的菌株点接在降解油脂培养基上,倒置培养(24
±
1)h后,测定d及d值,每个菌重复至少3个作为对照;
[0041]
s4
‑
4:纤维素分解菌的筛选;
[0042]
纤维素分解菌的水解产物与刚果红染液不显色,而纤维素与刚果红结合呈现红色,因此在纤维素刚果红培养基上,纤维素分解菌的菌落附近会出现水解圈;以d作为水解圈的直径,以d作为菌落直径,以d/d之比作为标准以判断产纤维素酶菌对纤维素的分解能力的强弱,所述d/d之比也直接反映了纤维素酶浓度的相对值;将分离纯化得到的菌株点接在降解纤维素培养基上,倒置培养(24
±
1)h后,测定d及d值,每个菌重复至少3个作为对照。
[0043]
进一步地,所述s5中对筛选后的耐高温降解菌进行菌种鉴定包括如下(s5
‑
1)~(s5
‑
3)的步骤
[0044]
s5
‑
1:细菌dna提取;
[0045]
s5
‑1‑
1:1ml的细胞悬液在8000g下离心2min;弃去上清液以后,用400μl ste buffer冲洗细胞两次;然后在8000g下离心2min,弃去上清;其中400μl ste buffer的组成包括100mm nacl、10mm tris/hcl、1mm edta、ph 8.0;
[0046]
s5
‑1‑
2:用200μlte buffer悬浮细胞,然后用ph为8.0的100μl的tris
‑
saturated phenol,加到离心管中,涡旋混合60s;其中200μlte buffer悬浮细胞的组成为10mm tris
‑
hcl、1mm edta、ph 8.0;
[0047]
s5
‑1‑
3:接着在4℃下用13000g离心5min以从有机相中分离出水相,然后取160μl上清液转移到干净的1.5ml ep管中;
[0048]
s5
‑1‑
4:加40μl的te buffer到ep管中,然后用100μl氯仿混合,在4℃,13000g离心5min。
[0049]
s5
‑1‑
5:用氯仿提取的方法纯化裂解液两到三遍后直到没有白色的界面出现;
[0050]
s5
‑1‑
6:取160μl上清液到干净的1.5ml ep管中,再加40μlte和5μl的rnase(10mg/ml)并在37℃下放置10min,以分解rna;
[0051]
s5
‑1‑
7:接着将100μl的氯仿加到离心管中,混合后,在4℃下13000g离心5min;
[0052]
s5
‑1‑
8:再将150μl的上清液转移到干净的1.5ml ep管中;
[0053]
此时的上清液包含有纯化的dna,而且可以直接用于序列实验并可以在
‑
20℃下保存;接着就可以用分光光度计测a260/a280 ratios;
[0054]
s5
‑
2:真菌dna提取;
[0055]
s5
‑2‑
1:离心菌体,再用灭菌ddh2o冲洗2次,放入经液氮预冷的研钵中,加入液氮
研磨至粉末状,用干净的灭菌不锈钢勺转移粉末到加有500μl提取液的离心管中,轻轻混匀;
[0056]
s5
‑2‑
2:向管中加入50μl 20%sds溶液,混匀,不可过于强烈震荡以防基因组dna断裂,65℃保温10min,并不时摇动;
[0057]
s5
‑2‑
3:加入150μl 5mol/l kac,混匀,置冰上20
‑
30min;
[0058]
s5
‑2‑
4:4℃,15000rpm离心15min,转移上清到另一离心管中,加入0.7v的异丙醇,混匀,
‑
20℃沉淀30min;
[0059]
s5
‑2‑
5:12000rpm离心10min回收基因组dna沉淀,吹干后加入适量的灭菌ddh2o或te溶解dna;
[0060]
s5
‑2‑
6:加入1/10体积的rnasea,37℃保温20min,除去rna;
[0061]
s5
‑2‑
7:c:i抽提后,加2v乙醇,
‑
20℃沉淀30min。12000rpm离心10min回收基因组dna沉淀;
[0062]
s5
‑2‑
8:用400μl 70%乙醇洗一次后,吹干,加入适量的灭菌ddh2o或te溶解dna;
[0063]
此时的上清液包含有纯化的dna,而且可以直接用于序列实验并可以在
‑
20℃下保存;接着就可以用分光光度计测a260/a280 ratios;
[0064]
s5
‑
3:凝胶电泳;
[0065]
引物序列
[0066]
27f:5’agagtttgatcctggctcag 3'
[0067]
1492r:5tacggctaccttgttacgactt 3'
[0068]
pcr扩增
[0069]
pcr反应体系(25μl):2.5μl 10
×
buffer、0.5μl 10mmdntp、引物各1μl、0.3μl(5u/μl)的taq酶和1μldna模板;
[0070]
pcr反应程序:94℃预变性5min,94℃变性30s,55℃退火45s,72℃延伸1min 30s,35个循环,最后72℃延伸10min;
[0071]
pcr产物的检测:取2μl pcr产物,点样于1.5%的琼脂糖凝胶中,以100bp marker作为标准分子量,100v电压,电泳40min,eb染色,用凝胶成像系统观察结果;
[0072]
通用16srrna引物扩增出来的片段有(1500
±
100)bp,凝胶成像系统观察到所有菌株在(1500
±
100)bp处都产生绿色荧光,说明每个菌种的16srrna得到提取;用切割工具将每个菌种在1500bp处的荧光条带分别切下,做好标记,然后送到测序公司测序;
[0073]
从测序公司测序后,将所得序列在网站eztaxon
‑
e.ezbiocloud.net核酸序列数据库中进行同源序列比较。
[0074]
进一步地,所述s5中对筛选鉴定后的菌种进行拮抗情况鉴定采用的是五点对峙法,所述五点对峙法包括如下步骤:
[0075]
将菌种鉴定后的菌株接种在lb培养基,pda培养基,高氏一号培养基和mea固体培养基平板中央,然后在距离菌种点(3
±
0.5)cm处点种待筛选菌株;以不接种菌株作为对照,置于(27
±
1)℃培养箱中培养,直到对照长满整个平板为止,筛选出无拮抗菌株;重复上述步骤至少3次,进行复筛,确保菌株间无拮抗作用;菌株间如果不存在拮抗作用,在五点对峙法平板上表现为两个菌种之间不会出现真空带,或两个菌种最终会混合生长在一块。
[0076]
进一步地,所述s6中对相互不拮抗的菌种进行多组比菌剂复配得到发酵效果最好
的一组的方法,包括如下(s6
‑
1)~(s6
‑
2)步骤:
[0077]
s6
‑
1:制备菌液;
[0078]
种子培养:挑取(斜面)培养基中的单菌落至装有液体培养基的瓶中,(30
±
2)℃恒温培养箱培养(24
±
1)h;其中,液体培养基与瓶的体积比例为(7.5:100),lb培养基用于筛选细菌;pda培养基用于筛选霉菌;高氏一号培养基用于筛选放线菌;mea培养基用于筛选酵母菌;
[0079]
发酵培养:将种子液以体积浓度0.5%
‑
1%的接种量至装有液体培养基的瓶中培养,其中,液体培养基与瓶的体积比例为(2:5);细菌的培养条件是(30
±
2)℃200rpm(18
±
0.5)h;霉菌的培养条件是(35
±
2)℃200rpm(18
±
0.5)h;放线菌的培养条件是(35
±
2)℃180rpm(18
±
0.5)h;酵母菌的培养条件是(28
±
0.5)℃200rpm(16
±
0.5)h;
[0080]
s6
‑
2:复合菌剂的复配;
[0081]
经s6
‑
1发酵培养后,制得苏云金芽胞杆菌、地衣芽孢杆菌、嗜热脂肪地芽孢杆菌、枯草芽胞杆菌、放线菌、放线菌、灰戴氏霉和热带假丝酵母菌,各个菌种配制相同体积的菌悬液,有效活菌数>1
×
109cfu/ml,进行正交设计;以餐厨垃圾为原料,进行有氧堆肥制作,从而得到本技术所述的各组份和配比。
[0082]
另外本发明还提供了一种耐高温餐厨垃圾腐熟复合菌剂的应用,所述耐高温餐厨垃圾腐熟复合菌剂由以上所述的任一方法制备而成,具体应用包括:将制备好的或固态或液态状态的耐高温餐厨垃圾腐熟复合菌剂投入到餐厨垃圾生化发酵的仓体内进行生化发酵,或将耐高温餐厨垃圾腐熟复合菌剂混入到出仓后的堆肥中进行生化发酵。
[0083]
与现有技术相比,本发明的有益效果体现在:
[0084]
(1)从餐厨垃圾生化仓样品中,通过选择培养基的筛选,得到耐高温的降解餐厨垃圾不同组分的菌种,因不同组份的菌种已经进行过拮抗情况鉴定,再将各活的菌种进行复配得到最佳菌种复配比。
[0085]
(2)本发明中的微生物复合菌剂中的菌株是耐60
‑
70℃高温的耐高温菌剂,在60
‑
70℃的情况下,不仅能杀死有害病菌和虫卵,还不影响菌种的活性。
[0086]
(3)本发明中的微生物复合菌剂采用的是固态发酵剂型,有利菌种保藏与运输。此外,菌剂中添加了菌剂引诱剂,有利于菌种数目的增大,即同等数量菌种所花时间变短。
[0087]
(4)本发明中的微生物复合菌剂中添加苏云金芽孢杆菌,其晶体蛋白对蚊、蝇等昆虫具有毒杀作用,对细菌没有抑制作用。
[0088]
(5)本发明中的复合菌剂包含的菌种均从餐厨垃圾生化仓样品中筛选得到,不会对周围环境和生态平衡造成危害。
附图说明
[0089]
无附图。
具体实施方式
[0090]
下面结合具体实施方式,对本发明的制备方法和基于该制备方法所制备的复合微生物除臭菌剂及其应用做进一步详细的说明。
[0091]
实施例1:
[0092]
本发明提供了一种耐高温餐厨垃圾腐熟复合菌剂,包括:
[0093]
苏云金芽胞杆菌、地衣芽孢杆菌、嗜热脂肪地芽孢杆菌、枯草芽胞杆菌、放线菌、灰戴氏霉菌、热带假丝酵母菌;各组份体积比为苏云金芽胞杆菌6份、地衣芽孢杆菌2份、嗜热脂肪地芽孢杆菌1份、枯草芽胞杆菌6份、放线菌1份、灰戴氏霉菌2份、热带假丝酵母菌6份蕈状芽胞杆菌。
[0094]
实施例2:
[0095]
本发明提供了一种耐高温餐厨垃圾腐熟复合菌剂的制备方法,包括如下s1~s7的步骤
[0096]
本发明在制备前,需先制备好各种培养基,培养基配方如下:
[0097]
lb培养基配方:胰蛋白胨(tryptone)10g/l,酵母提取物(yeast extract)5g/l,氯化钠(nacl)10g/l,加15g~20g琼脂粉,蒸馏水1000毫升,ph7.4,121℃灭菌20min。
[0098]
高氏1号培养基配方:可溶性淀粉(20g),kno3(1g),k2hpo4(0.5g),mgso4
·
7h2o(0.5g),nacl(0.5g),feso4
·
7h2o(0.01g),琼脂20g,ph=7.4
‑
7.6。
[0099]
mea培养基:麦芽浸粉30g,琼脂15.0g,大豆胨3.0g,ph5.4
‑
5.8,121℃灭菌20min。
[0100]
pda培养基:马铃薯200g,葡萄糖20g,琼脂15
‑
20g,115℃灭菌20min。
[0101]
降解淀粉培养基:可溶性淀粉20.0g,蛋白胨5.0g,氯化钠(naci)5.0g,琼脂20.0g,蒸馏水1000ml,ph7.2
‑
7.4。
[0102]
降解蛋白质培养基:干酪素4.0g,氯化锌(zncl2)0.14g,氯化钠(naci)0.16g,氯化钙(cac12)0.002g,七水合硫酸镁(mgso4
‑
7h2o)0.5g,硫酸亚铁(feso4)0.002g,七水合磷酸氢二钠(na2hpo4.7h2o)1.07g,酪素水解液0.05g,磷酸二氢钾(kh2po4)0.36g,琼脂20.0g,蒸馏水1000ml,ph6.5
‑
7.0。
[0103]
降解油脂培养基:氯化钠(nacl)5.0g,磷酸二氢钾(kh2po4)0.3g,七水合硫酸镁(mgso4
‑
7h2o)0.lg,磷酸氢二钾(k2hpo4)1.5g,硫酸氨((nh4)2so4)1.0g,豆油5.0ml,琼脂20.0g,蒸馏水1000ml,ph7.2
‑
7.4。
[0104]
降解纤维素培养基:磷酸二氢钾(kh2po4)0.5g,七水合硫酸镁(mgso4
‑
7h2o)0.25g,琼脂20.0g,羧甲基纤维素钠(cmc
‑
na)2.0g,刚果红染料0.2g,蒸馏水1000ml,ph7.0。
[0105]
上述培养基制备好后,开始对本发明的耐高温餐厨垃圾腐熟复合菌剂进行制备,耐高温餐厨垃圾腐熟复合菌剂的制备方法,具体包括如下s1~s7的步骤:
[0106]
首先从餐厨垃圾样品中提取出耐高温菌株,并对耐高温菌株进行分离;
[0107]
s1:制备样品稀释液;
[0108]
称取样品10g,倒入250ml的三角瓶中,加入90ml高温灭菌的生理盐水,震荡20min,使样品与生理盐水充分混匀,静置20
‑
30s,此时稀释液为10
‑
1。吸取1ml上述液体至9ml小试管中,制成10
‑
2菌液,以此类推,制得10
‑
3,10
‑
4,10
‑
5浓度梯度的样品释液。
[0109]
s2:涂布+恒温恒湿培养
[0110]
配置lb培养基,pda培养基,高氏一号培养基和mea培养基,高温灭菌后冷却至50℃
‑
60℃,倒入无菌平板,形成固体平板。选取100μl上述各浓度梯度的稀释液,分别滴加在4种固体平板上,并用已灭菌的涂布棒涂布均匀,每个梯度做3个对照,并做好相应标记。
[0111]
将经过接种的培养皿倒置放于恒温恒湿培养箱中,温度设置为60℃,湿度为40%,培养12h~24h小时后取出观察菌落生长状态。
[0112]
s3:分离纯化
[0113]
选取经涂布培养后,固体培养基上菌落数为20~200个的培养皿,挑选形态大小不同、有明显差异的单个菌落,采用平板划线法在lb培养基,pda培养基,高氏一号培养基和mea培养基上划线分离,传代3
‑
5次,分离纯化;将纯化后的菌种接种在相应斜面培养基,并保藏于4℃冰箱,待用。
[0114]
lb培养基用于筛选细菌;pda培养基用于筛选霉菌;高氏一号培养基用于筛选放线菌;mea培养基用于筛选酵母菌。
[0115]
通过上述温度60℃和湿度40%的培养,在lb培养基,pda培养基,高氏一号培养基和mea培养基平板上分别得到耐高温细菌、耐高温霉菌、耐高温放线菌和耐高温酵母菌。
[0116]
s4:耐高温降解菌的筛选
[0117]
s4
‑
1:淀粉分解菌的筛选
[0118]
淀粉分解菌可以分泌淀粉酶,淀粉酶可将淀粉水解成麦芽糖和葡萄糖。淀粉遇碘显蓝色,而麦芽糖和葡萄糖遇碘不显色,所以在平板上滴加卢卡氏碘液,菌落附近会出现无色的透明圈。以d/d之比作为标准以判断产淀粉酶菌对淀粉的分解能力的强弱,直接反映了淀粉酶浓度的相对值,其中,d代表透明圈的直径,d代表所得菌落的直径。
[0119]
将分离纯化得到的菌株点接在降解淀粉培养基上,倒置培养24h后,滴加卢卡氏碘液,用游标卡尺测定d及d值,每个菌重复3个作为对照。
[0120]
s4
‑
2:蛋白质分解菌的筛选
[0121]
蛋白质分解菌能分泌蛋白酶,将蛋白质分解为多肤及氨基酸等,使菌落周围出现透明圈。以d/d之比作为标准以判断产蛋白酶菌对蛋白质的分解能力的强弱,直接反映了蛋白酶浓度的相对值,其中,d代表透明圈的直径,d代表菌落直径。
[0122]
将分离纯化得到的菌株点接在降解蛋白质培养基上,倒置培养24h后,用游标卡尺测定d及d值,每个菌重复3个作为对照。
[0123]
s4
‑
3:油脂分解菌的筛选
[0124]
油脂分解菌能分泌脂肪酶,将脂肪分解为甘油和脂肪酸等小分子,使菌落周围出现被分解后朦胧的晕圈。以d/d之比作为标准以判断产脂肪酶菌对油脂的分解能力的强弱,直接反映了脂肪酶浓度的相对值,其中,d代表晕圈的直径,d代表菌落直径。
[0125]
将分离纯化得到的菌株点接在降解油脂培养基上,倒置培养24h后,用游标卡尺测定d及d值,每个菌重复3个作为对照。
[0126]
s4
‑
4:纤维素分解菌的筛选
[0127]
纤维素酶是一种复合酶,纤维素分解菌能够分泌多种纤维素酶,在其作用下,可将纤维素分解为低聚糖、纤维二糖及葡萄糖等小分子物质。水解产物与刚果红染液不显色,而纤维素与刚果红结合呈现红色,因此在纤维素刚果红培养基上,菌落附近会出现水解圈。以d/d之比作为标准以判断产纤维素酶菌对纤维素的分解能力的强弱,直接反映了纤维素酶浓度的相对值,其中,d代表水解圈的直径,d代表菌落直径。
[0128]
将分离纯化得到的菌株点接在降解纤维素培养基上,倒置培养24h后,用游标卡尺测定d及d值,每个菌重复3个作为对照。
[0129]
表2全部细菌菌株对淀粉、蛋白质、油脂和纤维素的降解效果
[0130][0131]
研究表明,当d/d0>1.3则表示该株菌对有机分解效果较好。由表2可知,编号x1、x2、x4、x6的细菌菌株对四类有机物降解最佳,需要做进一步的菌种鉴定。
[0132]
表3全部霉菌菌株对淀粉、蛋白质、油脂和纤维素的降解效果
[0133][0134]
研究表明,当d/d0>1.3则表示该株菌对有机分解效果较好。由表3可知,编号m3的霉菌菌株对四类有机物降解最佳,需要做进一步的菌种鉴定。
[0135]
表4全部放线菌菌株对淀粉、蛋白质、油脂和纤维素的降解效果
[0136][0137]
研究表明,当d/d0>1.3则表示该株菌对有机分解效果较好。由表4可知,编号f2与f4放线菌菌株对四类有机物降解最佳,需要做进一步的菌种鉴定。
[0138]
表5全部酵母菌菌株对淀粉、蛋白质、油脂和纤维素的降解效果
[0139][0140]
研究表明,当d/d0>1.3则表示该株菌对有机分解效果较好。由表5可知,编号j1的酵母菌菌株对四类有机物降解最佳,需要做进一步的菌种鉴定。
[0141]
s5:菌种鉴定
[0142]
s5
‑
1:细菌dna的提取
[0143]
s5
‑1‑
1)1ml的细胞悬液在8000g下离心2min。弃去上清液以后,用400μl ste buffer冲洗细胞两次,然后在8000g下离心2min,弃去上清;其中,400μl ste buffer的组成为100mm nacl,10mm tris/hcl、1mm edta、ph 8.0。
[0144]
s5
‑1‑
2)用200μlte buffer(10mm tris
‑
hcl、1mm edta,ph 8.0)悬浮细胞,然后用ph 8.0的100μl的tris
‑
saturated phenol加到离心管中,涡旋混合60s,其中,200μlte buffer的组成为10mm tris
‑
hcl、1mm edta,ph 8.0。
[0145]
s5
‑1‑
3)接着在4℃下用13000g离心5min以从有机相中分离出水相,然后取160μl上清液转移到干净的1.5ml ep管中。
[0146]
s5
‑1‑
4)加40μl的te buffer到ep管中,然后用100μl氯仿混合,在4℃,13000g离心5min。
[0147]
s5
‑1‑
5)用氯仿提取的方法纯化裂解液直到没有白色的界面出现;这个过程重复两到三遍。
[0148]
s5
‑1‑
6)取160μl上清液到干净的1.5ml ep管中,再加40μlte和5μl的rnase(10mg/ml)并在37℃下放置10min,以分解rna。
[0149]
s5
‑1‑
7)接着将100μl的氯仿加到离心管中,混合后,在4℃下13000g离心5min。
[0150]
s5
‑1‑
8)再将150μl的上清液转移到干净的1.5ml ep管中。
[0151]
此时的上清液包含有纯化的dna,而且可以直接用于序列实验并可以在
‑
20℃下保存。接着就可以用分光光度计测a260/a280 ratios。
[0152]
s5
‑
2:真菌dna的提取
[0153]
s5
‑2‑
1)离心菌体,再用灭菌ddh2o冲洗2次,放入经液氮预冷的研钵中,加入液氮研磨至粉末状,用干净的灭菌不锈钢勺转移粉末到加有500μl提取液的离心管中,轻轻混匀。
[0154]
s5
‑2‑
2)向管中加入50μl 20%sds溶液,混匀,不可过于强烈震荡以防基因组dna断裂,65℃保温10min,并不时摇动。
[0155]
s5
‑2‑
3)加入150μl 5mol/l kac,混匀,置冰上20
‑
30min。
[0156]
s5
‑2‑
4)4℃,15000rpm离心15min,转移上清到另一离心管中,加入0.7v的异丙醇,
混匀,
‑
20℃沉淀30min。
[0157]
s5
‑2‑
5)12000rpm离心10min回收基因组dna沉淀,吹干后加入适量的灭菌ddh2o或te溶解dna。
[0158]
s5
‑2‑
6)加入1/10体积的rnasea,37℃保温20min,除去rna。
[0159]
s5
‑2‑
7)c:i抽提后,加2v乙醇,
‑
20℃沉淀30min。12000rpm离心10min回收基因组dna沉淀。
[0160]
s5
‑2‑
8)用400μl 70%乙醇洗一次后,吹干,加入适量的灭菌ddh2 o或te溶解dna。
[0161]
此时的上清液包含有纯化的dna,而且可以直接用于序列实验并可以在
‑
20℃下保存。接着就可以用分光光度计测a260/a280 ratios。
[0162]
s5
‑
3:凝胶电泳
[0163]
引物序列
[0164]
27f:5’agagtttgatcctggctcag 3'
[0165]
1492r:5tacggctaccttgttacgactt 3'
[0166]
pcr扩增
[0167]
pcr反应体系(25μl):2.5μl10
×
buffer、0.5μl10 mmdntp、引物各1μl、0.3μl(5u/μl)的taq酶和1μl dna模板。
[0168]
pcr反应程序:94℃预变性5min,94℃变性30s,55℃退火45s,72℃延伸1min 30s,35个循环,最后72℃延伸10min。
[0169]
pcr产物的检测:取2μlpcr产物,点样于1.5%的琼脂糖凝胶中,以100bp marker作为标准分子量,100v电压,电泳40min,eb染色,用凝胶成像系统观察结果。
[0170]
通用16srrna引物扩增出来的片段大约1500bp,凝胶成像系统观察到所有菌株在1500bp处都产生绿色荧光,说明每个菌种的16srrna得到提取。用小刀将每个菌种在1500bp处的荧光条带分别切下,并做好标记,然后送到测序公司测序。
[0171]
从测序公司测序后,将所得序列在网站eztaxon
‑
e.ezbiocloud.net核酸序列数据库中进行同源序列比较,比对结果见表6
[0172]
表6菌种16s rrna菌种序列比对结果
[0173][0174]
[0175]
菌种x1、x2、x3、x4、f2、f4、m3、j1分别是苏云金芽胞杆菌、地衣芽孢杆菌、嗜热脂肪地芽孢杆菌、枯草芽胞杆菌、放线菌、放线菌、灰戴氏霉和热带假丝酵母菌。其中,f2和f4是同一种菌株(actinobacillus brumpt 1910)。
[0176]
s5
‑
4:拮抗作用鉴定
[0177]
采用五点对峙法:将菌种鉴定后的菌株接种在lb培养基,pda培养基,高氏一号培养基和mea固体培养基平板中央,然后在距离菌种点3cm处点种待筛选菌株。以不接种菌株作为对照,置于27℃培养箱中培养,直到对照长满整个平板为止,筛选出无拮抗菌株。重复上述步骤3次,进行复筛,确保菌株间无拮抗作用
[0178]
菌株间如果不存在拮抗作用,在五点对峙法平板上表现为两个菌种之间不会出现真空带,或两个菌种最终会混合生长在一块。
[0179]
试验证明菌种x1、x2、x3、x4、f2、m3和j1两两之间不存在拮抗作用。
[0180]
s6:菌剂的复配
[0181]
s6
‑
1:菌液制备
[0182]
种子培养:挑取斜面培养基中的单菌落至装有15ml液体培养基的200ml三角瓶中,30℃恒温培养箱培养24h。其中,lb培养基用于筛选细菌;pda培养基用于筛选霉菌;高氏一号培养基用于筛选放线菌;mea培养基用于筛选酵母菌。
[0183]
发酵培养:将种子液以体积浓度0.5%的接种量至装有200ml液体培养基的500ml三角瓶中培养。细菌的培养条件是30℃200rpm 18h;霉菌菌的培养条件是35℃200rpm 18h;放线菌的培养条件是35℃180rpm 18h;酵母菌的培养条件是28℃200rpm 16h。
[0184]
s6
‑
2:复合菌剂的复配
[0185]
苏云金芽胞杆菌、地衣芽孢杆菌、嗜热脂肪地芽孢杆菌、枯草芽胞杆菌、放线菌、放线菌、灰戴氏霉和热带假丝酵母菌,各个菌种配制体积为100ml的菌悬液,有效活菌数>1
×
109cfu/ml。然后,进行正交设计,如表7和表8所示,表7是正交试验因素水平表,表8试验正交表。
[0186]
表7正交试验因素水平表
[0187][0188]
表8试验正交表l
18
(37)
[0189][0190]
s6
‑
3:不同复配比发酵效果
[0191]
以餐厨垃圾为原料,进行有氧堆肥发酵,表9是不同复配比发酵效果数据,
[0192]
表9不同复配比的发酵效果
[0193]
[0194][0195]
表9中,实验组17的效果最佳。查询正交表格,苏云金芽胞杆菌、地衣芽孢杆菌、嗜热脂肪地芽孢杆菌、枯草芽胞杆菌、放线菌、放线菌、灰戴氏霉、热带假丝酵母菌7种菌种的配比是6:2:1:6:1:2:6。
[0196]
s7:固态菌剂制备方法
[0197]
s7
‑
1:载体的制备
[0198]
选择麦麸、麦壳、锯末、活性炭作为混合载体,其相应质量比例为10:3:1:1(麦麸:麦壳:锯末:活性炭),将其研磨,过30目筛网,121℃灭菌30min,然后放在105℃烘箱中烘干备用。
[0199]
s7
‑
2:供试菌菌液制备
[0200]
种子培养:挑取斜面培养基中的单菌落至装有15ml液体培养基的200ml三角瓶中,30℃恒温培养箱培养24h。其中,lb培养基用于筛选细菌;pda培养基用于筛选霉菌;高氏一号培养基用于筛选放线菌;mea培养基用于筛选酵母菌。
[0201]
发酵培养:将种子液以体积浓度0.5%的接种量至装有200ml液体培养基的500ml三角瓶中培养。细菌的培养条件是30℃200rpm 18h;霉菌菌的培养条件是35℃200rpm 18h;
放线菌的培养条件是35℃180rpm 18h;酵母菌的培养条件是28℃200rpm 16h。
[0202]
s7
‑
3:配置方法
[0203]
复合微生物菌液与载体按照2∶1的比例,葡糖糖的含量0.2
‑
0.5g/ml,海藻糖含量0.15g/ml,丙三醇为复合微生物菌液体积的3%。
[0204]
因此,7种菌液各400ml,混合载体添加量为1400g,葡糖糖添加量为500g,海藻糖420g,丙三醇84ml;其中,7种菌液的有效活菌数均>1
×
109cfu/ml。首先,7个菌种的混合液与混合载体搅拌均匀,再依次加入丙三醇、葡糖糖和海藻糖。混匀后,放在35℃烘箱中烘至含水率为25%,固态剂型制备完成。
[0205]
实施例3:
[0206]
本发明还提供了一种耐高温餐厨垃圾腐熟复合菌剂的应用,包括按照上述制备方法将所制备好的或液态状态或固态状态的耐高温餐厨垃圾腐熟复合菌剂,投入到餐厨垃圾生化发酵的仓体内进行生化发酵除臭,或将耐高温餐厨垃圾腐熟复合菌剂混入到出仓后的堆肥中进行生化发酵除臭。以固态菌剂为例在餐厨垃圾上的应用实例如下
[0207]
筛选三种市面上销售较好的腐熟剂t1、t2与t3,其中t1是舒国餐厨垃圾降解菌剂、t2是强兴堆肥发酵剂、t3是金宝贝肥料发酵剂,以餐厨垃圾为原料,按照好氧堆肥工艺处理,餐厨垃圾前段预处理一致,空白试验作为对照,检测固态菌剂的实际效果。
[0208]
经过实验验证得出如下表格10:
[0209]
表10不同菌剂的发酵效果
[0210][0211]
从表10的数据可以看出,固态菌剂的优势较为明显,其中,影响发酵温度、发酵时间及最终的种子发芽指数使用固态菌剂的各项指标都明显优于现市面上销售较好的腐熟剂t1、t2与t3。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1