一种肝脏类器官培养芯片及其制备方法与应用
1.本发明涉及组织工程和器官芯片技术领域,特别涉及一种肝脏类器官培养芯片及其制 备方法与应用。
背景技术:
2.类器官是器官特异性细胞的集合,这些细胞从干细胞或器官祖细胞发育而来,并能以 与人体内相似的方式经细胞分序和空间限制性的系别分化而实现自我组建。简而言之,类 器官是一种基于三维(three
‑
dimensional,3d)体外细胞培养系统,可复制出已分化组织的 复杂空间形态,并能够表现出细胞与细胞之间,细胞与其周围基质之间的相互作用和空间 位置形态。类器官能做到与人体内分化的组织具有相似的生理反应,与人体来源组织具有 极高的相似性。与传统二维(two
‑
dimensional,2d)细胞培养模式相比,类器官具有实质 性的改进。类器官包含多种细胞类型,突破了细胞间单纯的物理接触联系,形成了更加紧 密的细胞间、细胞与基质间高度相互作用,形成具有功能的“微器官”,能更好地用于模拟器 官组织的发生过程及生理病理状态,在基础研究以及临床诊疗方面具有广阔的应用前景和 商业价值。
3.目前,类器官的培养以基质胶培养为主。例如,肝脏类器官传统的培养方法是依赖于 matrigel的胶滴培养法。利用基质胶培养方法得到的肝脏类器官在形状、大小、以及细胞组 成等方面表现出极大的异质性,严重影响了肝脏类器官培养的质量可控性。此外,在基质 胶中培养的过程中,肝脏类器官之间相对位置容易发生变化,难以定位观察。上述局限性 导致了肝脏类器官的培养过程复杂、差异性大、通量低且不易于实时监测等局限性。
4.因此,为了克服上述传统肝脏类器官培养过程复杂、差异性大、通量低且不易于实时 监测等技术问题,有必要开发一种高通量原位培养肝脏类器官培养芯片,以用于肝脏类器 官的应用研究中。
技术实现要素:
5.本发明目的是提供一种肝脏类器官培养芯片及其制备方法与应用,适用于不同来源或 者是不同组织类型的均一且高通量的肝脏类器官培养。
6.为了实现上述目的,本发明采用如下技术方案:
7.在本发明的第一方面,提供了一种肝脏类器官培养芯片,包括:
8.细胞培养板;
9.具有微孔阵列的生物材料,设于所述细胞培养板内;其中,所述生物材料包括琼脂糖、 聚乙二醇和海藻酸钠中的至少一种;所述生物材料上设有多个微孔,且多个所述微孔均匀 排列形成所述微孔阵列。
10.进一步地,每个所述微孔的深度为0.1mm~5mm。
11.进一步地,相邻两个所述微孔之间距离为10μm~1mm。
12.进一步地,每个所述微孔的面积为78.00μm2~78.5mm2。
13.进一步地,所述生物材料具有生物相容性好、良好的光学通透性、易成型且疏水性或 经疏水性处理的特点,例如0.5%~10%的琼脂糖。
14.进一步地,所述细胞培养板包括96孔板、48孔板、24孔板、12孔板、6孔板、3.5cm 培养皿、6cm培养皿和10cm培养皿中的一种。
15.在本发明的第二方面,提供了所述肝脏类器官培养芯片的制备方法,所述方法包括:
16.在pmma上进行制作,获得具有微孔阵列的pmma阴模;
17.将pdms倒入所述pmma阴模上,真空干燥并抽真空,烘干后剥离,获得具有微孔阵 列的pdms阳模;
18.将液体生物材料倒入所述pdms阳模上,凝固后剥离,获得具有微孔阵列的生物材料;
19.将所述具有微孔阵列的生物材料处理成契合于细胞培养板的外形,后设于所述细胞培 养板上,获得肝脏类器官培养芯片。
20.在本发明的第三方面,提供了一种采用所述肝脏类器官培养芯片的类器官培养方法, 所述方法包括:
21.将常规培养的人胚胎干细胞或人诱导多功能干细胞消化成单个细胞,将所述单个细胞 接种于培养基中培养,获得前肠胚细胞;
22.将所述前肠胚细胞消化成单个细胞后接种于所述肝脏类器官培养芯片中的所述微孔阵 列中培养,获得肝脏类器官。
23.进一步地,所述单个人胚胎干细胞或人诱导多功能干细胞接种于培养基中培养,获得 前肠胚细胞,包括:
24.将所述单个细胞按照1
×
105/cm2接种于第一培养基中培养,所述第一培养基为含有100 ng/ml activina和50ng/ml bmp4的rpmi培养基;(所述rpmi培养基含有1%pen/strep 和25mm hepes,下同);
25.所述培养第二天换成第二培养基,所述第二培养基为:含有100ng/ml activina和0.2% knockout serum replacement的rpmi培养基;
26.所述培养第三天换成第三培养基培养,获得内胚层细胞,所述第三培养基为:含有100 ng/ml activin a和2%knockout serum replacement的rpmi培养基;rpmi培养基培养基(含 有1%b27、1%n2、10mm hepes、1%glutamax、1%gentamycin/amphotericin solution, 下同);
27.将所述内胚层细胞采用第四培养基培养1~3天,获得前肠胚细胞;其中,所述第四培 养基为:含有500ng/ml的fgf2和3μm chir99021的advanced dmem/f12。
28.进一步地,所述前肠胚细胞接种于所述肝脏类器官培养芯片中的所述微孔阵列中培养, 获得肝脏类器官,包括:
29.将所述前肠胚细胞消化成单个细胞,按照200/孔接种于所述肝脏类器官培养芯片中的 所述微孔阵列中,用含有80ng/ml fgf2和3μm chir99021的advanced dmem/f12培养 基维持培养,获得肝脏类器官。
30.上述技术方案中,肝脏类器官的类型包括但不限于psc或者eb来源的肝脏类器官、 成体干细胞来源的肝脏类器官、肝脏相关的肿瘤类器官。
31.本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
32.本发明提供的一种肝脏类器官培养芯片及其制备方法与应用,适用于不同来源或者是 不同组织类型的均一且高通量的肝脏类器官培养,微孔阵列可匹配各种市售的培养器皿, 充分考虑生物学家的操作习惯,降低学习成本,具有很高的用户友好性。此外,微孔阵列 与现有的细胞培养孔板高度结合,对现有的生物分析及成像仪器均有良好的兼容性;具体 地:
33.(1)本发明提供的一种肝脏类器官培养芯片,首次采用具有微孔阵列的生物材料应用 于肝脏类器官的培养,所述生物材料包括琼脂糖、聚乙二醇和海藻酸钠中的至少一种;采 用所述生物材料具有生物相容性好、良好的光学通透性和易成型的优点。
34.(2)本发明提供的一种肝脏类器官培养芯片的制备方法,操作简单,微孔阵列的微孔 单元可以根据需求实现定制化设计,适用于多种类型的肝脏类器官的培养,具有重复性高 且操作可控性强等优势,对于普通实验室和批量生产均有较好的优势。
35.(3)本发明提供的肝脏类器官培养方法,每个微孔理论接种200个前肠胚细胞,能够 有效地保证肝脏类器官的形成。每孔细胞量少于100个,则不能形成肝脏类器官;细胞量 超过400个,则形成的肝脏类器官死细胞较多,不利于类肝脏类器官的培养。
附图说明
36.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的 附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领 域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附 图。
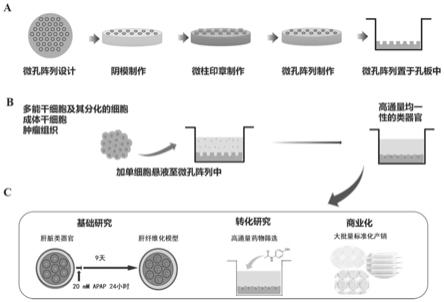
37.图1高通量微孔阵列的均一性肝脏类器官构建方法及应用的流程示意图;其中图1a微 孔阵列芯片的制作过程示意图;图1b和图1c为均一性肝脏类器官构建过程和均一性肝脏 类器官的应用示意图;
38.图2为高通量微孔阵列图;图2a为用于制作pmma阴模的微孔阵列设计图;图2b 为pdms阳模纵切面镜下图,标尺500μm;图2c为10mm直径琼脂糖微孔阵列置于48 孔板镜下图,标尺2mm;
39.图3为微孔阵列培养hepg
‑
2细胞小球效果。图3a
‑
c为100、200、400/微孔初始接种 密度第14天明场拍照结果,标尺500μm;图3d
‑
f为100、200、400/微孔初始接种密度第 14天单个微孔明场拍照结果,标尺100μm;图3g为三种密度hepg
‑
2小球直径统计,数 据采用mean
±
s.d.表示,n=127,与各自对照组相比,*p<0.05,**p<0.01。
40.图4为微孔阵列中hepg
‑
2小球的鉴定。图4a为微孔阵列中hepg
‑
2小球alb和afp 共染荧光拍照,标尺100μm;图4b为图4a中间小球放大图,标尺25μm;图4c为hepg
‑
2 阵列alb和hnf4α共染荧光拍照,标尺25μm;
41.图5为微孔阵列中人源肝脏类器官的培养;图5a为多能干细胞来源的均一性肝脏类器 官的构建流程示意图;图5b为肝脏类器官构建过程中各阶段特征性明场图;图5c为第24 天的肝脏类器官在不同倍数下的明场图;图5d为肝脏类器官分别在第10天、14天和24 天的生长面积统计;
42.图6为接种密度对肝脏类器官形成的影响;图6a为不同接种密度下第24天肝脏类
器 官的明场图;图6b为不同接种密度下第24天肝脏类器官面积分析;
43.图7为琼脂糖微孔阵列中人源肝脏类器官均一性分析;图7a为单个前肠胚细胞接种到 微孔阵列后聚集成三维结构的动态图;图7b为第24天微孔阵列和传统matrigel培养的肝 脏类器官的形态图;图7c为第24天微孔阵列和传统matrigel培养的肝脏类器官面积分析; 图7d为第24天微孔阵列和传统matrigel培养的肝脏类器官面积的标准差系数分析,其中 面积的标准差变异系数的计算方法为:变异系数c
·
v=(标准偏差sd/平均值mean)
ꢀ×
100%;
44.图8为人源肝脏类器官构建各阶段特征性标记物表达情况;图8a为开始加入分化培养 基前多能干细胞标记物oct3/4、nanog、sox
‑
2、ssea4的表达情况;图8b为分化至第4 天前肠标记物cdx2及epcam和ck19的表达情况;图8c为第24天肝脏类器官中肝脏 相关标记物alb、ck19、afp和epcam的表达情况;
45.图9为琼脂糖微孔阵列中肝脏纤维化模型的构建与表征;图9a为琼脂糖微孔阵列中肝 脏纤维化模型的示意图;图9b为琼脂糖微孔阵列中肝脏类器官构建肝纤维化模型的示意图; 图9c为微孔阵列中肝纤维化模型中col1a1和vim的表达情况;图9d为微孔阵列中肝 纤维化模型中il8和tnfa的表达情况。
具体实施方式
46.下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由 此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发 明,而非限制本发明。
47.在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使 用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域 技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
48.需要说明的是,当元件被称为“固定于”或“设于”另一个元件上,它可以直接在另一个元 件上或者间接设在另一个元件上;当一个元件被称为是“连接于”另一个元件,它可以是直接 连接到另一个元件或间接连接至另一个元件上。
49.需要理解的是,术语“长度”、“宽度”、“上”、下”、“前”、“后”、“第一”、“第二”、“竖 直”、“水平”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位 置关系,仅是为了便于描述本技术和简化描述,而不是指示或暗示所指的装置或元件必须 具有特定的方位、以特定的方位构造和操作,因此不能理解为对本技术的限制。
50.此外,在本技术的描述中,多个”、“若干个”的含义是两个或两个以上,除非另有明确 具体的限定。
51.本技术的技术方案总体思路如下:
52.根据本发明的一种典型的实施方式,提供一种肝脏类器官培养芯片,如图1所示,包 括:
53.细胞培养板1;
54.具有微孔阵列的生物材料2,设于所述细胞培养板1内;其中,所述生物材料2包括琼 脂糖、聚乙二醇和海藻酸钠中的至少一种;所述生物材料2上设有多个微孔21,且多个所 述微孔21均匀排列形成所述微孔阵列。
55.上述技术方案中,所述生物材料选用琼脂糖、聚乙二醇和海藻酸钠中的至少一种的原 因为该类生物材料具有生物相容性好、对细胞底黏附、良好的光学通透性和易成型的优点。 本发明首次采用具有微孔阵列的生物材料应用于均一性肝脏类器官的培养,本发明使用时, 将前肠胚细胞加入到所述具有微孔阵列的生物材料2的所述微孔21中进行培养,所培养的 类器官均在独立的腔室中生长发育,样本之间的干扰性低。
56.作为一种优选的实施方式,每个所述微孔的深度为0.1mm~5mm。每个所述微孔21 的深度为0.1mm~5mm的原因为:微孔大于5mm不易于培养基中营养物质的吸收,影响 类器官的形成;微孔小于0.1mm太浅了换液的时候类器官容易从微孔中脱离,影响类器官 的得率。更为优选地,每个所述微孔的深度为0.5mm~1.5mm,最为优选为1mm,更有利 于肝脏类器官的培养,可以大批量构建均一性的ipsc或eb来源的类器官、成体干细胞来 源的类器官、肿瘤类器官。
57.作为一种优选的实施方式,相邻两个所述微孔之间距离为10μm~1mm。本技术经过 试验发现该距离有利于单个细胞均匀地落在每个微孔中,提高类器官均一性;更为优选地, 相邻两个所述微孔之间距离为0.2mm;微孔阵列的阵列单元的数量可根据具体需求设计成 任意实验所需的数量。
58.作为一种优选的实施方式,所述微孔的面积78.50μm2~78.5mm2的原因:面积小于 78.50μm2不利于三维类器官的形成;面积大于78.5mm2会影响微孔阵列中形成类器官的通 量;
59.所述微孔呈圆形、椭圆形、半圆形、三角形、梯形或多边形,或者其他形状;微孔底 部为平底、v形底或u形底。需要说明的是,微孔的底部不与所述细胞培养板相接触,即 微孔的底部为生物材料。
60.上述技术方案中,所述细胞培养板包括但不限于96孔板、48孔板、24孔板、12孔板、 6孔板、3.5cm培养皿、6cm培养皿和10cm培养皿中的一种。可采用目前市面上常用的细 胞培养板。本发明的肝脏类器官培养芯片基于现有的细胞培养孔板进行改造,与现有的细 胞培养孔板高度结合,对现有的生物相关光学仪器均有良好的兼容性。
61.优选地,所述生物材料为浓度为0.5%~10%的琼脂糖。琼脂糖的浓度选用0.5%~10% 的原因,浓度过小则不易成型;浓度过大则不利于成像;
62.如果选用聚乙二醇,聚乙二醇的分子量范围为30~150kd,分子量优选为40kd;
63.如果选用海藻酸钠,浓度优选为2%;
64.如果选用两两组合,可根据实验需求自行配比。
65.根据本发明实施例另一种典型的实施方式,提供所述肝脏类器官培养芯片的制备方法, 所述方法包括:
66.步骤s1、在pmma上进行制作,获得具有微孔阵列的pmma阴模;
67.所述步骤s1具体包括:
68.步骤s101、微孔阵列图形设计
69.(1)使用autocad 2018软件设计微孔阵列,微孔单元为0.5mm直径圆形,间距为 0.2mm,阵列单元按照正六边形形状(包含中心点)分布;微孔阵列图形设计图如图1。
70.本发明实施例中,阵列单元选择正六边形形状的旨在提高阵列空间分布的均匀性。
71.(2)将autocad 2018设计的微孔阵列图保存为autocad r12/lt2 dxf(*.dxf) 格式。
72.步骤s102、微孔阵列pmma阴模制作
73.(1)将上述dxf格式文件导入artcam 2011软件,选择“刀具路径
‑
新2d路径
‑
钻孔”, 设置钻孔深度1mm,选择0.5mm pcb钻头,2mm厚基底材料,生成g
‑
code代码;
74.(2)将上述g
‑
code代码导入数控机床,固定pmma板,安装pcb钻头,设置z轴 距离。运行g
‑
code代码,钻孔完毕取下pmma板;pmma板为有机玻璃,此高分子透明 材料的化学名称叫聚甲基丙烯酸甲酯。
75.步骤s2、将pdms倒入所述pmma阴模上,真空干燥并抽真空,烘干后剥离,获得 具有微孔阵列的pdms阳模;
76.步骤s3、将液体生物材料倒入所述pdms阳模上,凝固后剥离,获得具有微孔阵列的 生物材料;
77.步骤s4、将所述具有微孔阵列的生物材料处理成契合于细胞培养板的外形,后设于所 述细胞培养板上,获得肝脏类器官培养芯片。
78.根据本发明另一种典型实施方式提供了所述肝脏类器官培养芯片的肝脏类器官培养方 法,所述方法包括:
79.将常规培养的人胚胎干细胞或人诱导多功能干细胞消化成单个细胞,将所述单个细胞 接种于培养基中培养,获得前肠胚细胞;
80.将所述前肠胚细胞接种于所述肝脏类器官培养芯片中的所述微孔阵列中培养,获得肝 脏类器官。
81.所述接种中,每孔接种细胞数量为50~1000(个/孔)有利于形成均一的肝脏类器官;
82.下面将结合附图对本技术的一种肝脏类器官培养芯片和培养方法进行详细说明。
83.实施例1、一种肝脏类器官培养芯片及其制备方法
84.一、一种肝脏类器官培养芯片,如图1所示,包括:
85.细胞培养板1;
86.具有微孔阵列的生物材料2,设于所述细胞培养板1内;其中,所述生物材料2包括琼 脂糖、聚乙二醇和海藻酸钠中的至少一种;所述生物材料2上设有多个微孔21,且多个所 述微孔21均匀排列形成所述微孔阵列。
87.每个所述微孔的深度为1mm。微孔上孔形状为圆形。
88.相邻两个所述微孔之间距离为0.2mm。
89.每个所述微孔的面积为0.19625mm2。
90.所述生物材料为浓度为2%的琼脂糖。
91.二、所述肝脏类器官培养芯片的制备方法
92.1.微孔阵列图形设计
93.(1)使用autocad 2018软件设计微孔阵列,微孔单元为0.5mm直径圆形,间距为 0.2mm,阵列单元按照正六边形形状(包含中心点)分布;微孔阵列图形设计图如图1。
94.本发明实施例中,阵列单元选择正六边形形状的旨在提高阵列空间分布的均匀性。
95.(2)将autocad 2018设计的微孔阵列图保存为autocad r12/lt2 dxf(*.dxf) 格式。
96.2.微孔阵列pmma阴模制作
97.(1)将上述dxf格式文件导入artcam 2011软件,选择“刀具路径
‑
新2d路径
‑
钻 孔”,设置钻孔深度1mm,选择0.5mm pcb钻头,2mm厚基底材料,生成g
‑
code代码;
98.(2)将上述g
‑
code代码导入数控机床,固定pmma板,安装pcb钻头,,设置z 轴距离。运行g
‑
code代码,钻孔完毕取下pmma板;pmma板为有机玻璃,此高分子透 明材料的化学名称叫聚甲基丙烯酸甲酯)。
99.3.微孔阵列pdms阳模制作
100.(1)将上述pmma阴模用超纯水清洗、烘干,并使用氮气枪清洁表面结构,将pmm a阴模放置于培养皿,在非结构区滴加10μl脱模剂,放置80℃烘箱10min;
101.(2)将pdms预聚物(a胶)与交联剂(b胶)按10:1质量比混合,取a胶40g 和b胶4g混合,并充分混匀后放置于真空干燥器中排尽气泡;
102.(3)将pdms(聚二甲基硅氧烷)于pmma阴模上,放置真空干燥器抽真空60min 排出气泡,放置80℃烘箱中2小时,小心剥离pdms阳模。
103.4.琼脂糖微孔阵列制作
104.(1)将上述pdms阳模用超纯水清洗、烘干,用氮气枪清洁表面结构;
105.(2)称量2g琼脂糖粉末,量取100ml超纯水,于锥形瓶中混合配置2%(w/v) 琼脂糖,置于微波炉加热5min;
106.(3)将琼脂糖趁热倾倒于pdms阳模上,用枪头刮排出pdms微柱间气泡,常温静置60min以使琼脂糖完全凝固,小心剥离琼脂糖;
107.(4)将琼脂糖微孔面朝上,使用10mm或6mm圆冲垂直打孔,分别得到契合于48 孔板或96孔板的琼脂糖微孔阵列;
108.(5)将上述琼脂糖微孔阵列放置于48孔板、96孔板中,用灭菌水清洗10次并除尽微 孔内的气泡,紫外消毒1小时待用。
109.实施例2
110.本发明实施例中,每个所述微孔的深度为0.1mm。相邻两个所述微孔之间距离为0.01 mm。每个所述微孔的面积为78.5
×
10
‑6mm2。所述生物材料为浓度为0.2%的琼脂糖。其他 结构和步骤均同实施例1。
111.实施例3
112.本发明实施例中,每个所述微孔的深度为5mm。相邻两个所述微孔之间距离为1mm。 每个所述微孔的面积为78.5mm2。所述生物材料为浓度为2%的琼脂糖。其他结构和步骤 均同实施例1。
113.实施例4
114.本发明实施例中,每个所述微孔的深度为1mm。相邻两个所述微孔之间距离为0.1mm。 每个所述微孔的面积为0.19625mm2。所述生物材料为浓度为5%的琼脂糖。其他结构和步 骤均同实施例1。
115.实施例5
116.本发明实施例中,每个所述微孔的深度为1mm。相邻两个所述微孔之间距离为
0.2mm。 每个所述微孔的面积为0.0785mm2。所述生物材料为浓度为2%的琼脂糖。其他结构和步 骤均同实施例1。
117.实施例6
118.本发明实施例中,每个所述微孔的深度为1mm。相邻两个所述微孔之间距离为0.2mm。 每个所述微孔的面积为0.19625mm2,每个微孔接种细胞数量为1000个。所述生物材料为 浓度为2%的琼脂糖。其他结构和步骤均同实施例1。
119.实施例7
120.本发明实施例中,每个所述微孔的深度为1mm。相邻两个所述微孔之间距离为0.2mm。 每个所述微孔的面积为0.19625mm2,每个微孔接种细胞数量为50个。所述生物材料为浓 度为2%的琼脂糖。其他结构和步骤均同实施例1。
121.实施例8
122.本发明实施例中,每个所述微孔的深度为1mm。相邻两个所述微孔之间距离为0.2mm。 每个所述微孔的面积为0.19625mm2,每个微孔接种细胞数量为200个。所述生物材料为浓 度为2%的海藻酸盐。其他结构和步骤均同实施例1。
123.实施例9
124.本发明实施例中,每个所述微孔的深度为1mm。相邻两个所述微孔之间距离为0.2mm。 每个所述微孔的面积为0.19625mm2,每个微孔接种细胞数量为200个。所述生物材料为10 kda的聚乙二醇。其他结构和步骤均同实施例1。
125.实施例10
126.本发明实施例中,每个所述微孔的深度为1mm。相邻两个所述微孔之间距离为0.2mm。 每个所述微孔的面积为0.19625mm2,每个微孔接种细胞数量为200个。所述生物材料为40 kda的聚乙二醇。其他结构和步骤均同实施例1。
127.对比例1
128.该对比例1为传统的matrigel。
129.对比例2
130.该对比例中,每个所述微孔的深度为0.05mm;其他结构和步骤均同实施例1。
131.对比例3
132.该对比例中,每个所述微孔的深度为6mm;其他结构和步骤均同实施例1。
133.对比例4
134.相邻两个所述微孔之间距离为0.05mm;其他结构和步骤均同实施例1。
135.对比例5
136.相邻两个所述微孔之间距离为5mm;其他结构和步骤均同实施例1。
137.对比例6
138.单个阵列单元的微孔面积为70.00μm2;其他结构和步骤均同实施例1。
139.对比例7
140.单个阵列单元的微孔面积为80mm2;其他结构和步骤均同实施例1。
141.对比例8
142.每个微孔接种的细胞数量为10个;其他结构和步骤均同实施例1。
143.对比例9
144.每个微孔接种的细胞数量为2000个;其他结构和步骤均同实施例1。
145.实验例1、人源肝脏类器官的培养
146.一、将各实施例和各对比例的芯片进行肝脏类器官的培养,方法如下:
147.1、hescs或hipscs向内胚层分化:常规培养的hescs(人胚胎干细胞)或hipscs(人 诱导多功能干细胞)用accutase消化成单个细胞,按照1*105/cm2,待细胞融合度达85
‑
90% 时,开始分化。第一天的培养基为:含有100ng/ml activina和50ng/ml bmp4的rpmi 培养基。第二天培养基为:含有100ng/ml activina和0.2%knockout serum replacement的 rpmi培养基。第三天培养基为:含有100ng/ml activin a和2%knockout serum replacement 的rpmi培养基。
148.2、内胚层细胞向前肠胚细胞分化:第4
‑
6天培养基为:含有500ng/ml的fgf2和3 μm chir99021的advanced dmem/f12。每天更换培养基,细胞在培养箱中常规培养。分 化的第6天,可见三维结构。
149.3、琼脂糖微孔阵列中接种前肠单细胞:分化至第6天,用accutase将前肠胚细胞消化成 单个细胞,按照200/孔接种于微孔阵列中,用含有80ng/ml fgf2和3μm chir99021的 advanced dmem/f12培养基维持培养4天,隔天换半液。
150.4、琼脂糖微孔阵列中肝脏类器官的培养:第10
‑
14天培养基为:含有2μm ra的a dvanced dmem/f12维持培养4天,隔天换液。第14
‑
24天培养基为:10ng/ml hgf、0. 1mm dexamethasone、20ng/ml osm的hepatocyte culture medium,每3天换液一次。
151.二、对上述实施例1
‑
10和对比例2
‑
9的微孔阵列芯片进行肝脏类器官培养效果进行统 计,如表1所示,其中面积的标准差变异系数的计算方法为:变异系数c
·
v=(标准偏差 sd/平均值mean)
×
100%;
152.表1
[0153][0154][0155]
由表1的数据可知:
[0156]
对比例1中,为传统的matrigel培养方法,存在类器官均一性差缺点;
[0157]
对比例2中,微孔的深度为0.05mm,小于本发明实施例0.1mm~5mm的范围,存在 微孔中的类器官在换液过程中容易丢失的缺点;
[0158]
对比例3中,微孔的深度为6mm,大于本发明实施例0.1mm~5mm的范围,存在微 孔阵列中的类器官不能充分接触培养基中的细胞因子等营养物质,造成类器官无法正常生 长的缺点;
[0159]
对比例4中,相邻微孔间的距离为0.005mm,小于本发明实施例10μm~1mm的范围, 存在在制作微孔阵列过程中微孔的完整性容易被破坏的缺点;
[0160]
对比例5中,相邻微孔间的距离为5mm,大于本发明实施例10μm~1mm的范围, 存在单位面积产生类器官的通量较低缺点;
[0161]
对比例6中,微孔面积为70.00μm2,小于本发明实施例78.00μm2~78.5mm2的范围, 存在微孔过小,限制类器官生长的缺点;
[0162]
对比例7中,微孔面积为80mm2,大于本发明实施例78.00μm2~78.5mm2的范围, 存在单位面积产生类器官的通量较低缺点;
[0163]
对比例8中,每孔接种细胞数量10(个/孔),小于本发明实施例50~1000(个/孔) 的范围,存在无法形成类器官的缺点;
[0164]
对比例9中,每孔接种细胞数量2000(个/孔),大于本发明实施例50~1000(个/孔) 的范围,存在微孔阵列中三维聚集物体积过大,容易造成类器官中间坏死的缺点;
[0165]
三、特征标记物的检测
[0166]
1、使用免疫荧光检测实施例1中分化至各阶段特征性标记物:在hescs或hipscs检 测干性标记物oct3/4、nanog;前肠阶段检测cdx2、epcam、ck19表达情况;肝脏类 器官阶段检测alb、epcam、ck19、afp的表达情况。
[0167]
2、实施例1微孔阵列中肝纤维化模型的构建与表征:在第24天,微孔阵列中的肝脏 类器官20mm apap处理后24小时换成hcm完全培养基构建肝纤维化模型。利用qpcr 检测经20mm apap处理后肝脏类器官中col1a1、vim和il8、tnfa表达情况。
[0168]
结果如图5
‑
图9;
[0169]
由图5和图8可知,在微孔阵列中成功构建了肝脏类器官;
[0170]
由图6可知,每个微孔阵列接种200个细胞最利于形成均一的肝脏类器官;
[0171]
由图7可知,与传统matrigel培养相比,微孔阵列中培养的肝脏类器官具有良好的均一 性;
[0172]
由图9可知,微孔阵列中肝脏类器官20mm apap处理后构建肝纤维化模型。qpcr 结果显示,经20mm apap处理后肝脏类器官中col1a1、vim和il8、tnfa表达上调, 初步说明微孔阵列中的肝脏类器官可以用来构建肝纤维化模型;
[0173]
实验例2、琼脂糖微孔阵列用于培养hepg2小球
[0174]
1、使用实施例1的芯片常规培养的hepg2按照100、200、400个细胞/微孔的接种密 度计算加样体积,向48孔板阵列加入细胞悬液,置于37℃培养箱培养,每隔三天明场拍照 并换液;
[0175]
2、对琼脂糖微孔阵列中培养的hepg2小球冰冻切片后进行免疫荧光检测,检测hnf4 α、afp和alb的表达情况。
[0176]
3、结果如图3和图4所示,
[0177]
由图3可知,琼脂糖微孔阵列中培养的14天的hepg2小球直径分布于200μm到300μm 之间,明场形态上具有较好的均一性。
[0178]
由图4可知,疫荧光结果显示琼脂糖微孔阵列中培养的14天的hepg2小球具有正常的 alb、afp表达。
[0179]
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的 包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还 包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的 要素。
[0180]
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概 念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选 实施例以及落入本发明范围的所有变更和修改。
[0181]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和 范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内, 则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1