高产β-葡萄糖苷酶黑曲霉菌株及应用
高产
β
‑
葡萄糖苷酶黑曲霉菌株及应用
技术领域
1.本发明属于生物质材料降解及其生产单细胞蛋白应用技术领域,涉及一株高产β
‑
葡萄糖苷酶黑曲霉菌株及应用。
背景技术:
2.目前,木质纤维素水解酶酶解效率低,用酶成本过高仍然是制约生物质资源利用的瓶颈之一,如何提高纤维素酶酶解效率系问题一直是业界研究的焦点。木质纤维素水解是多酶系协同作用的结果,其中β
‑
葡萄糖苷酶是纤维素酶系的重要组成部分,它负责将纤维素内切酶和外切酶通过协同作用释放的纤维寡糖和纤维二糖水解为葡萄糖。因此通过提高β
‑
葡萄糖苷酶的活性,不仅可以有效地提高纤维素酶总体酶活力,还可以通过降解纤维寡糖和纤维二糖降低其对纤维素内切酶和外切酶的抑制作用,从而提高纤维素酶系的水解效率。
3.除了在木质纤维素水解中发挥作用之外,β
‑
葡萄糖苷酶在纤维素酶诱导物合成以及菌体快速响应纤维素的过程中发挥着重要作用。一方面,β
‑
葡萄糖苷酶具备转糖基作用,能够将少量的葡萄糖转化为槐糖等二糖,这些二糖是纤维素酶发酵产酶生产过程中的高效诱导物。另一方面,一些β
‑
葡萄糖苷酶具有较强的β
‑
木糖苷酶活力或β
‑
半乳糖苷酶活力,可以产生木寡糖或乳糖以作为纤维素酶和半纤维素酶合成的诱导物,从而在提高纤维素酶和半纤维素诱导合成方面发挥着重要作用。
4.因此,无论是从提高纤维素酶系本身活性和水解效率的角度,还是从通过合成诱导物以提升纤维素酶诱导表达的角度,都表明β
‑
葡萄糖苷酶对于纤维素酶系产量及水解效率具有至为关键的作用。然而,目前广泛工业化应用的里氏木霉等菌种中的β
‑
葡萄糖苷酶含量和酶活力都较低,这成为纤维素酶系水解效率不高的主要限制因素之一。额外复配β
‑
葡萄糖苷酶是提升纤维素酶酶活力和水解效率的一种有效方法。
技术实现要素:
5.本发明提供的黑曲霉(aspergillus niger)突变株60b
‑
3dw,以黑曲霉(aspergillus niger)3.316(保藏于中国科学院微生物研究所普通菌种保藏中心,cgmcc no. 3.316)为出发菌株,经artp诱变,液滴微流控高通量筛选技术选育出β
‑
葡萄糖苷酶活力大幅度提高的突变株。
6.因此,本发明首先提供一株黑曲霉菌株60b
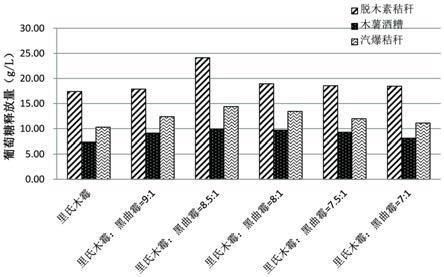
‑
3dw,其分类命名:黑曲霉aspergillus niger,菌株黑曲霉aspergillus niger 60b
‑
3dw被保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏号为:cgmcc no.22465,保藏时间为:2021年07月05日,保藏单位地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
7.进而,本发明提供一种β
‑
葡萄糖苷酶的生产方法,包括如下步骤:1)将黑曲霉菌株60b
‑
3dw接种于培养基中进行培养;2)以步骤1)中生长的黑曲霉菌株60b
‑
3dw的发酵液的形式从培养基中收获β
‑
葡萄
糖苷酶。
8.优选的是,所述的β
‑
葡萄糖苷酶的生产方法中,所述培养基包含如下组分:玉米芯45~55 g/l,酵母粉4~6 g/l,麦芽提取物4~6 g/l,硫酸铵2.6~3 g/l,磷酸二氢钾3~5 g/l,结晶硫酸镁0.8~1.0 g/l,结晶氯化钙0.8~1.0 g/l,初始ph调到6.0。
9.优选的是,所述的β
‑
葡萄糖苷酶的生产方法中,步骤1)中,将黑曲霉孢子于温度26~30℃和转速140~200转/分的条件下培养144~182小时;步骤2)中,将经过步骤1)培养得到的发酵液进行固液分离,收集上清液得到β
‑
葡萄糖苷酶的粗酶液。
10.本发明还提供一种复合纤维素酶制剂,其包含所述上述方法制备的β
‑
葡萄糖苷酶以及纤维素酶。更优选的是,纤维素酶来自于里氏木霉。具体地是以两者的发酵液作为粗酶液进行混配,优选地里氏木霉纤维素酶液:黑曲霉β
‑
葡萄糖苷酶发酵液按体积配比为7
‑
10:1,最优选为8
‑
9:1复配,且其中里氏木霉纤维素酶滤纸酶活力为30
‑
40 iu/ml,黑曲霉β
‑
葡萄糖苷酶酶活力为80
‑
100 iu/ml。)进一步地,本发明提供所述复合纤维素酶制剂在生物质材料降解中提供降解的功能。优选地,所述生物质材料是作物秸秆或酒糟,如水稻秸秆、小麦秸秆、高粱秸秆、玉米秸秆(例如脱木素玉米秸秆,汽爆玉米秸秆),或木薯酒糟等。
11.本发明通过对黑曲霉液滴生成、分选芯片以及液滴大小等条件优化,克服了黑曲霉菌丝生长过程会导致包裹液滴刺破造成液滴间交叉代谢物污染的弊端,同时对结合的荧光底物进行筛选及标记达到分选黑曲霉微液滴的目的,首次创建黑曲霉β
‑
葡萄糖苷酶液滴微流控高通量筛选技术,筛选通量可达10000个/h,将传统方法的筛选周期从7
‑
15天缩减到24 h内完成,突破传统丝状真菌筛选方法的技术瓶颈,精准定向提升黑曲霉菌株的β
‑
葡萄糖苷酶酶活力,大幅度提高β
‑
葡萄糖苷酶菌株选育的效率和成功率。最终获得一株高产β
‑
葡萄糖苷酶的黑曲霉菌株60b
‑
3dw。
12.本发明提供的黑曲霉菌株60b
‑
3dw在摇瓶发酵规模下,通过发酵法生产的β
‑
葡萄糖苷酶活力高达88 iu/ml,通过与里氏木霉纤维素酶制剂简单复配后形成复合纤维素酶制剂,复合纤维素酶制剂酶系更加平衡,生物质高固酶解条件下,葡萄糖释放量均提高35%以上,生物质材料中纤维素转化率>90%以上,并在秸秆单细胞蛋白中完成应用,实现秸秆单细胞蛋白产品中蛋白含量>25%。
附图说明
13.图1为本发明实施例中液滴微流控底物释放荧光值与β
‑
葡萄糖苷酶酶活力线性关系曲线图。
14.图2为本发明实施例中液滴培养不同时间荧光信号观察图。
15.图3为本发明实施例中β
‑
葡萄糖苷酶的液滴分选流程图。
16.图4为本发明实施例中黑曲霉菌株遗传稳定性检测图。
17.图5为本发明实施例中复合纤维素酶系水解不同生物质材料时葡萄糖释放量比较图。
具体实施方式
18.下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。但并不构成对本发明的限制。
19.实施例一、通过β
‑
葡萄糖苷酶菌株高通量筛选方法获得黑曲霉60b
‑
3dw菌株以黑曲霉(aspergillus niger)3.316为基础,发明人通过artp诱变,借助液滴微流控高通量平台,通过对黑曲霉液滴生成、分选底物以及液滴大小等条件优化,黑曲霉孢子通过液滴包埋并预培养16小时后,液滴直径为80
‑
90
ꢀµ
m,黑曲霉菌丝没有生长地过长刺破液滴,同时黑曲霉菌丝体又分泌足够的β
‑
葡萄糖苷酶与荧光底物相互作用,通过底物释放的荧光值分辨液滴中酶活力高低。克服了黑曲霉菌丝生长过程会导致包裹液滴刺破造成液滴间交叉代谢物污染的弊端,同时对结合的荧光底物进行筛选及标记达到分选黑曲霉微液滴的目的,首次创建黑曲霉β
‑
葡萄糖苷酶液滴微流控高通量筛选技术,筛选通量可达10000个/h,将传统方法的筛选周期从7
‑
15天缩减到24 h内完成,突破传统丝状真菌筛选方法的技术瓶颈,精准定向提升具有自主知识产权菌株的β
‑
葡萄糖苷酶酶活力,大幅度提高β
‑
葡萄糖苷酶菌株选育的效率和成功率。
20.1、黑曲霉生产β
‑
葡萄糖苷酶培养基及发酵培养液配方:玉米芯50 g/l,酵母粉5 g/l,麦芽提取物5 g/l,硫酸铵2.8 g/l,磷酸二氢钾4 g/l,结晶硫酸镁0.9 g/l,结晶氯化钙0.9 g/l,初始ph调到6.0。
21.2、黑曲霉生产β
‑
葡萄糖苷酶培养方法:待黑曲霉的孢子斜面长好后,用接种环从斜面上刮取一环接种于装有50 ml发酵培养液的500 ml摇瓶中,在转速为170 转/分,培养温度为28
±
2℃的条件下培养168
±
24小时将发酵液在10000转/分下离心10分钟,收集上清液为粗酶液。
22.3、里氏木霉生产纤维素酶制剂的发酵培养基配方:葡萄糖25 g/l,玉米浆干粉4 g/l,koh 1.66 g/l,(nh4)2so
4 2.8 g/l和mgso
4 0.6 g/l,初始ph为5.5。
23.4、里氏木霉生产纤维素酶制剂的培养方法:从里氏木霉平板上洗下孢子悬液浓度107个/ml,加入里氏木霉生产纤维素酶制剂的发酵培养基,培养温度为26℃~28℃,ph4.8~5.2,转速250~300 rpm,发酵液中溶氧量25~35%(v/v),培养120 h。
24.5、酵母种子液培养基:ypd培养基:1%葡萄糖,2%蛋白胨,1%酵母粉。
25.6、酵母种子液培养方法:用接种环从酵母平板刮取一环酵母菌落接入ypd培养基中,30℃,200 rpm培养24小时。
26.7、β
‑
葡萄糖苷酶活力测定方法:在50
°
c、ph为4.8的条件下,每分钟转化1 μmol底物 (15 mm纤维二糖)所需的酶量为一个酶活单位(iu)。
27.β
‑
葡萄糖苷酶活力的测定方法如下:
①ꢀ
向5 ml离心管中加入1 ml适当稀释的酶液。每个样品应至少包括2个稀释度的
酶液,一个稀释度在反应条件下释放略少于1.0 mg的葡萄糖,另一稀释度则释放略高于1.0 mg的葡萄糖。同时做底物空白和酶液空白对照,计算时应减去底物和酶液空白中的葡萄糖量;
②ꢀ
将酶溶液加热至50℃,添加1.0 ml的底物溶液,混匀;
③ꢀ
在50℃水浴中反应30 min;
④ꢀ
沸水浴5.0 min,终止反应;
⑤ꢀ
冷却,通过生物传感分析仪sba
‑
40c测定反应液中所释放的葡萄糖含量。
28.8、分选:诱变菌株孢子,利用液滴微流控进行高通量分选,选育β
‑
葡萄糖苷酶酶活力高的菌株。
29.首先是黑曲霉β
‑
葡萄糖苷酶液滴微流控的高通量筛选方法的建立a. β
‑
葡萄糖苷酶液滴微流控高通量筛选底物确定分别以不同酶活力 β
‑
葡萄糖苷酶与2 μm fluorescein di
‑
β
‑
d
‑
glucopyranoside反应液为水相同时生成油包水液滴,利用液滴微流控筛选系统对液滴进行荧光检测,检测结果显示底物fluorescein di
‑
β
‑
d
‑
glucopyranoside释放的荧光值与β
‑
葡萄糖苷酶酶活力之间有明确的线性关系,表明液体微流控系统可以利用fluorescein di
‑
β
‑
d
‑
glucopyranoside释放的荧光值作为筛选高酶活力β
‑
葡萄糖苷酶液滴的依据,如图1所示。
30.利用液滴微流控筛选系统对包埋β
‑
葡萄糖苷酶液滴进行分选,分选通量达200个/秒,准确率达96%,如图3所示。证明液滴微流控高通量筛选系统在分选高酶活力的β
‑
葡萄糖苷酶是可行的。
31.b. β
‑
葡萄糖苷酶液滴微流控高通量筛选分选时间的确定将黑曲霉孢子、培养基和反应底物fluorescein di
‑
β
‑
d
‑
glucopyranoside包埋在液滴中,按照前述优化的培养条件对液滴包埋并培养检测液滴的荧光。由图2中看出,液滴培养10 h开始有微弱荧光产生,培养16 h后液滴中发出强烈的荧光。结果证明,黑曲霉菌丝分泌的β
‑
葡萄糖苷酶可以与标记底物发生反应发出荧光,并随着培养时间延长荧光强度增加。培养16 h后液滴与底物反应释放的荧光值差别明显,为了提高液滴分选效率,最终选定在液滴预培养16 h后即可分选。
32.c. 高通量筛选后黑曲霉菌株培养及酶活力验证利用液滴微流控高通量筛选系统对黑曲霉诱变后孢子微液滴进行分选,分选通量达10000个/h。将分选出荧光信号强的液滴(液滴微流控分选速度20 μl/h,每个样品收集20 min),涂布于pda平板上进行后续培养。生长出来的单菌落分别接种于发酵培养基中进行培养,培养7天后,测定发酵液中β
‑
葡萄糖苷酶酶活力,并从中挑选出酶活力最高的一个转化子,而获得一株β
‑
葡萄糖苷酶酶活力大幅度提高的突变株,命名为黑曲霉60b
‑
3dw。黑曲霉(aspergillus niger)突变株60b
‑
3dw的β
‑
葡萄糖苷酶酶活力可以达到88 iu/ml左右,相比出发菌株黑曲霉(aspergillus niger)3.316分泌的β
‑
葡萄糖苷酶酶酶活力17.16 iu/ml,提高了412.8%。
33.实施例二、黑曲霉60b
‑
3dw菌株的遗传稳定性测试为了验证黑曲霉(aspergillus niger)突变株60b
‑
3dw的遗传稳定性,将突变株传
代6代后,于相同的发酵条件下进行发酵培养,比较其酶活力变化情况。以酶活力平均值
‑
传代次数作图,结果见图4。
34.突变株60b
‑
3dw各代菌株的酶活力分别为:88,85.8,87.6,88.8,88.5和86.3 iu/ml,可以看出这几次的传代,酶活力的变动幅度都不大,这就表明突变菌株60b
‑
3dw的遗传稳定性良好,可以作为后续发酵的实验菌株。
35.实施例三、黑曲霉60b
‑
3dw发酵的β
‑
葡萄糖苷酶和里氏木霉纤维素酶水解生物质效率取里氏木霉纤维素酶液和依照上述记载的培养方法获得的黑曲霉β
‑
葡萄糖苷酶发酵液按照不同比例(9.5:1, 8.5:1,8.0:1,7.5:1,7:1)复配后形成复合纤维素酶制剂,对酶活力进行测定。
36.1、滤纸酶活力测定在50
°
c、ph为4.8的条件下,每分钟从底物(50 mg whatman no.1 滤纸)降解释放 1 μmol还原糖所需要的酶量为一个酶活力单位(iu)。
37.滤纸酶活测定包括以下三部分实验试管的平行和相同处理:空白对照、葡萄糖标准曲线和发酵液检测。
38.①ꢀ
试管内添加1.0 ml 0.05m、ph4.8的柠檬酸缓冲液,添加0.5 ml里氏木霉稀释酶液 (该稀释度酶液在该反应条件下释放的葡萄糖量在2.0 mg左右);
②ꢀ
加入1cm
×
6 cm规格 (50
±
1mg) 的whatman no.1 滤纸条混合;
③ꢀ
置于50
°
c水浴反应60 min;
④ꢀ
加入3.0 ml dns溶液, 沸水浴5 min终止反应,冷水浴至室温;
⑤ꢀ
取
④
混合液170 μl加入1 ml水稀释;
⑥ꢀ
取
⑤
混合液200 μl于96孔板读数测定a540 ,从葡萄糖dns标准曲线换算样品的葡萄糖含量。其中滤纸酶活计算公式: x (iu/ml) =实验结果数据如下:
里氏木霉里氏木霉:黑曲霉=9:1里氏木霉:黑曲霉=8.5:1里氏木霉:黑曲霉=8:1里氏木霉:黑曲霉=7.5:1里氏木霉:黑曲霉=7:1od540nm0.960.981.141.111.030.95
利用公式计算滤纸酶活力计算结果如下:
里氏木霉里氏木霉:黑曲霉=9:1里氏木霉:黑曲霉=8.5:1里氏木霉:黑曲霉=8:1里氏木霉:黑曲霉=7.5:1里氏木霉:黑曲霉=7:1fpu/ml29.5130.3435.0634.2031.7929.26
结果表明,复合纤维素酶制剂的滤纸酶活力较里氏木霉纤维素酶制剂相比,酶活力均有不同程度的提高。尤其是当里氏木霉纤维素酶:黑曲霉β
‑
葡萄糖苷酶发酵液=8.5:1 时,复合纤维素酶制剂滤纸酶活力提升到35.06 fpu/ml,相比于里氏木霉纤维素酶滤纸酶活力29.51 fpu/ml,提高了18.81%。
39.2、降解不同底物的酶活力测定以脱木素玉米秸秆,汽爆玉米秸秆和木薯酒糟分别为底物,底物浓度为25%,反应体积为20 ml。里氏木霉纤维素酶液:黑曲霉β
‑
葡萄糖苷酶发酵液按照不同比例(9:1, 8.5:1,8.0:1,7.5:1,7:1)复配,复合纤维素酶的酶用量保持在10 fpu/g 底物在50℃水浴摇床中反应72 h。水解72小时后,样品高速离心后,水解上清液通过hplc
‑
87p 柱分析葡萄糖浓度的变化。结果如下表:
酶系脱木素秸秆释放葡萄糖量(g/l)木薯释放葡萄糖量(g/l)汽爆秸秆释放葡萄糖量(g/l)
里氏木霉17.417.3410.3里氏木霉:黑曲霉=9:117.899.1212.39里氏木霉:黑曲霉=8.5:124.149.914.4里氏木霉:黑曲霉=8:118.949.713.45里氏木霉:黑曲霉=7.5:118.559.311.98里氏木霉:黑曲霉=7:118.468.1111.12
40.如图5所示,复合纤维素酶制剂的滤纸酶活力较里氏木霉纤维素酶制剂相比,水解后葡萄糖释放量均有不同程度的提高。尤其是当里氏木霉纤维素酶:黑曲霉β
‑
葡萄糖苷酶发酵液=8.5:1 时,较里氏木霉酶系糖化结果相比,脱木素玉米秸秆、木薯酒糟、汽爆秸秆释放的葡萄糖量分别提高38.68%、34.88%、39.81%,实现在生物质高固酶解条件下,生物质材料中纤维素转化率>90%以上。
41.实施例四、黑曲霉60b
‑
3dw与里氏木霉在秸秆单细胞蛋白生产中应用里氏木霉/黑曲霉孢子液:取黑曲霉60b
‑
3dw和里氏木霉a2h分别划线pda平板于30℃培养5d,之后用无菌水洗脱孢子,然后用细胞过滤器过滤掉菌丝,再用血球计数板计数,最后调整黑曲霉和里氏木霉的孢子浓度均为1.2
×
108个/ml。
42.取汽爆预处理秸秆,按照料水比1:2.5加入水,作为固态发酵的培养基。里氏木霉和黑曲霉孢子液均按照5%接种量(即1:1配比)添加至汽爆预处理秸秆固态发酵的培养基表面,30℃下培养24
‑
36小时。当黑曲霉和里氏木霉水解秸秆24小时后,按照10%添加量向其中添加产朊假丝酵母种子液,继续30℃下固态发酵120小时。里氏木霉和黑曲霉在利用秸秆生长过程中分别向胞外分泌纤维素酶和β
‑
葡萄糖苷酶,两种酶系相互协同,高效降解玉米秸秆的纤维素转化为菌体可以利用的可发酵糖。当加入酵母种子液后,酵母可以高效利用可发酵糖转化为菌体蛋白;酵母的加入可以高效地降低培养基质中的可发酵糖浓度,有效地降低葡萄糖对黑曲霉/里氏木霉纤维素酶的反馈抑制作用,从而有利于提升黑曲霉/里氏木霉纤维素酶的分泌量,加快秸秆的酶解效率。分别于固态发酵3、4、5、6、7天取发酵后秸秆烘干后,测定固体总氮含量。按照粗蛋白=固体总氮含量*6.25,计算发酵后秸秆粗蛋白含量。结果显示,发酵7天后发酵后秸秆的粗蛋白含量约25.13%。时间(d)34567总氮含量(%)1.562.012.453.014.02粗蛋白含量(%)9.7512.5615.3118.8125.13
43.尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1