靶向降解Btk的化合物及其应用的制作方法
靶向降解btk的化合物及其应用
技术领域
1.本发明属于医药领域,具体地涉及靶向降解btk的化合物及其应用。
背景技术:
2.btk(bruton's tyrosine kinase)即布鲁顿酪氨酸蛋白激酶,是非受体酪氨酸激酶tec家族的成员,为细胞分化和增殖所必需基因,且在b细胞淋巴瘤、急性淋巴细胞白血病(all)和浆细胞瘤中均有表达。btk为b细胞受体(bcr)信号通路的关键组成部分,是靶向治疗b细胞淋巴瘤等疾病的很好靶点。
3.btk是b细胞发育、激活、信号传导和存活的关键调节物,参与对血管生成、细胞增殖和凋亡以及细胞运动的调节。除此之外,btk还参与到许多其他造血细胞信号途径,例如,参与巨噬细胞中toll样受体和细胞因子受体介导的信号通路,参与肥大细胞中ige受体的信号传导等。
4.近年来研究显示,btk信号通路是目前非霍奇金淋巴瘤(nhl),特别是慢性淋巴细胞白血病(cll)、b细胞淋巴瘤及自身免疫疾病(类风湿性关节炎、银屑病等)临床治疗研究中的新热点(邓容,赵利枝。btk抑制剂的研究进展。药学研究,2014,33(6):359-372。)。
5.因此,本领域技术人员致力于开发能够有效抑制、降解btk的化合物。
技术实现要素:
6.本发明的目的是提供一种能够抑制、降解btk的化合物,及其制备和应用。
7.在本发明的第一方面,提供了一种如下式i所示的化合物,或其药学上可接受的盐:
[0008][0009]
其中:
[0010]
x选自:c(r1)2、和c(=o);其中r1各自独立的选自:h、带有或不带有取代基的c
1-4
烃基;
[0011]
l为连接子(linker)。
[0012]
在另一优选例中,x为c(r1)2,并且r1为h。
[0013]
在另一优选例中,l的结构优选如下式:
[0014]
(ch2)
a-o-[(ch2)
b-o]
n-(ch2)c[0015]
其中,a、b、c分别独立地为0-10之间的整数;n为0-5之间的整数。
[0016]
在另一优选例中,b为2。
[0017]
在另一优选例中,n为0-3之间的整数
[0018]
本发明中0-10之间的整数包括0、1、2、3、4、5、6、7、8、9、和10。
[0019]
在另一优选例中,所述l优选为以下结构:
[0020][0021]
其中,d优选0至10之间的整数。
[0022]
在另一优选例中,d优选1至3之间的整数。
[0023]
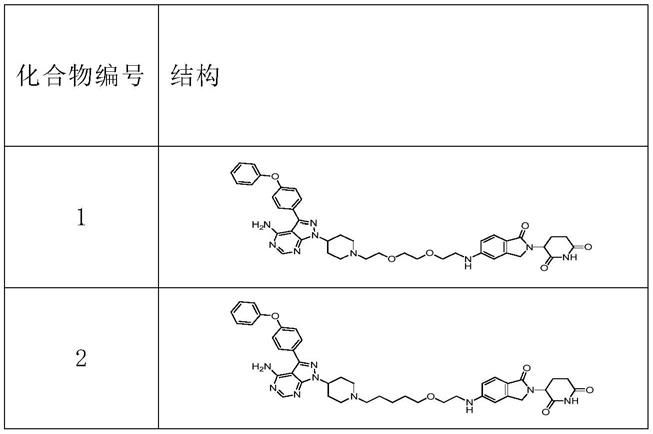
在另一优选例中,所述化合物选自下组:
[0024][0025]
本发明的第二方面,提供一种药物组合物及其施用方式,所述的组合物含有第一方面所述的化合物、其异构体、前药、药学上可接受的盐,以及药学上可接受的载体。
[0026]
在另一优选例中,所述药物组合物,还包含另外一种或多种抗肿瘤剂。
[0027]
在另一优选例中,所述的药物组合物用于抑制布鲁顿酪氨酸蛋白激酶(btk)的活性或降低布鲁顿酪氨酸蛋白激酶(btk)的水平。
[0028]
在另一优选例中,所述的药物组合物用于治疗布鲁顿酪氨酸蛋白激酶(btk)活性或表达量相关的疾病。
[0029]
本发明的第三方面,提供了一种如本发明第一方面所述的化合物的用途,用于:
[0030]
(a)制备治疗与布鲁顿酪氨酸蛋白激酶(btk)活性或表达量相关的疾病的药物;
[0031]
(b)制备布鲁顿酪氨酸蛋白激酶(btk)靶向抑制剂或降解剂;
[0032]
(c)体外非治疗性地抑制或降解布鲁顿酪氨酸蛋白激酶(btk)的活性;
[0033]
(d)体外非治疗性地抑制肿瘤细胞增殖;和/或
[0034]
(e)治疗与布鲁顿酪氨酸蛋白激酶(btk)活性或表达量相关的疾病。
[0035]
在另一优选例中,所述的疾病包括肿瘤、自身免疫疾病;优选地,所述肿瘤包括非霍奇金淋巴瘤(nhl)、慢性淋巴细胞白血病(cll)、b细胞淋巴瘤等;所述自身免疫疾病包括类风湿性关节炎、银屑病等。
[0036]
本发明的第四方面,提供了一种如本发明第一方面所述的式i化合物的制备方法,包括步骤:
[0037][0038]
(a)在惰性溶剂中,用式iii化合物和式ii化合物反应,得到式i化合物,
[0039]
m1为离去基团,m2为保护基团或氢;上述各式中,各基团的定义如上所述。
[0040]
在另一优选例中,所述方法还包括步骤:
[0041][0042]
(b)在惰性溶剂中,用式iv化合物和式v化合物反应,得到式ii化合物,m3为离去基团(卤素、磺酸酯等)。
具体实施方式
[0043]
本发明人经过广泛而深入的研究,制备了一类具有式i所示结构的化合物,并发现其具有布鲁顿酪氨酸蛋白激酶(btk)抑制和降解活性。且所述的化合物在极低浓度下,即对布鲁顿酪氨酸蛋白激酶(btk)产生抑制作用,抑制活性优异,因而可以用于治疗与布鲁顿酪氨酸蛋白激酶(btk)活性或表达量相关的疾病如肿瘤。在此基础上完成了本发明。
[0044]
本发明公开一类新化合物及其能抑制并降解布鲁顿酪氨酸蛋白激酶(btk)的用途。这些化合物能抑制并降解btk,可用于治疗肿瘤或自身免疫性疾病。
[0045]
术语
[0046]
本发明中,术语“c
1-8
烃基”是指只含有碳、氢两种原子的官能团,其中,碳原子的个数为1~8。烃基可以看作是相应的烃失去一个氢原子后剩下的自由基,其可为烷基、环烷基、烯基或炔基等;其结构可为直链、支链或环状;可以是脂肪族的,也可以是芳香族的。
[0047]
术语“c
1-6
烷基”指具有1~6个碳原子的直链或支链烷基,例如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基,或类似基团。
[0048]
除非另有指示,本文所指烷基可以是直链、支链或是环状的。
[0049]
本发明中,术语“含有”、“包含”或“包括”表示各种成分可一起应用于本发明的混
合物或组合物中。因此,术语“主要由...组成”和“由...组成”包含在术语“含有”中。
[0050]
本发明中,术语“药学上可接受的”成分是指适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应),即有合理的效益/风险比的物质。
[0051]
本发明中,术语“有效量”指治疗剂治疗、缓解或预防目标疾病或状况的量,或是表现出可检测的治疗或预防效果的量。对于某一对象的精确有效量取决于该对象的体型和健康状况、病症的性质和程度、以及选择给予的治疗剂和/或治疗剂的组合。因此,预先指定准确的有效量是没用的。然而,对于某给定的状况而言,可以用常规实验来确定该有效量,临床医师是能够判断出来的。
[0052]
在本文中,除特别说明之处,术语“取代”指基团上的一个或多个氢原子被选自下组的取代基取代:卤素、未取代或卤代的c
1-6
烷基、未取代或卤代的c
2-6
酰基、未取代或卤代的c
1-6
烷基-羟基。
[0053]
除非特别说明,本发明中,所有出现的化合物均意在包括所有可能的光学异构体,如单一手性的化合物,或各种不同手性化合物的混合物(即外消旋体)。本发明的所有化合物之中,各手性碳原子可以任选地为r构型或s构型,或r构型和s构型的混合物。
[0054]
如本文所用,术语“本发明化合物”指式i所示的化合物。该术语还包括及式i化合物的各种晶型形式、药学上可接受的盐、水合物或溶剂合物。
[0055]
如本文所用,术语“药学上可接受的盐”指本发明化合物与酸或碱所形成的适合用作药物的盐。药学上可接受的盐包括无机盐和有机盐。一类优选的盐是本发明化合物与酸形成的盐。适合形成盐的酸包括但并不限于:盐酸、氢溴酸、氢氟酸、硫酸、硝酸、磷酸等无机酸,甲酸、乙酸、丙酸、草酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、苦味酸、甲磺酸、苯甲磺酸,苯磺酸等有机酸;以及天冬氨酸、谷氨酸等酸性氨基酸。
[0056]
化合物及其药学上可接受的盐
[0057]
本发明涉及下式i化合物或其药学上可接受的盐;
[0058][0059]
其中:
[0060]
x选自:c(r1)2、和c(=o);其中r1各自独立的选自:h、带有或不带有取代基的c
1-4
烃基;
[0061]
l为连接子(linker)。
[0062]
本发明通过大量研究,对抑制并降解btk的化合物结构进行了大量的优化和筛选,结果表明上述式i中标“*”位置为n原子时,相较于其它类型的原子,不仅表现出了更高的btk降解活性,而且对依鲁替尼耐药的肿瘤细胞表现出了显著地抑制作用,具有更强的抗肿瘤活性,取得了预料不到的技术效果。
[0063]
本发明的化合物包可以与无机酸、有机酸或碱形成药学上可接受的盐。所述的无机酸包括但不限于盐酸、氢溴酸、硝酸、高氯酸、硫酸或磷酸等;所述的有机酸包括但不限于甲磺酸、三氟甲磺酸、乙磺酸、苯磺酸、对-甲苯磺酸、富马酸、草酸、乙酸、马来酸、抗坏血酸、乳酸、酒石酸、丙二酸、乙醇酸、琥珀酸和丙酸等;所述的碱包括但不限于无机盐和胺类。
[0064]
术语药学上可接受的盐指根据医学判断适用于接触人和哺乳动物的组织而无过度毒性、刺激、过敏反应等的那些盐。药学上可接受的盐为本领域公知的。
[0065]
本发明还涵盖含有式i化合物的前体药物的药物组合物。前体药物包括这样的化合物,其中前体分子通过碳酸酯键、氨基甲酸酯键、酰胺键、烷基酯键、磷酸酯键、氨基磷酸酯键共价结合到式i化合物的游离羧基、羟基、氨基或胺基上。
[0066]
化合物的制备
[0067]
制备方法
[0068]
下面更具体地描述本发明式i结构化合物的制备方法,但这些具体方法不对本发明构成任何限制。本发明化合物还可以任选将在本说明书中描述的或本领域已知的各种合成方法组合起来而方便的制得,这样的组合可由本发明所属领域的技术人员容易的进行。
[0069]
下列反应流程阐述本发明化合物的制备。除非另有指示,反应流程和随后的讨论中的各基团是如上述定义的。
[0070]
一般而言,可以采用下述方案获得式i的化合物:
[0071]
式i化合物的制备方法,包括步骤:
[0072][0073]
(a)在惰性溶剂中,用式iii化合物和式ii化合物反应,得到式i化合物,
[0074]
m1为离去基团,m2为保护基团或氢;上述各式中,各基团的定义如上所述。
[0075]
在另一优选例中,所述方法还包括步骤:
[0076][0077]
(b)在惰性溶剂中,用式iv化合物和式v化合物反应,得到式ii化合物,m3为离去基团(卤素、磺酸酯等)。
[0078]
式i化合物的应用
[0079]
所述的式i化合物可用于以下的一种或多种用途:
[0080]
(a)制备治疗与布鲁顿酪氨酸蛋白激酶(btk)活性或表达量相关的疾病的药物;
[0081]
(b)制备布鲁顿酪氨酸蛋白激酶(btk)靶向抑制剂或降解剂;
[0082]
(c)体外非治疗性地抑制或降解布鲁顿酪氨酸蛋白激酶(btk)的活性;
[0083]
(d)体外非治疗性地抑制肿瘤细胞增殖;和/或
[0084]
(e)治疗与布鲁顿酪氨酸蛋白激酶(btk)活性或表达量相关的疾病。
[0085]
在另一优选例中,所述的疾病包括肿瘤、自身免疫疾病;优选地,所述肿瘤包括非霍奇金淋巴瘤(nhl)、慢性淋巴细胞白血病(cll)、b细胞淋巴瘤等;所述自身免疫疾病包括类风湿性关节炎、银屑病等。
[0086]
本发明的式i化合物可用于制备一种药物组合物,所述的药物组合物包括:(i)有效量的式i化合物,或其药学上可接受的盐;和(ii)药学上可接受的载体。
[0087]
在另一优选例中,所述的有效量是指治疗有效量或抑制有效量。
[0088]
本发明的式i化合物还可以用于抑制或降解布鲁顿酪氨酸蛋白激酶(btk)的方法,所述的抑制是体外非治疗性的抑制也可以是治疗性的抑制。
[0089]
在另一优选例中,当对抑制对象施用抑制有效量的本发明的式i化合物或其药学上可接受的盐时,所述的抑制有效量为0.001-500nmol/l,较佳地为0.01-200nmol/l。
[0090]
特别地,本发明还提供了一种治疗与布鲁顿酪氨酸蛋白激酶(btk)活性或表达量相关的疾病的方法,所述方法包括:对治疗对象施用治疗有效量的式i化合物,或所述含有式i化合物作为有效成分的药物组合物。
[0091]
药物组合物和施用方法
[0092]
由于本发明化合物具有优异的对布鲁顿酪氨酸蛋白激酶(btk)的抑制活性,因此本发明化合物及其各种晶型,药学上可接受的无机或有机盐,水合物或溶剂合物,以及含有本发明化合物为主要活性成分的药物组合物可用于治疗、预防以及缓解由与btk活性或表达量相关的疾病。根据现有技术,本发明化合物可用于治疗包括肿瘤等的疾病。
[0093]
本发明的药物组合物包含安全有效量范围内的本发明化合物或其药理上可接受的盐及药理上可以接受的赋形剂或载体。其中“安全有效量”指的是:化合物的量足以明显改善病情,而不至于产生严重的副作用。通常,药物组合物含有1-2000mg本发明化合物/剂,更佳地,含有5-500mg本发明化合物/剂。较佳地,所述的“一剂”为一个胶囊或药片。
[0094]“药学上可以接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的化合物以及它们之间相互掺和,而不明显降低化合物的药效。药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂、润湿剂(如十二烷基硫酸钠)、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、无热原水等。
[0095]
本发明化合物或药物组合物的施用方式没有特别限制,代表性的施用方式包括(但并不限于):口服、瘤内、直肠、肠胃外(静脉内、肌肉内或皮下)、和局部给药。
[0096]
用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,活性化合物与至少一种常规惰性赋形剂(或载体)混合,如柠檬酸钠或磷酸二钙,或与下述成分混合:(a)填料或增溶剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,例如,羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,例如,甘油;(d)崩解剂,例如,琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐、和碳酸钠;(e)缓溶剂,例如石蜡;(f)吸收加速剂,例如,季胺化合物;(g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(h)吸附剂,例如,高岭土;和(i)润滑剂,例如,滑石、硬脂酸钙、硬脂
酸镁、固体聚乙二醇、十二烷基硫酸钠,或其混合物。胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。
[0097]
固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,这种组合物中活性化合物或化合物的释放可以延迟的方式在消化道内的某一部分中释放。可采用的包埋组分的实例是聚合物质和蜡类物质。必要时,活性化合物也可与上述赋形剂中的一种或多种形成微胶囊形式。
[0098]
用于口服给药的液体剂型包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,例知,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物等。
[0099]
除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、矫味剂和香料。
[0100]
除了活性化合物外,悬浮液可包含悬浮剂,例如,乙氧基化异十八烷醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或这些物质的混合物等。
[0101]
用于肠胃外注射的组合物可包含生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液,和用于重新溶解成无菌的可注射溶液或分散液的无菌粉末。适宜的含水和非水载体、稀释剂、溶剂或赋形剂包括水、乙醇、多元醇及其适宜的混合物。
[0102]
用于局部给药的本发明化合物的剂型包括软膏剂、散剂、贴剂、喷射剂和吸入剂。活性成分在无菌条件下与生理上可接受的载体及任何防腐剂、缓冲剂,或必要时可能需要的推进剂一起混合。
[0103]
本发明化合物可以单独给药,或者与其他药学上可接受的化合物联合给药。
[0104]
使用药物组合物时,是将安全有效量的本发明化合物适用于需要治疗的哺乳动物(如人),其中施用时剂量为药学上认为的有效给药剂量,对于60kg体重的人而言,日给药剂量通常为1~2000mg,优选5~500mg。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
[0105]
本发明的主要优点包括:
[0106]
1.提供了一种如式i所示的化合物。
[0107]
2.提供了一种结构新颖的btk降解剂及其制备和应用,所述的降解剂在极低浓度下即可降解btk的活性。
[0108]
3.提供了一类治疗与btk酶活性相关疾病的药物组合物。
[0109]
4.本发明通过大量研究,对化合物结构进行了优化,研究中意外发现了一类具有更高的btk降解活性,而且对依鲁替尼耐药的肿瘤细胞表现出了显著地抑制作用的化合物,取得了预料不到的技术效果。
[0110]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。本发明中涉及的生物材料(如细胞株和抗体),均可通过商业渠道购买获得。
[0111]
实施例1化合物1的制备
[0112][0113][0114]
1、化合物1-2的合成
[0115]
将化合物1-1(19.5g,100mmol)、n-溴代丁二酰亚胺(18.7g,105mmol)和偶氮二异丁腈(1.65g,10mmol)溶于二氯乙烷(500ml)中,80℃反应16小时。反应液冷却,减压浓缩,残余物经硅胶柱色谱纯化(石油醚:乙酸乙酯=100:1洗脱)后得到产物18.3g,收率67%,为无色油状物。esims(m/z):274.0[m+h]
+
.
[0116]
2、化合物1-3的合成
[0117]
将化合物1-2(18.3g,67mmol),化合物1-2a(11.5g,70mmol)和三乙胺(14.9g,147mmol)溶于n,n-二甲基甲酰胺(500ml)中,80℃反应40小时。反应液冷却,减压浓缩,残余物经硅胶柱色谱纯化(二氯甲烷:甲醇=50:1洗脱)后得到产物6.6g,收率34%,为白色固体。esims(m/z):290.1[m+h]
+
.
[0118]
3、化合物1-4的合成
[0119]
将化合物1-3(6.6g,22.8mmol)溶于四氢呋喃(200ml)中,加入2-(三甲基硅烷基)乙氧甲基氯(4.5g,27.4mmol)和三乙胺(3.5g,34.2mmol),回流反应16h。反应液冷却,减压浓缩,残余物经硅胶柱色谱纯化(二氯甲烷:甲醇=50:1洗脱),得到产物7.0g,收率73%,为淡黄色固体。esims(m/z):420.1[m+h]
+
.
[0120]
4、化合物1-5的合成
[0121]
将化合物1-4(7.0g,16.7mmol)溶于n,n-二甲基甲酰胺(100ml)和乙醇(100ml)中,
加入10%钯碳(1.0g),室温氢化反应24小时。反应液过滤,滤液减压浓缩,残余物经硅胶柱色谱纯化(二氯甲烷:甲醇=30:1洗脱),得到产物5.4g,收率83%,为淡黄色固体。esims(m/z):390.2[m+h]
+
.
[0122]
5、化合物1-7的合成
[0123]
氮气保护下,将化合物1-6(5.0g,16.5mmol)溶于四氢呋喃(100ml)中,加入三苯基膦(5.2g,19.8mmol)和偶氮二甲酸二异丙酯(4.3g,21.5mmol),室温下反应16小时。反应液减压浓缩,残余物经硅胶柱色谱纯化(二氯甲烷:甲醇=50:1洗脱),得到产物6.2g,收率77%,为黄色固体。esims(m/z):487.2[m+h]
+
.
[0124]
6、化合物1-8的合成
[0125]
将化合物1-7(6.2g,12.7mmol)溶于二氯甲烷(50ml)中,加入三氟乙酸(10ml),室温反应4小时。反应液减压浓缩,残余物经硅胶柱色谱纯化(二氯甲烷:甲醇=20:1洗脱),得到产物4.5g,收率91%,为淡黄色油状物。esims(m/z):387.2[m+h]
+
.
[0126]
7、化合物1-9的合成
[0127]
将三甘醇(15.0g,100mmol)和三乙胺(12.1g,120mmol)溶于二氯甲烷(500ml)中,加入对甲苯磺酰氯(39.8g,210mmol),室温下反应4小时。反应液用10%硫酸二氢钾水溶液(250ml
×
3)洗涤,无水硫酸钠干燥,减压浓缩,残余物经硅胶柱色谱纯化(二氯甲烷:甲醇=30:1洗脱),得到产物37.1g,收率81%,为无色油状物。esims(m/z):459.1[m+h]
+
.
[0128]
8、化合物1-10的合成
[0129]
将化合物1-5(2.0g,5.2mmol)溶于四氢呋喃(100ml)中,分批加入化合物1-9(5.9g,12.8mmol)和碳酸铯(4.2g,12.8mmol),氮气保护下回流反应72小时。反应液用乙酸乙酯(200ml)稀释,用饱和碳酸钠水溶液(150ml
×
3)洗涤,无水硫酸钠干燥,减压浓缩,残余物经硅胶柱色谱纯化(二氯甲烷:甲醇=50:1洗脱),得到产物0.55g,收率15%,为无色油状物。esims(m/z):676.1[m+h]
+
.
[0130]
9、化合物1-11的合成
[0131]
将化合物1-10(550mg,0.81mmol)溶于四氢呋喃(20ml)中,加入化合物1-8(346mg,0.89mmol)和二异丙基乙基胺(157mg,1.21mmol),氮气保护下60℃反应40小时。反应液冷却,减压浓缩,残余物经硅胶柱色谱纯化(二氯甲烷:甲醇=30:1洗脱),得到产物311mg,收率41%,为无色油状物。esims(m/z):890.3[m+h]
+
.
[0132]
10、化合物1的合成
[0133]
将化合物1-11(311mg,0.35mmol)溶于四氢呋喃(10ml)中,加入四丁基氟化铵(274mg,1.05mmol)室温反应24小时。反应液减压浓缩,残余物经制备硅胶板纯化(二氯甲烷:甲醇=12:1洗脱),得到产物67mg,收率25%,为淡黄色固体。esims(m/z):760.2[m+h]
+
.1h nmr(400mhz,dmso-d6):δ10.93(s,1h),8.24(s,1h),7.71
–
7.62(m,2h),7.48
–
7.35(m,5h),7.22
–
7.10(m,5h),6.73
–
6.64(m,2h),6.39(t,j=5.7hz,1h),5.01(dd,j=13.3,5.1hz,1h),4.67(s,1h),4.32
–
4.06(m,2h),3.64
–
3.52(m,8h),3.31
–
3.25(m,2h),3.05(s,2h),2.94
–
2.82(m,1h),2.63
–
2.51(m,3h),2.39
–
2.12(m,5h),1.99
–
1.80(m,3h).
[0134]
同理,参照上述实施例的方法,可以获得下表中的化合物:
链霉素的rpmi-1640完全培养基中,于37℃、5%co2及饱和湿度条件下的培养箱培养。
[0146]
细胞铺板:取处于对数生长期的tmd8细胞,离心后,加入适量完全培养基获得单细胞混悬液,采用血球计数板进行细胞计数,配制成1.5
×
105个/ml细胞悬液,以每孔100μl细胞悬液接种于96孔培养板中,置于co2细胞培养箱培养24h。
[0147]
细胞给药:取待测的本发明化合物,配制成2.5μm母液,每孔加入25μl实施例化合物,摇匀,置于co2细胞培养箱中,继续培养72h。
[0148]
cck-8检测:给药72h后,每孔加入10%cck-8溶液,置于co2细胞培养箱中,孵育1-4h。采用酶标仪于450nm下测定各孔吸光度。
[0149]
细胞增殖抑制率计算:
[0150]
细胞增殖抑制率(%)=[(ac-as)/(ac-ab)]
×
100%
[0151]
as:实验孔吸光度(含细胞、培养基、cck-8溶液和药物溶液)
[0152]
ac:对照孔吸光度(含细胞、培养基、cck-8溶液,不含药物)
[0153]
ab:空白孔吸光度(含培养基、cck-8溶液,不含细胞、药物)
[0154]
结果表明本发明的化合物能够显著地抑制tmd8细胞增殖,表现出了优异的抗肿瘤细胞增殖的活性。
[0155]
化合物ic
50
(nm)对照化合物157114
[0156]
实施例4化合物对oci-ly10细胞增殖抑制实验
[0157]
细胞培养:将oci-ly10细胞株(人淋巴瘤细胞)培养于含有10%胎牛血清和1%青霉素-链霉素的rpmi-1640完全培养基中,于37℃、5%co2及饱和湿度条件下的培养箱培养。
[0158]
细胞铺板:取处于对数生长期的oci-ly10细胞,离心后,加入适量完全培养基获得单细胞混悬液,采用血球计数板进行细胞计数,配制成1.5
×
105个/ml细胞悬液,以每孔100μl细胞悬液接种于96孔培养板中,置于co2细胞培养箱培养24h。
[0159]
细胞给药:取待测的本发明化合物,配制成2.5μm母液,每孔加入25μl实施例化合物,摇匀,置于co2细胞培养箱中,继续培养72h。
[0160]
cck-8检测:给药72h后,每孔加入10%cck-8溶液,置于co2细胞培养箱中,孵育1-4h。采用酶标仪于450nm下测定各孔吸光度。
[0161]
细胞增殖抑制率计算:
[0162]
细胞增殖抑制率(%)=[(ac-as)/(ac-ab)]
×
100%
[0163]
as:实验孔吸光度(含细胞、培养基、cck-8溶液和药物溶液)
[0164]
ac:对照孔吸光度(含细胞、培养基、cck-8溶液,不含药物)
[0165]
ab:空白孔吸光度(含培养基、cck-8溶液,不含细胞、药物)
[0166]
结果表明本发明的化合物能够显著地抑制oci-ly10细胞增殖,表现出了优异的抗肿瘤细胞增殖的活性。
[0167]
化合物ic
50
(nm)对照化合物12.511.2
[0168]
上述测试结果表明,本发明化合物的活性要显著由于对照化合物1,在相同的极低
浓度下针对btk蛋白降解率达到了对照化合物1的两倍以上,针对tmd8细胞株细胞增殖抑制能力是对照化合物1的四倍,表现出了优异的抗肿瘤细胞增殖的活性。
[0169]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1