一种类器官三维联合培养装置、培养系统及培养方法与流程
1.本发明涉及细胞技术领域,具体而言,涉及一种类器官三维联合培养装置、培养系统及培养方法。
背景技术:
2.药物引起的自身免疫性疾病,包括对肝脏和肌肉组织等器官的自身免疫反应,是药物不良反应中的一类,目前发病机制仍不明确。它也是新药研发过程导致失败的重要原因之一,因此,在药物研发阶段进行药物肝毒性筛选有助于降低研究和开发费用,也有助于提高新药研发的成功率。
3.尽管现有药物肝毒性预测体外三维培养装置较多,但大部分装置不具有仿生结构,而且仅能检测药物对肝细胞的细胞损伤程度,无法反映细胞损伤的具体机制。尤其是自身免疫性肝脏及肌肉损伤。
4.综上,如何准确模拟在体细胞状态,构建体外细胞三维培养同时实现对药物引起的自身免疫性疾病进行评估是药物研发过程中面临的难题之一。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种类器官三维联合培养装置、培养系统及培养方法以解决上述问题。
7.本发明是这样实现的:本发明提供了一种类器官三维联合培养装置,该装置可以准确模拟类器官在体细胞的状态,同时能实现对药物引起的自身免疫性疾病进行评估。
8.该三维联合培养装置包括底板和上盖,底板具有细胞培养室,细胞培养室内固定设置有固定柱,固定柱上套设有收束环,收束环具有用于安装水凝胶的安装槽,底板开设有至少3个培养基接口,且每个培养基接口均与细胞培养室连通。
9.细胞培养室用于细胞的培养,使用时,向细胞培养室中导入培养液以实现细胞的培养。培养液由底板的其中一个培养基接口接入,流经细胞培养室后,从底板的其他培养基接口流出。
10.在其他实施方式中,可以在培养液进口端和出口端设置泵。
11.设置至少3个培养基出口可以同时满足多个类器官的联合培养,在其他实施方式中,培养基的出口数目可以是3个,4个,5个或多个。
12.在一种实施方式中,固定柱、细胞培养室以及底板一体成型,例如利用cnc精密加工技术铸模制备。
13.收束环的内环可以与固定柱的外周套接,收束环的上下通透,水凝胶可以放置于收束环的安装槽内。由于水凝胶的结构不定型,因此可以在收束环的安装槽内不脱落。
14.收束环利用3d打印技术制备。在一种实施方式中,可采用光敏树脂制备。
15.在一种实施方式中,收束环的外径长、宽、高为10
‑
20mm、2
‑
4mm、1
‑
5mm;内径长、宽为9
‑
19mm、1
‑
2mm。长、宽、高优选为15mm、2mm、2mm; 内径长、宽优选为9mm、1mm。
16.在一种实施方式中,固定柱的长、宽分别为9
‑
19mm、1
‑
2mm。
17.在一种实施方式中,类器官三维培养装置的上盖利用cnc精密加工技术铸模制备。类器官三维培养装置底板及上盖采用pc制备。
18.在本发明应用较佳的实施方式中,上述细胞培养室具有培养基进口,且培养基进口与其中一个培养基接口连通。培养基接口垂直于底板的底面,高度为20
‑
30mm、直径为2
‑
5mm。
19.在本发明应用较佳的实施方式中,上述细胞培养室的具有培养基流出通道;培养基流出通道数目至少为两条;每条培养基流出通道的端部具有培养基出口,且每个培养基出口均与其中一个培养基接口相连。
20.在本发明应用较佳的实施方式中,上述当培养基流出通道数目为两条时,两条培养基流出通道的夹角为30
‑
170
°
;优选地,两条培养基流出通道的夹角为135
°
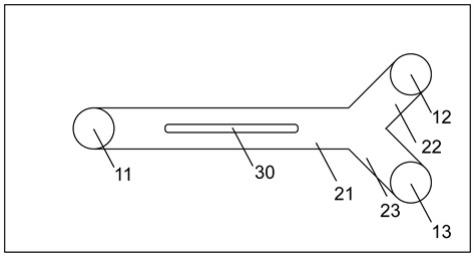
。每条培养基流出通道长、宽分别为5
‑
8mm、3
‑
5mm。
21.在本发明应用较佳的实施方式中,上述细胞培养室的深度为1
‑
5mm;优选为2mm。细胞培养室长、宽为15
‑
30mm、3
‑
5mm。
22.本发明提供了一种类器官三维联合培养系统,其包括至少两个类器官三维联合培养装置。
23.在本发明应用较佳的实施方式中,上述相邻类器官三维联合培养装置之间通过导管连接;导管的一端连接其中一个类器官三维联合培养装置的培养基接口,导管的另一端连接另外一个类器官三维联合培养装置的培养基接口以实现培养基的灌流;优选地,类器官三维联合培养装置的数目为3个。在其他实施方式中,也可以根据实际三维培养的需求设置类器官三维联合培养装置的数目为4个、5个或多个,从而实现更多类器官的三维联合培养。当连接更多数目的类器官三维联合培养装置时,用导管将培养基接口依次串接即可,每个类器官三维联合培养装置可以培养不同类器官细胞,例如联合培养淋巴细胞、肝细胞和骨骼肌细胞以模拟淋巴细胞、肝细胞和骨骼肌细胞在体细胞的状态,实现对药物引起的自身免疫性疾病进行评估。
24.在本发明应用较佳的实施方式中,上述类器官三维联合培养系统还包括收束环夹,收束环夹的一端具有2个固定连接的扩孔臂,收束环夹的另一端具有安装孔。
25.收束环夹用于辅助将水凝胶固定与收束环的安装槽内,需要说明的是,在其他实施方式中,收束环夹也可以根据需要进行设置,也可以采用无菌的装置辅助将水凝胶固定于收束环中。
26.收束环夹利用3d打印技术制备,在一种实施方式中,可采用光敏树脂制备,在其他实施方式中,也可采用其他的环氧树脂、聚砜树脂等材料制备。
27.在一种实施方式中,上述收束环夹的最宽处宽度为8.5
‑
10mm,最窄处宽度为1
‑
2mm。
28.使用时,将2个扩孔臂分别插入收束环的安装槽内,收束环夹另一端的安装孔用于嵌合步进电机的动力输出端(例如马达转子或传动轴)。将水凝胶的一端设置于收束环的安
装槽内,借助步进电机的传动装置的转动,带动收束环夹的窄端进行转动,从而不断将水凝胶缠绕至收束环内,待固定好,裁剪去除多余的水凝胶,完成固定。
29.本发明提供了一种类器官三维联合培养方法,其包括如下步骤:将包裹有类器官的水凝胶固定于收束环上,然后将收束环套设于固定柱上,将底板与上盖扣合,通过导管连接各类器官三维联合培养装置,沿培养基接口注入培养基进行培养。
30.在本发明应用较佳的实施方式中,上述使用收束环夹将水凝胶固定于收束环上;优选地,以收束环夹的扩孔臂固定收束环,将步进电机转子的传动端头嵌入收束环夹的安装孔,将水凝胶的一端固定在收束环上,启动步进电机完成固定。
31.包裹有类器官的水凝胶的制备方法参照专利cn201310593883.7公开的仿肝板结构肝细胞三维培养装置及其培养方法。
32.本发明具有以下有益效果:(1)本发明提供的类器官三维联合培养装置利用收束环,改进了类器官水凝胶丝的固定方式,使类器官水凝胶丝接种更加便捷,同时防止了污染,有助于实现精确控制细胞量。
33.(2)本发明所涉及的联合培养装置,所具有的模块化设计使其能够满足不同细胞组合的实验,扩展性强。
34.(3)联合培养装置能实现对药物引起的自身免疫性疾病的预测,有助于降低研究和开发费用,也有助于提高新药研发的成功率。
35.(4)本发明所涉及联合培养装置,能在体外模拟生物体内细胞、组织、器官、环境之间的正常物质交换和相互作用。
36.(5)本发明所涉及联合培养装置,能够用于研究不同的组织、器官、系统的细胞之间的代谢关系和经过细胞代谢后的产物。
附图说明
37.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
38.图1为本发明提供的一种类器官三维培养装置上盖的俯视图;图2为本发明提供的一种类器官三维培养装置底板的俯视图;图3为收束环的结构示意图;图4为收束环夹的结构示意图;图5为本发明提供的三维联合培养装置的结构透视图;图6为微流控芯片形成的包裹有淋巴结类器官的水凝胶丝的示意图;图7为微流控芯片形成的包裹有仿肝板结构类器官的水凝胶丝的示意图;图8为微流控芯片形成的包裹有骨骼肌类器官的水凝胶丝的示意图。
39.图标:11
‑
第一培养基接口;12
‑
第二培养基接口;13
‑
第三培养基接口;30
‑
固定柱;21
‑
细胞培养室;22
‑
第一培养液流出通道;23
‑
第二培养液流出通道;40
‑
收束环;41
‑
安装槽;42
‑
安装孔;43
‑
扩孔臂。
具体实施方式
40.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本发明实施例的组件可以以各种不同的配置来布置和设计。
41.因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
42.应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中不需要对其进行进一步定义和解释。
43.在本发明的描述中,需要说明的是,术语“中心”、“上”、“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”、“顺时针”、“逆时针”等指示的方位或位置关系为基于附图所示的方位或位置关系,或者是该发明产品使用时惯常摆放的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”、“第三”等仅用于区分描述,而不能理解为指示或暗示相对重要性。
44.此外,术语“水平”、“竖直”、“悬垂”等术语并不表示要求部件绝对水平或悬垂,而是可以稍微倾斜。如“水平”仅仅是指其方向相对“竖直”而言更加水平,并不是表示该结构一定要完全水平,而是可以稍微倾斜。
45.在本发明的描述中,还需要说明的是,除非另有明确的规定和限定,术语“设置”、“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
46.实施例1本实施例提供了一种类器官三维培养装置及类器官三维培养系统,参照图1和图5所示。图1和图2分别为类器官三维培养装置上盖和底板的结构示意图,图5为3个类器官三维培养装置串联形成的培养系统的结构透视图。
47.类器官三维培养装置包括相互对合以形成腔室结构的底板和上盖,图1即为上盖,下图为底板。底板与上盖扣接,本实施例在在底板开设有3个培养基接口,此外,在其他实施方式中,也可以根据需要设置培养基接口的数目。
48.参照图2所示,底板具有细胞培养室21以培养细胞,需要说明的是,每个培养基接口均与细胞培养室21连通。
49.细胞培养室21内固定设置有固定柱30,固定柱30上套设有收束环40。收束环40在使用前可以从固定柱30上拆卸下来,安装上水凝胶后,再套设在固定柱30上。参照图3所示,收束环40具有用于安装水凝胶的安装槽41。本实施例中设置安装槽41的形状为环形。
50.细胞培养室21的一端具有培养基进口,且培养基进口与第一培养基接口11相连。
51.参照图2所示,细胞培养室21具有2条培养基流出通道;分别为第一培养液流出通
道22和第二培养液流出通道23。每条培养基流出通道的端部具有培养基出口,且每个培养基出口均与其中一个培养基接口相连。
52.参照图2所示,第一培养液流出通道22的端部与第二培养基接口12相连,第二培养液流出通道23的端部与第三培养基接口13相连。
53.第一培养液流出通道22和第二培养液流出通道23的夹角为135
°
。
54.本实施例还提供了一种类器官三维联合培养系统,参照图5所示,其包括通过导管依次串联的3个类器官三维培养装置以及收束环夹,相邻类器官三维联合培养装置之间通过导管连接;导管的一端连接其中一个类器官三维联合培养装置的培养基接口,导管的另一端连接另外一个类器官三维联合培养装置的培养基接口以实现培养基的灌流。
55.请参照图4所示,收束环夹的一端具有2个固定连接的扩孔臂43,收束环夹的另一端具有安装孔42。使用时,将2个扩孔臂43分别插入收束环40的安装槽41内,收束环夹另一端的安装孔42用于嵌合步进电机的动力输出端(例如马达转子或传动轴)。将水凝胶的一端设置于收束环40的安装槽41内,借助步进电机的传动装置的转动,带动收束环夹的窄端进行转动,从而不断将水凝胶缠绕至收束环40内,待固定好,裁剪去除多余的水凝胶,完成固定。
56.本实施例中收束环40及收束环夹利用3d打印技术制备。收束环40及收束环夹采用光敏树脂制备。
57.收束环40外径长、宽、高为10mm、2mm、2mm;内径长、宽为9mm、1mm。
58.收束环夹最宽处宽度为8.5mm,最窄处宽度为1mm。
59.类器官三维培养装置底板及上盖的材料为pc,利用cnc精密加工技术铸模制备。
60.3个培养基接口的高度均为20mm、直径为2mm。
61.类器官三维培养装置的细胞培养室21、固定柱30、第一培养液流出通道22和第二培养液流出通道23的深度均为2mm。
62.类器官三维培养装置细胞培养室21长、宽为15mm、3mm。
63.类器官三维培养装置固定柱30的长、宽为9mm、1mm。
64.第一培养液流出通道22和第二培养液流出通道23的尺寸为:长、宽分别是5mm、3mm。
65.实施例2本实施例提供了一种淋巴结
‑
肝脏
‑
骨骼肌类器官三维联合培养的方法,其包括以下步骤:s1、将含巨噬细胞的海藻酸钠溶液、含淋巴t细胞的海藻酸钠溶液、缓冲液及胶凝液分别加入微流控芯片;将微流控芯片形成的包裹有淋巴结类器官的水凝胶丝(参照图6所示)导出装置,并用收束环夹在收束环40的扩孔臂43固定收束环40,安装孔42嵌入步进电机转子接头,用无菌镊子将水凝胶丝一端固定在收束环40上,启动步进电机,转速为50rpm,30秒固定结束,用无菌普通手术剪剪断水凝胶丝,从而将水凝胶固定在收束环40上;将收束环40嵌套入固定柱30上,撤去收束环夹,对合上盖,铝合金芯片夹固定;包裹有淋巴结类器官的水凝胶丝由一款微流控芯片构建而成。微流控芯片及构建方法具体描述参阅:仿肝板结构肝细胞三维培养装置及其培养方法(专利号 cn201310593883.7)。其中,缓冲液包括10%(w/v)葡聚糖、0.9%(w/v)nacl及10mmol/l heaps;含肝细胞的海藻酸钠
溶液包括0.7%(w/v)海藻酸钠、0.9%(w/v) nacl、0.05%(w/v)去端肽胶原、1%(w/v)牛血清白蛋白、10mmol/l heaps及3
×
107个/ml肝细胞;含内皮细胞的海藻酸钠溶液包括0.7% (w/v)海藻酸钠、0.9%(w/v)nacl、0.05%(w/v)去端肽胶原、1% (w/v)牛血清白蛋白、10mmol/l heaps及1
×
107个/ml内皮细胞;胶凝液包括10%(w/v)葡聚糖、20mmol/l bacl2、0.72%(w/v)nacl及 10mmol/l heaps。
66.s2、将含肝细胞的海藻酸钠溶液、含内皮细胞的海藻酸钠溶液、缓冲液及胶凝液分别加入微流控芯片;将微流控芯片形成的包裹有肝板结构的水凝胶(参照图7所示)导出装置,并固定于收束环40上,将收束环40嵌套入一个新的类器官三维培养装置底板的固定柱30上,对合上盖;本实施例使用的细胞为人正常肝永生化细胞株l02及人脐静脉内皮细胞株 ea.hy926复苏传代培养的细胞,细胞状态最佳,活力超过90%以上。
67.s3、将含骨骼肌细胞的海藻酸钠溶液、缓冲液及胶凝液分别加入微流控芯片;将微流控芯片形成的包裹有骨骼肌类器官的水凝胶(参照图8所示)导出装置,并固定于收束环40上,将收束环40嵌套入另一个新的类器官三维培养装置底板的固定柱30上s,对合上盖;s4、通过导管连接含培养基的注射器(用于注射培养基)、s1的淋巴结类器官三维培养装置、s2的仿肝板结构类器官三维培养装置和s3的骨骼肌器官三维培养装置,组成淋巴结
‑
肝脏
‑
骨骼肌类器官三维联合培养装置并持续灌流培养。
68.注射器内的培养基由微量注射泵泵入淋巴结类器官三维培养装置,通过培养基导管分别流入仿肝板结构类器官三维培养装置和骨骼肌器官三维培养装置后,回收用以细胞间相互作用,物质代谢等研究。
69.需要说明的是,本实施例提供的装置在细胞培养前,需进行高压灭菌、消毒烤干的处理。
70.以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1