一种制备赤藓糖醇的方法与流程
1.本发明属于生物技术领域,具体涉及一种提高生物法制备赤藓糖醇生产转化效率的方法。
背景技术:
2.赤藓糖醇(也称丁四醇)是一种四元多元醇,分子量122.1道尔顿,在很多水果蔬菜以及酿造食品中均存在(如梨、葡糖等水果以及酒类),但含量很少。由于赤藓糖醇具有零热量、无剂量限制以及纯生物发酵制备的优点,使得赤藓糖醇在食品中的应用更加广泛,已经在糖果、烘焙食品、无糖饮料等食品中广泛使用。比如:申请号为cn200710014055.8 的中国发明专利公开了一种含赤藓糖醇的夹心巧克力的制作方法;申请号为cn201110420379.8 的中国发明专利公开了一种含赤藓糖醇的复合无糖饮料及其制备方法;申请号为201180012533.6 的中国发明专利公开了一种含赤藓糖醇的糖果产品及其制备方法;申请号为cn201010569981.3 的中国发明专利公开了一种含赤藓糖醇的护肝健胃保健饮料及其制造方法。
3.另外赤藓糖醇还可以和其它功能糖或功能糖醇搭配应用在食品中。比如:申请号为cn200610168838.7 的中国发明专利公开了一种含木糖醇与赤藓糖醇的无冷却效应的无糖甜点;美国发明专利us7754268b2 公开了含木糖醇与/ 或赤藓糖醇的烘焙食品的制作方法;申请号为cn201010289677.3 与cn201010289668.4 的中国发明专利以及美国发明专利us7579032b2 都公开了一种含赤藓糖醇与塔格糖的零热量或低热量的饮料及其在食品中的用途;欧洲发明专利ep1057414b1 公开了一种含赤藓糖醇与山梨醇的无糖糖果的方法。
4.此外,赤藓糖醇还应用在牙膏、漱口水以及化妆品领域(详见美国发明专利us8287842b2、世界发明专利wo2001074323a1、美国发明专利us20060067902a1 以及美国发明专利us20060062752a1。
5.目前很多国家已经批准赤藓糖醇在食品上的使用。日本在1990 年就已经批准赤藓糖醇作为蔗糖的甜味替代剂,应用于各种糖果、饮料等食品中。美国于2001 年也批准赤藓糖醇在食品中的应用,欧盟、澳大利亚以及新西兰等国家都批准赤藓糖醇的使用。我国2008 年将赤藓糖醇列为食品添加剂新品种,并于2011 年制定了赤藓糖醇的国家标准(gb26404
‑
2011),并增加了一种合成赤藓糖醇的酵母菌株candida lipolytica(解脂假丝酵母),该酵母国际上现在命名为yarrowia lipolytica(耶氏解脂酵母或解脂亚罗酵母)。这一国家标准中规定的三种产赤藓糖醇的酵母分别是解脂亚罗酵母(candida lipolytica)、丛梗孢酵母(monillie lapollinis)以及类丝孢酵母(trichosporonoides megachiliensis),以葡萄糖为主要原料,经上述三种酵母中的一种发酵转化为赤藓糖醇,再经过精制等工艺得到食品添加剂赤藓糖醇晶体产品。
6.中国专利文献cn200610163644.8公开了生产赤藓糖醇的酵母菌株,该菌株与moniliella acetobuten最接近,由葡萄糖转化为赤藓糖醇的效率大于30%。该菌株不符合我国制定的国家标准,不能在我国得到使用。中国发明专利zl200510102929(授权公告号
cn100506972c)公开了一种解脂假丝酵母及其生产赤藓糖醇的方法,所使用的酵母虽然为我国国家标准规定的菌株(candida lipolytica)且已经在我国相关企业得到使用推广,但由葡萄糖合成赤藓糖醇的转化率偏低(47%)。欧洲发明专利文献ep0770683a1 公开了一种采用yarrowia lipolytica由葡萄糖合成赤藓糖醇的方法,但得到的最高转化率只有32.9%,转化率较低。美国发明专利文献us6110715 公开了一种采用trichosporonoides megachiliensis酵母能发酵葡萄糖合成赤藓糖醇,虽然该菌株符合我国国家标准,但报道的最高转化率只有35.1%,同样转化率较低而无实际使用价值。
7.中国专利申请201110329642.2披露了一种利用解脂耶罗威亚酵母菌株生产赤藓糖醇的工艺,其目的是解决现有技术搅拌和鼓风时间长,电耗高,易发生染菌,生产效率低,成本高等问题。该文献中披露所述的菌株是在公司在土壤或蜂巢中筛选获得解脂耶罗威亚酵母菌株,经人工繁殖后获得赤藓糖醇生产菌株;但该文献并没有公开所述菌株的任何特性信息,如菌株的单细胞形态,细胞形态的多样性变化,菌落的形态,分子鉴定等信息;同时,该文献也没有披露任何该菌株生产赤藓糖醇的转化效率;尽管文献在说明书中记载有“产品的纯度在99.5%以上”,“总收率为84.8%”,但是这些参数与赤藓糖醇的转化效率没有任何关系,进而本领域技术人员无法获知转化效率。
8.本技术人在2019年提交的中国发明专利申请201911018566.6中描述了在转化过程中添加额外的蔗糖合酶和环麦芽糊精糖基转移酶能够提高葡萄糖合成赤藓糖醇达到51%至61.2%,但在扩大反应规模后发现,该方法存在稳定性差的问题,在250ml摇瓶规模时,反应转化率最高能达到61.2%,而最低只有39%,在10l以上发酵罐规模时,反应转化率最高能达到49%,而最低只有32%,与对照相比几乎没有区别,在实际生产中推广应用仍需进行优化。
9.基于本领域酶促反应相关理论,在一般性利用细胞中多种酶促反应进行生物转化的实际生产过程中,提高整体酶促反应转化率的手段有以下几种:降低产物浓度、降低抑制剂浓度、使酶处于最适反应ph和温度等方式。具体到在以葡萄糖为原料,以酵母为发酵转化菌株生产赤藓糖醇的过程中,由于赤藓糖醇和葡萄糖分子量相差不大、性质相近,难以利用常规膜技术、透析、色谱等方式快速、低成本的去除产物赤藓糖醇,从而降低反应体系中的产物浓度以提高转化率。同时,由于使用的是酵母细胞进行转化,因此酶的反应ph和反应温度改变受到细胞的屏蔽作用无法完全自由控制,只能在一定程度下进行反应条件的调整。
10.因此,降低反应体系中的抑制剂浓度就成了提高转化率的一种可能的选择。在葡萄糖至赤藓糖醇的过程中,细胞内的磷酸戊糖途径以及多种酶参与了整个过程,其中普遍认为其中比较关键的酶是赤藓酮糖还原酶(lee j k , ha s j , kim s y , et al. increased erythritol production intorulasp. with inositol and phytic acid[j]. biotechnology letters, 2001, 23(7):497
‑
500.),同时,多种条件对细胞催化所采用菌株的生命活动也有一定影响,进而影响赤藓糖醇最终转化效率。例如cu
2+
,肌醇和植酸够提高赤藓糖醇转化效率,促进赤藓糖醇的产生。而mn
2+
、ca
2+
,cr
3+
,ni
2+
,v
4+
、有机酸、无机磷等能降低赤藓糖醇转化效率,减少赤藓糖醇的产生(spencer j f , sallans h r . production of polyhydric alcohols by osmophilic yeasts.[j]. canadian journal of microbiology, 1956, 2(2):72
‑
79.)。同时,其他代谢通路对于葡萄糖的分流代谢作用同样可能降低以葡萄糖为原料转化制备赤藓糖醇的总转化率。
[0011]
为了提高葡萄糖的利用率,可以从减少体系中抑制赤藓糖醇生成的组分,以及减少转化过程中葡萄糖的非转化代谢两方面展开研究。
技术实现要素:
[0012]
有鉴于此,本发明通过研究提供了一种优化提高赤藓糖醇转化效率的方法。通过在解脂亚罗酵母sy11(cgmcc no.22884)转化葡萄糖合成赤藓糖醇的过程中添加少量l
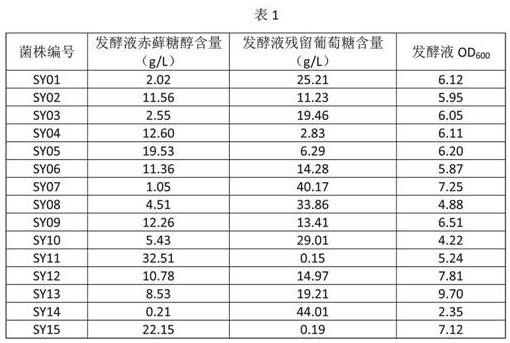
‑
苯丙氨酸,能够显著提高赤藓糖醇转化效率,这为以该菌株生产赤藓糖醇的工业化生产提供了一种切实可行、简单廉价的提高赤藓糖醇转化效率方法。
[0013]
本发明是在赤藓糖醇制备方法的基础上进行研究所获得的结果。赤藓糖醇制备方法通常的主要流程为:在液体培养基中培养酵母菌种,待发酵细胞密度达到一定数值之后,向发酵液中添加一定量葡萄糖,并维持一定温度和ph,利用酵母细胞进行葡萄糖转化为赤藓糖醇的转化反应。反应结束后经过滤除菌、浓缩、结晶等步骤,从发酵液中提纯赤藓糖醇。具体到解脂亚罗酵母菌体内,葡萄糖转化为赤藓糖醇合成途径为:葡萄糖转化为6
‑
磷酸葡萄糖,随后6
‑
磷酸葡萄糖进入磷酸戊糖途径,经过脱氢脱羧转化为5
‑
磷酸核酮糖,5
‑
磷酸核酮糖在磷酸戊糖异构酶及差向酶的作用下同分异构化生成5
‑
磷酸核糖和5
‑
磷酸木酮糖,产物在转酮酶作用下经转酮反应生成7
‑
磷酸景天酮糖,7
‑
磷酸景天酮糖再在转醛酶作用下通过转醛反应将三碳单位转移到3
‑
磷酸甘油醛的c1位置上,生成4
‑
磷酸赤藓糖,经过4
‑
磷酸赤藓糖激酶催化下,转化为赤藓糖,在赤藓糖还原酶作用下,最终成为赤藓糖醇。
[0014]
本发明人在进行提高生物法制备赤藓糖醇生产转化效率的改进研究实验时,为了避免葡萄糖被酵母非转化利用,在转化阶段添加葡萄糖的同时,添加了一定量的普鲁兰糖、支链淀粉、支链寡糖、直链淀粉、环麦芽糊精、淀粉等为酵母提供碳源,但最终赤藓糖醇转化率没有提高,实验结果没有达到预期效果。随后,本发明人向以上转化过程中添加了能够水解上述碳源的酶制剂,发现不同解脂亚罗酵母出现了不同的赤藓糖醇转化率结果:解脂亚罗酵母(yarrowia lipolytica) blc13(cgmcc no.7326)转化葡萄糖生成赤藓糖醇的转化率没有变化,而解脂亚罗酵母(yarrowia lipolytica) sy11(cgmcc no.22884)在添加了相应酶制剂后转化率略有提高。这一结果让本发明人意识到不同解脂亚罗酵母菌株在赤藓糖醇合成途径方面存在较大差异。随后,本发明人对解脂亚罗酵母(yarrowia lipolytica) sy11(cgmcc no.22884)进行全基因组测序和注释。对其基因组进行基因分析发现,其对于合成赤藓糖醇的关键酶基因序列和基因拷贝数与其他解脂亚罗酵母例如dsm 3286和clib122有所不同。例如:在解脂亚罗酵母dsm 3286菌株中,主要用于生成4
‑
磷酸赤藓糖的转醛酶(transaldolase)基因序列长度为978bp(基因序列如seq id no.1所示),拷贝数仅为1个,位于第六条染色体从2136781bp至2137755bp;在解脂亚罗酵母clib122菌株中,转醛酶(transaldolase)基因序列长度为978bp(基因序列如seq id no.2所示),拷贝数仅为1个,位于第六条染色体从2095358bp至2096335bp;而在解脂亚罗酵母 sy11(cgmcc no.22884)菌株基因组中,转醛酶(transaldolase)序列长度为978bp,拷贝数为3个,分布在第六条染色体中3个位置,分别是从2045787bp至2046764bp(基因序列如seq id no.3所示),2071254bp至2072231bp(基因序列如seq id no.4所示)和2105478bp至2106455bp(基因序列如seq id no.5所示)。领域内众所周知,通常基因拷贝数的增多能够提高基因的表达量。因此在解脂亚罗酵母sy11(cgmcc no.22884)中由于转醛酶的过量表达,其内部4
‑
磷
酸赤藓糖的产量会高于其他解脂亚罗酵母,为了使4
‑
磷酸赤藓糖尽可能积累并被4
‑
磷酸赤藓糖激酶催化为赤藓糖,应限制4
‑
磷酸赤藓糖在其他途径的消耗。而4
‑
磷酸赤藓糖是解脂亚罗酵母体内合成芳香族氨基酸的主要前体,其与磷酸烯醇式丙酮酸(pep)在3
‑
脱氧
‑
α
‑
阿拉伯庚酮糖酸
‑7‑
磷酸合成酶(dahp合成酶,arof/arog/aroh)的作用下,生成3
‑
脱氧
‑
α
‑
阿拉伯庚酮糖酸
‑7‑
磷酸(dahp),随后经一系列酶促反应最终生成l
‑
苯丙氨酸和l
‑
酪氨酸,l
‑
苯丙氨酸和l
‑
酪氨酸是3
‑
脱氧
‑
α
‑
阿拉伯庚酮糖酸
‑7‑
磷酸合成酶(dahp合成酶,arof/arog/aroh)负反馈抑制物,同时是3
‑
脱氧
‑
α
‑
阿拉伯庚酮糖酸
‑7‑
磷酸合成酶(dahp合成酶,arof/arog/aroh)基因表达的负反馈阻遏物。因此在发酵转化葡萄糖阶段,利用这一特点限制解脂亚罗酵母 sy11(cgmcc no.22884)合成芳香族氨基酸的能力将能够一定程度上提高赤藓糖醇的产量。
[0015]
具体而言,本发明提供一种提高生物法制备赤藓糖醇生产效率的方法,在以葡萄糖为原料,以解脂亚罗酵母sy11(cgmcc no.22884)为发酵转化菌株的基础上,在发酵转化过程中进行至一定阶段时,向反应液中添加一定质量的l
‑
苯丙氨酸,抑制4
‑
磷酸赤藓糖向芳香族氨基酸方向的转化,维持住4
‑
磷酸赤藓糖的积累,确保其向赤藓糖方向的转化,从而提高赤藓糖醇的发酵转化效率。
[0016]
在具体实施方式中,所述的菌株为解脂亚罗酵母菌(yarrowia lipolytica) sy11,保藏号为cgmcc no.22884。
[0017]
在具体的实施方式中,具体包括下述步骤:a、将酵母菌种进行培养发酵;其中,所述培养可以在摇瓶中进行,也可在发酵罐中进行,优选在体积1000升或以下体积中进行;b、发酵结束后,向发酵液中添加葡萄糖固体和l
‑
苯丙氨酸固体,并维持搅拌,进行葡萄糖转化为赤藓糖醇的转化反应;进一步包括下述步骤:c、反应结束后从发酵液中提纯赤藓糖醇。
[0018]
具体的反应条件也可以参考中国专利文献201310282059.x中所描述的进行。
[0019]
在一个具体实施方式中,步骤a中的所述发酵的培养基中,碳源为淀粉水解液,用量为200~400g/l;氮源为磷酸氢二铵,且氮源的用量为磷酸氢二铵20~30g/l;无机盐为硫酸镁、硫酸锌,且用量为硫酸镁0.5~2.5g/l,硫酸锌0.5~2.5g/l。
[0020]
其中优选地,步骤a中所述发酵具体为:将所述发酵用的培养基在105~121℃的温度下处理20~40分钟,冷却后再接入所述解脂亚罗酵母菌株进行发酵培养;发酵前期ph为5.0~7.0,待发酵至细胞密度od600值为20或以上时,用酸调节ph为3.1~4.0;发酵初始温度为28℃~32℃。
[0021]
进一步的优选实施方式中,步骤b中的所述发酵液中,添加葡萄糖固体之后,葡萄糖达到300~800g/l,添加l
‑
苯丙氨酸固体之后,发酵液中l
‑
苯丙氨酸达到0.5~2g/l,反应温度控制在25~28℃,反应ph控制在3.1~4.0。
[0022]
进一步的优选实施方式中,添加l
‑
苯丙氨酸固体的时机为:反应至发酵液中残糖消耗为初始值70%或以下时,再向发酵液中添加l
‑
苯丙氨酸固体。
[0023]
进一步的优选实施方式中,反应至残糖降至1g/l以下时,反应结束。
[0024]
进一步的优选实施方式,步骤c中所述从发酵液中提纯赤藓糖醇的步骤包括:在发
酵结束后经膜过滤、浓缩、结晶,即得赤藓糖醇晶体;所述过滤除菌具体为:发酵和反应结束后通过陶瓷膜过滤的方法将酵母细胞与发酵液分离,再通过纳滤膜分离去除所述发酵液中的分子量大于1000 道尔顿的大分子粘性物质,得清澈透明的发酵液;所述浓缩具体为:将所述清澈透明的发酵液在蒸发器中浓缩到固形物含量为70~80% (质量体积百分比),得富含赤藓糖醇的糖浆;所述结晶具体为:将所述富含赤藓糖醇的糖浆以3~5℃/h 的速率冷却至10℃以下,结晶完成后进行离心分离,即得赤藓糖醇晶体。
[0025]
如前所述,本发明的有益效果在于,在以葡萄糖为原料,以解脂亚罗酵母 sy11(cgmcc no.22884)为发酵转化菌株的基础上,在发酵转化过程中的反应液中添加少量l
‑
苯丙氨酸,减少合成赤藓糖醇的中间产物——4
‑
磷酸赤藓糖的非赤藓糖醇合成途径的消耗,从而提高赤藓糖醇发酵转化效率。这为以该菌株生产赤藓糖醇的工业化生产提供了一种切实可行、简单廉价的提高赤藓糖醇转化效率方法。
[0026]
在本发明的一个实施例中,按以上发酵反应策略能够实现葡萄糖转化赤藓糖醇转化率为56.3%,而在本发明另一个实施例中,同样条件下不添加l
‑
苯丙氨酸时,转化率为50.8%。
[0027]
在本发明的两个实施例中,在扩大规模发酵为200l和1000l的情况下,按以上发酵反应策略能够实现葡萄糖转化赤藓糖醇转化率分别为53.8%和56.5%。
[0028]
需要说明的是,在本发明的一个实施例中,利用本发明人保有的另一株解脂亚罗酵母(yarrowia lipolytica) blc13(cgmcc no.7326)为发酵菌种,按照本发明所述发酵反应策略葡萄糖转化赤藓糖醇转化率为50.2%,与之对应的是同样条件下不添加l
‑
苯丙氨酸时,转化率为50.6%。表明对于该菌株是否添加l
‑
苯丙氨酸对于赤藓糖醇转化率的提高没有影响。
具体实施方式
[0029]
下面结合具体实施方式对本发明作进一步详细的描述。但并不构成对本发明的限制。
[0030]
研究例1解脂亚罗酵母菌种(yarrowia lipolytica)sy11(cgmcc no.22884)的筛选。
[0031]
菌种分离来源:发酵制备赤藓糖醇过程中提取完赤藓糖醇的废母液。
[0032]
具体实验方法:配制酵母浸出粉胨葡萄糖培养基平板:10g/l酵母膏,20g/l蛋白胨,20g/l葡萄糖,20g/l琼脂粉。
[0033]
一级、二级产赤藓糖醇发酵培养基:10g/l酵母膏,10g/l蛋白胨,100g/l葡萄糖。
[0034]
将废母液均匀涂抹在灭菌后的酵母浸出粉胨葡萄糖培养基平板上,30℃静置培养24小时,挑选菌落直径大于等于2毫米的单菌落,分别接种于5ml灭菌后的一级产赤藓糖醇发酵培养基中,在30℃、250rpm培养12小时,再以初始菌体浓度od
600
=0.2分别取3ml接种于50ml灭菌后的二级产赤藓糖醇发酵培养基中,于30℃、250rpm培养24小时。剩余一级产赤藓糖醇发酵培养基2ml分别添加0.4ml灭菌后甘油保藏于
‑
80℃超低温冰箱中。
[0035]
分别将培养基煮沸后利用0.2微米过滤膜过滤,取过滤上清液使用高效液相色谱(hplc)的方法,检测产物赤藓糖醇和底物葡萄糖的含量,流动相为水,流速为1ml/min,柱温
85℃,进样量10μl,检测器为示差检测器。
[0036]
实验结果如表1所示。
[0037]
对上述发酵24小时产赤藓糖醇产量最高的sy11菌株进行一代基因测序结果显示,该菌株为解脂亚罗酵母(yarrowia lipolytica,或称耶罗解脂酵母),随后对该菌种进行了菌种保藏,保藏编号为cgmcc no.22884。
[0038]
研究例2解脂亚罗酵母菌种(yarrowia lipolytica)sy11(cgmcc no.22884)的基因组采用珠磨法提取,随后进行全基因组测序。
[0039]
具体实验方法:配制酵母浸出粉胨葡萄糖培养基:10g/l酵母膏,20g/l蛋白胨,20g/l葡萄糖。
[0040]
将解脂亚罗酵母sy11接种于灭过菌的50ml酵母浸出粉胨葡萄糖培养基中,30摄氏度,250rpm培养24小时,12000rpm离心10min收集菌体,用te洗涤两次,并溶于5ml te中,加入0.5g玻璃珠(直径0.3
‑
0.5mm)和2.5ml酚
‑
氯仿(体积比25:24),漩涡震荡3min,12000rpm离心2min,取上清液,加入等体积酚
‑
氯仿(体积比25:24),抽提后,12000rpm离心5min,取上清液,加入0.2ml rnasea,37℃温浴30min,加入两倍体积无水乙醇,
‑
20℃静置30min,10000rpm离心5min,沉淀物用70%乙醇洗两次,自然干燥后,溶于1ml te中,使用干冰保存后送测序公司进行三代基因组测序。
[0041]
选择解脂亚罗酵母 (yarrowia lipolytica)h222,ncim 3589,w29,yb567,yb566,yb392,dsm 3286,yb420基因组序列数据进行同源注释。从ncbi网站下载上述8个基因组全蛋白序列, 使用 tblastn 将蛋白序列比对到解脂亚罗酵母sy11三代基因组测序组装序列上,e
‑
value的阈值为1e
‑
5. 将不同蛋白的blast的hits用solar软件进行合并。利用genewise软件根据每个blast hit的对应基因区域预测解脂亚罗酵母sy11完整的基因结构。
[0042]
对解脂亚罗酵母sy11全基因组注释数据进行检索转醛酶(transaldolase)基因发现,解脂亚罗酵母sy11中共有3个转醛酶基因,转醛酶序列长度均为978bp,分布在第六条染色体中3个位置,分别是从2045787bp至2046764bp(基因序列如seq id no.3所示),2071254bp至2072231bp(基因序列如seq id no.4所示)和2105478bp至2106455bp(基因序列如seq id no.5所示)。
[0043]
研究例3利用解脂亚罗酵母菌种(yarrowia lipolytica)sy11(cgmcc no.22884),添加l
‑
苯丙氨酸的实验,按照如下方式进行:在2.5l摇瓶中,将解脂亚罗酵母菌种(yarrowia lipolytica)sy11(cgmcc no.22884)接种于含碳源、氮源、无机盐和水的发酵培养基中进行培养发酵。培养基体积为1l,其中,碳源为淀粉水解物,添加量为200g/l;氮源为磷酸氢二铵,添加为30g/l;无机盐为硫酸镁2.5g/l、硫酸锌2.5g/l;发酵培养基在121℃的温度下处理40 分钟,冷却后再接入所述解脂亚罗酵母菌株进行发酵培养。发酵条件为发酵前期ph为6.0,发酵初始温度为30℃。
[0044]
待发酵至细胞密度od
600
值为20时,用酸调节ph为3.5。向发酵液中添加葡萄糖600g,维持温度28℃,反应ph控制在3.5,此时测得残糖为55%,进行葡萄糖转化为赤藓糖醇的转化反应,并随时取样测量残糖数值。等反应液残糖浓度降至初始值的70%,即测得残糖为38.5%时,向反应液中添加l
‑
苯丙氨酸1.5g,继续进行反应。待反应至残糖降至0.1%以下时,反应结束。
[0045]
反应结束后通过陶瓷膜过滤的方法将酵母细胞与发酵液分离,再通过纳滤膜分离去除所述发酵液中的分子量大于1000道尔顿的大分子粘性物质,得清澈透明的发酵液。将上述清澈的发酵液在蒸发器中浓缩到固形物含量为80%(质量体积百分比),得富含赤藓糖醇的糖浆。将上述糖浆以3.5℃/h的速率冷却至5℃,进行赤藓糖醇结晶,结晶24小时后,离心分离,得赤藓糖醇晶体338g。
[0046]
所得单位体积转化液中赤藓糖醇晶体质量与单位体积转化液中所添加的葡萄糖质量之比值,即为赤藓糖醇转化率。
[0047]
计算公式为:赤藓糖醇转化率=(反应体系最终获得赤藓糖醇晶体质量/反应体系中添加的葡萄糖质量)
×
100%=(338 g /600 g)
×
100%=56.3%。因此,本次实验以葡萄糖为底物,以解脂亚罗酵母 (yarrowia lipolytica)sy11(cgmcc no.22884)为发酵反应菌种,添加l
‑
苯丙氨酸后,葡萄糖转化赤藓糖醇转化率为56.3%。
[0048]
研究例4利用解脂亚罗酵母菌种(yarrowia lipolytica)sy11(cgmcc no.22884),不添加l
‑
苯丙氨酸的实验,按照如下方式进行:在2.5l摇瓶中,将解脂亚罗酵母菌种(yarrowia lipolytica)sy11(cgmcc no.22884)接种于含碳源、氮源、无机盐和水的发酵培养基中进行培养发酵。培养基体积为1l,其中,碳源为淀粉水解物,添加量为250g/l;氮源为磷酸氢二铵,添加为29g/l;无机盐为硫酸镁2.5g/l、硫酸锌2.5g/l;发酵培养基在121℃的温度下处理40 分钟,冷却后再接入所述解脂亚罗酵母菌株进行发酵培养。发酵条件为发酵前期ph为6.0,发酵初始温度为30℃。
[0049]
待发酵至细胞密度od
600
值为20时,用酸调节ph为3.5。向发酵液中添加葡萄糖600g,维持温度28℃,反应ph控制在3.5,此时测得残糖为55%,进行葡萄糖转化为赤藓糖醇
的转化反应,并随时取样测量残糖数值。待反应至残糖降至0.1%以下时,反应结束。
[0050]
反应结束后通过陶瓷膜过滤的方法将酵母细胞与发酵液分离,再通过纳滤膜分离去除所述发酵液中的分子量大于1000道尔顿的大分子粘性物质,得清澈透明的发酵液。将上述清澈的发酵液在蒸发器中浓缩到固形物含量为80%(质量体积百分比),得富含赤藓糖醇的糖浆。将上述糖浆以3.5℃/h的速率冷却至5℃,进行赤藓糖醇结晶,结晶24小时后,离心分离,得赤藓糖醇晶体305g。
[0051]
所得单位体积转化液中赤藓糖醇晶体质量与单位体积转化液中所添加的葡萄糖质量之比值,即为赤藓糖醇转化率。
[0052]
计算公式为:赤藓糖醇转化率=(反应体系最终获得赤藓糖醇晶体质量/反应体系中添加的葡萄糖质量)
×
100%=(305 g /600 g)
×
100%=50.8%。因此,本次实验以葡萄糖为底物,以解脂亚罗酵母 (yarrowia lipolytica)sy11(cgmcc no.22884)为发酵反应菌种,反应阶段不添加l
‑
苯丙氨酸,葡萄糖转化赤藓糖醇转化率为50.8%。
[0053]
研究例5利用解脂亚罗酵母(yarrowia lipolytica) blc13(cgmcc no.7326),添加l
‑
苯丙氨酸的实验,按照如下方式进行:在2.5l摇瓶中,将解脂亚罗酵母(yarrowia lipolytica) blc13(cgmcc no.7326)接种于含碳源、氮源、无机盐和水的发酵培养基中进行培养发酵。培养基体积为1l,其中,碳源为淀粉水解物,添加量为220g/l;氮源为磷酸氢二铵,添加为30g/l;无机盐为硫酸镁2.5g/l、硫酸锌2.5g/l;发酵培养基在121℃的温度下处理40 分钟,冷却后再接入所述解脂亚罗酵母菌株进行发酵培养。发酵条件为发酵前期ph为6.0,发酵初始温度为30℃。
[0054]
待发酵至细胞密度od
600
值为20时,用酸调节ph为3.5。向发酵液中添加葡萄糖650g,维持温度28℃,反应ph控制在3.5,此时测得残糖为58%,进行葡萄糖转化为赤藓糖醇的转化反应,并随时取样测量残糖数值。等反应液残糖浓度降至初始值的70%,即测得残糖为40.6%时,向反应液中添加l
‑
苯丙氨酸1.5g,继续进行反应。待反应至残糖降至0.1%以下时,反应结束。
[0055]
反应结束后通过陶瓷膜过滤的方法将酵母细胞与发酵液分离,再通过纳滤膜分离去除所述发酵液中的分子量大于1000道尔顿的大分子粘性物质,得清澈透明的发酵液。将上述清澈的发酵液在蒸发器中浓缩到固形物含量为80%(质量体积百分比),得富含赤藓糖醇的糖浆。将上述糖浆以3.5℃/h的速率冷却至5℃,进行赤藓糖醇结晶,结晶24小时后,离心分离,得赤藓糖醇晶体326g。
[0056]
所得单位体积转化液中赤藓糖醇晶体质量与单位体积转化液中所添加的葡萄糖质量之比值,即为赤藓糖醇转化率。
[0057]
计算公式为:赤藓糖醇转化率=(反应体系最终获得赤藓糖醇晶体质量/反应体系中添加的葡萄糖质量)
×
100%=(326 g /650 g)
×
100%=50.2%。因此,本次实验以葡萄糖为底物,以解脂亚罗酵母(yarrowia lipolytica) blc13(cgmcc no.7326)为发酵反应菌种,添加l
‑
苯丙氨酸后,葡萄糖转化赤藓糖醇转化率为50.2%。
[0058]
研究例6利用解脂亚罗酵母(yarrowia lipolytica) blc13(cgmcc no.7326),不添加l
‑
苯丙氨酸的实验,按照如下方式进行:
在2.5l摇瓶中,将解脂亚罗酵母(yarrowia lipolytica) blc13(cgmcc no.7326)接种于含碳源、氮源、无机盐和水的发酵培养基中进行培养发酵。培养基体积为1l,其中,碳源为淀粉水解物,添加量为260g/l;氮源为磷酸氢二铵,添加为30g/l;无机盐为硫酸镁2.5g/l、硫酸锌2.5g/l;发酵培养基在121℃的温度下处理40 分钟,冷却后再接入所述解脂亚罗酵母菌株进行发酵培养。发酵条件为发酵前期ph为6.0,发酵初始温度为31℃。
[0059]
待发酵至细胞密度od
600
值为20时,用酸调节ph为3.5。向发酵液中添加葡萄糖640g,维持温度28℃,反应ph控制在3.5,此时测得残糖为57%,进行葡萄糖转化为赤藓糖醇的转化反应,并随时取样测量残糖数值。待反应至残糖降至0.1%以下时,反应结束。
[0060]
反应结束后通过陶瓷膜过滤的方法将酵母细胞与发酵液分离,再通过纳滤膜分离去除所述发酵液中的分子量大于1000道尔顿的大分子粘性物质,得清澈透明的发酵液。将上述清澈的发酵液在蒸发器中浓缩到固形物含量为80%(质量体积百分比),得富含赤藓糖醇的糖浆。将上述糖浆以3.5℃/h的速率冷却至5℃,进行赤藓糖醇结晶,结晶24小时后,离心分离,得赤藓糖醇晶体324g。
[0061]
所得单位体积转化液中赤藓糖醇晶体质量与单位体积转化液中所添加的葡萄糖质量之比值,即为赤藓糖醇转化率。
[0062]
计算公式为:赤藓糖醇转化率=(反应体系最终获得赤藓糖醇晶体质量/反应体系中添加的葡萄糖质量)
×
100%=(324 g /640 g)
×
100%=50.6%。因此,本次实验以葡萄糖为底物,以解脂亚罗酵母(yarrowia lipolytica) blc13(cgmcc no.7326)为发酵反应菌种,不添加l
‑
苯丙氨酸后,葡萄糖转化赤藓糖醇转化率为51.3%。
[0063]
应用实施例1在200l发酵罐中,按照如下方式进行:将解脂亚罗酵母菌种(yarrowia lipolytica)sy11(cgmcc no.22884)接种于含碳源、氮源、无机盐和水的发酵培养基中进行培养发酵。培养基体积为80l,其中,碳源为淀粉水解物,添加量为200g/l;氮源为磷酸氢二铵,添加为30g/l;无机盐为硫酸镁2.5g/l、硫酸锌2.5g/l;发酵培养基在121℃的温度下处理35 分钟,冷却后再接入所述解脂亚罗酵母菌株进行发酵培养。发酵条件为发酵前期ph为6.0,发酵初始温度为28℃。
[0064]
待发酵至细胞密度od
600
值为20时,用酸调节ph为3.5。向发酵液中添加葡萄糖50kg,维持温度28℃,反应ph控制在3.5,此时测得反应液总体积为85l,测得残糖为59%,进行葡萄糖转化为赤藓糖醇的转化反应,并随时取样测量残糖数值。等反应液残糖浓度降至初始值的70%,即测得残糖为41.3%时,向反应液中按照0.5g/l的添加量添加l
‑
苯丙氨酸42.5g,继续进行反应。待反应至残糖降至0.1%以下时,反应结束。
[0065]
反应结束后通过陶瓷膜过滤的方法将酵母细胞与发酵液分离,再通过纳滤膜分离去除所述发酵液中的分子量大于1000道尔顿的大分子粘性物质,得清澈透明的发酵液。将上述清澈的发酵液在蒸发器中浓缩到固形物含量为76%(质量体积百分比),得富含赤藓糖醇的糖浆。将上述糖浆以3℃/h的速率冷却至10℃,进行赤藓糖醇结晶,结晶24小时后,离心分离,得赤藓糖醇晶体26.9kg。
[0066]
所得单位体积转化液中赤藓糖醇晶体质量与单位体积转化液中所添加的葡萄糖质量之比值,即为赤藓糖醇转化率。
[0067]
计算公式为:赤藓糖醇转化率=(反应体系最终获得赤藓糖醇晶体质量/反应体系
中添加的葡萄糖质量)
×
100%=(26.9kg /50kg)
×
100%=53.8%。因此,本次实验以葡萄糖为底物,以解脂亚罗酵母 (yarrowia lipolytica)sy11(cgmcc no.22884)为发酵反应菌种,添加l
‑
苯丙氨酸后,葡萄糖转化赤藓糖醇转化率为53.8%。
[0068]
应用实施例2在1000l发酵罐中,按照如下方式进行:将解脂亚罗酵母菌种(yarrowia lipolytica)sy11(cgmcc no.22884)接种于含碳源、氮源、无机盐和水的发酵培养基中进行培养发酵。培养基体积为500l,其中,碳源为淀粉水解物,添加量为200g/l;氮源为磷酸氢二铵,添加为30g/l;无机盐为硫酸镁2.5g/l、硫酸锌2.5g/l;发酵培养基在121℃的温度下处理35 分钟,冷却后再接入所述解脂亚罗酵母菌株进行发酵培养。发酵条件为发酵前期ph为6.0,发酵初始温度为30℃。
[0069]
待发酵至细胞密度od
600
值为20时,用酸调节ph为3.5。向发酵液中添加葡萄糖300kg,维持温度28℃,反应ph控制在3.5,此时测得反应液总体积为535l,测得残糖为56%,进行葡萄糖转化为赤藓糖醇的转化反应,并随时取样测量残糖数值。等反应液残糖浓度降至初始值的70%,即测得残糖为39.2%时,向反应液中按照2g/l的添加量添加l
‑
苯丙氨酸1070g,继续进行反应。待反应至残糖降至0.1%以下时,反应结束。
[0070]
反应结束后通过陶瓷膜过滤的方法将酵母细胞与发酵液分离,再通过纳滤膜分离去除所述发酵液中的分子量大于1000道尔顿的大分子粘性物质,得清澈透明的发酵液。将上述清澈的发酵液在蒸发器中浓缩到固形物含量为76%(质量体积百分比),得富含赤藓糖醇的糖浆。将上述糖浆以4℃/h的速率冷却至10℃,进行赤藓糖醇结晶,结晶24小时后,离心分离,得赤藓糖醇晶体169.4kg。
[0071]
所得单位体积转化液中赤藓糖醇晶体质量与单位体积转化液中所添加的葡萄糖质量之比值,即为赤藓糖醇转化率。
[0072]
计算公式为:赤藓糖醇转化率=(反应体系最终获得赤藓糖醇晶体质量/反应体系中添加的葡萄糖质量)
×
100%=(169.4kg /300kg)
×
100%=56.5%。因此,本次实验以葡萄糖为底物,以解脂亚罗酵母 (yarrowia lipolytica)sy11(cgmcc no.22884)为发酵反应菌种,添加l
‑
苯丙氨酸后,葡萄糖转化赤藓糖醇转化率为56.5%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1