牛早期胚胎性别鉴定的方法和所用的试剂与流程
1.本发明属于生物技术领域,涉及一种性别鉴定的方法,尤其涉及一种牛早期胚胎性别鉴定的方法。特别是涉及一种使用环介导等温扩增法进行牛早期胚胎性别鉴定的方法。本发明还涉及使用环介导等温扩增法进行牛早期胚胎性别鉴定中所用的试剂。
背景技术:
2.畜牧业是利用畜禽等已经被人类驯化的动物,或者鹿、麝、狐、貂、水獭、鹌鹑等野生动物的生理机能,通过人工繁殖、饲养,使其将牧草和饲料等植物能转变为动物能,以取得肉、蛋、奶、羊毛、山羊绒、皮张、蚕丝和药材等畜产品的生产部门。区别于自给自足家畜饲养,畜牧业具有集中化、规模化的特点,已成为保障基本民生的支柱产业。
3.体外受精(in vitro fertilization)或(external fertilization)是指哺乳动物的精子和卵子在体外人工控制的环境中完成受精过程的技术,英文简称为ivf。由于它与胚胎移植技术(et)密不可分,又简称为ivf
‑
et。在生物学中,把体外受精胚胎移植到母体后获得的动物称试管动物(test
‑
tube animal)。这项技术成功于20世纪50年代,在最近20年发展迅速,现已日趋成熟而成为一项重要而常规的动物繁殖生物技术。
4.体外受精技术对动物生殖机理研究、畜牧生产、医学和濒危动物保护等具有重要意义。如用小鼠、大鼠或家兔等作实验材料,体外受精技术可用于研究哺乳动物配子发生、受精和胚胎早期发育机理。在家畜品种改良中,体外受精技术为胚胎生产提供了廉价而高效的手段,对充分利用优良品种资源,缩短家畜繁殖周期,加快品种改良速度等有重要价值。在人类,ivf
‑
et技术是治疗某些不孕症和克服性连锁病的重要措施之一。体外受精技术还是哺乳动物胚胎移植、克隆、转基因和性别控制等现代生物技术不可缺少的组成部分。
5.随着现代农业科技的发展,为了更充分利用良种母牛的繁殖潜力,加速遗传育种进程,在生产实践中应用高效的繁殖新技术成为必然。活体采卵(ovum pick up,opu)和体外受精技术(in vitro fertilization,ivf)是二十世纪八十年代快速发展起来的胚胎工程新技术,二者相结合可获得大量遗传系谱明确的胚胎,从而缩短世代间隔。目前,这两种技术已经成为欧美和大洋洲等畜牧业发达国家的农场主为扩大良种母牛群而采用的重要繁殖技术。
6.例如,在先申请案cn108728404a(申请号:201810576806.3)公开了一种牛体外受精胚胎培养的方法,其包括如该文献所述步骤。在先申请案cn111254109a(中国专利申请号2020100820171)为克服运输困难的问题,提供了一种运输培养液,其中包含甘氨酸等,使用该运输培养液进行牛卵母细胞的体外受精和胚胎培养的方法包括如下步骤:卵母细胞的采集和体外成熟、体外受精、胚胎体外培养及保存。该发明方法和运输培养液取得了优异的技术效果。此外,在先申请案cn112322579a(中国专利申请号2021100106576)涉及牛体外受精使用的培养液和提高牛体外受精的方法。牛体外受精的方法包括如该文献所述步骤。在体外受精操作完毕后,需要使受精卵进行体外发育即进行胚胎体外培养,得到的可用胚胎可以进行液氮冷冻保存。暂时性的冷冻保存对于提高动物繁殖效率是有益的。上述
cn108728404a、cn111254109a和cn112322579a通过引用以其全部内容并入本文。
7.在获得大量的体外受精胚胎后,一方面通常需要将该胚胎进行冻存进而等待有适宜生理期的受体母牛以进行胚胎体内繁殖,另一方面还有需要对这些胚胎进行性别鉴定以便根据需要选择适宜性别的胚胎移植到母体牛体内进行繁殖。
8.上述通过胚胎性别鉴定以供胚胎移植时的性别选择,即为通常意义上的性别控制技术。
9.众所周知,性别控制技术在畜牧生产中意义重大,这在刘阳文献[刘阳,等,动物胚胎性别鉴定技术的研究进展,畜禽业,2007,(03):4~5]中有详细记述。首先,家畜的性别控制技术是一项能显著提高家畜繁殖率的生物工程技术,控制后代的性别比例可增加选种强度,加快育种进程,对家畜育种、生产和遗传疾病的防治均有非常重要的意义。其次,家畜的性别控制技术也是畜牧业生产中的一项具有重要意义的繁殖技术,因为畜牧生产中许多重要的经济性状都与性别有关,例如:肉、蛋、奶、毛、茸等,通过控制后代的性别比例,可允许发挥受性别限制的生产性状(如泌乳)和受性别影响的生产性状(如生产速度、肉质等)的最大经济效益。随着分子生物学、细胞遗传学、免疫组织学等学科的迅速发展,以及现代高精密度仪器的问世,性别控制研究取得了长足的发展。目前,性别控制技术主要是在受精前性别控制和受精后性别控制这2个阶段进行。受精前性别控制最理想的途径是采取x和y精子分离,然后有目的地进行受精。受精后性别控制则是通过附植前胚胎的性别鉴定达到性别控制目的。但是从现在x、y精子分离技术的发展来看。虽然使用流式细胞分类仪已成功分离了x、y精子。但其成本高,分离效率较低,一时还难以在实际应用中推广。而胚胎性别鉴定方面,则取得了巨大的发展,已进入实用阶段。
[0010]
性别控制技术的发展源于性别决定的基因调控理论,性别控制分为性别决定和性别分化两个过程。动物性别决定是指动物早期胚胎未分化性腺分化为睾丸或卵巢的过程。决定性别的关键在于y染色体,y染色体的有无分别决定雄性和雌性。决定雄性的是y染色体短臂和1个微小片段,称为y染色体上的性别决定区,是启动睾丸形成的主基因。近年来,先后发现sry、dmrt1、sox9、sf
‑
1、wt1、lim1、lhx9和dax
‑
1等基因对动物性别的决定和性器官的分化起着重要作用[张秀华,等,性别决定机理与性别鉴定的研究进展,中国畜牧兽医,2004,7(31):23~25]。这一过程中,在雄性胚胎中主要涉及到sry的表达,sry的表达启动睾丸的形成,进而间接引发雄性动物第二性征的形成。性别分化主要是指定型的性腺调节生殖结构的形成。这个过程主要受性腺激素调控。对于雄性动物,性腺激素主要包括mis及睾酮。
[0011]
随着分子遗传学、发育生物学及相关学科的发展,人们对性别分化的认识提高到分子水平,家畜胚胎性别鉴定方法也随之发展到分子水平。目前已发展了许多胚胎性别鉴定的方法,主要有细胞遗传学方法、h
‑
y抗原法、雄性特异性dna探针法、pcr法、环介导等温扩增法等。
[0012]
pcr性别鉴定技术是目前已知相当成熟的技术。herr等于1990年首先成功建立了牛、羊胚胎性别鉴定的pcr法。pcr法具有特异性强、灵敏度高、快速准确、对胚胎影响小等优点,因此其在家畜胚胎性别鉴定中占有越来越重要的位置。其实质就是y
‑
染色体特异性片段或y
‑
染色体上的性别决定基因的检测技术。pcr能扩增出目标条带的胚胎即为雄性胚胎,否则即为雌性胚胎。pcr法的准确性首先依赖于核酸提取的质量。但是因为手工提取核酸的
方法在处理大量样本时存在很多缺陷,如成本高,耗时长,存在于胞内和胞外的抑止因子很难完全去除,而且很容易导致样品污染,从而影响pcr的准确性,导致假阴性结果出现几率提高[b.rittich et a1,pcr identification of salmonella cells in food and stool samples after immunomagnetic separation.bioseparation,2001(9):379~384]。因此,要扩大pcr法的应用规模,就有必要采用从提取dna到pcr都能自动完成的高通量全自动pcr工作站。pcr用于胚胎性别鉴定的主要过程一般包括:(1)胚胎的获取:冻胎、鲜胚或体外受精培养的胚胎都可以用来鉴定性别;(2)引物的设计:根据y
‑
染色体上的特异基因或dna片段的碱基序列来设计引物序列;(3)胚胎细胞取样及处理:用显微镜针从胚胎中吸取6~8只细胞,煮沸后进行pcr扩增;(4)pcr:反应总体积和反应条件因所用pcr种类的不同而各异;(5)电泳分析:取8~l2μl的pcr扩增产物在琼脂糖凝胶上进行电泳,紫外光下观察是否有特异性扩增带来判定胚胎性别。王栋等发明的两温度梯度多重pcr法,则是一种稳定、可靠快速的胚胎性别鉴定方法[王栋,等,两温度梯度多重pcr鉴别牛早期胚胎性别的技术.hereditas(beijing),2006,3(28):334~338]。该法可将pcr扩增时间缩短到38min,而且得到的pcr产物小,两条带相差较大,电泳检测时可以在较短的时间内得到明显的区分。由于产物片断较小和扩增时间的缩短,同传统pcr检测方法相比,检测时间大大缩短,可以使整个性别鉴别时间缩短到57min。基本能满足胚胎性别鉴定实践所需的快速、高效的要求。
[0013]
2004年hirayama报道了一种快速的采用环式恒温基因扩增技术(loop
‑
mediated isothermal amplification,lamp)[hirayama h,kageyama et al.rapid sexing of bovine preimplantation embryos using loop
‑
mediated isothermal amplification.theriogenology,2004,62(5):887~896],并且loopamp公司随后推出了其相应的胚胎性别鉴定试剂盒和浊度仪。该方法使用了4种不同的引物,对牛胚胎细胞中的雄性特异性核酸系列和雌雄共有核酸系列进行扩增反应,通过检测有无扩增反应来鉴定牛胚胎细胞的性别。有无扩增反应是通过检测反应过程中获得的副产品焦磷酸镁所形成的白色沉淀的混浊度来判定。该方法具有以下优点:(1)迅速:从冲出胚胎到鉴定结束仅需2~3h,大大缩短了胚胎在体外的培养时间;(2)精确:有很高的特异性,它采用雄性特异性以及雌雄共通引物,因此可以最大限度地排除误削,但试剂盒对dna污染反应极为灵敏,一旦有极少量的外源dna污染,就可能出现假阳性结果[黄河,李鑫.环介导等温扩增法鉴定胚胎性别在生产中的应用.草食家畜,2004,(8):42~43];(3)简便:只需一台loopamp终点浊度仪,就能完成扩增、检出、判定整个过程,无需电泳。
[0014]
众所周知,用于鉴定哺乳动物胚胎性别的环介导等温扩增法具有极高的灵敏度高,易受污染,对操作过程要求非常严格,只要混入极其少量的目标基因以外的基因或其它检验品扩增物就可能造成误判。
[0015]
然而,如上文所述的,通过体外受精获得的胚胎通常需要从胚胎培养液中获得,或者胚胎经历冷冻保存,而胚胎培养液、冷冻保存使用的冷冻液(例如包含pbs+fbs+乙二醇+蔗糖)以及胚胎性别鉴定前所用的胚胎解冻液(例如包含pbs+fbs+蔗糖)中,通常含有fbs即胎牛血清这类动物源性物质,进行可能严重影响环介导等温扩增法的准确性。已经发现,可能因该类胚胎培养液、冷冻液和解冻液造成环介导等温扩增法最常出现的问题是,雌雄共用引物反应的结果呈现阴性因而需要进行重新检测。
[0016]
因此,克服因胚胎培养液、胚胎冷冻液、解冻液中动物源性物质对牛早期胚胎性别
鉴定的环介导等温扩增方法的不良影响,仍是本领域技术人员当前面临的一项重要问题。
技术实现要素:
[0017]
本发明的目的在于提供一种牛早期胚胎性别鉴定的方法,尤其是提供一种使用环介导等温扩增法(本领域通常称为lamp法)进行牛早期胚胎性别鉴定的方法,例如使用环介导等温扩增法进行牛桑椹胚性别鉴定的方法,期待该等方法能够呈现令人期待的技术效果。已经出人意料的发现,如本文所述的,在对胚胎进行分割前用特定的pbs液处理后,本发明方法呈现优异的技术效果。本发明基于此类发现而得以完成。
[0018]
为此,本发明第一方面涉及牛早期胚胎性别鉴定的方法,其包括如下步骤:
[0019]
(1)使卵母细胞和精子进行体外受精,受精卵培养得到桑椹胚;
[0020]
(2)将分选的生长良好的桑椹胚用分割液洗涤,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜下,用分割刀割取(例如至少2份,例如2份)包含10~12个细胞的胚胎组织作为性别鉴定的样品;
[0021]
(3)提供环介导等温扩增实时浊度检测系统和环介导等温扩增法性别鉴定试剂盒,该试剂盒由雄性反应用master mix i、雌雄共同反应用master mix ii、bstdna polyrrlerase、extraction solution(dna提取液)、control dna(阳性对照)组成;
[0022]
(4)样品制作
[0023]
胚胎样品:将切割的包含分割液6μl的胚胎样品放入灭菌离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上,混匀后离心,制成样品溶液,备用;
[0024]
阴性对照样品:取分割液6μl放入灭菌离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上,混匀后离心,制成阴性对照样品溶液,备用;
[0025]
阳性对照样品:取6μl的control dna放入灭菌离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上,混匀后离心,制成阳性对照样品溶液,备用;
[0026]
(5)配制master mix
[0027]
在冰浴条件下配制,
[0028]
雄性反应用master mix(即反应混合液i):取60μl的master mix i置灭菌离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0029]
雌雄共通反应用master mix(即反应混合液ii):取60μl的master mix ii置灭菌离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0030]
(6)样品混合
[0031]
每份检品用2支反应离心管;
[0032]
取6个反应离心管,1、2、3号管中分别加入20μl反应混合液i,4、5、6号管中分别加入20μl反应混合液ii;
[0033]
取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到1、2、3号反应管中,另取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到4、5、6号反应管中,充分混合、离心;
[0034]
(7)环介导等温扩增扩增反应、检测和结果判定
[0035]
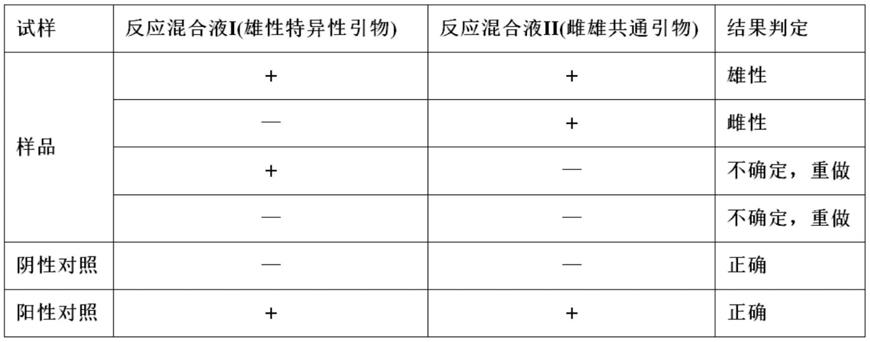
将6个反应离心管置环介导等温扩增实时浊度检测系统中于63℃扩增40min,反应结束后记录各管中以“+”和
“‑”
表示的结果,按下表进行雌雄判定:
[0036][0037]
在阴性对照和阳性对照的结果均为正确的前提下,依据样品在两种反应混合液中的结果,判定该样品为雄性、雌性、不确定需要重做三类情形。
[0038]
根据本发明第一方面的方法,其中所述的牛选自:中国黄牛、荷斯坦牛、西门塔尔牛、中国水牛、日本和牛。
[0039]
根据本发明第一方面的方法,其中步骤(1)是照如下方式进行的:
[0040]
(11)采集卵母细胞并使其进行体外成熟;
[0041]
(12)使精子悬液与成熟的卵母细胞在受精培养液滴孵育以完成体外受精;
[0042]
(13)体外受精操作完毕后使胚胎在胚胎培养液中培养至桑椹胚生长良好,显微镜下挑选出桑椹胚。
[0043]
根据本发明第一方面的方法,步骤(11)中,采集卵母细胞是照下述方式进行的:
[0044]
离体采集:取屠宰场卵巢盛放于加双抗生理盐水的保温桶中,31~33℃条件下,3h内运回实验室;抽取表面2~8mm的卵泡,收集沉淀,在体视显微镜下捡出至少含有3层卵丘细胞包裹的卵母细胞cocs(即,卵丘
‑
卵母细胞复合体),在洗卵液中洗涤2遍,去除多余杂质;或者
[0045]
活体采集:对牛进行活体采卵,将所得卵泡液在体视显微镜下捡出至少含3层卵丘细胞包裹的卵丘
‑
卵母细胞复合体(cocs),放入包含hepes的成熟培养液中38.8℃、3h内运回实验室。
[0046]
根据本发明第一方面的方法,步骤(11)中,卵母细胞体外成熟是照下述方式进行的:采集所得cocs在卵母细胞成熟培养液中洗涤1次,再转移到新的成熟培养液中培养22~24h,培养条件为38.8℃、5.5~6.5%co2、饱和湿度,使卵母细胞体外成熟。
[0047]
根据本发明第一方面的方法,步骤(12)体外受精是照下述方式进行的:
[0048]
将成熟的cocs在受精培养液中洗涤1次,再转移到受精培养液中,放入培养箱中,备用;
[0049]
从液氮中取一支冻精细管,37℃水浴解冻;无菌操作剪开细管两端,使精液注入盛有精液制备培养液的15ml离心管中,328
×
g离心2次,每次5min,离心后弃上清;将300μl精液制备培养液加入上述离心管,重悬精子沉淀,取适当的精子悬液进行精子计数;
[0050]
将计算好体积的精子悬液加入盛有卵母细胞的受精培养液滴中,并将培养盘放入培养箱,使精卵共孵育16
‑
20h,培养条件为38.8℃、5.5
‑
6.5%co2、饱和湿度,完成体外受精。
[0051]
根据本发明第一方面的方法,步骤(13)是照如下方式进行胚胎体外培养和分选桑椹胚的:
[0052]
体外受精操作完毕后,将胚胎周围的颗粒细胞用剥卵针去除干净,放入胚胎培养液中培养,此时记为胚胎培养的第1天,培养条件为38.8℃、6%o2、88%n2、饱和湿度,于第5天在立体显微镜下挑选生长良好的桑椹胚,用于胚胎分割和/或性别鉴定的操作。
[0053]
根据本发明第一方面的方法,其中步骤(2)是照如下方式进行分割的:在无菌平皿(例如直径为100mm的无菌塑料平皿)中,用分割液制作若干个分割液滴,每个100μl;将分选的桑椹胚用分割液洗2次,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜下;将胚胎分割刀与玻璃固定管安装于显微操作仪上,用固定管固定住胚胎,用分割刀割取包含10~12个细胞的胚胎组织作为性别鉴定的样品。
[0054]
根据本发明第一方面的方法,其中所述胚胎在分割以用于性别鉴定后,剩余部分一分为二分割后进行胚胎的继续培养和发育,以作为生产用胚胎。
[0055]
根据本发明第一方面的方法,其中所述分割液为包含如下组分的灭菌水溶液:9.39g磷酸氢二钾、3.5g磷酸二氢钾、68g蔗糖、12g聚维酮k30、补加注射用水至1000ml。例如,其制法为:将各物料加适量注射用水溶解,补加注射用水至1000ml,滤过,在115℃灭菌30分钟。
[0056]
根据本发明第一方面的方法,其中步骤(4)中,样品制作所用的灭菌离心管为灭菌的0.5ml离心管。
[0057]
根据本发明第一方面的方法,其中步骤(4)中,样品制作时加入dna提取液后在室温下放置5~6min。
[0058]
根据本发明第一方面的方法,其中步骤(5)中,所用灭菌离心管为灭菌的1.5ml离心管。
[0059]
根据本发明第一方面的方法,所述分割液为包含如下组分的灭菌水溶液:9.39g磷酸氢二钾、3.5g磷酸二氢钾、68g蔗糖、12g聚维酮k30、补加注射用水至1000ml;例如,其使用如下常规方法制得:将各物料加适量注射用水溶解,补加注射用水至1000ml,滤过,在115℃灭菌30分钟。
[0060]
根据本发明第一方面的方法,所述包含hepes的运输培养液,其配方如具体实施方式所述。
[0061]
根据本发明第一方面的方法,所述加双抗生理盐水是包含青霉素400iu/ml、链霉素400μg/ml的生理盐水。
[0062]
根据本发明第一方面的方法,所述洗卵液是添加了3mg/ml牛血清白蛋白的by基础培养液。
[0063]
根据本发明第一方面的方法,所述成熟培养液是添加了100ml/l fbs、10μg/ml fsh、10μg/ml lh、1μg/ml e2、20ng/ml egf的by基础培养液。
[0064]
根据本发明第一方面的方法,所述包含hepes的成熟培养液是添加了15mmol/l hepes、100ml/l fbs、10μg/ml fsh、10μg/ml lh、1μg/ml e2、20ng/ml egf的by基础培养液。
[0065]
根据本发明第一方面的方法,所述受精培养液,其包含:112.0mm氯化钠、4.02mm氯化钾、2.25mm的氯化钙二水合物、0.52mm六水氯化镁、0.83mm磷酸二氢钾、37.0mm碳酸氢钠、1.25mm丙酮酸钠、10μg/ml肝素、4mg/ml牛血清白蛋白(bsa)、100u/ml青霉素、100μg/ml链霉素的水溶液。
[0066]
根据本发明第一方面的方法,所述精液制备培养液,其包含:112.0mm氯化钠、4.02mm氯化钾、2.25mm的氯化钙二水合物、0.52mm六水氯化镁、0.83mm磷酸二氢钾、37.0mm碳酸氢钠、1.25mm丙酮酸钠、10μg/ml肝素、4mg/ml牛血清白蛋白(bsa)、10mm咖啡因、100u/ml青霉素、100μg/ml链霉素的水溶液。
[0067]
根据本发明第一方面的方法,所述胚胎培养液,其配方如具体实施方式所述。
[0068]
根据本发明第一方面的方法,所述by基础培养液,其配方如具体实施方式所述。
[0069]
根据本发明第一方面的方法,所述pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g与磷酸二氢钾3.5g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0070]
根据本发明第一方面的方法,所述pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖20~30g(例如25g)和壬酸钠1.0~1.5g(例如1.25g),加水使成1000ml,滤过,在115℃灭菌30分钟。
[0071]
根据本发明第一方面的方法,所述环介导等温扩增法性别鉴定试剂盒是dna amplification kit。
[0072]
根据本发明第一方面的方法,所述环介导等温扩增实时浊度检测系统是la
‑
500等温扩增实时浊度检测系统。
[0073]
进一步的,本发明第二方面提供了一种用于牛早期胚胎性别鉴定的pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g与磷酸二氢钾3.5g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0074]
根据本发明第二方面的pbs液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖20~30g(例如25g)和壬酸钠1.0~1.5g(例如1.25g),加水使成1000ml,滤过,在115℃灭菌30分钟。
[0075]
根据本发明第二方面的pbs液,其是用于本发明第一方面任一实施方案所述步骤(2)中对桑椹胚进行预处理。
[0076]
本发明任一方面或该任一方面的任一实施方案所具有的任一技术特征同样适用其它任一实施方案或其它任一方面的任一实施方案,只要它们不会相互矛盾,当然在相互之间适用时,必要的话可对相应特征作适当修饰。下面对本发明的各个方面和特点作进一步的描述。
[0077]
本发明所引述的所有文献,它们的全部内容通过引用并入本文,并且如果这些文献所表达的含义与本发明不一致时,以本发明的表述为准。此外,本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍然希望在此对这些术语和短语作更详尽的说明和解释,提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。
[0078]
本发明使用的胎牛血清可以容易的从市场购得其标准化商品形式,例如可以从各种代理商处购得gibco公司的澳洲胎牛血清(货号:10099141)、新西兰胎牛血清(货号:
10091148)、北美胎牛血清(货号:16000044)、墨西哥胎牛血清(货号:10437028)等。在本发明上下文的试验中,如未特别说明,所用的胎牛血清是gibco公司的澳洲胎牛血清(货号:10099141)。
[0079]
环介导等温扩增法鉴定牛早期胚胎性别的相关原理已有详细报道。例如,黄金明文献(黄金明,等,lamp法鉴定奶牛早期胚胎性别的效果研究,家畜生态学报,26(1):20)记载,lamp是一种崭新的dna扩增方法,具有简单、快速、特异性强的特点,具有替代pcr方法的可能性。该方法主要是利用4种不同的特异性引物识别靶基因的6个特定区域,且可在等温条件进行扩增反应。基因的扩增和产物的检测可一步完成,扩增效率高,可在15~60min扩增109~1010倍;特异性高,所有靶基因序列的检测可只通过扩增产物的有无来判别。有无扩增反应是利用专用的“loopamp终点浊度检测仪”检测反应过程的副产物焦磷酸镁所形成白色沉淀的浑浊度来判定的。
[0080]
胚胎分割(embryo bisection)是借助显微操作技术或徒手操作方法分割早期胚胎成二、四等多等份再移植给受体母畜,从而获得同卵双胎或多胎的生物学新技术。例如,本技术人的在先申请案cn2021105115124发明详细记载了胚胎分割的方法,其全部内容通过引用并入本文。已经出人意料地发现,在本技术人上述在先申请的有关胚胎分割方法的基础上作细微的改动,即可有效地用于胚胎性别鉴定,并且本发明方法可以在同一个胚胎上同时用于性别鉴定和胚胎分割,方法准确可靠。
[0081]
本发明提供的胚胎性别鉴定技术呈现如本文所述优异技术效果。
具体实施方式
[0082]
通过下面的实施例可以对本发明进行进一步的描述,然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。在本发明中,如未特别说明,提及谷氨酸或者谷氨酸钠时,均是指l
‑
谷氨酸或者l
‑
谷氨酸钠。在本发明中,必要时,如未特别说明,试验数据以平均值
±
标准差表示,必要时采用spss21.0软件进行方差分析以确定其结果差异的显著性。在本发明中,如无特别说明,所用胚胎分割刀系用双面剃须刀改装而成。
[0083]
本发明的具体试验中,如未另外说明,使用的相关试剂详述如下:
[0084]
包含hepes的运输培养液,其中包含:甘氨酸50.0mg/l、l
‑
丙氨酸25.0mg/l、l
‑
精氨酸盐酸盐70.0mg/l、l
‑
天冬氨酸30.0mg/l、l
‑
胱氨酸二盐酸盐26.0mg/l、l
‑
谷氨酸75.0mg/l、l
‑
谷氨酰胺100.0mg/l、l
‑
组氨酸盐酸盐一水合物21.88mg/l、l
‑
羟基脯氨酸10.0mg/l、l
‑
异亮氨酸40.0mg/l、l
‑
亮氨酸60.0mg/l、l
‑
赖氨酸盐酸盐70.0mg/l、l
‑
甲硫氨酸15.0mg/l、l
‑
苯丙氨酸25.0mg/l、l
‑
脯氨酸40.0mg/l、l
‑
丝氨酸25.0mg/l、l
‑
苏氨酸30.0mg/l、l
‑
色氨酸10.0mg/l、l
‑
酪氨酸二钠盐二水合物58.0mg/l、l
‑
缬氨酸25.0mg/l、抗坏血酸0.05mg/l、生物素0.01mg/l、氯化胆碱0.5mg/l、d
‑
泛酸钙0.01mg/l、叶酸0.01mg/l、甲萘醌0.01mg/l、烟酰胺0.025mg/l、烟酸0.025mg/l、对氨基苯甲酸0.05mg/l、盐酸吡哆醛0.025mg/l、盐酸吡
哆醇0.025mg/l、核黄素0.01mg/l、盐酸硫胺素0.01mg/l、维生素a醋酸酯0.1mg/l、维生素d2即骨化醇0.1mg/l、α
‑
生育酚磷酸钠盐0.01mg/l、肌醇0.05mg/l、无水氯化钙200.0mg/l、硝酸铁九水合物0.7mg/l、无水硫酸镁97.67mg/l、氯化钾400.0mg/l、氯化钠6800.0mg/l、磷酸二氢钠一水合物140.0mg/l、硫酸腺嘌呤10.0mg/l、5'
‑
磷酸腺苷0.2mg/l、三磷酸腺苷1.0mg/l、胆固醇0.2mg/l、葡萄糖1000.0mg/l、脱氧核糖0.5mg/l、还原型谷胱甘肽0.05mg/l、盐酸鸟嘌呤0.3mg/l、次黄嘌呤钠0.354mg/l、酚红20.0mg/l、核糖0.5mg/l、醋酸钠50.0mg/l、胸腺嘧啶0.3mg/l、吐温80为20.0mg/l、尿嘧啶0.3mg/l、黄嘌呤钠0.3mg/l,以及0.01iu/ml的fsh、0.01iu/ml的lh、1μg/ml的e2,50ng/ml的egf、100ng/ml的igf、10%庆大霉素、55μg/ml丙酮酸钠、1.2mm/l半胱氨酸、3mg/ml的bsa、10mm/l的hepes,以及牛磺酸40mg/l、葡萄糖酸锌2mg/l。
[0085]
加双抗生理盐水:包含青霉素400iu/ml、链霉素400μg/ml的生理盐水。
[0086]
洗卵液:添加了3mg/ml牛血清白蛋白的by基础培养液。
[0087]
成熟培养液:添加了100ml/l fbs、10μg/ml fsh、10μg/ml lh、1μg/ml e2、20ng/ml egf的by基础培养液。
[0088]
包含hepes的成熟培养液:添加了15mmol/l hepes、100ml/l fbs、10μg/ml fsh、10μg/ml lh、1μg/ml e2、20ng/ml egf的by基础培养液。
[0089]
其中,egf——表皮生长因子,fsh——卵泡刺激素,fbs——胎牛血清,e2——雌二醇,lh——促黄体生成素。
[0090]
受精培养液,包含:112.0mm氯化钠、4.02mm氯化钾、2.25mm的氯化钙二水合物、0.52mm六水氯化镁、0.83mm磷酸二氢钾、37.0mm碳酸氢钠、1.25mm丙酮酸钠、10μg/ml肝素、4mg/ml牛血清白蛋白(bsa)、100u/ml青霉素、100μg/ml链霉素的水溶液。
[0091]
精液制备培养液,包含:112.0mm氯化钠、4.02mm氯化钾、2.25mm的氯化钙二水合物、0.52mm六水氯化镁、0.83mm磷酸二氢钾、37.0mm碳酸氢钠、1.25mm丙酮酸钠、10μg/ml肝素、4mg/ml牛血清白蛋白(bsa)、10mm咖啡因、100u/ml青霉素、100μg/ml链霉素的水溶液。
[0092]
胚胎培养液,包含:109.5mm氯化钠、3.1mm氯化钾、26.2mm碳酸氢钠、0.8mm六水氯化镁、1.19mm磷酸二氢钾、0.4mm丙酮酸钠、1.5mm葡萄糖、5mm半乳糖酸钙、10v/v%胎牛血清(fbs)、l
‑
谷氨酰胺1mm、2v/v%必需氨基酸、1v/v%非必须氨基酸、3mm的谷胱甘肽、枸橼酸钠0.04w/v%、麦芽糖0.02w/v%的水溶液;所述必需氨基酸为以下氨基酸按重量比例添加:l
‑
盐酸精氨酸6.32g、l
‑
胱氨酸二盐酸盐1.564g、l
‑
盐酸组氨酸一水物2.1g、l
‑
异亮氨酸2.625g、l
‑
亮氨酸2.62g、l
‑
赖氨酸盐酸盐3.625g、l
‑
蛋氨酸0.755g、l
‑
苯丙氨酸1.65g、l
‑
苏氨酸2.38g、l
‑
色氨酸0.51g、l
‑
酪氨酸1.8g和l
‑
缬氨酸2.34g,所述非必须氨基酸为以下氨基酸按重量比例添加:l
‑
丙氨酸0.89g、l
‑
天门冬酰胺一水物1.5g、l
‑
天冬氨酸1.33g、l
‑
谷氨酸1.47g、甘氨酸0.75g、l
‑
脯氨酸1.15g和l
‑
丝氨酸1.05g。
[0093]
by基础培养液,其是包含如下组分的水溶液:氯化钙200mg/l、九水硝酸铁0.72mg/l、氯化钾400mg/l、硫酸镁97.7mg/l、氯化钠6800mg/l、一水磷酸二氢钠140mg/l、碳酸氢钠2200mg/l、醋酸钠50mg/l、l
‑
丙氨酸25mg/l、l
‑
精氨酸盐酸盐70mg/l、l
‑
天冬氨酸30mg/l、l
‑
半胱氨酸盐酸盐一水合物0.11mg/l、l
‑
胱氨酸二盐酸盐26mg/l、l
‑
谷氨酸75mg/l、甘氨酸50mg/l、l
‑
组氨酸盐酸盐一水合物21.88mg/l、l
‑
羟脯氨酸10mg/l、l
‑
异亮氨酸20mg/l、l
‑
亮氨酸60mg/l、l
‑
赖氨酸盐酸盐70mg/l、l
‑
蛋氨酸15mg/l、l
‑
苯丙氨酸25mg/l、l
‑
脯氨酸40mg/
l、l
‑
丝氨酸25mg/l、l
‑
苏氨酸30mg/l、l
‑
色氨酸10mg/l、l
‑
酪氨酸二钠二水合物57.66mg/l、l
‑
缬氨酸25mg/l、抗坏血酸0.05mg/l、α
‑
d
‑
生育酚磷酸酯0.01mg/l、生物素0.01mg/l、骨化醇0.1mg/l、d
‑
泛酸钙0.01mg/l、氯化胆碱0.5mg/l、叶酸0.01mg/l、肌醇0.05mg/l、三水合甲萘醌亚硫酸氢钠0.019mg/l、烟酸0.025mg/l、烟酰胺0.025mg/l、p
‑
氨基苯甲酸0.05mg/l、盐酸吡哆辛0.05mg/l、核黄素0.01mg/l、盐酸硫胺素0.01mg/l、维生素a乙酸酯0.14mg/l、硫酸腺嘌呤10mg/l、腺嘌呤0.2mg/l、腺苷三磷酸二钠1mg/l、胆固醇0.2mg/l、2
‑
脱氧
‑
d
‑
核糖0.5mg/l、d
‑
葡萄糖1000mg/l、谷胱甘肽0.05mg/l、盐酸鸟嘌呤0.3mg/l、次黄嘌呤钠0.354mg/l、核糖0.5mg/l、胸腺素0.3mg/l、吐温805mg/l、尿嘧啶0.3mg/l、黄嘌呤钠0.34mg/l、酚红10mg/l、0.25mg/l亚硒酸钠和0.075mg/l无水硫酸铜。
[0094]
分割液,其为包含如下组分的灭菌水溶液:9.39g磷酸氢二钾、3.5g磷酸二氢钾、68g蔗糖、12g聚维酮k30、补加注射用水至1000ml;其制法为常规制法:将各物料加适量注射用水溶解,补加注射用水至1000ml,滤过,在115℃灭菌30分钟。pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖25g和壬酸钠1.25g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0095]
环介导等温扩增法性别鉴定试剂盒(dna amplification kit,日本荣研,其由雄性反应用master mix i、雌雄共同反应用master mix ii、bstdna polyrrlerase、extraction solution(dna提取液)、control dna(阳性对照)组成)。
[0096]
环介导等温扩增实时浊度检测系统(la
‑
500等温扩增实时浊度检测系统,eiken chemical co.,ltd)。
[0097]
其余试药如未特别说明均购自sigma
‑
aldrich。
[0098]
实施例1:牛体外受精胚胎的分割方法(离体采卵)
[0099]
试验用牛:中国黄牛(南阳牛,役用品种)。
[0100]
步骤(1)、卵母细胞的采集和体外成熟
[0101]
离体采集:取屠宰场卵巢盛放于加双抗生理盐水的保温桶中,31~33℃条件下,3h内运回实验室;抽取表面2~8mm的卵泡,收集沉淀,在体视显微镜下捡出至少含有3层卵丘细胞包裹的卵母细胞cocs(即,卵丘
‑
卵母细胞复合体),在洗卵液中洗涤2遍,去除多余杂质;
[0102]
将以上采集所得cocs在卵母细胞成熟培养液中洗涤1次,再转移到新的成熟培养液中培养22~24h,培养条件为38.8℃、5.5~6.5%co2、饱和湿度,使卵母细胞体外成熟;
[0103]
步骤(2)、体外受精
[0104]
将成熟的cocs在受精培养液中洗涤1次,再转移到受精培养液中,放入培养箱中,备用;
[0105]
从液氮中取一支冻精细管,37℃水浴解冻;无菌操作剪开细管两端,使精液注入盛有精液制备培养液的15ml离心管中,328
×
g离心2次,每次5min,离心后弃上清;将300μl精液制备培养液加入上述离心管,重悬精子沉淀,取适当的精子悬液进行精子计数;
[0106]
将计算好体积的精子悬液加入盛有卵母细胞的受精培养液滴中,并将培养盘放入培养箱,使精卵共孵育16
‑
20h(实际操作18小时),培养条件为38.8℃、5.5
‑
6.5%co2、饱和湿度,完成体外受精;
[0107]
步骤(3)、胚胎体外培养和分选桑椹胚
[0108]
体外受精操作完毕后,将胚胎周围的颗粒细胞用剥卵针去除干净,放入胚胎培养液中培养,此时记为胚胎培养的第1天,培养条件为38.8℃、6%o2、88%n2、饱和湿度,于第5天在立体显微镜下挑选生长良好的桑椹胚,用于胚胎分割和/或性别鉴定的操作。
[0109]
步骤(4)、桑椹胚的分割
[0110]
在直径为100mm的无菌塑料平皿中,用分割液制作若干个分割液滴,每个100μl;将分选的桑椹胚用分割液洗2次,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜(200倍,olympus公司)下;将胚胎分割刀与玻璃固定管安装于显微操作仪上,用固定管固定住胚胎,用分割刀割取包含10~12个细胞的胚胎组织作为性别鉴定的样品[按此方法,每个桑椹胚可以割取6~8份样品以用于性别鉴定的方法学考察;但在需要获取经性别鉴定的胚胎或者分割胚时,可以据上述方法从一个胚胎上割取两份包含10~12个细胞的胚胎组织以用于性别鉴定,剩余部分一分为二分割后进行胚胎的继续培养和发育,即成为生产用胚胎]。
[0111]
pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖25g和壬酸钠1.25g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0112]
步骤(5)、样品制作和配制master mix
[0113]
胚胎样品:将切割的胚胎样品放入灭菌的0.5ml离心管中,转移胚胎样品时保持分割液的液量约6μl,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成样品溶液,备用。
[0114]
阴性对照样品:取分割液6μl放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阴性对照样品溶液,备用;
[0115]
阳性对照样品:取6μl的control dna放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阳性对照样品溶液,备用;
[0116]
在冰浴条件下配制,
[0117]
雄性反应用master mix(即反应混合液i):取60μl的master mix i置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0118]
雌雄共通反应用master mix(即反应混合液ii):取60μl的master mix ii置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得。
[0119]
步骤(6)、样品混合
[0120]
每份检品用2支反应离心管(雄性反应用和雌雄反应用);
[0121]
取6个反应离心管,前3个反应管(1、2、3号管)中分别加入20μl反应混合液i、后3个反应管(4、5、6号管)中分别加入20μl反应混合液ii;
[0122]
取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到1、2、3号反应管中,取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到4、5、6号反应管中,充分混合、离心。
[0123]
步骤(7)、环介导等温扩增扩增反应、检测和结果判定
[0124]
将6个反应离心管置环介导等温扩增实时浊度检测系统中于63℃扩增40min,反应
结束后记录各管中以“+”和
“‑”
表示的结果,按下表进行雌雄判定:
[0125][0126]
使用本实施例1的方法进行性别鉴定,共对15个桑椹胚进行分割获得的102个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,从其中的7个胚胎中割取的50个样品均为雄性结果,从其余8个胚胎中割取的52个样品均为雌性结果,未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。
[0127]
实施例2:牛体外受精胚胎的分割方法(离体采卵)
[0128]
试验用牛:荷斯坦牛(乳牛品种)。
[0129]
步骤(1)、卵母细胞的采集和体外成熟
[0130]
离体采集:取屠宰场卵巢盛放于加双抗生理盐水的保温桶中,31~33℃条件下,3h内运回实验室;抽取表面2~8mm的卵泡,收集沉淀,在体视显微镜下捡出至少含有3层卵丘细胞包裹的卵母细胞cocs(即,卵丘
‑
卵母细胞复合体),在洗卵液中洗涤2遍,去除多余杂质;
[0131]
将以上采集所得cocs在卵母细胞成熟培养液中洗涤1次,再转移到新的成熟培养液中培养22~24h,培养条件为38.8℃、5.5~6.5%co2、饱和湿度,使卵母细胞体外成熟;
[0132]
步骤(2)、体外受精
[0133]
将成熟的cocs在受精培养液中洗涤1次,再转移到受精培养液中,放入培养箱中,备用;
[0134]
从液氮中取一支冻精细管,37℃水浴解冻;无菌操作剪开细管两端,使精液注入盛有精液制备培养液的15ml离心管中,328
×
g离心2次,每次5min,离心后弃上清;将300μl精液制备培养液加入上述离心管,重悬精子沉淀,取适当的精子悬液进行精子计数;
[0135]
将计算好体积的精子悬液加入盛有卵母细胞的受精培养液滴中,并将培养盘放入培养箱,使精卵共孵育16
‑
20h(实际操作18小时),培养条件为38.8℃、5.5
‑
6.5%co2、饱和湿度,完成体外受精;
[0136]
步骤(3)、胚胎体外培养和分选桑椹胚
[0137]
体外受精操作完毕后,将胚胎周围的颗粒细胞用剥卵针去除干净,放入胚胎培养液中培养,此时记为胚胎培养的第1天,培养条件为38.8℃、6%o2、88%n2、饱和湿度,于第5天在立体显微镜下挑选生长良好的桑椹胚,用于胚胎分割和/或性别鉴定的操作。
[0138]
步骤(4)、桑椹胚的分割
[0139]
在直径为100mm的无菌塑料平皿中,用分割液制作若干个分割液滴,每个100μl;将
分选的桑椹胚用分割液洗2次,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜(200倍,olympus公司)下;将胚胎分割刀与玻璃固定管安装于显微操作仪上,用固定管固定住胚胎,用分割刀割取包含10~12个细胞的胚胎组织作为性别鉴定的样品[按此方法,每个桑椹胚可以割取6~8份样品以用于性别鉴定的方法学考察;但在需要获取经性别鉴定的胚胎或者分割胚时,可以据上述方法从一个胚胎上割取两份包含10~12个细胞的胚胎组织以用于性别鉴定,剩余部分一分为二分割后进行胚胎的继续培养和发育,即成为生产用胚胎]。
[0140]
pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖25g和壬酸钠1.25g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0141]
步骤(5)、样品制作和配制master mix
[0142]
胚胎样品:将切割的胚胎样品放入灭菌的0.5ml离心管中,转移胚胎样品时保持分割液的液量约6μl,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成样品溶液,备用。
[0143]
阴性对照样品:取分割液6μl放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阴性对照样品溶液,备用;
[0144]
阳性对照样品:取6μl的control dna放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阳性对照样品溶液,备用;
[0145]
在冰浴条件下配制,
[0146]
雄性反应用master mix(即反应混合液i):取60μl的master mix i置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0147]
雌雄共通反应用master mix(即反应混合液ii):取60μl的master mix ii置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得。
[0148]
步骤(6)、样品混合
[0149]
每份检品用2支反应离心管(雄性反应用和雌雄反应用);
[0150]
取6个反应离心管,前3个反应管(1、2、3号管)中分别加入20μl反应混合液i、后3个反应管(4、5、6号管)中分别加入20μl反应混合液ii;
[0151]
取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到1、2、3号反应管中,取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到4、5、6号反应管中,充分混合、离心。
[0152]
步骤(7)、环介导等温扩增扩增反应、检测和结果判定
[0153]
将6个反应离心管置环介导等温扩增实时浊度检测系统中于63℃扩增40min,反应结束后记录各管中以“+”和
“‑”
表示的结果,按实施例1表格所示标准进行雌雄判定。
[0154]
使用本实施例2的方法进行性别鉴定,共对20个桑椹胚进行分割获得的144个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,从其中的11个胚胎中割取的76个样品均为雄性结果,从其余9个胚胎中割取的68个样品均为雌性结果,未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。
[0155]
实施例3:牛体外受精胚胎的分割方法(离体采卵)
[0156]
试验用牛:西门塔尔牛(肉牛品种)。
[0157]
步骤(1)、卵母细胞的采集和体外成熟
[0158]
离体采集:取屠宰场卵巢盛放于加双抗生理盐水的保温桶中,31~33℃条件下,3h内运回实验室;抽取表面2~8mm的卵泡,收集沉淀,在体视显微镜下捡出至少含有3层卵丘细胞包裹的卵母细胞cocs(即,卵丘
‑
卵母细胞复合体),在洗卵液中洗涤2遍,去除多余杂质;
[0159]
将以上采集所得cocs在卵母细胞成熟培养液中洗涤1次,再转移到新的成熟培养液中培养22~24h,培养条件为38.8℃、5.5~6.5%co2、饱和湿度,使卵母细胞体外成熟;
[0160]
步骤(2)、体外受精
[0161]
将成熟的cocs在受精培养液中洗涤1次,再转移到受精培养液中,放入培养箱中,备用;
[0162]
从液氮中取一支冻精细管,37℃水浴解冻;无菌操作剪开细管两端,使精液注入盛有精液制备培养液的15ml离心管中,328
×
g离心2次,每次5min,离心后弃上清;将300μl精液制备培养液加入上述离心管,重悬精子沉淀,取适当的精子悬液进行精子计数;
[0163]
将计算好体积的精子悬液加入盛有卵母细胞的受精培养液滴中,并将培养盘放入培养箱,使精卵共孵育16
‑
20h(实际操作18小时),培养条件为38.8℃、5.5
‑
6.5%co2、饱和湿度,完成体外受精;
[0164]
步骤(3)、胚胎体外培养和分选桑椹胚
[0165]
体外受精操作完毕后,将胚胎周围的颗粒细胞用剥卵针去除干净,放入胚胎培养液中培养,此时记为胚胎培养的第1天,培养条件为38.8℃、6%o2、88%n2、饱和湿度,于第5天在立体显微镜下挑选生长良好的桑椹胚,用于胚胎分割和/或性别鉴定的操作。
[0166]
步骤(4)、桑椹胚的分割
[0167]
在直径为100mm的无菌塑料平皿中,用分割液制作若干个分割液滴,每个100μl;将分选的桑椹胚用分割液洗2次,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜(200倍,olympus公司)下;将胚胎分割刀与玻璃固定管安装于显微操作仪上,用固定管固定住胚胎,用分割刀割取包含10~12个细胞的胚胎组织作为性别鉴定的样品[按此方法,每个桑椹胚可以割取6~8份样品以用于性别鉴定的方法学考察;但在需要获取经性别鉴定的胚胎或者分割胚时,可以据上述方法从一个胚胎上割取两份包含10~12个细胞的胚胎组织以用于性别鉴定,剩余部分一分为二分割后进行胚胎的继续培养和发育,即成为生产用胚胎]。
[0168]
pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖25g和壬酸钠1.25g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0169]
步骤(5)、样品制作和配制master mix
[0170]
胚胎样品:将切割的胚胎样品放入灭菌的0.5ml离心管中,转移胚胎样品时保持分割液的液量约6μl,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成样品溶液,备用。
[0171]
阴性对照样品:取分割液6μl放入灭菌的0.5ml离心管中,加入dna提取液即
extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阴性对照样品溶液,备用;
[0172]
阳性对照样品:取6μl的control dna放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阳性对照样品溶液,备用;
[0173]
在冰浴条件下配制,
[0174]
雄性反应用master mix(即反应混合液i):取60μl的master mix i置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0175]
雌雄共通反应用master mix(即反应混合液ii):取60μl的master mix ii置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得。
[0176]
步骤(6)、样品混合
[0177]
每份检品用2支反应离心管(雄性反应用和雌雄反应用);
[0178]
取6个反应离心管,前3个反应管(1、2、3号管)中分别加入20μl反应混合液i、后3个反应管(4、5、6号管)中分别加入20μl反应混合液ii;
[0179]
取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到1、2、3号反应管中,取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到4、5、6号反应管中,充分混合、离心。
[0180]
步骤(7)、环介导等温扩增扩增反应、检测和结果判定
[0181]
将6个反应离心管置环介导等温扩增实时浊度检测系统中于63℃扩增40min,反应结束后记录各管中以“+”和
“‑”
表示的结果,按实施例1表格所示标准进行雌雄判定。
[0182]
使用本实施例3的方法进行性别鉴定,共对18个桑椹胚进行分割获得的128个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,从其中的9个胚胎中割取的63个样品均为雄性结果,从其余9个胚胎中割取的65个样品均为雌性结果,未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。
[0183]
实施例4:牛体外受精胚胎的分割方法(离体采卵)
[0184]
试验用牛:中国水牛(役用品种)。
[0185]
步骤(1)、卵母细胞的采集和体外成熟
[0186]
离体采集:取屠宰场卵巢盛放于加双抗生理盐水的保温桶中,31~33℃条件下,3h内运回实验室;抽取表面2~8mm的卵泡,收集沉淀,在体视显微镜下捡出至少含有3层卵丘细胞包裹的卵母细胞cocs(即,卵丘
‑
卵母细胞复合体),在洗卵液中洗涤2遍,去除多余杂质;
[0187]
将以上采集所得cocs在卵母细胞成熟培养液中洗涤1次,再转移到新的成熟培养液中培养22~24h,培养条件为38.8℃、5.5~6.5%co2、饱和湿度,使卵母细胞体外成熟;
[0188]
步骤(2)、体外受精
[0189]
将成熟的cocs在受精培养液中洗涤1次,再转移到受精培养液中,放入培养箱中,备用;
[0190]
从液氮中取一支冻精细管,37℃水浴解冻;无菌操作剪开细管两端,使精液注入盛有精液制备培养液的15ml离心管中,328
×
g离心2次,每次5min,离心后弃上清;将300μl精液制备培养液加入上述离心管,重悬精子沉淀,取适当的精子悬液进行精子计数;
[0191]
将计算好体积的精子悬液加入盛有卵母细胞的受精培养液滴中,并将培养盘放入培养箱,使精卵共孵育16
‑
20h(实际操作18小时),培养条件为38.8℃、5.5
‑
6.5%co2、饱和湿度,完成体外受精;
[0192]
步骤(3)、胚胎体外培养和分选桑椹胚
[0193]
体外受精操作完毕后,将胚胎周围的颗粒细胞用剥卵针去除干净,放入胚胎培养液中培养,此时记为胚胎培养的第1天,培养条件为38.8℃、6%o2、88%n2、饱和湿度,于第5天在立体显微镜下挑选生长良好的桑椹胚,用于胚胎分割和/或性别鉴定的操作。
[0194]
步骤(4)、桑椹胚的分割
[0195]
在直径为100mm的无菌塑料平皿中,用分割液制作若干个分割液滴,每个100μl;将分选的桑椹胚用分割液洗2次,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜(200倍,olympus公司)下;将胚胎分割刀与玻璃固定管安装于显微操作仪上,用固定管固定住胚胎,用分割刀割取包含10~12个细胞的胚胎组织作为性别鉴定的样品[按此方法,每个桑椹胚可以割取6~8份样品以用于性别鉴定的方法学考察;但在需要获取经性别鉴定的胚胎或者分割胚时,可以据上述方法从一个胚胎上割取两份包含10~12个细胞的胚胎组织以用于性别鉴定,剩余部分一分为二分割后进行胚胎的继续培养和发育,即成为生产用胚胎]。
[0196]
pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖25g和壬酸钠1.25g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0197]
步骤(5)、样品制作和配制master mix
[0198]
胚胎样品:将切割的胚胎样品放入灭菌的0.5ml离心管中,转移胚胎样品时保持分割液的液量约6μl,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成样品溶液,备用。
[0199]
阴性对照样品:取分割液6μl放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阴性对照样品溶液,备用;
[0200]
阳性对照样品:取6μl的control dna放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阳性对照样品溶液,备用;
[0201]
在冰浴条件下配制,
[0202]
雄性反应用master mix(即反应混合液i):取60μl的master mix i置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0203]
雌雄共通反应用master mix(即反应混合液ii):取60μl的master mix ii置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得。
[0204]
步骤(6)、样品混合
[0205]
每份检品用2支反应离心管(雄性反应用和雌雄反应用);
[0206]
取6个反应离心管,前3个反应管(1、2、3号管)中分别加入20μl反应混合液i、后3个反应管(4、5、6号管)中分别加入20μl反应混合液ii;
[0207]
取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到1、2、3号反应管
中,取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到4、5、6号反应管中,充分混合、离心。
[0208]
步骤(7)、环介导等温扩增扩增反应、检测和结果判定
[0209]
将6个反应离心管置环介导等温扩增实时浊度检测系统中于63℃扩增40min,反应结束后记录各管中以“+”和
“‑”
表示的结果,按实施例1表格所示标准进行雌雄判定。
[0210]
使用本实施例4的方法进行性别鉴定,共对19个桑椹胚进行分割获得的132个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,从其中的9个胚胎中割取的60个样品均为雄性结果,从其余10个胚胎中割取的72个样品均为雌性结果,未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。
[0211]
实施例5:牛体外受精胚胎的分割方法(离体采卵)
[0212]
试验用牛:日本和牛(肉牛品种)。
[0213]
步骤(1)、卵母细胞的采集和体外成熟
[0214]
离体采集:取屠宰场卵巢盛放于加双抗生理盐水的保温桶中,31~33℃条件下,3h内运回实验室;抽取表面2~8mm的卵泡,收集沉淀,在体视显微镜下捡出至少含有3层卵丘细胞包裹的卵母细胞cocs(即,卵丘
‑
卵母细胞复合体),在洗卵液中洗涤2遍,去除多余杂质;
[0215]
将以上采集所得cocs在卵母细胞成熟培养液中洗涤1次,再转移到新的成熟培养液中培养22~24h,培养条件为38.8℃、5.5~6.5%co2、饱和湿度,使卵母细胞体外成熟;
[0216]
步骤(2)、体外受精
[0217]
将成熟的cocs在受精培养液中洗涤1次,再转移到受精培养液中,放入培养箱中,备用;
[0218]
从液氮中取一支冻精细管,37℃水浴解冻;无菌操作剪开细管两端,使精液注入盛有精液制备培养液的15ml离心管中,328
×
g离心2次,每次5min,离心后弃上清;将300μl精液制备培养液加入上述离心管,重悬精子沉淀,取适当的精子悬液进行精子计数;
[0219]
将计算好体积的精子悬液加入盛有卵母细胞的受精培养液滴中,并将培养盘放入培养箱,使精卵共孵育16
‑
20h(实际操作18小时),培养条件为38.8℃、5.5
‑
6.5%co2、饱和湿度,完成体外受精;
[0220]
步骤(3)、胚胎体外培养和分选桑椹胚
[0221]
体外受精操作完毕后,将胚胎周围的颗粒细胞用剥卵针去除干净,放入胚胎培养液中培养,此时记为胚胎培养的第1天,培养条件为38.8℃、6%o2、88%n2、饱和湿度,于第5天在立体显微镜下挑选生长良好的桑椹胚,用于胚胎分割和/或性别鉴定的操作。
[0222]
步骤(4)、桑椹胚的分割
[0223]
在直径为100mm的无菌塑料平皿中,用分割液制作若干个分割液滴,每个100μl;将分选的桑椹胚用分割液洗2次,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜(200倍,olympus公司)下;将胚胎分割刀与玻璃固定管安装于显微操作仪上,用固定管固定住胚胎,用分割刀割取包含10~12个细胞的胚胎组织作为性别鉴定的样品[按此方法,每个桑椹胚可以割取6~8份样品以用于性别鉴定的方法学考察;但在需要获取经性别鉴定的胚胎或者分割胚时,可以据上述方法从一个胚胎上割取两份包含10~12个细胞的胚胎组织以用于性别鉴定,剩余部分一分为二分割后进行胚胎的继续培养和发育,即成
为生产用胚胎]。
[0224]
pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖25g和壬酸钠1.25g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0225]
步骤(5)、样品制作和配制master mix
[0226]
胚胎样品:将切割的胚胎样品放入灭菌的0.5ml离心管中,转移胚胎样品时保持分割液的液量约6μl,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成样品溶液,备用。
[0227]
阴性对照样品:取分割液6μl放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阴性对照样品溶液,备用;
[0228]
阳性对照样品:取6μl的control dna放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阳性对照样品溶液,备用;
[0229]
在冰浴条件下配制,
[0230]
雄性反应用master mix(即反应混合液i):取60μl的master mix i置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0231]
雌雄共通反应用master mix(即反应混合液ii):取60μl的master mix ii置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得。
[0232]
步骤(6)、样品混合
[0233]
每份检品用2支反应离心管(雄性反应用和雌雄反应用);
[0234]
取6个反应离心管,前3个反应管(1、2、3号管)中分别加入20μl反应混合液i、后3个反应管(4、5、6号管)中分别加入20μl反应混合液ii;
[0235]
取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到1、2、3号反应管中,取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到4、5、6号反应管中,充分混合、离心。
[0236]
步骤(7)、环介导等温扩增扩增反应、检测和结果判定
[0237]
将6个反应离心管置环介导等温扩增实时浊度检测系统中于63℃扩增40min,反应结束后记录各管中以“+”和
“‑”
表示的结果,按实施例1表格所示标准进行雌雄判定。
[0238]
使用本实施例5的方法进行性别鉴定,共对20个桑椹胚进行分割获得的141个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,从其中的10个胚胎中割取的69个样品均为雄性结果,从其余10个胚胎中割取的72个样品均为雌性结果,未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。
[0239]
实施例6:分割胚的发育
[0240]
使用实施例1~5方法,延续至其步骤(4)桑椹胚的分割,从每个桑椹胚中割取2份样品以用于性别鉴定后,剩余部分一分为二分割得到两个半胚,进行胚胎的继续培养和发育;用吸管将分割所得半胚移入另一干净的分割液滴内处理10min,接着移入胚胎培养液中培养(38.8℃、6%o2、88%n2、饱和湿度)24h,于5~6h期间检查半胚复原数(即分割成功数,用以计算分割成功率),于23~24h期间检查桑椹胚是否发育到扩张囊胚(若成功发育到扩
张囊胚则表明发育成功可用于胚胎移植,以此计算囊胚发育率)。
[0241]
在本实施例中,考察胚胎性别鉴定和胚胎分割方法的效果;使用实施例1~5方法分别考察24、26、23、28、25个桑椹胚,鉴定的性别分别为(雄/雌)12/12、14/12、12/11、14/14、12/13,阴性对照组和阳性对照组的结果均为正确,均未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果;对这些经性别鉴定的桑椹胚分割所得半胚进行胚胎的继续培养和发育,考察并计算分割成功率(%)以及分割后发育的囊胚发育率(%);实施例1~5的结果如下:实施例1~5的分割成功率(%,均值)分别为:54.2%、56.7%、54.5%、59.4%、60.4%;实施例1~5的囊胚发育率(%,均值)分别为:50.7%、54.6%、49.3%、52.4%、53.7%。在另外一些比较实验中,分别参照实施例1~5的方法,桑椹胚不作性别鉴定取样而是直接进行一分为二分割得半胚,同法进行分割胚的发育,各实施例15~19个桑椹胚分割培养后的分割成功率(%)均在52~60%范围内、囊胚发育率(%)均在47~55%范围内。这些结果表明,经历本发明以上实施例1~5方法性别鉴定分割取样的桑椹胚继续进行一分为二分割所得半胚仍然具有良好的分割成功率和囊胚发育率,表明本发明性别鉴定方法不会对胚胎产生不良影响。
[0242]
实施例7:胚胎性别鉴定
[0243]
分别参考实施例1~5的方法进行性别鉴定,不同的仅是操作过程中所用pbs液中未添加果糖。在参考实施例1时,共对16个桑椹胚进行分割获得的113个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,20个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余93个样品为雄性或雌性的结果。在参考实施例2时,共对15个桑椹胚进行分割获得的105个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,17个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余88个样品为雄性或雌性的结果。在参考实施例3时,共对17个桑椹胚进行分割获得的118个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,23个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余95个样品为雄性或雌性的结果。在参考实施例4时,共对14个桑椹胚进行分割获得的99个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,19个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余80个样品为雄性或雌性的结果。在参考实施例5时,共对16个桑椹胚进行分割获得的114个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,19个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余95个样品为雄性或雌性的结果。从上述结果可见,在所用的pbs液中如果不添加果糖,会有约16~21%的机率出现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,但是均未出现反应混合液i为
“‑”
且反应混合液ii为
“‑”
的“不确定,重做”的结果。
[0244]
实施例8:胚胎性别鉴定
[0245]
分别参考实施例1~5的方法进行性别鉴定,不同的仅是操作过程中所用pbs液中未添加壬酸钠。在参考实施例1时,共对16个桑椹胚进行分割获得的114个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,25个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余89个样品为雄性或雌性的结果。在参考实施例2时,共对14个桑椹胚进行分割获得的97个样品进行了测定,结果:阴性对照组和阳性对
照组的结果均为正确,24个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余73个样品为雄性或雌性的结果。在参考实施例3时,共对15个桑椹胚进行分割获得的106个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,25个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余81个样品为雄性或雌性的结果。在参考实施例4时,共对14个桑椹胚进行分割获得的98个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,20个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余78个样品为雄性或雌性的结果。在参考实施例5时,共对16个桑椹胚进行分割获得的113个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,25个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余88个样品为雄性或雌性的结果。从上述结果可见,在所用的pbs液中如果不添加壬酸钠,会有约20~25%的机率出现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,但是均未出现反应混合液i为
“‑”
且反应混合液ii为
“‑”
的“不确定,重做”的结果。
[0246]
实施例9:胚胎性别鉴定
[0247]
分别参考实施例1~5的方法进行性别鉴定,不同的仅是操作过程中所用pbs液中未添加果糖亦未添加壬酸钠。在参考实施例1时,共对14个桑椹胚进行分割获得的99个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,22个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余77个样品为雄性或雌性的结果。在参考实施例2时,共对13个桑椹胚进行分割获得的92个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,20个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余72个样品为雄性或雌性的结果。在参考实施例3时,共对16个桑椹胚进行分割获得的113个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,24个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余89个样品为雄性或雌性的结果。在参考实施例4时,共对15个桑椹胚进行分割获得的106个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,26个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余80个样品为雄性或雌性的结果。在参考实施例5时,共对16个桑椹胚进行分割获得的111个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,24个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,其余87个样品为雄性或雌性的结果。从上述结果可见,在所用的pbs液中如果不添加果糖亦不添加壬酸钠,会有约21~25%的机率出现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果,但是均未出现反应混合液i为
“‑”
且反应混合液ii为
“‑”
的“不确定,重做”的结果。
[0248]
在另外一些试验中,参照实施例1~5的方法,不同的仅是调节pbs液中果糖的量在20~30g/1000ml范围内,每个试验对93~131个分割样品进行了性别鉴定试验,结果:阴性对照组和阳性对照组的结果均为正确,全部样品均显示为雄性或雌性结果,均未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。表明本发明实施例1~5的方法中的果糖可以在较宽范围内使用。
[0249]
在另外一些试验中,参照实施例1~5的方法,不同的仅是调节pbs液中壬酸钠的量在1.0~1.5g/1000ml范围内,每个试验对97~123个分割样品进行了性别鉴定试验,结果:
阴性对照组和阳性对照组的结果均为正确,全部样品均显示为雄性或雌性结果,均未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。表明本发明实施例1~5的方法中的壬酸钠可以在较宽范围内使用。
[0250]
实施例11:牛体外受精胚胎的分割方法(活体采卵)
[0251]
试验用牛:中国黄牛(南阳牛,役用品种)。
[0252]
步骤(1)、卵母细胞的采集和体外成熟
[0253]
活体采集:对牛进行活体采卵,将所得卵泡液在体视显微镜下捡出至少含3层卵丘细胞包裹的卵丘
‑
卵母细胞复合体(cocs),放入包含hepes的成熟培养液中38.8℃、3h内运回实验室;
[0254]
将以上采集所得cocs在卵母细胞成熟培养液中洗涤1次,再转移到新的成熟培养液中培养22~24h,培养条件为38.8℃、5.5~6.5%co2、饱和湿度,使卵母细胞体外成熟;
[0255]
步骤(2)、体外受精
[0256]
将成熟的cocs在受精培养液中洗涤1次,再转移到受精培养液中,放入培养箱中,备用;
[0257]
从液氮中取一支冻精细管,37℃水浴解冻;无菌操作剪开细管两端,使精液注入盛有精液制备培养液的15ml离心管中,328
×
g离心2次,每次5min,离心后弃上清;将300μl精液制备培养液加入上述离心管,重悬精子沉淀,取适当的精子悬液进行精子计数;
[0258]
将计算好体积的精子悬液加入盛有卵母细胞的受精培养液滴中,并将培养盘放入培养箱,使精卵共孵育16
‑
20h(实际操作18小时),培养条件为38.8℃、5.5
‑
6.5%co2、饱和湿度,完成体外受精;
[0259]
步骤(3)、胚胎体外培养和分选桑椹胚
[0260]
体外受精操作完毕后,将胚胎周围的颗粒细胞用剥卵针去除干净,放入胚胎培养液中培养,此时记为胚胎培养的第1天,培养条件为38.8℃、6%o2、88%n2、饱和湿度,于第5天在立体显微镜下挑选生长良好的桑椹胚,用于胚胎分割和/或性别鉴定的操作。
[0261]
步骤(4)、桑椹胚的分割
[0262]
在直径为100mm的无菌塑料平皿中,用分割液制作若干个分割液滴,每个100μl;将分选的桑椹胚用分割液洗2次,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜(200倍,olympus公司)下;将胚胎分割刀与玻璃固定管安装于显微操作仪上,用固定管固定住胚胎,用分割刀割取包含10~12个细胞的胚胎组织作为性别鉴定的样品[按此方法,每个桑椹胚可以割取6~8份样品以用于性别鉴定的方法学考察;但在需要获取经性别鉴定的胚胎或者分割胚时,可以据上述方法从一个胚胎上割取两份包含10~12个细胞的胚胎组织以用于性别鉴定,剩余部分一分为二分割后进行胚胎的继续培养和发育,即成为生产用胚胎]。
[0263]
pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖25g和壬酸钠1.25g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0264]
步骤(5)、样品制作和配制master mix
[0265]
胚胎样品:将切割的胚胎样品放入灭菌的0.5ml离心管中,转移胚胎样品时保持分割液的液量约6μl,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放
置5min以上(具体操作时为5~6min),混匀后离心,制成样品溶液,备用。
[0266]
阴性对照样品:取分割液6μl放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阴性对照样品溶液,备用;
[0267]
阳性对照样品:取6μl的control dna放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阳性对照样品溶液,备用;
[0268]
在冰浴条件下配制,
[0269]
雄性反应用master mix(即反应混合液i):取60μl的master mix i置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0270]
雌雄共通反应用master mix(即反应混合液ii):取60μl的master mix ii置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得。
[0271]
步骤(6)、样品混合
[0272]
每份检品用2支反应离心管(雄性反应用和雌雄反应用);
[0273]
取6个反应离心管,前3个反应管(1、2、3号管)中分别加入20μl反应混合液i、后3个反应管(4、5、6号管)中分别加入20μl反应混合液ii;
[0274]
取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到1、2、3号反应管中,取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到4、5、6号反应管中,充分混合、离心。
[0275]
步骤(7)、环介导等温扩增扩增反应、检测和结果判定
[0276]
将6个反应离心管置环介导等温扩增实时浊度检测系统中于63℃扩增40min,反应结束后记录各管中以“+”和
“‑”
表示的结果,按实施例1表格所示标准进行雌雄判定。
[0277]
使用本实施例11的方法进行性别鉴定,共对16个桑椹胚进行分割获得的110个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,从其中的8个胚胎中割取的57个样品均为雄性结果,从其余8个胚胎中割取的53个样品均为雌性结果,未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。
[0278]
实施例12:牛体外受精胚胎的分割方法(活体采卵)
[0279]
试验用牛:荷斯坦牛(乳牛品种)。
[0280]
步骤(1)、卵母细胞的采集和体外成熟
[0281]
活体采集:对牛进行活体采卵,将所得卵泡液在体视显微镜下捡出至少含3层卵丘细胞包裹的卵丘
‑
卵母细胞复合体(cocs),放入包含hepes的成熟培养液中38.8℃、3h内运回实验室;
[0282]
将以上采集所得cocs在卵母细胞成熟培养液中洗涤1次,再转移到新的成熟培养液中培养22~24h,培养条件为38.8℃、5.5~6.5%co2、饱和湿度,使卵母细胞体外成熟;
[0283]
步骤(2)、体外受精
[0284]
将成熟的cocs在受精培养液中洗涤1次,再转移到受精培养液中,放入培养箱中,备用;
[0285]
从液氮中取一支冻精细管,37℃水浴解冻;无菌操作剪开细管两端,使精液注入盛有精液制备培养液的15ml离心管中,328
×
g离心2次,每次5min,离心后弃上清;将300μl精
液制备培养液加入上述离心管,重悬精子沉淀,取适当的精子悬液进行精子计数;
[0286]
将计算好体积的精子悬液加入盛有卵母细胞的受精培养液滴中,并将培养盘放入培养箱,使精卵共孵育16
‑
20h(实际操作18小时),培养条件为38.8℃、5.5
‑
6.5%co2、饱和湿度,完成体外受精;
[0287]
步骤(3)、胚胎体外培养和分选桑椹胚
[0288]
体外受精操作完毕后,将胚胎周围的颗粒细胞用剥卵针去除干净,放入胚胎培养液中培养,此时记为胚胎培养的第1天,培养条件为38.8℃、6%o2、88%n2、饱和湿度,于第5天在立体显微镜下挑选生长良好的桑椹胚,用于胚胎分割和/或性别鉴定的操作。
[0289]
步骤(4)、桑椹胚的分割
[0290]
在直径为100mm的无菌塑料平皿中,用分割液制作若干个分割液滴,每个100μl;将分选的桑椹胚用分割液洗2次,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜(200倍,olympus公司)下;将胚胎分割刀与玻璃固定管安装于显微操作仪上,用固定管固定住胚胎,用分割刀割取包含10~12个细胞的胚胎组织作为性别鉴定的样品[按此方法,每个桑椹胚可以割取6~8份样品以用于性别鉴定的方法学考察;但在需要获取经性别鉴定的胚胎或者分割胚时,可以据上述方法从一个胚胎上割取两份包含10~12个细胞的胚胎组织以用于性别鉴定,剩余部分一分为二分割后进行胚胎的继续培养和发育,即成为生产用胚胎]。
[0291]
pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖25g和壬酸钠1.25g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0292]
步骤(5)、样品制作和配制master mix
[0293]
胚胎样品:将切割的胚胎样品放入灭菌的0.5ml离心管中,转移胚胎样品时保持分割液的液量约6μl,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成样品溶液,备用。
[0294]
阴性对照样品:取分割液6μl放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阴性对照样品溶液,备用;
[0295]
阳性对照样品:取6μl的control dna放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阳性对照样品溶液,备用;
[0296]
在冰浴条件下配制,
[0297]
雄性反应用master mix(即反应混合液i):取60μl的master mix i置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0298]
雌雄共通反应用master mix(即反应混合液ii):取60μl的master mix ii置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得。
[0299]
步骤(6)、样品混合
[0300]
每份检品用2支反应离心管(雄性反应用和雌雄反应用);
[0301]
取6个反应离心管,前3个反应管(1、2、3号管)中分别加入20μl反应混合液i、后3个反应管(4、5、6号管)中分别加入20μl反应混合液ii;
[0302]
取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到1、2、3号反应管中,取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到4、5、6号反应管中,充分混合、离心。
[0303]
步骤(7)、环介导等温扩增扩增反应、检测和结果判定
[0304]
将6个反应离心管置环介导等温扩增实时浊度检测系统中于63℃扩增40min,反应结束后记录各管中以“+”和
“‑”
表示的结果,按实施例1表格所示标准进行雌雄判定。
[0305]
使用本实施例12的方法进行性别鉴定,共对18个桑椹胚进行分割获得的125个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,从其中的9个胚胎中割取的64个样品均为雄性结果,从其余9个胚胎中割取的61个样品均为雌性结果,未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。
[0306]
实施例13:牛体外受精胚胎的分割方法(活体采卵)
[0307]
试验用牛:西门塔尔牛(肉牛品种)。
[0308]
步骤(1)、卵母细胞的采集和体外成熟
[0309]
活体采集:对牛进行活体采卵,将所得卵泡液在体视显微镜下捡出至少含3层卵丘细胞包裹的卵丘
‑
卵母细胞复合体(cocs),放入包含hepes的成熟培养液中38.8℃、3h内运回实验室;
[0310]
将以上采集所得cocs在卵母细胞成熟培养液中洗涤1次,再转移到新的成熟培养液中培养22~24h,培养条件为38.8℃、5.5~6.5%co2、饱和湿度,使卵母细胞体外成熟;
[0311]
步骤(2)、体外受精
[0312]
将成熟的cocs在受精培养液中洗涤1次,再转移到受精培养液中,放入培养箱中,备用;
[0313]
从液氮中取一支冻精细管,37℃水浴解冻;无菌操作剪开细管两端,使精液注入盛有精液制备培养液的15ml离心管中,328
×
g离心2次,每次5min,离心后弃上清;将300μl精液制备培养液加入上述离心管,重悬精子沉淀,取适当的精子悬液进行精子计数;
[0314]
将计算好体积的精子悬液加入盛有卵母细胞的受精培养液滴中,并将培养盘放入培养箱,使精卵共孵育16
‑
20h(实际操作18小时),培养条件为38.8℃、5.5
‑
6.5%co2、饱和湿度,完成体外受精;
[0315]
步骤(3)、胚胎体外培养和分选桑椹胚
[0316]
体外受精操作完毕后,将胚胎周围的颗粒细胞用剥卵针去除干净,放入胚胎培养液中培养,此时记为胚胎培养的第1天,培养条件为38.8℃、6%o2、88%n2、饱和湿度,于第5天在立体显微镜下挑选生长良好的桑椹胚,用于胚胎分割和/或性别鉴定的操作。
[0317]
步骤(4)、桑椹胚的分割
[0318]
在直径为100mm的无菌塑料平皿中,用分割液制作若干个分割液滴,每个100μl;将分选的桑椹胚用分割液洗2次,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜(200倍,olympus公司)下;将胚胎分割刀与玻璃固定管安装于显微操作仪上,用固定管固定住胚胎,用分割刀割取包含10~12个细胞的胚胎组织作为性别鉴定的样品[按此方法,每个桑椹胚可以割取6~8份样品以用于性别鉴定的方法学考察;但在需要获取经性别鉴定的胚胎或者分割胚时,可以据上述方法从一个胚胎上割取两份包含10~12个细胞的胚胎组织以用于性别鉴定,剩余部分一分为二分割后进行胚胎的继续培养和发育,即成
为生产用胚胎]。
[0319]
pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖25g和壬酸钠1.25g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0320]
步骤(5)、样品制作和配制master mix
[0321]
胚胎样品:将切割的胚胎样品放入灭菌的0.5ml离心管中,转移胚胎样品时保持分割液的液量约6μl,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成样品溶液,备用。
[0322]
阴性对照样品:取分割液6μl放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阴性对照样品溶液,备用;
[0323]
阳性对照样品:取6μl的control dna放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阳性对照样品溶液,备用;
[0324]
在冰浴条件下配制,
[0325]
雄性反应用master mix(即反应混合液i):取60μl的master mix i置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0326]
雌雄共通反应用master mix(即反应混合液ii):取60μl的master mix ii置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得。
[0327]
步骤(6)、样品混合
[0328]
每份检品用2支反应离心管(雄性反应用和雌雄反应用);
[0329]
取6个反应离心管,前3个反应管(1、2、3号管)中分别加入20μl反应混合液i、后3个反应管(4、5、6号管)中分别加入20μl反应混合液ii;
[0330]
取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到1、2、3号反应管中,取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到4、5、6号反应管中,充分混合、离心。
[0331]
步骤(7)、环介导等温扩增扩增反应、检测和结果判定
[0332]
将6个反应离心管置环介导等温扩增实时浊度检测系统中于63℃扩增40min,反应结束后记录各管中以“+”和
“‑”
表示的结果,按实施例1表格所示标准进行雌雄判定。
[0333]
使用本实施例13的方法进行性别鉴定,共对19个桑椹胚进行分割获得的135个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,从其中的9个胚胎中割取的64个样品均为雄性结果,从其余10个胚胎中割取的71个样品均为雌性结果,未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。
[0334]
实施例14:牛体外受精胚胎的分割方法(活体采卵)
[0335]
试验用牛:中国水牛(役用品种)。
[0336]
步骤(1)、卵母细胞的采集和体外成熟
[0337]
活体采集:对牛进行活体采卵,将所得卵泡液在体视显微镜下捡出至少含3层卵丘细胞包裹的卵丘
‑
卵母细胞复合体(cocs),放入包含hepes的成熟培养液中38.8℃、3h内运回实验室;
[0338]
将以上采集所得cocs在卵母细胞成熟培养液中洗涤1次,再转移到新的成熟培养液中培养22~24h,培养条件为38.8℃、5.5~6.5%co2、饱和湿度,使卵母细胞体外成熟;
[0339]
步骤(2)、体外受精
[0340]
将成熟的cocs在受精培养液中洗涤1次,再转移到受精培养液中,放入培养箱中,备用;
[0341]
从液氮中取一支冻精细管,37℃水浴解冻;无菌操作剪开细管两端,使精液注入盛有精液制备培养液的15ml离心管中,328
×
g离心2次,每次5min,离心后弃上清;将300μl精液制备培养液加入上述离心管,重悬精子沉淀,取适当的精子悬液进行精子计数;
[0342]
将计算好体积的精子悬液加入盛有卵母细胞的受精培养液滴中,并将培养盘放入培养箱,使精卵共孵育16
‑
20h(实际操作18小时),培养条件为38.8℃、5.5
‑
6.5%co2、饱和湿度,完成体外受精;
[0343]
步骤(3)、胚胎体外培养和分选桑椹胚
[0344]
体外受精操作完毕后,将胚胎周围的颗粒细胞用剥卵针去除干净,放入胚胎培养液中培养,此时记为胚胎培养的第1天,培养条件为38.8℃、6%o2、88%n2、饱和湿度,于第5天在立体显微镜下挑选生长良好的桑椹胚,用于胚胎分割和/或性别鉴定的操作。
[0345]
步骤(4)、桑椹胚的分割
[0346]
在直径为100mm的无菌塑料平皿中,用分割液制作若干个分割液滴,每个100μl;将分选的桑椹胚用分割液洗2次,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜(200倍,olympus公司)下;将胚胎分割刀与玻璃固定管安装于显微操作仪上,用固定管固定住胚胎,用分割刀割取包含10~12个细胞的胚胎组织作为性别鉴定的样品[按此方法,每个桑椹胚可以割取6~8份样品以用于性别鉴定的方法学考察;但在需要获取经性别鉴定的胚胎或者分割胚时,可以据上述方法从一个胚胎上割取两份包含10~12个细胞的胚胎组织以用于性别鉴定,剩余部分一分为二分割后进行胚胎的继续培养和发育,即成为生产用胚胎]。
[0347]
pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖25g和壬酸钠1.25g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0348]
步骤(5)、样品制作和配制master mix
[0349]
胚胎样品:将切割的胚胎样品放入灭菌的0.5ml离心管中,转移胚胎样品时保持分割液的液量约6μl,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成样品溶液,备用。
[0350]
阴性对照样品:取分割液6μl放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阴性对照样品溶液,备用;
[0351]
阳性对照样品:取6μl的control dna放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阳性对照样品溶液,备用;
[0352]
在冰浴条件下配制,
[0353]
雄性反应用master mix(即反应混合液i):取60μl的master mix i置灭菌的1.5ml
离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0354]
雌雄共通反应用master mix(即反应混合液ii):取60μl的master mix ii置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得。
[0355]
步骤(6)、样品混合
[0356]
每份检品用2支反应离心管(雄性反应用和雌雄反应用);
[0357]
取6个反应离心管,前3个反应管(1、2、3号管)中分别加入20μl反应混合液i、后3个反应管(4、5、6号管)中分别加入20μl反应混合液ii;
[0358]
取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到1、2、3号反应管中,取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到4、5、6号反应管中,充分混合、离心。
[0359]
步骤(7)、环介导等温扩增扩增反应、检测和结果判定
[0360]
将6个反应离心管置环介导等温扩增实时浊度检测系统中于63℃扩增40min,反应结束后记录各管中以“+”和
“‑”
表示的结果,按实施例1表格所示标准进行雌雄判定。
[0361]
使用本实施例14的方法进行性别鉴定,共对17个桑椹胚进行分割获得的118个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,从其中的8个胚胎中割取的55个样品均为雄性结果,从其余9个胚胎中割取的63个样品均为雌性结果,未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。
[0362]
实施例15:牛体外受精胚胎的分割方法(活体采卵)
[0363]
试验用牛:日本和牛(肉牛品种)。
[0364]
步骤(1)、卵母细胞的采集和体外成熟
[0365]
活体采集:对牛进行活体采卵,将所得卵泡液在体视显微镜下捡出至少含3层卵丘细胞包裹的卵丘
‑
卵母细胞复合体(cocs),放入包含hepes的成熟培养液中38.8℃、3h内运回实验室;将以上采集所得cocs在卵母细胞成熟培养液中洗涤1次,再转移到新的成熟培养液中培养22~24h,培养条件为38.8℃、5.5~6.5%co2、饱和湿度,使卵母细胞体外成熟;
[0366]
步骤(2)、体外受精
[0367]
将成熟的cocs在受精培养液中洗涤1次,再转移到受精培养液中,放入培养箱中,备用;
[0368]
从液氮中取一支冻精细管,37℃水浴解冻;无菌操作剪开细管两端,使精液注入盛有精液制备培养液的15ml离心管中,328
×
g离心2次,每次5min,离心后弃上清;将300μl精液制备培养液加入上述离心管,重悬精子沉淀,取适当的精子悬液进行精子计数;
[0369]
将计算好体积的精子悬液加入盛有卵母细胞的受精培养液滴中,并将培养盘放入培养箱,使精卵共孵育16
‑
20h(实际操作18小时),培养条件为38.8℃、5.5
‑
6.5%co2、饱和湿度,完成体外受精;
[0370]
步骤(3)、胚胎体外培养和分选桑椹胚
[0371]
体外受精操作完毕后,将胚胎周围的颗粒细胞用剥卵针去除干净,放入胚胎培养液中培养,此时记为胚胎培养的第1天,培养条件为38.8℃、6%o2、88%n2、饱和湿度,于第5天在立体显微镜下挑选生长良好的桑椹胚,用于胚胎分割和/或性别鉴定的操作。
[0372]
步骤(4)、桑椹胚的分割
[0373]
在直径为100mm的无菌塑料平皿中,用分割液制作若干个分割液滴,每个100μl;将
分选的桑椹胚用分割液洗2次,接着移入pbs液中预处理20min,然后移入分割液滴内,置于倒置显微镜(200倍,olympus公司)下;将胚胎分割刀与玻璃固定管安装于显微操作仪上,用固定管固定住胚胎,用分割刀割取包含10~12个细胞的胚胎组织作为性别鉴定的样品[按此方法,每个桑椹胚可以割取6~8份样品以用于性别鉴定的方法学考察;但在需要获取经性别鉴定的胚胎或者分割胚时,可以据上述方法从一个胚胎上割取两份包含10~12个细胞的胚胎组织以用于性别鉴定,剩余部分一分为二分割后进行胚胎的继续培养和发育,即成为生产用胚胎]。
[0374]
pbs液即磷酸盐缓冲液,其ph值为6.8~7.2且是照如下方式配制的:取磷酸氢二钾9.39g、磷酸二氢钾3.5g、果糖25g和壬酸钠1.25g,加水使成1000ml,滤过,在115℃灭菌30分钟。
[0375]
步骤(5)、样品制作和配制master mix
[0376]
胚胎样品:将切割的胚胎样品放入灭菌的0.5ml离心管中,转移胚胎样品时保持分割液的液量约6μl,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成样品溶液,备用。
[0377]
阴性对照样品:取分割液6μl放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阴性对照样品溶液,备用;
[0378]
阳性对照样品:取6μl的control dna放入灭菌的0.5ml离心管中,加入dna提取液即extraction solution液12μl,使其悬浊,在室温下放置5min以上(具体操作时为5~6min),混匀后离心,制成阳性对照样品溶液,备用;
[0379]
在冰浴条件下配制,
[0380]
雄性反应用master mix(即反应混合液i):取60μl的master mix i置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得;
[0381]
雌雄共通反应用master mix(即反应混合液ii):取60μl的master mix ii置灭菌的1.5ml离心管中,加3μl的bstdna polyrrlerase,混匀,离心,即得。
[0382]
步骤(6)、样品混合
[0383]
每份检品用2支反应离心管(雄性反应用和雌雄反应用);
[0384]
取6个反应离心管,前3个反应管(1、2、3号管)中分别加入20μl反应混合液i、后3个反应管(4、5、6号管)中分别加入20μl反应混合液ii;
[0385]
取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到1、2、3号反应管中,取阴性样品、胚胎样品、阳性对照(control dna)各5μl分别加入到4、5、6号反应管中,充分混合、离心。
[0386]
步骤(7)、环介导等温扩增扩增反应、检测和结果判定
[0387]
将6个反应离心管置环介导等温扩增实时浊度检测系统中于63℃扩增40min,反应结束后记录各管中以“+”和
“‑”
表示的结果,按实施例1表格所示标准进行雌雄判定。
[0388]
使用本实施例15的方法进行性别鉴定,共对17个桑椹胚进行分割获得的122个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,从其中的8个胚胎中割取的57个样品均为雄性结果,从其余9个胚胎中割取的65个样品均为雌性结果,未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。
[0389]
实施例16:分割胚的发育
[0390]
使用实施例11~15方法,延续至其步骤(4)桑椹胚的分割,从每个桑椹胚中割取2份样品以用于性别鉴定后,剩余部分一分为二分割得到两个半胚,进行胚胎的继续培养和发育;用吸管将分割所得半胚移入另一干净的分割液滴内处理10min,接着移入胚胎培养液中培养(38.8℃、6%o2、88%n2、饱和湿度)24h,于5~6h期间检查半胚复原数(即分割成功数,用以计算分割成功率),于23~24h期间检查桑椹胚是否发育到扩张囊胚(若成功发育到扩张囊胚则表明发育成功可用于胚胎移植,以此计算囊胚发育率)。
[0391]
在本实施例中,考察胚胎性别鉴定和胚胎分割方法的效果;使用实施例11~15方法分别考察22、27、24、25、29个桑椹胚,鉴定的性别分别为(雄/雌)11/11、14/13、12/12、12/13、14/15,阴性对照组和阳性对照组的结果均为正确,均未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果;对这些经性别鉴定的桑椹胚分割所得半胚进行胚胎的继续培养和发育,考察并计算分割成功率(%)以及分割后发育的囊胚发育率(%);实施例11~15的结果如下:实施例11~15的分割成功率(%,均值)分别为:54.7%、58.7%、54.2%、61.5%、55.3%;实施例1~5的囊胚发育率(%,均值)分别为:53.6%、51.3%、47.6%、52.6%、54.6%。在另外一些比较实验中,分别参照实施例11~15的方法,桑椹胚不作性别鉴定取样而是直接进行一分为二分割得半胚,同法进行分割胚的发育,各实施例17~21个桑椹胚分割培养后的分割成功率(%)均在52~60%范围内、囊胚发育率(%)均在48~55%范围内。这些结果表明,经历本发明以上实施例11~15方法性别鉴定分割取样的桑椹胚继续进行一分为二分割所得半胚仍然具有良好的分割成功率和囊胚发育率,表明本发明性别鉴定方法不会对胚胎产生不良影响。
[0392]
实施例17:胚胎性别鉴定
[0393]
分别参考实施例11~15的方法进行性别鉴定,不同的仅是操作过程中所用pbs液中未添加果糖。
[0394]
分别参考实施例11~15的方法进行性别鉴定时,各实例分别对14~20个桑椹胚进行分割获得的94~127个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,各实例分别有15~19个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果(达到16~19%的机率),其余样品均为正确,均未出现反应混合液i为
“‑”
且反应混合液ii为
“‑”
的“不确定,重做”的结果。
[0395]
实施例18:胚胎性别鉴定
[0396]
分别参考实施例11~15的方法进行性别鉴定,不同的仅是操作过程中所用pbs液中未添加壬酸钠。
[0397]
分别参考实施例11~15的方法进行性别鉴定时,各实例分别对16~21个桑椹胚进行分割获得的110~145个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,各实例分别有23~35个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果(达到20~25%的机率),其余样品均为正确,均未出现反应混合液i为
“‑”
且反应混合液ii为
“‑”
的“不确定,重做”的结果。
[0398]
实施例19:胚胎性别鉴定
[0399]
分别参考实施例11~15的方法进行性别鉴定,不同的仅是操作过程中所用pbs液中未添加果糖亦未添加壬酸钠。
[0400]
分别参考实施例11~15的方法进行性别鉴定时,各实例分别对13~16个桑椹胚进行分割获得的90~114个样品进行了测定,结果:阴性对照组和阳性对照组的结果均为正确,各实例分别有20~28个样品呈现反应混合液i为“+”且反应混合液ii为
“‑”
的“不确定,重做”的结果(达到22~25%的机率),其余样品均为正确,均未出现反应混合液i为
“‑”
且反应混合液ii为
“‑”
的“不确定,重做”的结果。
[0401]
在另外一些试验中,参照实施例11~15的方法,不同的仅是调节pbs液中果糖的量在20~30g/1000ml范围内,每个试验对67~92个分割样品进行了性别鉴定试验,结果:阴性对照组和阳性对照组的结果均为正确,全部样品均显示为雄性或雌性结果,均未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。表明本发明实施例11~15的方法中的果糖可以在较宽范围内使用。
[0402]
在另外一些试验中,参照实施例11~15的方法,不同的仅是调节pbs液中壬酸钠的量在1.0~1.5g/1000ml范围内,每个试验对78~102个分割样品进行了性别鉴定试验,结果:阴性对照组和阳性对照组的结果均为正确,全部样品均显示为雄性或雌性结果,均未出现反应混合液ii为
“‑”
的两种“不确定,重做”的结果。表明本发明实施例11~15的方法中的壬酸钠可以在较宽范围内使用。
[0403]
本文中所举的实施例仅用以说明本发明的组成及功效,并非因此局限本发明的专利范围,故对于本领域的技术人员来说,在不脱离本发明结构的前提下,还可以作出类似修改,均隶属于本发明的专利范畴。这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1