一种拉罗替尼中间体的制备方法与流程
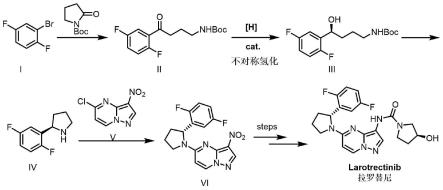
1.本发明属于医药合成技术领域,公开了一种拉罗替尼中间体(r)-2-(2,5-二氟苯基)吡咯烷的制备方法。
背景技术:
2.拉罗替尼是一种广谱抗癌药,在2018年年底被fda批准在美国上市。该抗癌药可以用于治疗携带ntrk基因融合的局部晚期或转移性实体瘤的成人和儿童患者。人体神经营养因子受体酪氨酸激酶(ntrk)家族包括trka、trkb 和trkc三种蛋白,它们分别由ntrk1、ntrk2和ntrk3这三种基因编码。此款抗癌药则是通过抑制信号通路中的ntrk,来阻断上述过程。研究显示,极大部分的实体瘤都存在ntpk基因融合现象,所以此款药物对多种实体瘤有不错的疗效。拉罗替尼的结构如下所示:
[0003][0004]
其中,(r)-2-(2,5-二氟苯基)吡咯烷是合成拉罗替尼过程中的关键中间体,结构如下:
[0005][0006]
目前已公开的方法中,该化合物的合成均需要通过手性色谱或手性试剂拆分消旋体得到,例如专利cn108218754a、cn102224153a、us2014371217a1、 cn111302997a等,这些合成工艺均存在步骤繁琐、收率低、合成成本高昂等问题,难以用于工业化生产。
[0007]
现有技术中公开了拉罗替尼的制备方法,其中wo2016077841a1公开了以5-氯-3-硝基吡唑并[1,5-a]嘧啶为原料,与(r)-2-(2,5-二氟苯基)吡咯烷发生取代反应得到关键中间体,再经过还原,缩合,取代得到拉罗替尼。该方法由于纯化操作复杂,使用的中间体成本较高,整个路线工业化成本高。
[0008]
专利cn107987082a将(r)-2-(2,5-二氟苯基)吡咯烷和中间体的缩合放到最后一步反应,有效降低了生产成本,适合医药工业化生产。
[0009]
cn108101820a公开了一种手性吡咯烷的合成工艺及中间体,具体包括化合物(ii)在手性催化剂和当量的还原剂硼烷的二甲硫醚的作用下得到目标化合物 (iii),再经多步反应得到化合物(iv)。由于该反应使用了过量的硼烷试剂,反应放大时易释放出恶臭的二甲硫醚气体,对环境不友好,更不利于生产的劳动保护。同时由于淬灭时放热剧烈,反应存在较大的安全隐患,不利于工业化生产。
[0010][0011]
另外,cn109354578a公开了一种替尼中间体以及替尼的合成方法,具体包括由化合物(ii)在下式r-dpen-ru络合物催化作用下,通过转移氢化反应制备化合物(iii)。由于该反应催化剂使用了价格高昂的贵金属钌,且反应转化数最高仅200,生产成本高,难以用于工业化生产。
[0012][0013]
总结现有技术方案中,中间体(r)-2-(2,5-二氟苯基)吡咯烷的合成一直存在合成工艺复杂,成本高昂的问题,因而这也导致拉罗替尼的制备成本高昂。为简化工艺,提高生产效率,发展一种高效绿色且成本低廉的制备拉罗替尼及其中间体的方法,具有十分重要的意义。
技术实现要素:
[0014]
本发明提供一种拉罗替尼及其中间体(r)-2-(2,5-二氟苯基)吡咯烷的制备方法,该方法以手性的过渡金属配体络合物为催化剂,以氢气作氢源,能够在温和的条件下实现拉罗替尼的手性制备,具有配体廉价易得,反应简洁,收率高、对映选择性好、成本低、绿色环保等优点。
[0015]
本发明提供的合成路线如下:
[0016][0017]
具体地,本发明通过以下技术方案来实现:
[0018]
首先,本发明提供了一种式(iii)化合物的制备方法,由式(ii)所示化合物在过渡金属催化剂的存在下,通过金属的不对称催化氢化得到手性醇(iii),其反应方程式为:
[0019][0020]
所述不对称催化氢化步骤中,所述过渡金属催化剂由金属盐和手性配体混合后生成,催化剂金属盐选自钌、铑、铱、钯等常见过渡金属化合物,手性配体选自:
[0021][0022]
作为本发明中不对称催化步骤的一种优选技术方案,过渡金属优选为铱,金属盐优选地为[ir(cod)cl]2;所述配体选自l3、l6和l15,具有以下r和ar基团组合的化合物:l3:ar=ph,r=tbu;l6:ar=4-mec6h4,r=
t
bu;l15:ar=3, 5-(
t
bu)2c6h3。
[0023]
本发明提供的不对称催化氢化反应的体系为均相体系。
[0024]
作为本发明中不对称催化步骤的一种优选技术方案,所述均相催化氢化反应溶剂为甲醇、乙醇、异丙醇、四氢呋喃、二氯甲烷、乙酸乙酯、正己烷、二氯甲烷、1,2-二氯乙烷、甲苯、二甲苯、1,4-二氧六环、甲基叔丁基醚的一种或者任意比例的混合物,优选醇类溶剂。
[0025]
作为本发明中不对称催化步骤的一种优选技术方案,所用的碱为叔丁醇钾、叔丁醇钠、叔丁醇锂、氢氧化钠、氢氧化钾、碳酸钠、碳酸钾、碳酸铯、甲醇钠、甲醇钾的一种或任意比例的混合物。
[0026]
作为本发明中不对称催化步骤的一种优选技术方案,所述反应的温度为 20-80摄氏度,更优选30-60摄氏度;所述反应的氢气压力为1-10mpa,更优选 3-5mpa;反应时间为2-24小时。
[0027]
作为本发明中不对称催化步骤的一种优选技术方案,所述化合物(ii)与催化剂的摩尔比为5mmol:0.01-1nmol。
[0028]
本发明还提供了一种拉罗替尼中间体的制备方法,其合成路线为:
[0029][0030]
具体地包含以下步骤:1)以2,5-二氟溴苯为原料,将其溶于合适的溶剂中,加入异丙基氯化镁,生成格氏试剂,再与n-boc-吡咯烷酮进行反应得到化合物 (ii);2)在手性催化剂下,采用前述的制备方法对化合物(ii)进行不对称催化氢化还原得到手性醇化合物(iii);3)手性醇(iii)在合适的条件下发生分子内环化,得到高光学活性的重要中间体(r)-2-(2,5-二氟苯基)吡咯烷(iv);4) 式(iv)化合物和式(v)化合物发生取代反应得到拉罗替尼中间体vi。
[0031]
本发明还提供一种下式化合物(iv)的制备方法,由式(i)化合物合成拉罗替尼重要中间体(iv)的合成路线包括:
[0032][0033]
具体地,在“一锅”反应中完成,具体包括:
[0034]
(1)首先化合物(iii)的羟基与合适的试剂反应转化为基团r,得到中间体(iii-a),r选自卤素、磺酸酯、磷酸酯等常见离去基团,包括氯、溴、碘、甲磺酸酯(oms)、三氟甲磺酸酯(otf)、对甲苯磺酸酯(ots)、硝基磺酸酯(ons)等;
[0035]
(2)脱去氨基保护基的试剂为盐酸,三氟乙酸,硫酸,磷酸,甲磺酸等,优选为三氟乙酸;
[0036]
(3)最后在碱性条件下发生关环反应得到中间体(iv),加入试剂包括常见的有机碱和无机碱等。
[0037]
本发明进一步提供了一种制备拉罗替尼的方法,由所述的制备方法制备得到中间体(iv),进一步制备得到中间体vi和拉罗替尼。该方法可以是现有技术已知的制备方法[tetrahedron 2021,85,132064],合成路线如下:
[0038][0039]
本发明相对于现有技术的有益效果包括:
[0040]
(1)本发明利用不对称催化氢化技术合成的中间体(r)-2-(2,5-二氟苯基)吡咯烷,操作简便,接近当量的产物转化,ee值高达》99%,具有优异的收率和立体选择性控制。由于收率高,不涉及任何拆分步骤,产生废水废料少,与现有技术相比具有较大的成本优势。
[0041]
(2)另外,催化剂用量少且催化效率高,使用优选的催化剂体系ir/f-amphox,不对称氢化反应具有非常高的反应活性,催化剂转化数(ton,turnovernumber) 高达100000。这使得拉罗替尼的整体合成工艺操作简便、降低废弃物排放、成本大幅下降、易于产业化应用;
[0042]
(3)本发明操作稳定、成本低廉、环境友好,具有极高的经济效益,工业化价值巨大。
附图说明
[0043][0044]
图1,本发明拉罗替尼中间体的合成路线示意图。
[0045]
图2,手性化合物iii的hplc谱图。
[0046]
图3,消旋化合物iii的hplc谱图。
[0047]
图4,化合物iii的核磁氢谱。
[0048]
图5,化合物iii的核磁碳谱。
[0049]
图6,手性化合物vi的hplc谱图。
[0050]
图7,消旋化合物vi的hplc谱图。
[0051]
图8,化合物vi的核磁氢谱。
[0052]
图9,化合物vi的核磁碳谱。
具体实施方式
[0053]
下面结合实施例和附图对本发明作进一步详细的描述,但发明的实施方式不限于此。
[0054]
实施例1
[0055][0056]
将2,5-二氟溴苯(38.6g,200mmol)溶于200mlthf中,冷却至0℃滴加 120ml异丙基
氯化镁溶液(2m的thf溶液,240mmol),滴加完毕后,室温反应1小时,控温20℃以下,缓慢滴加40.7g n-boc-吡咯烷酮(用25ml thf 稀释,220mmol)。滴加完毕后,控温20℃下,反应90分钟。反应结束后,用2 m稀盐酸水溶液淬灭反应,随后将反应混合液转移至分液漏斗中,分液,水相用乙酸乙酯200ml分两次萃取,合并有机相,干燥旋干,快速过硅胶柱,粗产物用mtbe重结晶,得白色固体20.3g,产率为34%,即化合物(ii)。
[0057]1h nmr(400mhz,cdcl3)δ7.56
–
7.52(m,1h),7.23
–
7.17(m,1h),7.14
–ꢀ
7.08(m,1h),4.59(br,1h),3.20(t,j=6.8hz,2h),3.03
–
2.99(m,2h),1.95
–
1.88 (m,2h),1.42(s,9h).
13
c nmr(151mhz,cdcl3)δ196.69,158.60(dd,j=244.6, 2.0hz),157.87(dd,j=250.6,2.1hz),155.97,126.55(dd,j=15.6,6.0hz),121.18 (dd,j=24.6,9.3hz),118.17(dd,j=27.3,7.9hz),116.47(dd,j=25.0,3.3hz), 79.17,40.55(d,j=7.6hz),39.92,28.33,24.21.
19
f nmr(565mhz,cdcl3)δ
ꢀ‑
115.03,-117.58.hrms(esi)calculated for c
15h19
f2nnao3[m+na]
+
322.1231;found 322.1220.
[0058]
实施例2(s/c=10000)
[0059][0060]
在氩气氛围下,将[ir(cod)cl]2(1.4mg,0.002mmol)和手性配体 f-amphox-t
bu-l3(2.4mg,0.0042mmol)溶于10ml异丙醇中,在室温条件下搅拌3小时,得到橙色澄清溶液。用微量注射器取该橙色溶液50ul,加入到中间体(ii)(59.8mg,0.2mmol)、异丙醇(1ml)和甲醇钾(0.7mg,0.01mmol) 的混合体系中。将反应体系置于高压釜中,用氢气置换高压釜中的气体三次,最后充入50atm氢气,在25℃下反应4小时。反应结束后,缓慢释放高压釜中的气体,反应液用硅胶抽滤滤掉催化剂和碱,用dcm冲洗,滤液减压浓缩白色固体57.2mg,即氢化产物(iii),产率为95%,经hplc分析,测得ee值为》99%。化合物iii表征数据:[α]
d25
=-18.2(c=1.00in chcl3).
[0061]
对映异构体通过hplc法测定,色谱条件为:chiralcelad-3柱,210nm, 30℃,流动相:n-hexane:i-proh=90:10;流速1.0ml/min;tr(major)=10.5min, tr(minor)=14.1min.
[0062]1h nmr(400mhz,cdcl3)δ7.20
–
7.16(m,1h),6.95
–
6.83(m,2h),4.98(q, j=5.7hz,1h),4.71(br,1h),3.42(s,1h),3.18
–
3.07(m,2h),1.72(q,j=7.3hz, 2h),1.65
–
1.50(m,2h),1.39(s,9h).
13
c nmr(151mhz,cdcl3)δ158.92(dd,j= 242.0,1.9hz),156.29,155.25(dd,j=240.6,2.1hz),133.84(dd,j=15.6,6.3hz), 116.11(dd,j=25.0,8.5hz),114.75(dd,j=24.2,8.6hz),113.73(dd,j=24.9,5.0 hz),79.33,67.23,40.12,34.71,28.30,26.21.
19
f nmr(376mhz,cdcl3)δ-118.46,
ꢀ‑
125.70.hrms(esi)calculated for c
15h21
f2nnao3[m+na]
+
324.1387;found
ꢀꢀ
324.1378.
[0063]
其中,所述化合物iii进一步合成重要中间体iv及拉罗替尼的路线如图1;手性化合物iii的hplc谱图如图2;消旋化合物iii的hplc谱图如图3;化合物iii的核磁氢谱和碳谱分别如图4和图5所示。
[0064]
实施例3-12
[0065]
本发明为考察不对称氢化反应所用催化剂的种类对转化率(conv.)以及对映体选择性(ee)的影响。在实施例2的基础上,将催化剂配体l3依次替换为l1、l2、 l4、l5、l6、l8、l13、l15、l20、l22。
[0066]
实施例3-12中不同催化剂对化合物(ii)还原的转化率以及ee值的影响结果见下表1所示;其中,转化率(conv.)和对映体选择性(ee)由hplc测得。
[0067]
表1
[0068]
编号催化剂反应时间conv.(%)ee(%)实施例2l32h》99》99实施例3l12h9577实施例4l22h9480实施例5l42h9087实施例6l52h9392实施例7l62h9999实施例8l82h9895实施例9l132h9399实施例10l152h9999实施例11l202h9599实施例12l222h9699
[0069]
实施例13-21
[0070]
为考察反应体系所加碱对反应的影响,以异丙醇作为溶剂,在实施例2的基础上,将叔丁醇钾依次替换为碳酸钠、碳酸铯、氢氧化钾、氢氧化钠、甲醇钾、甲醇钠、碳酸钾、叔丁醇钠、叔丁醇锂。反应时间2h,s/c=10000,进行以下实施例13-21,其合成路线如下所示,其结果见下表2所示。
[0071]
表2
[0072]
[0073][0074]
实施例22-26
[0075]
为考察反应体系溶剂对反应的影响,在实施例2的基础上,将溶剂依次替换为meoh、thf、etoac、dcm、和toluene等。不同溶剂对化合物(ii)还原的转化率以及ee值的影响结果见下表3所示;其中,转化率(conv.)和对映体选择性(ee) 由hplc测得。
[0076]
表3
[0077]
编号催化剂反应溶剂conv.(%)ee(%)实施例1f-amphox-t
bu-l3iproh》99》99实施例22f-amphox-t
bu-l3meohnr-实施例23f-amphox-t
bu-l3thf599实施例24f-amphox-t
bu-l3etoac3099实施例25f-amphox-t
bu-l3dcm9999实施例26f-amphox-t
bu-l3toluene3599
[0078]
实施例27-30
[0079]
进一步地,以催化剂f-amphox-t
bu-l3作为催化剂、绿色的溶剂异丙醇作为溶剂,分别改变催化剂用量、反应时间等,结果如下表4所示。
[0080]
表4
[0081][0082][0083]
实施例31(放大,s/c=100000)
[0084][0085]
在氩气氛围下,将[ir(cod)cl]2(1.4mg,0.002mmol)和手性配体 f-amphox-t
bu-l3(2.4mg,0.0042mmol)溶于10ml异丙醇中,在室温条件下搅拌3小时,得到橙色澄清溶液。用注射器取该橙色溶液2.5ml,加入到中间体(ii)(29.9g,100mmol)、异丙醇(50ml)和甲醇钾(70mg,1mmol)的混合体系中。将反应体系置于高压釜中,用氢气置换高压釜中的气体三次,最后充入50atm氢气,在25℃下反应24小时。反应结束后,缓慢释放高压釜中的气体,反应液用硅胶抽滤滤掉催化剂和碱,用dcm冲洗,滤液减压浓缩白色固体 29.5g,即氢化产物(iii),产率为98%,经hplc分析,测得ee值为》99%。
[0086]
实施例32,式iii-a化合物,基团r为甲磺酸酯(oms)
[0087][0088]
称取6.0g化合物iii(20mmol),加入20ml二氯甲烷溶解,再滴加5.6ml 三乙胺(40mmol),将反应体系置于0℃低温冷浴中,边搅拌边缓慢滴加1.7ml 甲磺酰氯(22mmol),滴加完继续在0℃反应30min,反应结束后,用饱和碳酸钠洗涤,60ml二氯甲烷分三次萃取,浓缩得黄色油状液体7.2g。然后向上述得到的黄色油状液体中滴加25ml三氟乙酸和25ml二氯甲烷的混合液,室温搅拌2h,反应结束后浓缩反应液,然后加入100ml水溶解,将反应液置于0℃低温冷浴中,边搅拌边滴加150ml氢氧化钠溶液(2m)。用150ml乙酸乙酯分三次萃取反应混合液,保留有机相,用无水硫酸钠干燥,减压除去溶剂,经过柱纯化得到3.1g淡黄色油状液体(iv),反应收率为84%,经hplc分析,测得ee值为96%,其核磁氢谱数据与文献一致(j.am.chem.soc.2019,141, 14083-14088.)
[0089]
实施例33,式v化合物x为氯原子(cl)。
[0090][0091]
式iv化合物(1.83g,10mmol)、式v化合物(1.99g,10mmol)和20ml 乙醇加入至50ml三口瓶中,搅拌均匀,保持体系温度在30℃以内。滴加三乙胺(1.53ml,11mmol),滴加完毕后,50℃反应2小时,反应完毕后直接旋干过柱纯化(石油醚:乙酸乙酯=2:1),得到拉罗替尼中间体vi 2.76g,收率为80%,经hplc分析,测得ee值为96%。化合物vi表征数据:[α]
d25
=-27.0(c =1.00in chcl3).
[0092]
对映异构体通过hplc法测定,色谱条件为:chiralcel ia柱,250nm,30℃, 流动相n-hexane:i-proh=90:10;流速1.0ml/min;tr(minor)=26.6min,t
r (major)=28.9min.
[0093]
major:1h nmr(600mhz,dmso-d6)δ8.71(d,j=7.8hz,1h),8.42(s,1h), 7.16
–
7.08(m,1h),6.95
–
6.89(m,2h),6.68(d,j=7.8hz,1h),5.48(d,j=5.6hz, 1h),3.98
–
3.92(m,1h),3.58(q,j=8.1hz,1h),2.38
–
2.32(m,1h),2.01
–
1.83 (m,3h).
13
c nmr(151mhz,dmso-d6)δ158.06(d,j=240.1hz),156.16,155.76 (d,j=240.8hz),142.85,141.53,136.99,132.04(dd,j=15.9,7.1hz),119.34, 116.69(dd,j=24.6,8.6hz),114.68(dd,j=24.2,8.7hz),114.07(dd,j=25.1,4.5 hz),100.49,56.39,48.18,32.65,23.13.
19
f nmr(565mhz,dmso-d6)δ-118.93 (ddd,j=16.9,12.7,8.4hz),-123.75(dd,j=15.2,6.7hz).
[0094]
minor:1h nmr(600mhz,dmso-d6)δ8.54(d,j=7.8hz,1h),8.51(s,1h), 7.26
–
7.22(m,1h),7.11
–
7.08(m,1h),6.98
–
6.96(m,1h),6.12(d,j=7.8hz, 1h),5.26(d,j=7.4hz,1h),3.98
–
3.92(m,1h),3.77
–
3.73(m,1h),2.48
–
2.43 (m,1h),2.01
–
1.83(m,3h).
13
c nmr(151mhz,dmso-d6)δ158.30(d,j=241.5 hz),156.40,155.38(d,j=236.4hz),143.32,141.79,136.94,130.62(dd,j=15.8, 6.8hz),119.60,117.51(dd,j=24.1,8.7hz),115.77(dd,j=24.1,8.6hz),113.89 (dd,j=30.0,4.2hz),100.20,56.46,48.38,34.04,22.00.
19
f nmr(565mhz, dmso-d6)δ-117.66(ddd,j=16.4,12.0,7.9hz),-122.75
–‑
122.91(m).
[0095]
其中,手性化合物vi的hplc谱图如图6所示;消旋化合物vi的hplc 谱图如图7所示;化合物vi的核磁氢谱图如图8所示;化合物vi的核磁碳谱图如图9所示。
[0096]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1