重组核酸序列、重组表达载体以及基因工程菌的制作方法
1.本发明属于微生物工程技术领域,具体地说,涉及用于发酵生产1,5-戊二胺的重组核酸序列、重组表达载体、基因工程菌及其用途。
背景技术:
2.1,5-戊二胺的用途相当广泛且在工业生产中具有很高的经济价值,例如可以与二元酸进行聚合反应合成新型尼龙。目前,1,5-戊二胺的生物合成主要利用两种策略进行:发酵生产或体外酶催化。对于发酵生产,1,5-戊二胺通过赖氨酸脱羧酶(l-lysine decarboxylase,简称ldc,ec 4.1.1.18)将l-赖氨酸脱去一个羧基而生成。具体的,可以将赖氨酸脱羧酶基因添加至产赖氨酸的微生物例如谷氨酸棒杆菌和大肠杆菌中,从而将赖氨酸生物合成途径延长至1,5-戊二胺生物合成途径。
3.目前已有通过dna重组技术改造的具有l-赖氨酸生产能力的棒杆菌属和埃希杆菌属的细菌,其效率的提高是通过过表达l-赖氨酸合成途径的相关基因和反馈抑制脱敏的相关基因,或者强化从葡萄糖代谢开始的能量供应途径而实现的。反馈抑制脱敏的相关基因,例如天冬氨酸激酶ⅲ(lysc)是赖氨酸合成途径中的特异关键酶。然而,由于菌体本身耐受的1,5-戊二胺浓度有限,如果在发酵体系中前期表达了赖氨酸脱羧酶转化生成的1,5-戊二胺过多,就会对菌体造成毒害,从而抑制菌体生长及利用葡萄糖生产l-赖氨酸的过程(qian,et al.,biotechnol.bioeng.2011;108:93
–
103)。
4.例如:公开号为wo2019006723a1,公开日为2019年1月19日,名称为“heterologous expression of thermophilic lysine dec-arboxylase and uses thereof”的专利文献公开了一种嗜热赖氨酸脱羧酶的异源表达及其用途。在该专利文献所公开的技术方案中,先使用嗜热赖氨酸脱羧酶,通过高温控制酶活性。
5.又例如:公开号为cn105368766a,公开日为2016年3月2日,名称为“一株生产戊二胺的基因工程菌及其制备戊二胺的方法”的中国专利文献公开了一种戊二胺生产菌株及其高效生产戊二胺的工艺。在该专利文献所公开的技术方案中,通过使用温控型启动子表达赖氨酸脱羧酶,一定程度上解决了稳定性问题,但使用高温进行催化又额外增加了能耗和生产成本。
6.因此,需要开发更经济、稳定、高效的1,5-戊二胺生产工艺。
技术实现要素:
7.为了克服现有技术的不足,本发明的目的在于一种重组核酸序列、重组表达载体以及基因工程菌,以实现1,5-戊二胺的稳定、高效、低成本生产。
8.为了实现上述目的,本发明通过以下几个方面实现:
9.第一方面,本发明提出了一种重组核酸序列,所述重组核酸序列包括串联启动子、赖氨酸脱羧酶基因以及增强细胞耐受压力的基因,其中,所述串联启动子包括piclr启动子和稳定期特异性启动子,所述稳定期特异性启动子选自下述的一种或多种:pcsie、pbola、
posmy、pkate、p21、p22、p23和p24。
10.耐渗透胁迫是细胞生理性能的重要方面。对于分泌到胞外的大宗化学品,产量越高,渗透胁迫越大,细胞需具备耐渗透胁迫能力才能获得高产量。
11.串联启动子一方面具有强启动子的启动能力,另一方面iclr是一个局部调控转录抑制因子,iclr蛋白能够抑制自身和乙醛酸途径中的arcabc操纵子的转录。iclr启动子的启动还受到fadr的激活。
12.本发明通过将包括piclr启动子和稳定期特异性启动子的串联启动子,及其控制之下的赖氨酸脱羧酶基因重组插入到细菌染色体中,增强启动子强度,保证l-赖氨酸脱羧酶的足量、稳定表达,大大降低宿主细胞耐受1,5-戊二胺毒害而导致的能耗,从而促进1,5-戊二胺的生产,而整个过程无需使用抗性基因、诱导元件等等。
13.本领域技术人员理解,为了提高目的基因在宿主细胞中的表达,可以根据该宿主细胞的密码子偏好对目的基因的编码序列进行优化。例如,可以将目的基因的稀有密码子进行同义替换,使之更接近于宿主细胞的密码子使用方式。通过这种方法,提高外源基因在宿主细胞中表达量的报道已有很多。
14.优选地,所述piclr启动子来源于大肠杆菌(escherichia coli)、谷氨酸棒状杆菌(corynebacterium glutamicum)以及蜂房哈夫尼菌(hafnia alvei)中的任意一种或几种。
15.更优选地,所述piclr启动子的核苷酸序列如seq id no:83-85任意一项所示;所述稳定期特异性启动子的核苷酸序列如seq id no:1-8任意一项所示;和/或,所述赖氨酸脱羧酶基因选自来自大肠杆菌、谷氨酸棒状杆菌、蜂房哈夫尼菌中的任意一种的cada基因或ldcc基因。
16.进一步更优选地,所述cada基因的核苷酸序列如seq id no:9所示。
17.在一些实施方案中,所述赖氨酸脱羧酶(简称ldc,ec 4.1.1.18)的基因可以来自微生物、动物或植物的细胞,包括但不局限于大肠杆菌(escherichia coli)、枯草芽孢杆菌(bacillus subtilis)、嗜碱芽孢杆菌(bacillus halodurans)、天蓝色链霉菌(streptomyces coelicolor)、蜂房哈夫尼菌(hafnia alvei)、谷氨酸棒状杆菌(corynebacterium glutamicum)或奥克西托克雷白杆菌(klebsiella oxytoca)等。
18.在一些实施方案中,赖氨酸脱羧酶基因是来自于大肠杆菌的cada基因或ldcc基因,例如cada基因的序列可以是seq id no:9,cada蛋白的序列可以是seq id no:10。另外,赖氨酸脱羧酶也可以来自于上述菌株经过诱变或随机突变之后的菌株或基因工程菌。赖氨酸脱羧酶还可以是上述来源的赖氨酸脱羧酶的突变体(包括天然突变体和人工重组突变体)或者活性片段(保留了赖氨酸脱羧酶活性的截短形式的蛋白片段)。
19.在一些实施方案中,所述串联启动子中的稳定期特异性启动子选自pcsie、pbola、posmy、pkate、p21、p22、p23和p24中的任意一种或几种。
20.所述稳定期特异性启动子可以来自微生物、动物或植物的细胞,包括但不局限于大肠杆菌(escherichia coli)、枯草芽孢杆菌(bacillus subtilis)、嗜碱芽孢杆菌(bacillus halodurans)、天蓝色链霉菌(streptomyces coelicolor)、蜂房哈夫尼菌(hafnia alvei)、谷氨酸棒状杆菌(corynebacterium glutamicum)或奥克西托克雷白杆菌(klebsiella oxytoca)等。
21.所述pcsie的序列可以是seq id no:1;pbola的序列可以是seq id no:2;posmy的
序列可以是seq id no:3;pkate的序列可以是seq id no:4;p21的序列可以是seq id no:5;p22的序列可以是seq id no:6;p23的序列可以是seq id no:7;p24的序列可以是seq id no:8。
22.在本文中,促进1,5-戊二胺从细胞排出的基因是指,其表达产物促进微生物细胞将1,5-戊二胺排出到细胞外,从而降低胞内1,5-戊二胺浓度及其对胞内赖氨酸脱羧酶活性的抑制,促进1,5-戊二胺的生产。在一些实施方案中,所述促进戊二胺排出的基因包括外膜孔蛋白的基因或增加细胞耐压能力的基因。更具体地,所述促进戊二胺排出的外膜孔蛋白或增加细胞耐压能力的蛋白还可以是上述蛋白的突变体(包括天然突变体和人工重组突变体)或者活性片段。可选地,结合增加细胞耐受压力的基因(如rpos、crp、puur、pepa以及soxs)和/或外膜孔蛋白基因(如ompa、ompc、ompf、ompw和ompx),以进一步降低胞内1,5-戊二胺浓度,提高1,5-戊二胺的产量。
23.优选地,所述重组核酸序列还包括组成型启动子。
24.更优选地,所述组成型启动子选自plac、trp、tac、trc和pl中的任意一种或几种。
25.进一步更优选地,所述组成型启动子的核苷酸序列如seq id no:60所示。
26.在本文中所使用的组成型启动子是本领域技术人员所熟知的,其可以使促进1,5-戊二胺从细胞排出的基因或增加细胞耐压能力的基因在宿主细胞中表达,例如可以使用plac、trp、tac、trc或pl启动子。例如,plac的序列可以是seq id no:60。
27.优选地,所述增强细胞耐受压力的基因与组成型启动子可操作地连接,所述增强细胞耐受压力的基因选自:rpos、crp、puur、pepa以及soxs中的任意一种或几种。
28.更优选地,所述增强细胞耐受压力的基因的核苷酸序列如seq id no:11-15任意一项所示。其中,rpos基因的序列可以是seq id no:11,其蛋白序列如seq id no:16所示,crp基因的序列可以是seq id no:12,其蛋白序列如seq id no:17所示,puur基因的序列可以是seq id no:13的编码序列,其蛋白序列如seq id no:18所示,pepa基因的序列可以是seq id no:14,其蛋白序列如seq id no:19所示,soxs基因的序列可以是seq id no:15,其蛋白序列如seq id no:20所示。
29.优选地,所述重组核酸序列还包括编码外膜孔蛋白的基因。
30.更优选地,所述编码外膜孔蛋白的基因与组成型启动子可操作性地连接,和/或,所述编码外膜孔蛋白的基因选自:ompa、ompc、ompf、ompw和ompx中的任意一种或几种;更优选地,所述编码外膜孔蛋白的基因的核苷酸序列如seq id no:62-66任意一项所示。其中,ompa基因的序列可以是seq id no:62,其蛋白序列如seq id no:67所示,ompc基因的序列可以是seq id no:63,其蛋白序列如seq id no:68所示,ompf基因的序列可以是seq id no:64的编码序列,其蛋白序列如seq id no:69所示,ompw基因的序列可以是seq id no:65,其蛋白序列如seq id no:70所示,ompx基因的序列可以是seq id no:66,其蛋白序列如seq id no:71所示。
31.在本文所述的重组dna中,所述串联启动子(元件a)和赖氨酸脱羧酶基因(元件b)可操作地连接(表示为a-b),使得赖氨酸脱羧酶的转录和表达在戊二胺诱导型启动子的控制之下。优选地,所连接的a-b可以实现在宿主细胞中表达受戊二胺浓度的调控,通过所述串联启动子控制l-赖氨酸脱羧酶的生产,提高1,5-戊二胺的产量。
32.在本文所述的重组dna中,组成型启动子(元件c)和促进戊二胺排出的基因(元件
d)可操作的连接(表示为c-d),使得促进戊二胺排出的基因的转录和表达在组成型启动子的控制之下;组成型启动子(元件e)和增加细胞耐压能力的基因(元件f)可操作的连接(表示为e-f)。可选地,前述所连接的a-b、c-d和e-f可以进行可操作的连接或者独立存在。
33.优选地,所述重组核酸序列选自以下组:
34.(1)piclr-p24-cada-plac-rpos、piclr-p24-cada-plac-crp、piclr-p24-cada-plac-puur、piclr-p24-cada-plac-pepa或piclr-p24-cada-plac-soxs;和,
35.(2)piclr-p24-cada-plac-rpos-plac-ompa、piclr-p24-cada-plac-rpos-plac-ompc、piclr-p24-cada-plac-rpos-plac-ompf、piclr-p24-cada-plac-rpos-plac-ompw或piclr-p24-cada-plac-rpos-plac-ompx。
36.第二方面,本发明提出了一种重组表达载体,所述重组表达载体包括上述的重组核酸序列。
37.优选地,所述重组表达载体的骨架质粒包括puc18、puc19、pbr322、pacyc、pet、psc101以及它们的衍生质粒。
38.或,优选地,在本发明所述的技术方案中,采用pkd46进行大肠杆菌染色体重组。
39.在本文中,赖氨酸脱羧酶基因可以包含在一个质粒中。
40.在本文中,促进1,5-戊二胺从细胞排出的基因或增加细胞耐压能力的基因可以包含在与赖氨酸脱羧酶基因相同的质粒中。或者,其也可以包含在不同的质粒中,独立于宿主染色体而在宿主细胞内表达。
41.第三方面,本发明提出了一种生产1,5-戊二胺的基因工程菌,所述基因工程菌包含上述的重组核酸序列。
42.在本文中,所述基因工程菌的染色体中包含在所述串联启动子控制之下的赖氨酸脱羧酶基因。由此,通过使用piclr-稳定期特异性启动子串联启动子调控l-赖氨酸脱羧酶的表达,降低1,5-戊二胺耐受过程中的能耗,促进l-赖氨酸的生产,进而提高1,5-戊二胺的产量。进一步地,所述基因工程菌还可以通过重组在染色体中包含所述促进1,5-戊二胺从细胞排出的基因或在所转化的表达质粒中包含所述促进1,5-戊二胺从细胞排出的基因,由此通过表达促进1,5-戊二胺从细胞排出的蛋白而降低胞内1,5-戊二胺浓度及其对胞内赖氨酸脱羧酶活性的抑制,进而提高1,5-戊二胺的产量。
43.作为出发菌株,可以使用可生产l-赖氨酸的大肠杆菌(escherichia coli)m11a3菌株,该菌株现已保藏于中国典型培养物保藏中心,地址:中国武汉,武汉大学,邮编430072,保藏编号cctcc no:m2018456,保藏日期2018年7月6日。
44.优选地,所述重组核酸序列位于游离的重组表达载体或整合到染色体中。
45.更优选地,所述基因工程菌的宿主菌来源于埃希氏菌属(escherichia)、棒杆菌属(corynebacterium)、芽孢杆菌属(bacillus)、栖热菌属(thermus)、短杆菌属(brevibacterium)或哈夫尼菌属(hafnia)的菌种。
46.进一步更优选地,所述基因工程菌的宿主菌来源于大肠杆菌(escherichia coli)、嗜热菌(thermus.thermophilus)、蜂房哈夫尼菌(hafnia alvei)、枯草芽孢杆菌(bacillus subtilis)或谷氨酸棒状杆菌(corynebacterium glutamicum)。
47.第四方面,本发明提出了一种生产1,5-戊二胺的方法,所述方法包括步骤:在发酵培养基中对含有上述的基因工程菌进行培养以生产1,5-戊二胺。
48.在一些实施方案中,基因工程菌培养温度为20-50℃。
49.在本文中,将所述重组dna构建到具有生产l-赖氨酸能力的工程菌中,发酵培养重组菌并进行赖氨酸积累,发酵培养温度控制在20-50℃,进行菌体的快速生长以及赖氨酸积累,进入发酵稳定期后,使赖氨酸脱羧酶大量表达,转化生产1,5-戊二胺。
50.如本文所用,术语“约”在用于修改温度范围内的数值时表示该数值与该值的合理偏差,例如,在该范围内所述的值之下或之上1℃或2℃以内,是在所述值或范围的预期含义内。
51.在一些实施方案中,培养在约25℃至约45℃的温度下进行。在其他实施方案中,培养在约30℃至约40℃的温度下进行。在进一步的实施方案中,培养在约35℃至约39℃的温度下进行。
52.第五方面,本发明提出了生产1,5-戊二胺的方法,所述方法包括步骤:在发酵培养基中对含有上述的基因工程菌进行培养以生产1,5-戊二胺。
53.第六方面,本发明提出了上述的重组核酸序列、重组表达载体或基因工程菌在生产1,5-戊二胺中的应用。
54.借由上述技术方案,本发明至少具有下列优点及有益效果:
55.本发明使用了包括piclr启动子和稳定期特异性启动子的串联启动子,当菌体生长到稳定期后才会启动赖氨酸脱羧酶基因的足量表达。与表达嗜热赖氨酸脱羧酶或温控启动子表达赖氨酸脱羧酶相比,本发明可以通过在染色体上插入所述串联启动子-赖氨酸脱羧酶基因序列,实现赖氨酸脱羧酶稳定和足量的表达,另外,该菌株去除了抗生素、特殊环境条件或其他诱导剂的使用,整个发酵培养过程自调控。
56.将其应用于1,5-戊二胺生产,可以显著降低细胞生长及l-赖氨酸生产阶段产生的1,5-戊二胺的细胞毒性,提高l-赖氨酸产量;发酵结束后,可以将l-赖氨酸几乎全部转化为1,5-戊二胺,从而实现了1,5-戊二胺产量的增加。同时使用了增加细胞耐受能力的蛋白和或促进戊二胺排出的蛋白,转化的同时将1,5-戊二胺输出胞外,综合显著地提高重组菌株发酵生产1,5-戊二胺的产量,实现了1,5-戊二胺的稳定、高效、低成本生产。
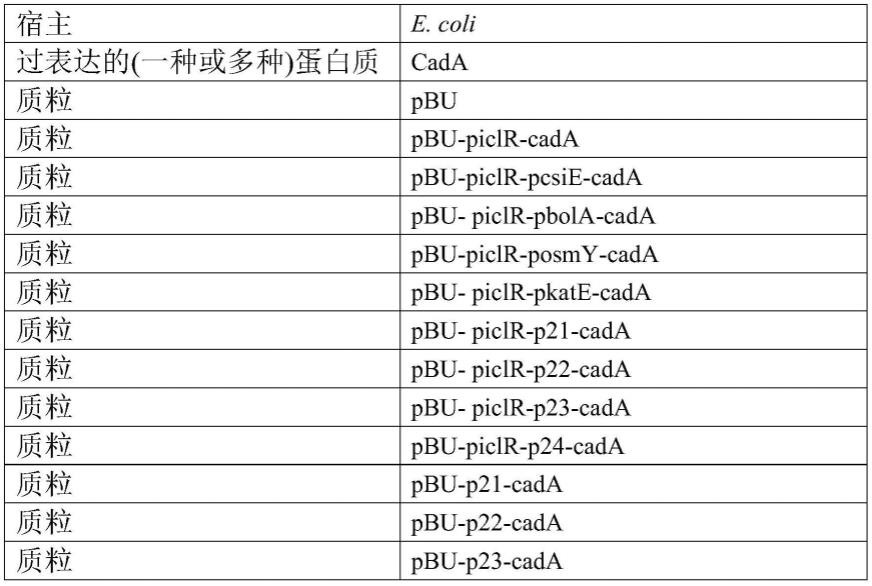
具体实施方式
57.下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
58.以下实施例用于说明本发明,但不用来限制本发明的范围。应当理解,尽管本文示例了实施本发明的一些实施方案,根据本公开,本领域技术人员会认识到,可以进行众多修改而不脱离本发明的精神和预期范围。还应当理解,本文所用的术语用于仅描述具体实施方案并且不意在是限制性的,因为本发明的范围将仅由所附的权利要求及其等同物限定。
59.若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrook j&russell dw,molecular cloning:a laboratory manual,2001),或按照制造厂商说明书建议的条件。
60.以下实施例中涉及到的pcr扩增、纯化、质粒提取、酶切、酶切产物连接、转化等的具体步骤、条件参数等均按所购相关酶和试剂的说明书进行。其中pcr扩增所用的dna聚合
酶、酶切所用的限制性内切酶、酶切产物连接所用的连接酶均购自宝生物工程(大连)有限公司。质粒提取试剂盒、dna胶回收试剂盒、pcr纯化试剂盒均购自康宁生命科学(吴江)有限公司引物均购自赛默飞世尔科技(中国)有限公司(invitrogen)。
61.以下实施例中涉及到的质粒转化方法如下:将连接产物加至100μl的大肠杆菌e.coli bl21(de3)感受态细胞中,冰浴30min后,42℃热激90s。冰上孵育5min后加入1ml的lb。涂布至相对应的抗性平板上。
62.本发明中,培养基中l-赖氨酸和1,5-戊二胺的量可以通过核磁共振方法检测。
63.本发明中涉及到的百分号“%”,若未特别说明,是指质量百分比;但溶液的百分比,除另有规定外,是指100ml溶液中含有溶质的克数。
64.实施例中使用的宿主、过表达的蛋白质及质粒汇总如下表1所示。
65.表1.
66.[0067][0068]
实施例1pbu质粒骨架的构建
[0069]
以市售大肠杆菌k12 mg1655的基因组为模板,引物对upp-uf(seq id no:21)和upp-ur(seq id no:22)扩增出upp-u片段(seq id no:23),引物对upp-df(seq id no:24)和upp-dr(seq id no:25)扩增出upp-500bp-d(seq id no:26)片段,引物对upp-f(seq id no:27)和upp-r(seq id no:28)扩增出pupp-upp-d片段(seq id no:29)。
[0070]
以市售质粒pbr322为模板,引物对p1p2-teta-f(seq id no:30)和p1p2-teta-r(seq id no:31)扩增出质粒上包含p1p2启动子和teta序列(即带抗性标记)的片段p1p2-teta(seq id no:32)。将upp-u、upp-500bp-d、p1p2-teta和pupp-upp-d片段pcr产物切胶回收后,与ecori和naei双酶切后的pbr322载体进行连接,使用多片段一步法克隆试剂盒将基因片段和载体进行重组连接。重组连接后的混合物转化至e.coli jm109(购自宝生物工程(大连)有限公司)感受态细胞中,在含有氨苄青霉素的lb平板上进行筛选,获得多个单菌落。通过菌落pcr和测序验证正确后,抽提质粒即得到包含upp-u、upp-500bp-d、p1p2-teta和pupp-upp-d四个片段的质粒,该质粒命名为pbu载体。
[0071]
实施例2赖氨酸脱羧酶cada基因的克隆
[0072]
以市售大肠杆菌k12 mg1655的基因组为模板,引物对cada-f(序列如seq id no:33所示)和cada-r(序列如seq id no:34所示)扩增出cada基因片段(序列如seq id no:9所示),将cada基因片段和ecori单酶切后的实施例1获得的pbu载体进行切胶回收纯化,使用多片段一步法克隆试剂盒将基因片段和载体进行重组,产生的质粒名为pbu-cada。
[0073]
以市售大肠杆菌k12 mg1655的基因组为模板,引物对piclr-f(序列如seq id no:35所示)和piclr-r(序列如seq id no:36所示)扩增出piclr启动子,序列如seq id no:83所示,当然在一些其他的实施方式中,根据来源的不同,pirclr序列还可以来源自谷氨酸棒状杆菌(corynebacterium glutamicum)的如seq id no:84所示的piclr-cg,或来自蜂房哈
夫尼菌(hafnia alvei)的如seq id no:85所示的piclr-ha。将piclr启动子片段和saci单酶切后的pbu-cada载体进行切胶回收纯化,使用多片段一步法克隆试剂盒将基因片段和载体进行重组连接。重组连接后的混合物转化至e.coli jm109(购自宝生物工程(大连)有限公司)感受态细胞中,在含有氨苄青霉素的lb平板上进行筛选,获得多个单菌落。通过菌落pcr和测序验证正确后,抽提质粒即得到pbu-piclr-cada质粒,该质粒包含了piclr启动子控制下的cada基因。
[0074]
实施例3构建pbu-piclr-稳定期特异性启动子-cada和pbu-稳定期特异性启动子-cada质粒
[0075]
以市售大肠杆菌k12 mg1655的基因组为模板,分别利用引物pcsie-f(序列如seq id no:37所示)/pcsie-r(序列如seq id no:38所示),pbola-f(序列如seq id no:39所示)/pbola-r(序列如seq id no:40所示),posmy-f(序列如seq id no:41所示)/posmy-r(序列如seq id no:42所示),pkate-f(序列如seq id no:43所示)/pkate-r(序列如seq id no:44所示),pcsie-f2(序列如seq id no:45所示)/pcsie-r(序列如seq id no:38所示),pbola-f2(序列如seq id no:46所示)/pbola-r(序列如seq id no:40所示),posmy-f2(序列如seq id no:47所示)/posmy-r(序列如seq id no:42所示),pkate-f2(序列如seq id no:48所示)/pkate-r(序列如seq id no:44所示);扩增稳定期特异性启动子pcsie(序列如seq id no:1所示),pbola(序列如seq id no:2所示),posmy(序列如seq id no:3所示),pkate(序列如seq id no:4所示),将pcr产物进行切胶回收后,分别与saci酶切的实施例2获得的pbu-piclr-cada和pbu-cada质粒连接,得到含有4个串联启动子的质粒:pbu-piclr-pcsie-cada,pbu-piclr-pbola-cada,pbu-piclr-posmy-cada,pbu-piclr-pkate-cada;和只含有4个稳定期特异性启动子的质粒:pbu-pcsie-cada,pbu-pbola-cada,pbu-posmy-cada,和pbu-pkate-cada。
[0076]
使用本领域常用基因序列合成方法分别合成p21、p22、p23、p24条启动子的双链dna序列(5
’‑3’
),然后分别连接至saci酶切的实施例2获得的pbu-piclr-cada和pbu-cada质粒中。得到含有4个串联启动子的质粒pbu-piclr-p21-cada,pbu-piclr-p22-cada,pbu-piclr-p23-cada,pbu-piclr-p24-cada;和只含有4个稳定期特异性启动子的质粒:pbu-p21-cada,pbu-p22-cada,pbu-p23-cada,pbu-p24-cada。
[0077]
实施例4构建1,5-戊二胺生产菌株并检测1,5-戊二胺产量
[0078]
本发明中出发菌株采用可生产l-赖氨酸的大肠杆菌(escherichia coli)m11-a3菌株,该菌株现已保藏于中国典型培养物保藏中心(cctcc),地址:中国武汉,武汉大学,邮编430072,保藏编号cctcc no:m2018456,保藏日期2018年7月6日。
[0079]
首先,制备电转感受态,通过热激法转化市售pkd46质粒至m11-a3菌株感受态,含有100μg/ml氨苄青霉素的lb抗性平板中筛选培养后,挑取单菌落于5ml的lb液体培养基中,30℃,200rpm,培养8h;以1%的接种量转接到50ml含的lb液体培养基中培养至od600约为0.15,加入1ml 2mm的l-阿拉伯糖溶液,继续培养至od600为0.4~0.5;随即转入50ml离心管中冰浴20min,使其停止生长;4℃,4000rpm,离心10min,收集菌体;再用40ml预冷的无菌水洗涤菌体,离心收集细胞;重复上述步骤;用20ml预冷的10%甘油洗涤菌体,离心收集细胞;最后用500μl预冷的10%甘油重悬菌体,将得到的m11-a3/pkd46感受态进行分装备用。
[0080]
以实施例3构建得到的16个质粒(如下表2所示)作为模板,使用引物对upp-uf/
upp-r分别扩增获得可用于染色体上同源重组的片段,并进行切胶回收。每个片段分别转入受体菌m11a3/pkd46菌株中。涂布在含有10μg/ml四环素的lb抗性平板中进行筛选。针对每个质粒转化挑取3个单菌落至添加有氨苄青霉素的600μl lb培养基中,37℃培养8h后,取1μl菌体作为模板进行pcr验证筛选出正确的重组菌株,并甘油保种。
[0081]
将甘油保种的16株菌株接种至含有0.1ug/ml 5-fu(5-氟尿嘧啶)的lb液体培养基中,37℃,200rpm,培养8h;取菌液分别划线至含有和不含有5-氟尿嘧啶的lb培养基平板,过夜培养。平板分析显示在含有5-氟尿嘧啶的平板上不能生长的菌株,从对应的不含5-氟尿嘧啶的平板上随机选取6个单克隆,取1μl菌体作为模板再次进行pcr验证,如果p1p2-teta和pupp-upp片段已同时被移除,表明获得正确的重组株,将正确的重组株进行甘油保种。
[0082]
上述重组株各选取3个转化子,与和出发株m11a3一同分别涂布不含抗生素的种子培养基(含有4wt%葡萄糖,0.1wt%kh2po4,0.1wt%mgso4,1.6wt%(nh4)2so4,0.001wt%feso4,0.001wt%mnso4,0.2%酵母提取物),于37℃培养过夜。然后,分别各挑取3个单克隆,利用5ml种子培养基(含有4wt%葡萄糖,0.1wt%kh2po4,0.1wt%mgso4,1.6wt%(nh4)2so4,0.001wt%feso4,0.001wt%mnso4,0.2wt%酵母提取物)进行培养,37℃、225rpm过夜。然后将每个菌株再分别转接至50ml新鲜的发酵培养基(30g/l葡萄糖,0.7wt%ca(hco3)2,0.1wt%kh2po4,0.1wt%mgso4,1.6wt%(nh4)2so4,0.001wt%feso4,0.001wt%mnso4,0.2%酵母提取物的培养基)于37℃、170rpm继续培养48h,利用核磁检测并计算各培养基中的1,5-戊二胺的含量(表2)。
[0083]
表2核磁检测重组株与出发菌株相比的1,5-戊二胺产量及od600
[0084][0085]
从表2可以看出,使用稳定期特异性启动子直接表达cada的重组菌株pcsie-cada/m11a3,pbola-cada/m11a3,posmy-cada/m11a3,pkate-cada/m11a3,p21-cada/m11a3,p22-cada/m11a3,p23-cada/m11a3,p24-cada/m11a3,发酵48h后,检测到0.88~2.23g/kg的l-赖氨酸和1.14~2.12g/kg的1,5-戊二胺,说明赖氨酸脱羧酶表达量偏少,仅将部分l-赖氨酸转化为1,5-戊二胺。
[0086]
相比之下,使用串联启动子表达cada的重组菌株piclr-pcsie-cada/m11a3,piclr-pbola-cada/m11a3,piclr-posmy-cada/m11a3,piclr-pkate-cada/m11a3,piclr-p21-cada/m11a3,piclr-p22-cada/m11a3,piclr-p23-cada/m11a3,piclr-p24-cada/m11a3,通过测试发现在发酵48h的时候,使用了串联启动子表达cada的各重组菌株与使用稳定期特异性启动子直接表达cada的8个重组菌株相比,生成的1,5-戊二胺的产量有进一步的提高,同时l-赖氨酸近乎全部转化为1,5-戊二胺,其中piclr-p24-cada/m11a3菌株的1,5戊二胺产量最高,最后积累了2.93g/kg以上的1,5-戊二胺,且几乎没有l-赖氨酸残留。
[0087]
实施例5构建pbu-piclr-p24-plac-rpos、pbu-piclr-p24-cada-plac-crp、pbu-piclr-p24-cada-plac-puur、pbu-piclr-p24-plac-pepa、pbu-piclr-p24-cada-plac-soxs
质粒
[0088]
以市售大肠杆菌k12 mg1655的基因组为模板,引物对rpos-f(序列如seq id no:49所示)和rpos-r(序列如seq id no:50所示)扩增出rpos基因(序列如seq id no:11所示),引物对crp-f(序列如seq id no:51所示)和crp-r(序列如seq id no:52所示)扩增出crp基因(序列如seq id no:12所示)。引物对puur-f(序列如seq id no:53所示)和puur-r(序列如seq id no:54所示)扩增出puur基因(序列如seq id no:13所示)。引物对pepa-f(序列如seq id no:55所示)和pepa-r(序列如seq id no:56所示)扩增出pepa基因(序列如seq id no:14所示)。引物对soxs-f(序列如seq id no:57所示)和soxs-r(序列如seq id no:58所示)扩增出soxs基因(序列如seq id no:15所示)。以市售puc18质粒dna为模板,引物对plac-f(序列如seq id no:59示)和plac-r(序列如seq id no:60所示)扩增出plac启动子(seq id no:61);
[0089]
将plac启动子片段、rpos基因片段和xbai单酶切后的pbu-piclr-p24-cada和pbu-p24-cada质粒进行切胶回收纯化,使用多片段一步法克隆试剂盒将基因片段和载体进行重组连接,产生的质粒名为pbu-piclr-p24-cada-plac-rpos和pbu-p24-cada-plac-rpos。
[0090]
将plac启动子片段、crp基因片段和xbai单酶切后的pbu-piclr-p24-cada和pbu-p24-cada质粒进行切胶回收纯化,使用多片段一步法克隆试剂盒将基因片段和载体进行重组连接,产生的质粒名为pbu-piclr-p24-cada-plac-crp和pbu-p24-cada-plac-crp。
[0091]
将plac启动子片段、puur基因片段和xbai单酶切后的pbu-piclr-p24-cada和pbu-p24-cada质粒进行切胶回收纯化,使用多片段一步法克隆试剂盒将基因片段和载体进行重组连接,产生的质粒名为pbu-piclr-p24-cada-plac-puur和pbu-p24-cada-plac-puur。
[0092]
将plac启动子片段、pepa基因片段和xbai单酶切后的pbu-piclr-p24-cada和pbu-p24-cada质粒进行切胶回收纯化,使用多片段一步法克隆试剂盒将基因片段和载体进行重组连接,产生的质粒名为pbu-piclr-p24-cada-plac-pepa和pbu-p24-cada-plac-pepa。
[0093]
将plac启动子片段、soxs基因片段和xbai单酶切后的pbu-piclr-p24-cada和pbu-p24-cada质粒进行切胶回收纯化,使用多片段一步法克隆试剂盒将基因片段和载体进行重组连接,产生的质粒名为pbu-piclr-p24-cada-plac-soxs和pbu-p24-cada-plac-soxs。
[0094]
实施例6构建1,5-戊二胺生产菌株
[0095]
以实施例5构建得到的5对质粒作为模板,使用引物对upp-uf/upp-r分别扩增获得可用于染色体上同源重组的片段,并进行切胶回收。每个片段分别转入受体菌m11-a3/pkd46菌株中。涂布在含有10μg/ml四环素的lb抗性平板中进行筛选。挑取12个单菌落至添加有氨苄青霉素的600μl lb培养基中,37℃培养8h后,取1μl菌体作为模板进行pcr验证筛选正确的重组株,并甘油保种。
[0096]
将甘油保种的菌株接种至含有0.1ug/ml 5-fu(5-氟尿嘧啶)的lb液体培养基中,37℃,200rpm,培养8h;取菌液分别划线至含有和不含有5-氟尿嘧啶的lb培养基平板,过夜培养。平板分析显示在含有5-氟尿嘧啶的平板上不能生长的菌株,从对应的不含5-氟尿嘧啶的平板上选取6个单克隆,取1μl菌体作为模板再次进行pcr验证,如果p1p2-teta和pupp-upp片段已同时被移除,表明获得正确的重组株,将正确的重组株进行甘油保种。
[0097]
实施例7检测菌株1,5-戊二胺产量
[0098]
自实施例6中获得的重组株各选取3个转化子,出发株m11a3、piclr-p24
‑‑
cada/
m11a3和p24-cada/m11a3作为对照菌株,分别涂布不含抗生素的种子培养基(含有4wt%葡萄糖,0.1wt%kh2po4,0.1wt%mgso4,1.6wt%(nh4)2so4,0.001wt%feso4,0.001wt%mnso4,0.2%酵母提取物),于37℃培养过夜。然后分别各挑取3个单克隆,利用5ml种子培养基(含有4wt%葡萄糖,0.1wt%kh2po4,0.1wt%mgso4,1.6wt%(nh4)2so4,0.001wt%feso4,0.001wt%mnso4,0.2wt%酵母提取物)进行培养,37℃、225rpm过夜。然后将每个菌株再分别转接至50ml新鲜的发酵培养基(30g/l葡萄糖,0.7%ca(hco3)2,0.1%kh2po4,0.1%mgso4,1.6%(nh4)2so
4,
0.001%feso4,0.001%mnso4,0.2%酵母提取物的培养基,此外一组摇瓶添加30g/kg的戊二胺)中于37℃、170rpm继续培养48h,取样测定添加或不添加戊二胺条件下每个菌株的od600。未添加戊二胺的一组样品,利用核磁检测并计算各培养基中的戊二胺的含量(结果参见表3)。
[0099]
如表3所示,添加戊二胺的摇瓶,稀释20倍后测定菌株的od600,与m11-a3,pcilr-p24-cada/m11a3,p24-cada/m11a3重组菌株相比,表达增加细胞压力耐受能力的基因rpos,crp,puur,pepa以及soxs的10个新菌株,od600受影响显著减少(即菌株od600下降少),其中picr-p24-cada-plac-rpos/m11a3菌株od600最高,说明其耐受戊二胺的能力最强。
[0100]
如表4所示,表达促进1,5-戊二胺排出蛋白的菌株piclr-p24-cada-plac-rpos/m11a3,piclr-p24-cada-plac-crp/m11a3,piclr-p24-cada-plac-puur/m11a3,piclr-p24-cada-plac-pepa/m11a3,piclr-p24-cada-plac-soxs/m11a3与piclr-p24-cada/m11a3重组菌株相比,生成的1,5-戊二胺的产量有进一步的提高,同时l-赖氨酸近乎全部转化为1,5-戊二胺,其中piclr-p24-cada-plac-rpos/m11a3菌株1,5戊二胺产量最高,最后积累了3.68g/kg以上的1,5-戊二胺,且几乎没有l-赖氨酸残留。
[0101]
表3添加及未添加戊二胺条件下测定菌株的od600
[0102]
菌株od600-未添加戊二胺od600-添加戊二胺m11a30.826
±
0.0070.521
±
0.008piclr-cada/m11a30.842
±
0.0050.507
±
0.003piclr-p24-cada/m11a30.863
±
0.0030.516
±
0.004p24-cada/m11a30.856
±
0.0140.497
±
0.001piclr-p24-cada-plac-rpos/m11a30.889
±
0.0040.794
±
0.007p24-cada-plac-rpos/m11a30.878
±
0.0020.743
±
0.006piclr-p24-cada-plac-crp/m11a30.841
±
0.0040.693
±
0.003p24-cada-plac-crp/m11a30.854
±
0.0090.634
±
0.005piclr-p24-cada-plac-puur/m11a30.839
±
0.0050.675
±
0.005p24-cada-plac-puur11a30.849
±
0.0060.615
±
0.006piclr-p24-cada-plac-pepa/m11a30.875
±
0.0090.733
±
0.008p24-cada-plac-pepa/m11a30.859
±
0.0030.671
±
0.003piclr-p24-cada-plac-soxs/m11a30.847
±
0.0020.690
±
0.007p24-cada-plac-soxs/m11a30.818
±
0.0040.686
±
0.006
[0103]
表4核磁检测重组株与出发菌株相比的戊二胺产量
[0104][0105][0106]
实施例8构建pbu-piclr-p24-plac-rpos-plac-ompa、pbu-piclr-p24-cada-plac-rpos-plac-ompc、pbu-piclr-p24-cada-plac-rpos-plac-ompf、pbu-piclr-p24-plac-rpos-plac-ompw、pbu-piclr-p24-cada-plac-rpos-plac-ompx质粒
[0107]
以市售大肠杆菌k12 mg1655的基因组为模板,引物对ompa-f(序列如seq id no:73所示)和ompa-r(序列如seq id no:74所示)扩增出ompa基因(序列如seq id no:62所示),引物对ompc-f(序列如seq id no:75所示)和ompc-r(序列如seq id no:76所示)扩增出ompc基因(序列如seq id no:63所示)。引物对ompf-f(序列如seq id no:77所示)和ompf-r(序列如seq id no:78所示)扩增出ompf基因(序列如seq id no:64所示)。引物对ompw-f(序列如seq id no:79所示)和ompw-r(序列如seq id no:80所示)扩增出ompw基因(序列如seq id no:65所示)。引物对ompx-f(序列如seq id no:81所示)和ompx-r(序列如seq id no:82所示)扩增出ompx基因(序列如seq id no:66)所示。以市售puc18质粒dna为模板,引物对plac-f2(序列如seq id no:72)和plac-r(序列如seq id no:59所示)扩增出
plac-ompa/m11a3,piclr-p24-cada-plac-rpos-plac-ompc/m11a3,piclr-p24-cada-plac-rpos-plac-ompf/m11a3,piclr-p24-cada-plac-rpos-plac-ompw/m11a3,piclr-p24-cada-plac-rpos-plac-ompx/m11a3与piclr-p24-cada-plac-rpos/m11a3重组菌株相比,生成的1,5-戊二胺的产量有进一步的提高,同时l-赖氨酸近乎全部转化为1,5-戊二胺,其中piclr-p24-cada-plac-rpos-plac-ompa/m11a3菌株1,5戊二胺产量最高,最后积累了4.18g/kg以上的1,5-戊二胺,且几乎没有l-赖氨酸残留。
[0118]
表5核磁检测重组株与出发菌株相比的戊二胺产量
[0119][0120]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1