一种基于数字微流控系统的酵母表面展示方法与流程
1.本发明属于生物医学检测分析领域,具体涉及一种基于数字微流控系统的酵母表面展示方法。
背景技术:
2.酵母表面展示是一种蛋白真核表面展示技术。首先,把外源基因连接在特定的表面展示载体上,转化酵母细胞,诱导外源目的蛋白表达。表达的融合目的蛋白,通过与酵母细胞壁上的特定蛋白相互作用,固定在酵母细胞壁上,从而达到将外源蛋白分子展示在酵母细胞表面的目的。酵母展示技术目前可应用到多个方面,为蛋白进化,抗体筛选,抗体亲和力等方面提供了新的解决方法。
3.传统酵母展示技术,需要构建蛋白展示文库,通过对酵母进行诱导,将蛋白展示在酵母表面后。再通过macs系统或磁珠法对酵母进行富集-扩增-富集的循环,通过若干次循环后,将目的酵母进行一定程度上的富集。随后再通过流式细胞仪对酵母细胞进行荧光分选,选出阳性克隆后进行培养。随后再对阳性克隆进行铺板,选择单克隆进行测序和检测。但是传统的酵母展示技术,由于其流程复杂,人工操作量大,及碍于酵母生长速度较慢,整体的实验周期较长,从而阻碍了对展示蛋白的筛选速率。
4.微流控芯片利用结构各异的微通道和形式多样的外加力场,对微量流体或样品在微观尺度上进行操纵、处理与控制,从而实现了传统实验室的部分乃至全部功能在一块微芯片上的集成。相比于传统方法,其具有成本低、分析速度快、试剂消耗少等优势,代表着未来生物、化学分析走向微型化的发展方向。然而,常规微流控芯片的局限性也是非常明显的,其需要机械泵、阀配合使用,集成化难度大,难以实现样品的连续多步处理;同时不易实现对多试剂位置和反应时间的精确控制:并且较难满足多个反应体系或者多种反应条件并行进行的高通量检测分析的应用需求。
5.数字微流控技术(digital microfluidics,dmf)作为一种新兴的离散化微液滴操纵手段,则有望改变这一现状。其工作原理是利用介电湿润原理来进行液滴的操控。加在电极上的电势会改变电极的固、液表面张力,利用液滴与电极之间的接触角的不对称产生切向推力,以此来驱动液滴的移动,实现对液滴的精准操控。液滴作为数字微流控芯片中的独立单元,每个液滴都可以独立地参与不同的微反应,提高反应的通量。
6.相比于传统的实验处理技术,既拥有传统微流控技术样品消耗量少、高并行性的能力,同时,又不依赖微泵、微阀或微混合器等元件,不需要加工复杂的三维流体通道,具有可动态配置的优点。更为重要的是,数字微流控芯片可以实现由宏观大体积试剂到精确可控体积微纳液滴的生成,对精确控制反应条件、保证结果的精确有效性非常有利;而且,液滴的运输路径可以通过计算机程序进行逻辑控制,易于实现自动化,能够实现多通路实时可控反应,对于实现样品制备、反应、分离、检测等生化实验基本操作的完全集成化具有重要的意义。
7.基于此,本发明提供一种基于数字微流控系统的酵母表面展示方法,可以在数字
微流控芯片上实现高通量酵母表面展示。
技术实现要素:
8.本发明目的在于提供一种基于数字微流控系统的酵母表面展示方法,解决的技术问题是现有的酵母表面展示系统步骤繁琐、筛选周期长的不足。
9.本发明的目的是通过以下技术方案来实现的:
10.一种基于数字微流控系统的酵母表面展示方法,包括以下步骤:
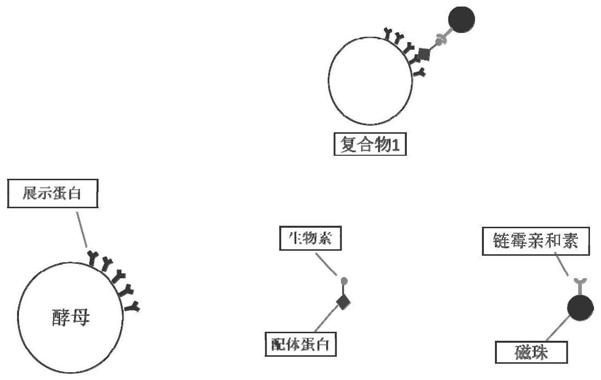
11.(1)构建特定免疫原的酵母展示文库,将酵母展示文库中的酵母菌株与生物素化后的配体蛋白、链酶亲和素磁珠进行孵育,得到含有文库酵母-生物素化蛋白-磁珠三者复合物的酵母文库液体;
12.(2)将步骤(1)中含有复合物的液体注入到数字微流控系统的芯片中,在电压下,通过电极将液体分成适当体积大小的液滴;启动数字微流控平台的磁吸附模块,通过磁吸附模块与复合物中磁珠之间的磁吸附作用,将含有复合物的液滴进行固定,在电极作用下,移除不含有复合物的液滴,对复合物进行润洗,得到含复合物的液滴;
13.(3)通过荧光物标记抗体对经过步骤(2)处理后的含复合物的液滴进行抗原定位,再分液处理得到微液滴,通过荧光检测系统筛选出含有有效阳性细胞的微液滴,加入培养基进行培养,即完成酵母表面展示。
14.本发明基于数字微流控系统的酵母表面蛋白展示方法,通过将磁吸附模块整合到数字微流控芯片系统中,将酵母文库菌与磁珠进行结合形成复合物,再通过磁吸附系统与磁珠之间磁吸附作用,实现对酵母细胞的富集,然后通过数字微流控芯片对液滴进行控制和撕裂,生成并分选出含有酵母细胞的微液滴,再通过荧光检测系统,选出阳性细胞,完成对酵母的表面展示。
15.本发明中,步骤(2)中电压为10-300v。
16.进一步地,所述磁吸附模块的高斯值在1000-6000范围。
17.本发明的一些实施方案中,通过荧光物标记抗体对经过步骤(2)处理后的含复合物的液滴进行抗原定位采用间接荧光物标记抗体,具体过程如下:在电极作用下,将一抗移动到复合物液滴中,解除磁吸附作用,重悬后,使一抗和酵母表面展示蛋白进行结合;开启数字微流控平台的磁吸附模块,通过磁吸附模块与磁珠之间的磁吸附作用,将含磁珠的复合物进行固定,在电极作用下,移动去除多余的一抗溶液;润洗复合物后,通过电极将荧光二抗移动到复合物液滴中,使荧光二抗与一抗结合;开启数字微流控平台的磁吸附模块,通过磁吸附模块与磁珠之间的磁吸附作用,将含磁珠的复合物进行固定,在电极作用下,移动去除多余的荧光二抗溶液,进行润洗。
18.本发明的一些实施方案中,通过荧光物标记抗体对经过步骤(2)处理后的含复合物的液滴进行抗原定位采用直接荧光物标记抗体,具体过程如下:在电极作用下,将荧光物标记抗体移动到含有复合物的液滴中,解除磁吸附作用,进行孵育,使荧光物标记抗体和酵母表面展示蛋白进行结合。
19.本发明可以做以下改进,在采用直接荧光物标记抗体对复合物的液滴进行抗原定位之前,对复合物液滴进行磁珠洗脱处理,具体过程如下:在电极作用下,将洗脱液移动到含复合物的液滴处,解除磁吸附作用,重悬,使抗体和配体蛋白分离。随后加入中和液对洗
脱液进行中和处理。
20.进一步地,所述洗脱液为酸性溶液,在重悬后加入的中和液为碱性溶液,调ph至7.0-7.4。
21.进一步地,酸性溶液ph为2-3,洗脱时间为10min以内;碱液为tris缓冲液。
22.本发明中,润洗采用pbs缓冲液。
23.本发明中,分液处理采用微量分液技术进行。
24.本发明中,通过荧光光学系统筛选出含有有效阳性细胞的微液滴的具体过程如下:通过荧光光学系统对微液滴进行判断,若微液滴中出现荧光,则判断荧光细胞数量,若细胞数量大于一个,则回流到原有大液滴中重新等待分液,若细胞数量为一个,则判断为有效阳性细胞微液滴。
25.本发明中,培养基组成是ypd培养基。
26.与现有技术相比,本发明具有以下有益效果:
27.(1)本发明基于数字微流控系统的酵母表面展示方法,通过将磁吸附模块整合到数字微流控芯片系统中,将酵母文库菌与磁珠进行结合形成复合物,再通过磁吸附系统与磁珠之间磁吸附作用,实现对酵母细胞的富集,然后通过荧光物标记抗体标记和荧光检测完成酵母表面展示。
28.(2)本发明基于数字微流控系统的酵母表面展示方法,将酵母表面展示的富集和筛选过程集成到数字微流控芯片上,无需使用流式细胞仪,很大程度上节约了仪器的购买和人员的培训等成本;整个流程高度集成,自动化程度高,操作相对简单。
29.(3)本发明方法其操作周期大大缩短,提高了整体的时间效率,相比传统酵母表面展示技术20天左右的实验周期,可缩短至3-4天内完成。
附图说明
30.图1为本发明中文库酵母-生物素化蛋白-链酶亲和素磁珠三者复合物的结构示意图;
31.图2为本发明芯片区域设计示意图;
32.图3为本发明阳性酵母细胞富集过程中移动复合物液滴的过程示意图;
33.图4为本发明阳性酵母细胞富集过程中复合物液体与磁吸附模块作用被固定的过程示意图;
34.图5为本发明阳性酵母细胞富集过程中移除未被磁吸附模块固定的液体过程示意图;
35.图6、图7、图8为本发明阳性酵母细胞富集过程中移动pbs溶液对复合物进行润洗的过程示意图;
36.图9、图10为实施例1标签一抗和复合物反应的过程示意图;
37.图11为实施例1去除多余标签一抗的过程示意图;
38.图12、图13为实施例1移动pbs溶液对一抗复合物进行润洗的过程示意图;
39.图14、图15为实施例1荧光显色二抗和标签一抗复合物反应的过程示意图;
40.图16为实施例1去除多余荧光显色二抗的过程示意图;
41.图17、图18、图19为实施例1移动pbs溶液对荧光显色复合物进行润洗的过程示意
图;
42.图20为实施例1对荧光标记细胞进行重悬的过程示意图;
43.图21为实施例1对荧光标记细胞进行分选的过程示意图;
44.图22为实施例2对复合物进行酸洗脱的过程示意图;
45.图23、图24、图25、图26为实施例2中和酸洗脱液滴的过程示意图;
46.图27、图28为实施例2对洗脱后液滴进行有效细胞分离的过程示意图;
47.图29为实施例2移动荧光标记抗体液滴的过程示意图;
48.图30为实施例2对微液滴进行荧光标记的过程示意图;
49.图31、图32为实施例2对荧光标记细胞进行微滴筛选的过程示意图;
50.图33为本发明数字微流控系统装置的截面图。
51.附图中标记如下:1、酵母文库液体;2、阳性酵母复合物;3、阴性酵母;4、pbs;5、标签一抗;6、荧光二抗;7、盐酸;8、tris缓冲液;9、荧光标记抗体;10、磁吸附模块;11、磁珠;12、阳性显色酵母;13、微液滴;a、文库及反应液储存区;b、文库富集反应区;c、荧光细胞分液及检测区。
具体实施方式
52.以下结合具体的实施例对本发明作进一步的说明,以便本领域技术人员更好理解和实施本发明的技术方案。
53.实施例1
54.图1-21所示基于数字微流控系统的酵母表面展示方法,包括以下步骤:
55.(1)通过ifn-γ免疫兔子,获得免疫后的血清、骨髓和脾脏,提取rna并反转录,通过特定的引物扩增得到抗体库序列,构建酵母展示文库。将酵母展示文库中的酵母菌株与生物素化后的ifn-γ蛋白、链酶亲和素磁珠11进行孵育,得到含有文库酵母-生物素化蛋白-磁珠11三者复合物的酵母文库液体1,能被对应蛋白识别的细胞均可形成阳性酵母复合物2,其余不能被对应蛋白识别的阴性酵母3细胞,则继续保持游离状态。
56.(2)将步骤(1)中的液体注入到如图33所示数字微流控系统的芯片中,芯片包括文库及反应液储存区a,文库富集反应区b和荧光细胞分液及检测区c,在35v的电压下,开启电极,在电极作用下,对芯片中的液体进行控制,将含有复合物的液体分成适当体积大小的液滴;开启数字微流控平台的磁吸附模块10,磁吸附模块的高斯值在3000-4000范围。通过数字微流控平台内磁吸附模块10与阳性酵母复合物2中磁珠11之间的磁吸附作用,含有阳性酵母复合物2的液滴将被固定,开启电极,在电极作用下,不含有阳性酵母复合物2的液滴无法与磁珠11发生作用,不能被固定,从而区分出含有阳性酵母复合物2的液滴,将未被磁吸附模块10固定的液体移除。
57.(3)在电极作用下,将冷冻的pbs4润洗缓冲液,移动到含有阳性酵母复合物2的液滴处,解除磁吸附作用使细胞重悬,静置1min后,启动磁吸附模块10,移除润洗pbs 4缓冲液,重复1次,去除残余不结合磁珠11的阴性酵母3细胞。
58.(4)通过电极将chicken-anti-c-myc(1:100)和mouse-anti-ha(1:100)混合标签一抗5移动到阳性酵母复合物2液滴中,重悬复合物后,室温静置反应20min,使标签一抗5和酵母表面展示蛋白带有的标签进行结合。开启数字微流控平台的磁吸附模块10,通过磁吸
附模块10与磁珠11之间的磁吸附作用,将含磁珠11的复合物进行固定,在电极作用下,移动去除多余的标签一抗5溶液。
59.(5)在电极作用下,将冷冻的pbs4润洗缓冲液,移动到含有复合物的液滴处,解除磁吸附作用使细胞重悬,静置1min后,启动磁吸附模块10,移除润洗pbs 4缓冲液,重复1次,去除残余的标签一抗5。
60.(6)通过电极将goat anti-chicken alexa fluor 647(1:100)和goat anti-mouse alexa fluor488(1:100)混合荧光二抗6移动到阳性酵母复合物2液滴中,重悬复合物后,4℃静置反应20min,使荧光二抗6和标签一抗5进行结合。开启数字微流控平台的磁吸附模块10,通过磁吸附模块10与磁珠11之间的磁吸附作用,将含磁珠11的复合物进行固定,在电极作用下,移动去除多余的荧光二抗6溶液。
61.(7)在电极作用下,将冷冻的pbs4润洗缓冲液,移动到含有复合物的液滴处,解除磁吸附作用使细胞重悬,静置1min后,启动磁吸附模块10,移除润洗pbs 4缓冲液,重复1次,去除残余的荧光二抗6。
62.(8)开启电极,将孵育后的液滴移动到分液区,利用微量分液技术对液滴进行分液处理,得到微液滴13,通过荧光光学系统对微液滴13进行判断,若微液滴13中出现荧光,则判断荧光细胞数量,若阳性显色酵母12细胞数量大于一个,则回流到原有大液滴中重新等待分液,若阳性显色酵母12细胞数量为一个,则判断为含有有效阳性细胞的微液滴13,筛选出来转移到培养区中;若微液滴13中没有检测到荧光,则将液滴移动到废液区,转移到芯片外。转移到培养区的微液滴13,加入2
×
ypd培养基,30℃培养8h扩增酵母细胞,再移出到芯片外,即完成对表面展示酵母的筛选。
63.实施例2
64.一种基于数字微流控系统的酵母表面展示方法,包括以下步骤:
65.(1)通过ifn-γ免疫兔子,获得免疫后的血清、骨髓和脾脏,提取rna并反转录,通过特定的引物扩增得到抗体库序列,构建酵母展示文库。将酵母展示文库中的酵母菌株与生物素化后的ifn-γ蛋白、链酶亲和素磁珠11进行孵育,得到含有文库酵母-生物素化蛋白-磁珠11三者复合物的酵母文库液体1,能被对应蛋白识别的细胞均可形成阳性酵母复合物2,其余不能被对应蛋白识别的阴性酵母3细胞,则继续保持游离状态;
66.(2)将步骤(1)中的液体注入到数字微流控系统的芯片中,在45v的电压下,开启电极,在电极作用下,对芯片中的液体进行控制,将含有复合物的液体分成适当体积大小的液滴;开启数字微流控平台的磁吸附模块10,磁吸附模块的高斯值在3000-4000范围。通过数字微流控平台内磁吸附模块10与阳性酵母复合物2中磁珠11之间的磁吸附作用,含有阳性酵母复合物2的液滴将被固定,开启电极,在电极作用下,不含有阳性酵母复合物2的液滴无法与磁珠11发生作用,不能被固定,从而区分出含有阳性酵母复合物2的液滴,将未被磁吸附模块10固定的液体移除;
67.(3)开启电极,在电极作用下,将pbs 4润洗缓冲液移动到含有阳性酵母复合物2的液滴中,对复合物进行润洗,然后移除pbs 4溶液,重复1次;解除磁吸附作用,在电极作用下,将洗脱液100mm盐酸7(ph为2-3),移动到含有复合物的液滴处,解除磁吸附作用使细胞重悬,静置5min以解除磁珠11和展示酵母复合物的结合(通过加入酸性溶液切断阳性酵母复合物2中,抗体和配体蛋白的链接),马上在电极作用下,移动1m tris缓冲液8中和液滴至
ph 7.4左右。
68.(4)开启数字微流控平台的磁吸附模块10,通过磁吸附模块10将酸洗脱的磁珠11进行固定,在电极作用下,移动去除磁珠11后的复合物液滴,使液滴和磁珠11分离,保留液滴,去除磁珠11成分。
69.(5)将荧光标记抗体9含有6x-his tag fitc单克隆抗体的液滴移动到去除磁珠11后的液滴,使细胞在两者混合液中重悬,然后将重悬液移动到待孵育区域进行孵育30min。开启电极,将孵育后的液滴移动到分液区,利用微量分液技术对液滴进行分液处理,得到微液滴13,通过荧光光学系统对微液滴13进行判断,若微液滴13中出现荧光,则判断荧光细胞数量,若阳性显色酵母12细胞数量大于一个,则回流到原有大液滴中重新等待分液,若阳性显色酵母12细胞数量为一个,则判断为含有有效阳性细胞的微液滴13,筛选出来转移到培养区中;若微液滴13中没有检测到荧光,则将液滴移动到废液区,转移到芯片外。转移到培养区的微液滴13,加入2
×
ypd培养基,30℃培养8h扩增酵母细胞,再移出到芯片外,即完成对表面展示酵母的筛选。
70.以上实施实例对本发明不同的实施过程进行了详细的阐述,但是本发明的实施方式并不仅限于此,所属技术领域的普通技术人员依据本发明中公开的内容,均可实现本发明的目的,任何基于本发明构思基础上做出的改进和变形均落入本发明的保护范围之内,具体保护范围以权利要求书记载的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1