细胞的制作方法
细胞
1.本技术是基于申请日为2015年12月23日,优先权日为2014年12月24日, 申请号为201580065695.4,发明名称为:“细胞”的专利申请的分案申请。
发明领域
2.本发明涉及细胞,其包含多于一个嵌合抗原受体(car)。
3.发明背景
4.已经描述了一些免疫治疗试剂用于癌症治疗,包括治疗性单克隆抗体 (mab),免疫缀合的mab,放射缀合的mab和双特异性t细胞衔接器 (engager)。
5.通常,这些免疫治疗试剂靶向单个抗原:例如,利妥昔单抗(rituximab) 靶向cd20;myelotarg靶向cd33;而阿仑单抗(alemtuzumab)靶向cd52。
6.人cd19抗原是属于免疫球蛋白超家族的95kd跨膜糖蛋白。cd19在b细 胞分化中非常早期表达,并仅在末端b细胞分化为浆细胞时丢失。因此,cd19 在除多发性骨髓瘤外的所有b细胞恶性肿瘤上表达。由于正常b细胞区室 (compartment)的缺失是可接受的毒性,cd19是有吸引力的car靶标,且 使用car靶向cd19的临床研究已经看到了有希望的结果。
7.肿瘤学领域中的一个具体问题为题由goldie-coldman假说提供:其描述 了仅仅靶向单个抗原可以导致通过所述抗原的调整的肿瘤逃逸,其是由于大 多数癌症中的固有的高突变率。该抗原的表达调整可以降低已知免疫疗法的 效力,包括靶向cd19的那些。
8.因此,伴随靶向cd19的免疫疗法的问题是b细胞恶性肿瘤可以突变并变 成cd19阴性。这可以导致对cd19靶向疗法不响应的cd19阴性癌症的复发。 例如,在一项儿科研究中,grupp等人报道了在用于b型急性淋巴细胞白血病 的cd19靶向嵌合抗原受体疗法后,全部复发的一半是由于cd19阴性疾病 (56
th american society of hematology annual meeting and exposition)。
9.因此,对于能够靶向多于一种细胞表面结构,以反映与多种癌症(包括cd19阳性癌症)相关的标志物表达的复杂模式的免疫治疗试剂存在需要。
10.嵌合抗原受体(car)
11.嵌合抗原受体是将例如单克隆抗体(mab)的特异性移植到t细胞的效 应子功能的蛋白。它们的通常形式是i型跨膜结构域蛋白,具有抗原识别氨 基末端,间隔区,跨膜结构域,全部连接至复合胞内域,其传输t细胞存活 和活化信号(参见图1a)。
12.这些分子最常见的形式是来源于识别靶抗原的单克隆抗体的单链可变 片段(scfv),经由间隔区和跨膜结构域融合至信号传导胞内域的融合。响 应scfv对其靶标的识别,此类分子导致t细胞的活化。当t细胞表达此类car 时,它们识别并杀死表达该靶抗原的靶细胞。已经开发了几种针对肿瘤相关 抗原的car,且使用此类表达car的t细胞的过继转移方法目前已经在临床 研究中用于多种癌症的治疗。
13.已经观察到使用car方法用于癌症治疗,肿瘤异质性和免疫编辑能够导 致从car治疗逃逸。例如,在grupp等人描述的研究(2013;new eng.j.med368:1509-1518,paper no 380,ash 2014)中,car修饰的t细胞方法用于急 性b淋巴细胞白血病的治疗。在该临床试验
中,发现具有完全消退的10名患 者一个月后确实复发,且他们中的5名复发cd19阴性疾病。
14.因此,对于解决癌症逃逸和肿瘤异质性问题的替代car治疗方法存在需 要。
15.两种car结合特异性的表达
16.已经开发了称为串联car或tancar的双特异性car以试图同时靶向多 种癌症特异性标志物。在tancar中,细胞外结构域包含串联的,通过接头 连接的两种抗原结合特异性。因此,两种结合特异性(scfv)两者连接至单 个跨膜部分;一个scfv与膜并置,而另一个位于远端位置。
17.grada等人(2013,mol ther nucleic acids 2:e105)描述了tancar,其包 括cd19特异性scfv,随后是gly-ser接头然后是her2特异性scfv。her2-scfv 位于近膜位置,而cd19-scfv在远端位置。该tan car显示针对两种肿瘤限 制性抗原的每一种诱导不同的t细胞活性。选择该排列是因为her2(632 aa/)和cd19(280aa,)的长度使其本身适用于特定的空间排列。 还已知her2 scfv结合her2的最远端4个环。
18.该方法的问题是由于远端scfv的存在,特别是其结合至抗原,近膜scfv 可能无法接近。鉴于需要考虑到靶细胞上抗原的空间排列选择两种scfv的相 对位置,可能无法针对所有的scfv结合对使用该方法。此外,tancar方法不 太可能用于多于两种scfv,具有三个或更多个scfv的tancar将是非常大的 分子,且scfv可能相互折回,掩盖抗原结合位点。还存在疑问的是最远端的 scfv(其被两个或更多个其它scfv从跨膜结构域分开)的抗原结合将能够触 发t细胞活化。
19.因此,对于在细胞例如t细胞的表面上表达两种car结合特异性的替代 方法存在需要。
20.发明简述
21.本发明人已经开发了car t细胞,其在细胞表面表达两种car,一种对 于cd19特异性,且一种对于cd22特异性。
22.因此,本发明的第一个方面提供细胞,其在细胞表面共表达第一嵌合抗 原受体(car)和第二car,每个car包含抗原结合结构域,其中第一car 的抗原结合结构域结合cd19且第二car的抗原结合结构域结合cd22。
23.一个car结合cd19且另一个car结合cd22的事实是有利的,因为一些 淋巴瘤和白血病在cd19靶向后变成cd19阴性(或可能在cd22靶向后是 cd22阴性),因此当这种情况发生时,其给出了“后备”抗原。
24.该细胞可以是免疫效应细胞,例如t细胞或自然杀伤(nk)细胞。本文 提及的关于t细胞的特征等同适用于其他免疫效应细胞,例如nk细胞。
25.每个car可以包含:
26.(i)抗原结合结构域;
27.(ii)间隔区;和
28.(iii)跨膜结构域。
29.每个car可以包含:
30.(i)抗原结合结构域;
31.(ii)间隔区;
32.(iii)跨膜结构域;和
33.(iv)胞内域。
34.第一car的间隔区可以不同于第二car的间隔区,是的第一和第二car 不形成异二聚体。
35.第一car的间隔区可以具有不同于第二car的间隔区的长度和/或构 型,使得每个car对于识别其各自的靶抗原调整。
36.第二car的抗原结合结构域可以结合cd22上的膜远端抗原。第二car 的抗原结合结构域可以结合cd22的ig结构域1,2,3或4上的表位,例如cd22 的ig结构域3上的表位。
37.第一car的抗原结合结构域可以结合由外显子1,3或4编码的cd19上的 表位。
38.一个car的胞内域可以包含共刺激结构域和含有itam的结构域;且另 一个car的胞内域可以包含tnf受体家族结构域和含有itam的结构域。
39.例如,一个car(其可以是cd19或cd22特异性的)可以具有以下结构:
40.agb1-间隔区1-tm1-costim-itam
41.其中:
42.agb1是抗原结合结构域;
43.间隔区1是间隔区;
44.tm1是跨膜结构域;
45.costim是共刺激结构域;和
46.itam是含有itam的胞内域;
47.且另一个car(其可以是cd22或cd19特异性的)可以具有以下结构:
48.agb2-间隔区2-tm2-tnf-itam
49.其中:
50.agb2是抗原结合结构域;
51.间隔区2是间隔区;
52.tm2是跨膜结构域;
53.tnf是tnf受体胞内域;和
54.itam是含有itam的胞内域。
55.在第二个方面,本发明提供编码如本发明第一方面定义的第一和第二嵌 合抗原受体(car)两者的核酸序列。
56.该核酸序列可以具有以下结构:
57.agb1-间隔区1-tm1-coexpr-abb2-间隔区2-tm2
58.其中
59.agb1是编码第一car的抗原结合结构域的核酸序列;
60.间隔区1是编码第一car的间隔区的核酸序列;
61.tm1是编码第一car的跨膜结构域的核酸序列;
62.coexpr是使得能够共表达两个car的核酸序列;
63.agb2是编码第二car的抗原结合结构域的核酸序列;
64.间隔区2是编码第二car的间隔区的核酸序列;
65.tm2是编码第二car的跨膜结构域的核酸序列;
66.该核酸序列当在t细胞中表达时,编码在切割位点切割的多肽,使得第 一和第二
car在t细胞表面共表达。
67.该核酸序列可以具有以下结构:
68.agb1-间隔区1-tm1-endo1-coexpr-abb2-间隔区2-tm2-endo2
69.其中
70.agb1是编码第一car的抗原结合结构域的核酸序列;
71.间隔区1是编码第一car的间隔区的核酸序列;
72.tm1是编码第一car的跨膜结构域的核酸序列;
73.endo1是编码第一car的胞内域的核酸序列;
74.coexpr是使得能够共表达两个car的核酸序列;
75.agb2是编码第二car的抗原结合结构域的核酸序列;
76.间隔区2是编码第二car的间隔区的核酸序列;
77.tm2是编码第二car的跨膜结构域的核酸序列;
78.endo2是编码第二car的胞内域的核酸序列;
79.该核酸序列当在t细胞中表达时,编码在切割位点切割的多肽,使得第 一和第二car在t细胞表面共表达。
80.允许两种car的共表达的核酸序列可以编码自切割肽或序列,其允许共 表达两种car的替代方式,例如内部核糖体进入序列或2
nd
启动子或其它方 式,由此本领域技术人员可以从同一载体表达两种蛋白。
81.为了避免同源重组,在编码相同或相似氨基酸序列的序列区域中,例如 跨膜和/或细胞内t细胞信号传导结构域(胞内域),可以使用替代密码子。 例如,可以在编码间隔区,跨膜结构域和/或全部或部分胞内域的序列部分中 使用替代密码子,使得两种car对于这个或这些部分具有相同或相似的氨基 酸序列,但由不同的核酸序列编码。
82.在第三个方面,本发明提供试剂盒,其包含
83.(i)编码第一嵌合抗原受体(car)的第一核酸序列,该核酸序列具有 以下结构:
84.agb1-间隔区1-tm1
85.其中
86.agb1是编码第一car的抗原结合结构域的核酸序列;
87.间隔区1是编码第一car的间隔区的核酸序列;
88.tm1是编码第一car的跨膜结构域的核酸序列;
89.和
90.(ii)编码第二嵌合抗原受体的第二核酸序列,该核酸序列具有以下结构:
91.agb2-间隔区2-tm2
92.agb2是编码第二car的抗原结合结构域的核酸序列;
93.间隔区2是编码第二car的间隔区的核酸序列;和
94.tm2是编码第二car的跨膜结构域的核酸序列。
95.试剂盒可以包含
96.(i)编码第一嵌合抗原受体(car)的第一核酸序列,该核酸序列具有 以下结构:
97.agb1-间隔区1-tm1-endo1
98.其中
99.agb1是编码第一car的抗原结合结构域的核酸序列;
100.间隔区1是编码第一car的间隔区的核酸序列;
101.tm1是编码第一car的跨膜结构域的核酸序列;
102.endo1是编码第一car的胞内域的核酸序列;和
103.和
104.(ii)编码第二嵌合抗原受体(car)的第二核酸序列,该核酸序列具有 以下结构:
105.agb2-间隔区2-tm2-endo2
106.agb2是编码第二car的抗原结合结构域的核酸序列;
107.间隔区2是编码第二car的间隔区的核酸序列;
108.tm2是编码第二car的跨膜结构域的核酸序列;
109.endo2是编码第二car的胞内域的核酸序列。
110.在第四个方面,本发明提供试剂盒,其包含:包含第一核酸序列的第一 载体;和包含第二核酸序列的第二载体。
111.该载体可以是质粒载体,逆转录病毒载体或转座子载体。该载体可以是 慢病毒载体。
112.在第五个方面,本发明提供包括根据本发明的第二个方面的核酸序列的 载体。该载体可以是慢病毒载体。
113.该载体可以是质粒载体,逆转录病毒载体或转座子载体。
114.在本发明的第六个方面,提供用于制备根据本发明的第一个方面的细胞 的方法,其包括向t细胞中引入编码第一和第二car的一种或多种核酸序列; 或一种或多种载体,如上文所定义的。
115.该细胞可以来自从患者分离的样品,相关或不相关的造血移植供体,完 全无关联的供体,来自脐带血,从胚胎细胞系分化,从可诱导的祖细胞系分 化,或来源于转化的细胞系。
116.在第七个方面,本发明药物组合物,其包含多种根据本发明的第一个方 面的细胞。
117.在第八个方面,本发明提供用于治疗和/或预防疾病的方法,其包括向受 试者施用根据本发明的第七个方面的药物组合物的步骤。
118.该方法可以包括以下步骤:
119.(i)从受试者分离含细胞的样品;
120.(ii)使用一种或多种编码第一和第二car的核酸序列或包含此类核酸序 列的一种或多种载体转导或转染该细胞;和
121.(iii)将来自(ii)的细胞施用至受试者。
122.该疾病可以是癌症。该癌症可以是b细胞恶性肿瘤。
123.在第九个方面,本发明提供根据本发明的第七个方面的药物组合物,其 用于治疗和/或预防疾病。
124.在第十个方面,本发明提供根据本发明的第一个方面的细胞在制造用于 治疗和/或预防疾病的药物中的用途。
125.本发明还提供核酸序列,其包含:
126.a)编码第一嵌合抗原受体(car)的第一核苷酸序列;
127.b)编码第二car的第二核苷酸序列;
128.其中一个car结合cd19而另一个car结合cd22;和
129.c)编码自切割肽的序列,其定位于第一和第二核苷酸序列之间,使得两 个car表达为单独的实体。
130.在第一和第二核苷酸中的一个或多个部分,在编码相同或相似的氨基酸 序列的区域中可以使用替代密码子。
131.本发明还提供包含此类核酸的载体和细胞。
132.本发明还开发了具有改进的特性的新的抗cd19和抗cd22 car。
133.因此在第十一个方面,本发明提供包含cd19结合结构域的嵌合抗原受 体(car),其包含
134.a)具有互补决定区(cdr)的重链可变区(vh),所述互补决定区具有 以下序列:
135.cdr1
–
sywmn(seq id no.15);
136.cdr2
–
qiwpgdgdtnyngkfk(seq id no.16);
137.cdr3
–
retttvgryyyamdy(seq id no.17);和
138.b)具有cdr的轻链可变区(vl),所述cdr具有以下序列:
139.cdr1
–
kasqsvdydgdsyln(seq id no.18);
140.cdr2
–
dasnlvs(seq id no.19);
141.cdr3
–
qqstedpwt(seq id no.20)。
142.cd19结合结构域可以包含具有如seq id no.23或seq id no 24所示的 序列的vh结构域;或具有如seq id no.25,seq id no.26或seq id no.40 所示的序列的vl结构域,或具有至少90%序列同一性的其变体,其保留了结 合cd19的能力。
143.cd19结合结构域可以包含如seq id no.21,seq id no.22或seq idno.39所示的序列,或具有至少90%序列同一性的其变体,其保留了结合 cd19的能力。
144.在第十二个方面,本发明提供包含cd22结合结构域的嵌合抗原受体 (car),其包含
145.a)具有互补决定区(cdr)的重链可变区(vh),所述互补决定区具有 以下序列:
146.cdr1
–
nywin(seq id no.27);
147.cdr2
–
niypsdsftnynqkfkd(seq id no.28)
148.cdr3
–
dtqerswyfdv(seq id no.29);和
149.b)具有cdr的轻链可变区(vl),所述cdr具有以下序列:
150.cdr1
–
rssqslvhsngntylh(seq id no.30);
151.cdr2
–
kvsnrfs(seq id no.31)
152.cdr3
–
sqsthvpwt(seq id no.32)。
153.cd22结合结构域可以包含具有如seq id no.35或seq id no 36所示的 序列的vh结构域;或具有如seq id no.37或seq id no.38所示的序列的vl 结构域,或具有至少90%序列同一性的其变体,其保留了结合cd22的能力。
154.cd22结合结构域可以包含如seq id no.33或seq id no.34所示的序 列,或具有至少90%序列同一性的其变体,所述变体保留了结合cd22的能力。
155.在第十三个方面提供细胞,其在细胞表面表达根据本发明的第十一个方 面的嵌合抗原受体和根据本发明的第十二个方面的嵌合抗原受体。
156.在第十四个方面,提供编码根据本发明的第十一个方面的嵌合抗原受体 和根据本发明的第十二个方面的嵌合抗原受体的核酸序列。
157.在第十五个方面,本发明提供包含根据本发明的第十四个方面的核酸序 列的载体。该载体可以是慢病毒载体。
158.该载体可以是质粒载体,逆转录病毒载体或转座子载体。
159.在第十六个方面,本发明提供制备根据本发明的第十三个方面的细胞的 方法,其包括向细胞中引入如上文所述定义的一种或多种核酸序列;或一种 或多种载体的步骤。
160.该细胞可以是t细胞或者自然杀伤(nk)细胞。该细胞可以来自从患者 分离的样品,相关或不相关的造血移植供体,完全无关联的供体,来自脐带 血,从胚胎细胞系分化,从可诱导的祖细胞系分化,或来源于转化的细胞系。
161.在第十七个方面,本发明提供药物组合物,其包含多种根据本发明的第 十三个方面的细胞。
162.在第十八个方面,本发明提供用于治疗和/或预防疾病的方法,其包括向 受试者施用根据本发明的第十七个方面的药物组合物的步骤。
163.该方法可以包括以下步骤:
164.(i)从受试者分离含细胞的样品;
165.(ii)使用一种或多种编码第一和第二car的核酸序列或包含此类核酸序 列的一种或多种载体转导或转染该细胞;和
166.(iii)将来自(ii)的细胞施用至受试者。
167.该疾病可以是癌症。该癌症可以是b细胞恶性肿瘤。
168.在第十九个方面,本发明提供根据本发明的第十七个方面的药物组合 物,其用于治疗和/或预防疾病。
169.在第二十个方面,本发明提供根据本发明的第十三方面的细胞在制造用 于治疗和/或预防疾病的药物中的用途。
170.还提供根据本发明的第一个方面的细胞,其包含如本发明的第十一个方 面中定义的第一car和如本发明第十二个方面中定义的第二car。
171.还提供根据本发明的第二个方面的核酸序列,其编码如本发明的第十一 个方面中定义的第一car和如本发明第十二个方面中定义的第二car。
172.还提供根据本发明的第三个方面的试剂盒,其中第一核酸序列编码如本 发明的第十一个方面中定义的第一car且第二核酸序列编码如本发明第十 二个方面中定义的第二car。
173.还提供根据本发明的第五个方面的载体,其包含编码如本发明的第十一 个方面中定义的第一car和如本发明第十二个方面中定义的第二car的核 酸序列。
174.本发明还已经发现,在or门系统中,如果共刺激结构域和产生存活信 号的结构域在两个(或更多个)car之间“拆分(split)”,性能得到改善。
175.因此,在第二十一个方面提供细胞,其在细胞表面共表达第一嵌合抗原 受体(car)和第二car,每个car包含胞内信号传导结构域,其中第一 car的胞内信号传导结构域
包含共刺激结构域;且第二car的胞内信号传导 结构域包含tnf受体家族胞内域。
176.共刺激结构域可以是cd28共刺激结构域。
177.tnf受体家族胞内域可以是例如ox-40或4-1bb胞内域。
178.第一和第二car的胞内信号传导结构域还可以包含含有itam的结构 域,例如cd3 zeta胞内域。
179.第一car可以具有以下结构
180.agb1-间隔区1-tm1-costim-itam
181.其中:
182.agb1是第一car的抗原结合结构域;
183.间隔区1是第一car的间隔区;
184.tm1是第一car的跨膜结构域;
185.costim是共刺激结构域;和
186.itam是含有itam的胞内域。
187.第二car可以具有以下结构:
188.agb2-间隔区2-tm2-tnf-itam
189.其中:
190.agb2是第二car的抗原结合结构域;
191.间隔区2是第二car的间隔区;
192.tm2是第二car的跨膜结构域;
193.tnf是tnf受体胞内域;和
194.itam是含有itam的胞内域。
195.第一和第二car中的一个car可以靶向cd19且另一个car可以靶向 cd22。
196.在第二十二个方面,提供编码如本发明的第二十一个方面定义的第一和 第二嵌合抗原受体(car)两者的核酸序列。
197.该核酸序列可以具有以下结构:
198.agb1-间隔区1-tm1-costim-itam1-coexpr-abb2-间隔区2-tm2-tnf-it am2
199.其中
200.agb1是编码第一car的抗原结合结构域的核酸序列;
201.间隔区1是编码第一car的间隔区的核酸序列;
202.tm1是编码第一car的跨膜结构域的核酸序列;
203.costim是编码共刺激结构域的核酸序列;
204.itam1是编码第一car的含有itam的胞内域的核酸序列;
205.coexpr是使得能够共表达两个car的核酸序列;
206.agb2是编码第二car的抗原结合结构域的核酸序列;
207.间隔区2是编码第二car的间隔区的核酸序列;
208.tm2是编码第二car的跨膜结构域的核酸序列;
209.tnf是编码tnf受体胞内域的核酸序列;
210.itam2是编码第二car的含有itam的胞内域的核酸序列;
211.当该核酸序列在细胞中表达时,编码在切割位点切割的多肽,使得第一 和第二
car在细胞表面共表达。
212.在第二十三个方面,本发明提供试剂盒,其包含
213.(i)编码如本发明第二十一个方面定义的第一嵌合抗原受体(car)的 第一核酸序列,该核酸序列具有以下结构:
214.agb1-间隔区1-tm1-costim-itam1
215.其中
216.agb1是编码第一car的抗原结合结构域的核酸序列;
217.间隔区1是编码第一car的间隔区的核酸序列;
218.tm1是编码第一car的跨膜结构域的核酸序列;
219.costim是编码共刺激结构域的核酸序列;
220.itam1是编码第一car的含有itam的胞内域的核酸序列;
221.和
222.(ii)编码如本发明第二十一个方面定义的所述第二嵌合抗原受体(car) 的第二核酸序列,该核酸序列具有以下结构:
223.abb2-间隔区2-tm2-tnf-itam2
224.其中
225.agb2是编码第二car的抗原结合结构域的核酸序列;
226.间隔区2是编码第二car的间隔区的核酸序列;
227.tm2是编码第二car的跨膜结构域的核酸序列;
228.tnf是编码tnf受体胞内域的核酸序列;
229.itam2是编码第二car的含有itam的胞内域的核酸序。
230.在第二十四个方面,提供包含根据本发明的第二十二个方面或如本发明 的第二十三个方面定义的核酸序列的载体。
231.在第二十五个方面,提供用于制备根据本发明的第二十一个方面的细胞 的方法,其包括向细胞中引入以下的步骤:根据本发明的第二十二个方面的 核酸序列;如本发明的第二十三个方面中定义的第一核酸序列和第二核酸序 列;或根据本发明的第二十四个方面的载体。
232.在第二十六个方面,本发明提供药物组合物,其包含多种根据本发明的 第二十一个方面的细胞。
233.还提供用于治疗和/或预防疾病的方法,其包括向受试者施用根据本发明 的第二十六个方面的药物组合物的步骤。
234.还提供根据本发明的第二十六个方面的药物组合物,用于治疗和/或预防 疾病。
235.还提供根据本发明的第二十一个方面的细胞在制造用于治疗和/或预防 疾病的药物中的用途。
236.通过提供靶向cd19的一种car和靶向cd22的一种car,可以靶向这些 标志物的每一种,从而减少癌症逃逸的问题。
237.因为car在细胞表面表达为单独的分子,该方法克服了伴随tancar的 空间和可接近性的问题。也改善了细胞活化的效率。如果每个car具有其自 己的间隔区,可以对于特定的靶抗原调整该间隔区并从而调整结合结构域从 细胞表面伸出的距离和其柔性等。该选
择不受到伴随tancar的设计考虑的 影响,即一个car需要与t细胞膜并置而一个car需要在远端,与第一car 串联定位。
238.通过提供编码由切割位点分开的两种car的单个核酸,可以使用简单的 单个转导程序工程化细胞以共表达两种car。可以使用具有在单独的构建体 中的car编码序列的双重转染程序,但这将更复杂和昂贵,并对于核酸要求 更多的整合位点。双重转染程序也将伴随关于两种编码car的核酸是否已经 转导并有效表达的不确定性。
239.car将具有高同源性,例如跨膜和/或细胞内信号传导结构域可能是高 度同源的。如果对于两种car使用相同或相似的接头,那么它们也将是高度 同源的。这提示其中在单个核酸序列上提供两种car的方法将是不适合的, 因为序列之间的同源重组的可能性。然而,本发明人已经发现通过高同源性 的序列编码区域部分的“密码子摆动(codon wobbling)”,可以高效地从单 个构建体表达两种car。密码子摆动涉及在编码相同或相似的氨基酸序列的 序列区域中使用替代密码子。
240.本公开包括以下实施方案:
241.1.细胞,其在细胞膜处共表达第一嵌合抗原受体(car)和第二car, 每个car包含抗原结合结构域,其中所述第一car的抗原结合结构域结合c d19且第二car的抗原结合结构域结合cd22。
242.2.根据实施方案1的细胞,其中每个car包含:
243.(i)抗原结合结构域;
244.(i)间隔区;和
245.(iii)跨膜结构域;
246.其中所述第一car的间隔区不同于所述第二car的间隔区。
247.3.根据实施方案2的细胞,其中所述第二car的抗原结合结构域结合c d22的ig结构域1、2、3或4上的表位。
248.4.核酸序列,所述核酸序列编码如实施方案1至3中任一项定义的第一和 第二嵌合抗原受体(car)两者。
249.5.根据实施方案4的核酸序列,其具有以下结构:
250.agb1-间隔区1-tm1-coexpr-abb2-间隔区2-tm2
251.其中
252.agb1是编码所述第一car的抗原结合结构域的核酸序列;
253.间隔区1是编码所述第一car的间隔区的核酸序列;
254.tm1是编码所述第一car的跨膜结构域的核酸序列;
255.coexpr是使得能够共表达两个car的核酸序列;
256.agb2是编码所述第二car的抗原结合结构域的核酸序列;
257.间隔区2是编码所述第二car的间隔区的核酸序列;
258.tm2是编码所述第二car的跨膜结构域的核酸序列;
259.该核酸序列,当在t细胞中表达时,编码在切割位点切割的多肽,使得 所述第一和所述第二car在t细胞表面处共表达。
260.6.根据实施方案5的核酸序列,其中coexpr编码包含自切割肽的序列。
261.7.根据实施方案5或6的核酸序列,其中为了避免同源重组,在编码相同 或相似的
氨基酸序列的序列区域中使用替代密码子。
262.8.试剂盒,所述试剂盒包含
263.(i)编码如实施方案1至3中任一项定义的第一嵌合抗原受体(car)的 第一核酸序列,该核酸序列具有以下结构:
264.agb1-间隔区1-tm1
265.其中
266.agb1是编码所述第一car的抗原结合结构域的核酸序列;
267.间隔区1是编码所述第一car的间隔区的核酸序列;
268.tm1是编码所述第一car的跨膜结构域的核酸序列;
269.和
270.(ii)编码如实施方案1至3中任一项定义的第二嵌合抗原受体(car)的 第二核酸序列,该核酸序列具有以下结构:
271.abb2-间隔区2-tm2
272.agb2是编码所述第二car的抗原结合结构域的核酸序列;
273.间隔区2是编码所述第二car的间隔区的核酸序列;和
274.tm2是编码所述第二car的跨膜结构域的核酸序列。
275.9.试剂盒,所述试剂盒包含:第一载体,其包含如实施方案8中定义的 所述第一核酸序列;和第二载体,其包含如实施方案8中定义的所述第二核 酸序列。
276.10.根据实施方案9的试剂盒,其中所述载体为整合病毒载体或转座子。
277.11.载体,所述载体包含根据实施方案4至7中任一项的核酸序列。
278.12.根据实施方案11的逆转录病毒载体或慢病毒载体或转座子。
279.13.制备根据实施方案1至3中任一项的细胞的方法,其包括向细胞中引 入以下的步骤:根据实施方案4至7中任一项的核酸序列;如实施方案8中定 义的第一核酸序列和第二核酸序列;和/或如实施方案9中定义的第一载体和 第二载体或根据实施方案11或12的载体。
280.14.根据实施方案13的方法,其中所述细胞来自从受试者分离的样品。
281.15.药物组合物,所述药物组合物包含多种根据实施方案1至3中任一项 的细胞。
282.16.用于治疗和/或预防疾病的方法,其包括向受试者施用根据实施方案 15的药物组合物的步骤。
283.17.根据实施方案16的方法,其包括以下步骤:
284.(i)从受试者分离含细胞的样品;
285.(ii)使用以下转导或转染所述细胞:根据实施方案4至7中任一项的核酸 序列;如实施方案8中定义的第一核酸序列和第二核酸序列;和/或如实施方 案9或10中定义的第一载体和第二载体或根据实施方案11或12的载体;和
286.(iii)将来自(ii)的细胞施用至受试者。
287.18.根据实施方案16或17的方法,其中所述疾病是癌症。
288.19.根据实施方案18的方法,其中所述癌症是b细胞恶性肿瘤。
289.20.根据实施方案15的药物组合物,其用于治疗和/或预防疾病。
290.21.根据实施方案1至3中任一项的细胞在制造用于治疗和/或预防疾病 的药物中
的用途。
291.22.嵌合抗原受体(car),所述嵌合抗原受体包含cd19结合结构域, 其包含
292.a)具有互补决定区(cdr)的重链可变区(vh),所述互补决定区具有 以下序列:
293.cdr1
–
sywmn(seq id no.15);
294.cdr2
–
qiwpgdgdtnyngkfk(seq id no.16);
295.cdr3
–
retttvgryyyamdy(seq id no.17);和
296.b)具有cdr的轻链可变区(vl),所述cdr具有以下序列:
297.cdr1
–
kasqsvdydgdsyln(seq id no.18);
298.cdr2
–
dasnlvs(seq id no.19);
299.cdr3
–
qqstedpwt(seq id no.20)。
300.23.根据实施方案22的car,其中所述cd19结合结构域包含具有如seqid no.23或seq id no 24所示的序列的vh结构域;或具有如seq id no.25, seq id no.26或seq id no.40所示的序列的vl结构域,或具有至少90%序 列同一性的其变体,所述变体保留了结合cd19的能力。
301.24.根据实施方案22的car,其中所述cd19结合结构域包含如seq idno.21,seq id no.22或seq id no.39所示的序列,或具有至少90%序列同 一性的其变体,所述变体保留了结合cd19的能力。
302.25.包含cd22结合结构域的嵌合抗原受体(car),其包含
303.a)具有互补决定区(cdr)的重链可变区(vh),所述互补决定区具 有以下序列:
304.cdr1
–
nywin(seq id no.27);
305.cdr2
–
niypsdsftnynqkfkd(seq id no.28)
306.cdr3
–
dtqerswyfdv(seq id no.29);和
307.b)具有cdr的轻链可变区(vl),所述cdr具有以下序列:
308.cdr1
–
rssqslvhsngntylh(seq id no.30);
309.cdr2
–
kvsnrfs(seq id no.31)
310.cdr3
–
sqsthvpwt(seq id no.32)。
311.26.根据实施方案25的car,其中所述cd22结合结构域包含具有如seqid no.35或seq id no 36所示的序列的vh结构域;或具有如seq id no.37 或seq id no.38所示的序列的vl结构域,或具有至少90%序列同一性的其 变体,所述变体保留了结合cd22的能力。
312.27.根据实施方案25的car,其中所述cd22结合结构域包含如seq idno.33或seq id no.34所示的序列,或具有至少90%序列同一性的其变体, 所述变体保留了结合cd22的能力。
313.28.根据实施方案1至3中任一项的细胞,其中所述第一car是如实施方 案22至24中任一项所定义的,且所述第二car是如实施方案25至27中任一项 所定义的。
314.29.根据实施方案4至7中任一项的核酸序列,所述核酸序列编码如实施 方案22至24中任一项所定义的第一car和如实施方案25至27中任一项所定 义的第二car。
315.30.根据实施方案8至10中任一项的试剂盒,其中所述第一核酸序列编码 如实施方案22至24中任一项所定义的第一car且所述第二核酸序列编码如 实施方案25至27中任一项所定义的第二car。
316.31.根据实施方案11或12的载体,其包含根据实施方案29的核酸序列。
317.32.细胞,其在细胞表面处共表达第一嵌合抗原受体(car)和第二 car,每个car包含细胞内信号传导结构域,其中所述第一car的细胞内信 号传导结构域包含共刺激结构域;且所述第二car的细胞内信号传导结构域 包含tnf受体家族胞内域(endodomain)。
318.33.根据实施方案32的细胞,其中所述共刺激结构域是cd28共刺激结构 域。
319.34.根据实施方案32或33的细胞,其中所述tnf受体家族胞内域是 ox-40或4-1bb胞内域。
320.35.根据实施方案32至34任一项的细胞,其中所述第一和第二car的细 胞内信号传导结构域还包含含有itam的结构域。
321.36.根据实施方案35的细胞,其中所述第一car具有以下结构:
322.agb1-间隔区1-tm1-costim-itam
323.其中:
324.agb1是所述第一car的抗原结合结构域;
325.间隔区1是所述第一car的间隔区;
326.tm1是所述第一car的跨膜结构域;
327.costim是共刺激结构域;和
328.itam是含有itam的胞内域;
329.且所述第二car具有以下结构:
330.agb2-间隔区2-tm2-tnf-itam
331.其中:
332.agb2是所述第二car的抗原结合结构域;
333.间隔区2是所述第二car的间隔区;
334.tm2是所述第二car的跨膜结构域;
335.tnf是tnf受体胞内域;和
336.itam是含有itam的胞内域。
337.37.核酸序列,所述核酸序列编码如实施方案32至36中任一项定义的所 述第一和第二嵌合抗原受体(car)两者。
338.38.根据实施方案37的核酸序列,其具有以下结构:
339.agb1-间隔区1-tm1-costim-itam1-coexpr-abb2-间隔区2-tm2-tnf-it am2
340.其中
341.agb1是编码所述第一car的抗原结合结构域的核酸序列;
342.间隔区1是编码所述第一car的间隔区的核酸序列;
343.tm1是编码所述第一car的跨膜结构域的核酸序列;
344.costim是编码共刺激结构域的核酸序列;
345.itam1是编码所述第一car的含有itam的胞内域的核酸序列;
346.coexpr是使得能够共表达两个car的核酸序列;
347.agb2是编码所述第二car的抗原结合结构域的核酸序列;
348.间隔区2是编码所述第二car的间隔区的核酸序列;
349.tm2是编码所述第二car的跨膜结构域的核酸序列;
350.tnf是编码tnf受体胞内域的核酸序列;
351.itam2是编码所述第二car的含有itam的胞内域的核酸序列;
352.该核酸序列,当在细胞中表达时,编码在切割位点切割的多肽,使得所 述第一和第二car在细胞表面共表达。
353.39.试剂盒,其包含
354.(i)编码如实施方案32至36中任一项定义的所述第一嵌合抗原受体(ca r)的第一核酸序列,该核酸序列具有以下结构:
355.agb1-间隔区1-tm1-costim-itam1
356.其中
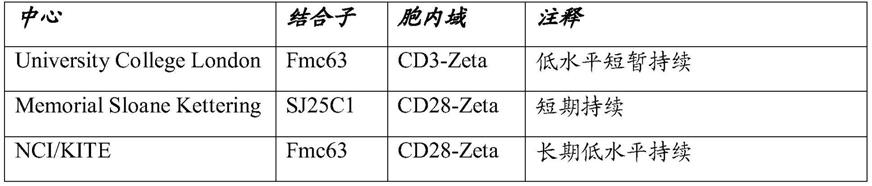
357.agb1是编码所述第一car的抗原结合结构域的核酸序列;
358.间隔区1是编码所述第一car的间隔区的核酸序列;
359.tm1是编码所述第一car的跨膜结构域的核酸序列;
360.costim是编码共刺激结构域的核酸序列;
361.itam1是编码所述第一car的含有itam的胞内域的核酸序列;
362.和
363.(ii)编码如实施方案32至36中任一项定义的所述第二嵌合抗原受体(ca r)的第二核酸序列,该核酸序列具有以下结构:
364.abb2-间隔区2-tm2-tnf-itam2
365.其中
366.agb2是编码所述第二car的抗原结合结构域的核酸序列;
367.间隔区2是编码所述第二car的间隔区的核酸序列;
368.tm2是编码所述第二car的跨膜结构域的核酸序列;
369.tnf是编码tnf受体胞内域的核酸序列;
370.itam2是编码所述第二car的含有itam的胞内域的核酸序。
371.40.载体,所述载体包含根据实施方案37或38的核酸序列。
372.41.制备根据实施方案37或38中的任一项的细胞的方法,其包括向细胞 引入以下的步骤:根据实施方案37或38的核酸序列;如实施方案39中定义的 第一核酸序列和第二核酸序列;或根据实施方案40的载体。
373.42.药物组合物,所述药物组合物包含多种根据实施方案32或36中任一 项的细胞。
374.43.用于治疗和/或预防疾病的方法,其包括向受试者施用根据实施方案 42的药物组合物的步骤。
375.44.根据实施方案42的药物组合物,用于治疗和/或预防疾病。
376.45.根据实施方案32至36中任一项的细胞在制造用于治疗和/或预防疾 病的药物中的用途。
377.附图简述
378.图1:a)说明经典car的示意图。(b)至(d):不同代的和不同排列的car 胞内域:(b)最初的设计通过fcεr1-γ或cd3ζ胞内域仅传输itam信号,而后 来的设计在同一个复合胞内域中传输另外的(c)一种或(d)多种共刺激信号。
379.图2:b细胞成熟通路/b细胞个体发生。dr=hla-dr;ccd79=胞质cd79; ccd22=胞质cd22。cd19和cd22抗原两者都在b细胞成熟中的早期期间表 达。正是这些细胞发育成b细胞急性白血病。同时靶向cd19以及cd22两者 对于靶向b细胞急性白血病是最合适的。
380.图3:设计抗cd19 or cd22 car基因盒的策略。选择识别cd19的结合 子和识别cd22的接合子。对于每个car选择最适间隔区结构域和信号传导 结构域。(a)构建or门基因盒使得两种car使用fmd-2a肽共表达。任何同源 序列进行密码子摆动以避免重组。(c)两种car作为单独的蛋白在t细胞表面 上表达。
381.图4:密码子摆动以允许相同的肽序列在逆转录病毒载体中共表达但避 免同源重组的例子。这里,野生型hch2ch3-cd28tmzeta与密码子摆动的 hch2ch3-cd28tmzeta对齐。
382.图5:证明抗cd19 or cd22门的功能性。(a)构建体的草图:s1-信号肽1; ha-血凝素标签;hch2ch3-铰链,igg1野生型序列的ch2ch3; cd28tmz-cd28跨膜结构域和cd3 zeta摆动的序列;2a-口蹄疫2a肽;s2-信 号肽2;v5-v5表位标签;acd22-抗cd22 scfv;hch2ch3'-铰链,igg1摆动 的序列的ch2ch3;cd28tmz-cd28跨膜结构域和cd3 zeta摆动的序列;(b) 从单个载体共表达两种受体。在使用okt2和抗cd28刺激后使用双顺反子载 体转导外周血t细胞。通过使用抗v5-fitc(invitrogen)和抗ha-pe(abcam) 染色在转导后五天分析细胞。可以在t细胞表面上同时检测两种car。(c)使 用不表达cd19或cd22的,单独表达cd19或cd22的,或表达两种抗原的靶 细胞激发非转导的t细胞,仅表达抗cd19 car的t细胞,仅表达抗cd22 car 的t细胞,和表达抗cd19 or cd22 car门的t细胞。表达抗cd19 or cd22car门的t细胞可以杀灭靶细胞,即便一种抗原不存在。
383.图6:鼠cd22alab scfv,人源化cd22alab scfv和m971 scfv的biacore 亲和力测定。
384.图7:鼠cd19alab scfv和人源化cd19alab的biacore亲和力测定。
385.图8:cd19alab scfv和fmc63 scfv与可溶性scfv-cd19结合之间的结合 动力学的比较。
386.图9:说明比较研究中使用的cd19alab car,fmc63 car,cd22alabcar和m971 car的示意图。
387.图10:对cd19阳性靶细胞的杀伤,比较具有cd19alab抗原结合结构 域的car和具有fmc63结合结构域的等同car。
388.图11:a)对cd22阳性靶细胞的杀伤,比较具有cd22alab抗原结合结 构域的car和具有m971结合结构域的等同car。b)比较1:1与cd22阳性supt1细胞共培养后ifnγ释放的测定。
389.图12:cd19结构和外显子。
390.图13:说明实施例5中测试的四种构建体的示意图和构建体图谱。在构 建体图谱中,使用
‘
标记的部分是密码子摆动的。
391.a:cd19和cd22 car两者都具有41bb-cd3zeta复合胞内域;b:cd19 和cd22 car两者都具有ox40-cd3zeta复合胞内域;c:cd19 car具有 41bb-cd3zeta复合胞内域且cd22 car具有cd28-cd3zeta复合胞内域;和 d:cd19 car具有ox40-cd3zeta复合胞内域且cd22 car具有 cd28-cd3zeta复合胞内域。
392.图14:表达图13中所示的构建体的细胞对靶细胞的杀伤。
393.发明详述
394.嵌合抗原受体(car)
395.car,其示意性显示于图1中,是嵌合i型跨膜蛋白,其将细胞外抗原识 别结构域(结合子)连接至细胞内信号传导结构域(胞内域)。结合子通常 是来源于单克隆抗体(mab)的单链可变片段(scfv),但其可以基于包含 抗体样抗原结合位点的其它形式。通常需要间隔区结构域以将结合子从膜分 离并允许其适合的定向。通常使用的间隔区结构域是igg1的fc。取决于抗原, 更紧密的间隔区可以满足,例如来自cd8α的茎部或仅单独的igg1铰链。跨 膜结构域将蛋白锚定在细胞膜中并将间隔区连接至胞内域。
396.早期的car设计具有来源于fcεr1或cd3ζ的γ链的细胞内部分的胞内 域。因此,这些第一代受体传输免疫信号1,其足够触发t细胞杀伤同族靶细 胞,但不能完全活化t细胞以增殖或存活。为了克服这一限制,构建了复合 胞内域:将t细胞共刺激分子的细胞内部分融合至cd3ζ的细胞内部分,产生 了第二代受体,其在抗原识别后能够同时传输活化和共刺激信号。最通常使 用的共刺激结构域是cd28的共刺激结构域。这提供了最强力的共刺激信号
‑ꢀ
称为免疫信号2,其触发t细胞增殖。已经描述了一些受体,其包括tnf受体 家族胞内域,例如紧密相关的ox40和41bb,其传输存活信号。现在已经描 述可甚至更强力的第三代car,其具有能够传输活化,增殖和存活信号的胞 内域。
397.可以使用例如逆转录病毒载体将编码car的核酸转移至t细胞。可以采 用慢病毒。以这种方式,可以生成大量癌症特异性t细胞用于过继细胞转移。 当car结合靶抗原时,这导致活化信号传输至其在上表达的t细胞。因此car 将特异性和t细胞的细胞毒性引导至表达靶向的抗原的肿瘤细胞。
398.本发明的第一个方面涉及细胞,其共表达第一car和第二car,其中一 个car结合cd19而另一个car结合cd22,使得t细胞可以识别表达这些标 志物的任一种的靶细胞。
399.因此,本发明的第一和第二car的抗原结合结构域结合不同的抗原,且 两种car可以包含活化胞内域。两种car可以包含间隔区结构域,其可以相 同,或足够不同以防止两种不同受体之间的交叉配对。因此,可以工程化细 胞以当识别cd19和cd22的任一或两者时活化。这在肿瘤学领域是有用的, 如goldie-coldman假说所述:对单个抗原的单独靶向可以导致肿瘤逃逸,其 通过由于大多数癌症中固有的高突变率的所述抗原的调整。通过同时靶向两 种抗原,这种逃逸的可能性大大降低。
400.重要的是两种car不发生异二聚化。
401.本发明的t细胞的第一和第二car可以作为包含两种car连同切割位点 的多肽产生。
402.信号肽
403.本发明的细胞的car可以包含信号肽,使得当car在细胞内部表达时, 例如t细胞,新生蛋白被引导至内质网和随后引导至细胞膜,在那里其表达。
404.信号肽的核心可以含有一长段疏水性氨基酸,其具有形成单个α螺旋的 倾向。信号肽可以以短的,带正电的氨基酸段开始,其帮助转位期间执行多 肽的正确拓扑结构。在信号肽的末端,通常是由信号肽酶识别并切割的氨基 酸段。信号肽可以在转位期间或转位完成后切割,以生成游离的信号肽和成 熟蛋白。接着,游离的信号肽被特定蛋白酶消化。
405.信号肽可以在分子的氨基末端。
406.信号肽可以包含seq id no.1,2或3,或其具有5,4,3,2或1个氨基酸 突变(插入,取代或添加)的变体,只要信号肽仍然发挥功能以引起car的细 胞表面表达。
407.seq id no.1:mgtsllcwmalcllgadhadg
408.seq id no.1的信号肽是紧密且高效的。预测它在末端甘氨酸之后产生 约95%的切割,产生由信号肽酶进行的有效移除。
409.seq id no.2:mslpvtalllplalllhaarp
410.seq id no.2的信号肽来源于igg1。
411.seq id no.3:mavptqvlgllllwltdarc
412.seq id no.3的信号肽来源于cd8。
413.第一car的信号肽可以具有与第二car的信号肽不同的序列。
414.cd19
415.人cd19抗原是属于免疫球蛋白超家族的95kd跨膜糖蛋白。cd19分类为 i型跨膜蛋白,具有单个跨膜结构域,胞质c末端,和细胞外n末端。cd19 的一般结构示于图12中。
416.cd19是正常和肿瘤b细胞,以及滤泡状树突状细胞的生物标志物。实际 上,在发育期间,其从最早期的可识别b谱系细胞到b细胞母细胞存在于b细 胞上,但在成熟至浆细胞时丢失。其主要作为b细胞共受体连同cd21和cd81 作用。当活化时,cd19的胞质尾部变得磷酸化,其引起src家族激酶的结合 和pi-3激酶的募集。cd19在b细胞分化的非常早期表达,并仅在末期b细胞 分化为浆细胞时丢失。因此,cd19在除多发性骨髓瘤的b细胞恶性肿瘤上表 达。
417.在不同的中心已经测试了针对cd19的不同设计的car,如下表概述:
418.表1
[0419][0420][0421]
如以上所示,目前大多数的研究已经使用来源于杂交瘤fmc63的scfv作 为结合结构域的一部分以识别cd19。
[0422]
如图12中所示,编码cd19的基因包含十个外显子:外显子1至4编码细 胞外结构域;外显子5编码跨膜结构域;和外显子6至10编码胞质结构域;
[0423]
在本发明的cd19/cd22 or门中,抗cd19 car的抗原结合结构域可以 结合由cd19基因的外显子1编码的cd19的表位。
[0424]
在本发明的cd19/cd22 or门中,抗cd19 car的抗原结合结构域可以 结合由cd19基因的外显子3编码的cd19的表位。
[0425]
在本发明的cd19/cd22 or门中,抗cd19 car的抗原结合结构域可以 结合由cd19
基因的外显子4编码的cd19的表位。
[0426]
cd19alab
[0427]
本发明人已经开发了新的抗cd19 car,其与包含结合子fmc63的已知抗 cd19 car相比具有改进的特性。car的抗原结合结构域基于cd19结合子 cd19 alab,其具有以下鉴定的cdr和vh/vl区域。
[0428]
因此,本发明还提供car,其包含cd19结合结构域,其包含a)具有互 补决定区(cdr)的重链可变区(vh),所述cdr具有以下序列:
[0429]
cdr1
–
sywmn(seq id no.15);
[0430]
cdr2
–
qiwpgdgdtnyngkfk(seq id no.16);
[0431]
cdr3
–
retttvgryyyamdy(seq id no.17);和
[0432]
b)具有cdr的轻链可变区(vl),所述cdr具有以下序列:
[0433]
cdr1
–
kasqsvdydgdsyln(seq id no.18);
[0434]
cdr2
–
dasnlvs(seq id no.19);
[0435]
cdr3
–
qqstedpwt(seq id no.20)。
[0436]
可以在每个cdr中引入一个或多个突变(取代,添加或缺失)而不负面 影响cd19结合活性。每个cdr可以例如具有一个,两个或三个氨基酸突变。
[0437]
本发明的car可以包含以下氨基酸序列之一:
[0438]
seq id no.21(鼠cd19alabscfv序列)
[0439]
qvqlqqsgaelvrpgssvkisckasgyafssywmnwvkqrpgqglewi gqiwpgdgdtnyngkfkgkatltadessstaymqlsslasedsavyfcar retttvgryyyamdywgqgttvtvssdiqltqspaslavslgqratisck asqsvdydgdsylnwyqqipgqppklliydasnlvsgipprfsgsgsgtdf tlnihpvekvdaatyhcqqstedpwtfgggtkleik
[0440]
seq id no.22(人源化cd19alabscfv序列
–
heavy 19,kappa 16)
[0441]
qvqlvqsgaevkkpgasvklsckasgyafssywmnwvrqapgqslewi gqiwpgdgdtnyngkfkgratltadesartaymelsslrsgdtavyfca rretttvgryyyamdywgkgtlvtvssdiqltqspdslavslgeratinc kasqsvdydgdsylnwyqqkpgqppklliydasnlvsgvpdrfsgsgsg tdftltisslqaadvavyhcqqstedpwtfgqgtkveikr
[0442]
seq id no.39(人源化cd19alab scfv序列
–
heavy 19,kappa 7)
[0443]
qvqlvqsgaevkkpgasvklsckasgyafssywmnwvrqapgqslewi gqiwpgdgdtnyngkfkgratltadesartaymelsslrsgdtavyfca rretttvgryyyamdywgkgtlvtvssdiqltqspdslavslgeratinc kasqsvdydgdsylnwyqqkpgqppkvliydasnlvsgvpdrfsgsgsg tdftltisslqaadvavyycqqstedpwtfgqgtkveikr
[0444]
scfv可以以vh-vl方向(如seq id no.21,22和39所示)或vl-vh方向。
[0445]
本发明的car可以包含以下vh序列之一:
[0446]
seq id no.23(鼠cd19alab vh序列)
[0447]
qvqlqqsgaelvrpgssvkisckasgyafssywmnwvkqrpgqglewi gqiwpgdgdtnyngkfkgkatltadessstaymqlsslasedsavyfcar retttvgryyyamdywgqgttvtvss
[0448]
seq id no.24(人源化cd19alab vh序列)
[0449]
qvqlvqsgaevkkpgasvklsckasgyafssywmnwvrqapgqslewi gqiwpgdgdtnyngkfkgr
atltadesartaymelsslrsgdtavyfca rretttvgryyyamdywgkgtlvtvss
[0450]
本发明的car可以包含以下vl序列之一:
[0451]
seq id no.25(鼠cd19alab vl序列)
[0452]
diqltqspaslavslgqratisckasqsvdydgdsylnwyqqipgqppkll iydasnlvsgipprfsgsgsgtdftlnihpvekvdaatyhcqqstedpwtf gggtkleik
[0453]
seq id no.26(人源化cd19alab vl序列,kappa 16)
[0454]
diqltqspdslavslgeratinckasqsvdydgdsylnwyqqkpgqppkl liydasnlvsgvpdrfsgsgsgtdftltisslqaadvavyhcqqstedpwt fgqgtkveikr
[0455]
seq id no.40(人源化cd19alab vl序列,kappa 7)
[0456]
diqltqspdslavslgeratinckasqsvdydgdsylnwyqqkpgqppkv liydasnlvsgvpdrfsgsgsgtdftltisslqaadvavyycqqstedpwt fgqgtkveikr
[0457]
本发明的car可以包含如seq id no.21、22、23、24、25、26、39或40 所示的序列的变体,其具有至少80、85、90、95、98或99%序列同一性,条 件是该变体序列保留了结合cd19的能力(如果适用,当连同互补vl和vh 结构域时)。
[0458]
可以通过程序例如blast(其可以在http://blast.ncbi.nlm.nih.gov免费获 得)容易地确定两个多肽序列之间的百分比同一性。
[0459]
cd22
[0460]
人cd22抗原是属于凝集素的siglec家族的分子。其发现于成熟b细胞 和一些未成熟b细胞的表面上。通常来讲,cd22是防止免疫系统过度活化和 发展自身免疫疾病的调节分子。
[0461]
cd22是糖结合跨膜蛋白,其通过定位于其n末端的免疫球蛋白(ig)结 构域特异性识别唾液酸。ig结构域的存在使得cd22为免疫球蛋白超家族的成 员。cd22作为b细胞受体(bcr)信号传导的抑制性受体发挥功能。
[0462]
cd22是igsf的分子,其可以以两种亚型存在,一种具有七个结构域和 包含三个itim(基于免疫受体酪氨酸的抑制性基序)和一个itam的胞质内 尾部;和剪切变体,其作为替代包含五个细胞外结构域和携带一个itim的胞 质内尾部。认为cd22是参与控制b细胞对抗原响应的抑制性受体。与cd19 相似,广泛认为cd22是泛-b抗原,尽管已经描述了在一些非淋巴组织上的 表达。使用治疗性单克隆抗体和免疫缀合物靶向cd22已经进入临床测试。
[0463]
haso(blood;2013;121(7))等人描述了抗cd22 car的例子。具体的, 描述了具有来源于m971,ha22和bl22 scfv的抗原结合结构域的抗cd22car。
[0464]
抗cd22 car的抗原结合结构域可以以范围在30-50nm例如30-40nm的 kd结合cd22。kd可以是约32nm。
[0465]
cd22具有七个细胞外igg样结构域,其通常鉴定为ig结构域1至ig结构域 7,其中ig结构域7为b细胞膜最近端而ig结构域7为ig细胞膜最远端(参见如 上所述的haso et al 2013中的图2b)。
[0466]
下表中总结了依据cd22的氨基酸序列 (http://www.uniprot.org/uniprot/p20273)的ig结构域的位置。
[0467]
ig结构域氨基酸120-138
2143-2353242-3264331-4165419-5006505-5827593-676
[0468]
第二car的抗原结合结构域可以结合cd22上的膜远端表位。第二car 的抗原结合结构域可以结合cd22的ig结构域1、2、3或4上的表位,例如cd22 的ig结构域3上的表位。第二car的抗原结合结构域可以结合定位于cd22的 氨基酸22-416之间的表位,例如cd22的氨基酸242-326之间的表位。
[0469]
抗cd22抗体ha22和bl22(haso et al 2013,如上文)和cd22alab, 在下文中描述,结合cd22的ig结构域3上的表位。
[0470]
第二car的抗原结合结构域可以不结合cd22上的膜近端表位。第二 car的抗原结合结构域可以不结合cd22的ig结构域5、6或7上的表位。第二 car的抗原结合结构域可以不结合定位于cd22的氨基酸419-676之间的表 位,例如cd22的505-676之间的表位。
[0471]
cd22alab
[0472]
本发明人已经开发了新的抗cd22 car,其与包含结合子m971的已知抗 cd22 car相比具有改善的特性(参见实施例2和3和haso et al(2013),如上 文)。car的抗原结合结构域基于cd22结合子cd22alab,其具有以下鉴定 的cdr和vh/vk区。
[0473]
因此,本发明还提供包含cd22结合结构域的car,其包含
[0474]
a)具有互补决定区(cdr)的重链可变区(vh),所述互补决定区具 有以下序列:
[0475]
cdr1
–
nywin(seq id no.27);
[0476]
cdr2
–
niypsdsftnynqkfkd(seq id no.28)
[0477]
cdr3
–
dtqerswyfdv(seq id no.29);和
[0478]
b)具有cdr的轻链可变区(vl),所述cdr具有以下序列:
[0479]
cdr1
–
rssqslvhsngntylh(seq id no.30);
[0480]
cdr2
–
kvsnrfs(seq id no.31)
[0481]
cdr3
–
sqsthvpwt(seq id no.32)。
[0482]
可以向该或每个cdr引入一个或多个突变(取代,添加或缺失)而不负 面影响cd22结合活性。每个cdr可以例如具有一个,两个或三个氨基酸突 变。
[0483]
本发明的car可以包含以下氨基酸序列之一:
[0484]
seq id no.33(鼠cd22alabscfv序列)
[0485]
qvqlqqpgaelvrpgasvklsckasgytftnywinwvkqrpgqglewi gniypsdsftnynqkfkdkatltvdkssstaymqlssptsedsavyyctr dtqerswyfdvwgagttvtvssdvvmtqtplslpvslgdqasiscrssq slvhsngntylhwylqkpgqspklliykvsnrfsgvpdrfsgsgsgtdft lkisrveaedlglyfcsqsthvpwtfgggtkleik
[0486]
seq id no.34(人源化cd22alabscfv序列)
[0487]
evqlvesgaevkkpgssvkvsckasgytftnywinwvrqapgqglewi gniypsdsftnynqkfkdratltvdkststaylelrnlrsddtavyyctr dtqerswyfdvwgqgtlvtvssdivmtqspatlsvspgeratls
crssqs lvhsngntylhwyqqkpgqaprlliykvsnrfsgvparfsgsgsgveftl tisslqsedfavyycsqsthvpwtfgqgtrleik
[0488]
该scfv可以以vh-vl方向(如seq id nos 33和34中所示)或vl-vh方 向。
[0489]
本发明的car可以包含以下vh序列之一:
[0490]
seq id no.35(鼠cd22alab vh序列)
[0491]
qvqlqqpgaelvrpgasvklsckasgytftnywinwvkqrpgqglewi gniypsdsftnynqkfkdkatltvdkssstaymqlssptsedsavyyctr dtqerswyfdvwgagttvtvss
[0492]
seq id no.36(人源化cd22alab vh序列)
[0493]
evqlvesgaevkkpgssvkvsckasgytftnywinwvrqapgqglewi gniypsdsftnynqkfkdratltvdkststaylelrnlrsddtavyyctr dtqerswyfdvwgqgtlvtvss
[0494]
本发明的car可以包含以下vl序列之一:
[0495]
seq id no.37(鼠cd22alab vl序列)
[0496]
dvvmtqtplslpvslgdqasiscrssqslvhsngntylhwylqkpgqspk lliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedlglyfcsqsthvpw tfgggtkleik
[0497]
seq id no.38(人源化cd22alab vl序列)
[0498]
divmtqspatlsvspgeratlscrssqslvhsngntylhwyqqkpgqapr lliykvsnrfsgvparfsgsgsgveftltisslqsedfavyycsqsthvpwt fgqgtrleik
[0499]
本发明的car可以包含如seq id no.33、34、35、36、37或38所示的序 列的变体,其具有至少80、85、90、95、98或99%的序列同一性,条件是该 变体序列保留了结合cd22的能力(如果适用,当连同互补vl和vh结构域 时)。
[0500]
b细胞个体发生和后来的肿瘤期间的b细胞抗原表达
[0501]
广泛认为cd19是泛-b抗原,尽管偶尔其也可以显示出一些谱系不忠 (lineage infidelity)。cd19分子包含由较小的结构域分开的两个细胞外igsf 结构域,和长的胞质内尾部,其几乎与分子的细胞外部分一样大,携带一个 itam。cd19是b细胞发育和活化中的关键分子。cd22是igsf的分子,其可 以以两种亚型存在,一种具有七个结构域和包含三个itim(基于免疫受体酪 氨酸的抑制性基序)和一个itam的胞质内尾部;和剪切变体,其作为替代 包含五个细胞外结构域和携带一个itim的胞质内尾部。认为cd22是参与控 制b细胞对抗原响应的抑制性受体。与cd19相似,广泛认为cd22是泛-b抗 原,尽管已经描述了在一些非淋巴组织上的表达(wen et al.(2012)j.immunol. baltim.md 1950 188,1075
–
1082)。使用治疗性单克隆抗体和免疫缀合物靶向 cd22已经进入临床测试。已经描述了生成cd22特异性car(haso et al,2013, blood:volume 121;7:1165-74,和james et al 2008,journal of immunology, volume 180;issue 10;pages 7028-38)
[0502]
b细胞白血病的详细免疫表型鉴定研究表明,尽管表面cd19总是存在, 表面cd22几乎总是存在。例如,raponi等人(2011,如上文)研究了427例 b-all的表面抗原表型,发现在研究的病例中有341例存在cd22。
[0503]
在上述car19靶向后cd19下调的可能性可以由goldie-coldman假说来 解释。goldie-coldman假说预测,肿瘤细胞以取决于其固有遗传不稳定性的 速率突变为抗性表型,并且癌症将含有抗性克隆的概率取决于突变率和肿瘤 大小。尽管癌细胞可能难以变得对细胞毒性t细胞的直接杀伤固有抗性,但 抗原丢失是可能仍然是的。事实上,先前已经报
道了这种现象,其中靶向黑 素瘤抗原和ebv驱动的淋巴瘤。根据goldie-coldman假说,治愈的最佳机会 将是同时攻击非交叉的抗性靶标。鉴于cd22在几乎所有b-all病例中都表 达,cd19连同cd22的同时car靶向可以减少抗cd19阴性克隆的出现。
[0504]
抗原结合结构域
[0505]
抗原结合结构域是car的部分,其识别抗原。本领域已知许多抗原结合 结构域,包括基于抗体,抗体模拟物和t细胞受体的抗原结合位点的那些。 例如,抗原结合结构域可以包含:来源于单克隆抗体的单链可变片段(scfv); 靶抗原的天然配体;对于靶标具有足够亲和力的肽;单域抗体;人工单结合 子例如darpin(设计的锚蛋白重复蛋白);或来源于t细胞受体的单链。
[0506]
结合cd19的car的抗原结合结构域可以是能够结合cd19的任何结构 域。例如,抗原结合结构域可以包含如表1中所述的cd19结合子。
[0507]
结合cd19的car的抗原结合结构域可以包含来源于表2中所示的cd19 之一的序列。
[0508]
表2
[0509][0510][0511]
结合cd22的car的抗原结合结构域可以是能够结合cd22的任何结构 域。例如,该抗原结合结构域可以包含如表3中所述的cd22结合子。
[0512]
表3
[0513][0514][0515]
间隔区结构域
[0516]
car包含间隔区序列以连接抗原结合结构域和跨膜结构域,并在空间上 分开抗原抗原结合结构域和胞内域。柔性间隔区允许抗原结合域在不同方向 上定向以促进结合。
[0517]
在本发明的细胞中,第一和第二car可以包含不同的间隔区分子。例如, 间隔区序列可以例如包含igg1 fc区,igg1铰链或人cd8茎部或小鼠cd8茎 部。或者间隔区可以包含替代接头序列,其具有与igg1 fc区,igg1铰链或 cd8茎部相似的长度和/或结构域间隔特性。可以改变人igg1间隔区以去除fc 结合基序。
[0518]
抗cd19 car的间隔区可以包含cd8茎部间隔区,或具有与cd8茎部间 隔区长度等同的间隔区。抗cd19 car的间隔区可以具有至少30个氨基酸或 至少40个氨基酸。其可以具有35-55个氨基酸,例如40-50个氨基酸。其可以 具有约46个氨基酸。
[0519]
抗cd22 car的间隔区可以包含igg1铰链间隔区,或具有与igg1铰链间 隔区长度
等同的间隔区。抗cd22 car的间隔区可以具有少于30个氨基酸或 少于25个氨基酸。其可以具有15-25个氨基酸,例如18-22个氨基酸。其可以 具有约20个氨基酸。
[0520]
这些间隔区的氨基酸序列的例子在以下给出:
[0521]
seq id no.4(人igg1的铰链-ch2ch3)
[0522]
aepkspdkthtcppcpappvagpsvflfppkpkdtlmiartpevtcvvvdv shedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwl ngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsl tclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksr wqqgnvfscsvmhealhnhytqkslslspgkkd
[0523]
seq id no.5(人cd8茎部):
[0524]
tttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdi
[0525]
seq id no.6(人igg1铰链):
[0526]
aepkspdkthtcppcpkdpk
[0527]
seq id no.7(cd2胞外域)
[0528]
keitnaletwgalgqdinldipsfqmsddiddikwektsdkkkiaqfrke ketfkekdtyklfkngtlkikhlktddqdiykvsiydtkgknvlekifdl kiqervskpkiswtcinttltcevmngtdpelnlyqdgkhlklsqrvithk wttslsakfkctagnkvskessvepvscp ekgld
[0529]
seq id no.8(cd34胞外域)
[0530]
sldnngtatpelptqgtfsnvstnvsyqetttpstlgstslhpvsqhgnea ttnitettvkftstsvitsvygntnssvqsqtsvistvfttpanvstpettlk pslspgnvsdlsttstslatsptkpytssspilsdikaeikcsgirevkltqgi cleqnktsscaefkkdrgeglarvlcgeeqadadagaqvcslllaqsev rpqclllvlanrteissklqlmkkhqsdlkklgildfteqdvashqsysq kt
[0531]
由于car通常是同二聚体(参见图1a),交叉配对可能产生异二聚体嵌 合抗原受体。由于多种原因这是不需要的,例如:(1)靶细胞上的表位可能 不在相同“水平”使得交叉配对的car可能仅能够结合一种抗原;(2)来自 不同scfv的vh和vl可以交换使得任一种不能识别靶标或更差地,识别无法 预期和无法预测的抗原。第一car的间隔区可以与第二car的间隔区足够不 同以避免交叉配对。第一间隔区的氨基酸序列与第二间隔区在氨基酸水平可 以共享少于50%,40%,30%或20%的同一性。
[0532]
跨膜结构域
[0533]
跨膜结构域是car跨越膜的序列。
[0534]
跨膜结构域可以是任何蛋白结构,其在膜中热力学稳定。其通常是包含 几个疏水残基的alpha螺旋。任何跨膜蛋白的跨膜结构域可以用于提供本发明 的跨膜部分。本领域技术人员可以使用tmhmm算法 (http://www.cbs.dtu.dk/services/tmhmm-2.0/)确定蛋白的跨膜结构域的存 在和跨度。此外,考虑到蛋白的跨膜结构域是相对简单的结构,即预测形成 足够长度的疏水alpha螺旋以跨越膜的多肽序列,也可以是用人工设计的tm 结构域(us 7052906 b1描述了合成跨膜组分)。
[0535]
跨膜结构域可以来源于cd28,其产生良好的受体稳定性。
[0536]
跨膜结构域可以来源于人1型。1型跨膜序列示作seq id no.45。
[0537]
seq id no.45
[0538]
iiaiavvgalllvalifgtasyli
[0539]
活化胞内域
[0540]
活化胞内域是car的信号传输部分。在抗原识别后,受体簇,原生cd45 和cd148从突触排除,且信号传输至细胞。最普遍使用的胞内域组分是 cd3-zeta,其含有3个itam。其在抗原结合后传输活化信号至t细胞。cd3-zeta 可能不提供全部完全活化信号,且可能需要另外的共刺激信号。例如,可以 与cd3-zeta一同使用嵌合cd28和ox40,以传输增殖/存活信号,或可以全部 三个一起使用。
[0541]
本发明的细胞包含两种car,每种具有胞内域。
[0542]
第一car的胞内域和第二car的胞内域可以包含:
[0543]
(i)含有itam的胞内域,例如来自cd3 zeta的胞内域;和/或
[0544]
(ii)共刺激结构域,例如来自cd28的胞内域;和/或
[0545]
(iii)传输存活信号的结构域,例如tnf受体家族胞内域例如ox-40或 4-1bb。
[0546]
在一个排列中,共刺激和产生存活信号的结构域在or门中的两个(或 更多个)car之间“共享”。例如,在or门具有两个car(car a和car b) 的情况下,car a可以含有共刺激结构域(例如cd28胞内域)且car b可 以包含tnf受体家族胞内域,例如ox-40或4-1bb。
[0547]
含有itam基序的胞内域在本发明中可以作为活化胞内域。已知几种蛋 白含有具有一个或多个itam基序的胞内域。举几例,此类蛋白的例子包括 cd3 epsilon链,cd3 gamma链和cd3 delta链。itam基序可以被容易地识别, 因为酪氨酸被任意两个其他氨基酸从亮氨酸或异亮氨酸分开,产生标志 (signature)yxxl/i。通常,但不总是这样,两个这些基序被分子的尾部中 的6至8个氨基酸分开(yxxl/ix(6-8)yxxl/i)。因此,本领域技术人员能够容 易地发现含有一个或多个itam以传输活化信号的存在的蛋白。此外,由于 该基序是简单的,且不要求复杂的二级结构,本领域技术人员可以设计含有 人工itam的多肽以传输活化信号(参见wo2000/063372,其涉及合成信号 传导分子)。
[0548]
具有活化胞内域的car的跨膜和细胞内t细胞信号传导结构域(胞内域) 可以包含如seq id no.9、10或11所示的序列,或具有至少80%的序列同一 性的其变体。
[0549]
seq id no.9包含cd28跨膜结构域和cd3 z胞内域
[0550]
fwvlvvvggvlacysllvtvafiifwvrrvkfsrsadapayqqgqnqly nelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmae ayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
[0551]
seq id no.10包含cd28跨膜结构域和cd28和cd3 zeta胞内域
[0552]
fwvlvvvggvlacysllvtvafiifwvrskrsrllhsdymnmtprrpgp trkhyqpyapprdfaayrsrvkfsrsadapayqqgqnqlynelnlgrre eydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkg errrgkghdglyqglstatkdtydalhmqalppr
[0553]
seq id no.11包含cd28跨膜结构域和cd28,ox40和cd3 zeta胞内域
[0554]
fwvlvvvggvlacysllvtvafiifwvrskrsrllhsdymnmtprrpgp trkhyqpyapprdfaayrsrdqrlppdahkppgggsfrtpiqeeqadahs tlakirvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpe mggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyq glstatkdtydalhmqalppr
[0555]
变体序列可以与seq id no.9、10或11具有至少80%、85%、90%、95%、 98%或99%序列同一性,条件是该序列提供了有效的跨膜结构域和有效的细 胞内t细胞信号传导结构域。
[0556]“拆分”or门胞内域
[0557]
本发明提供or门,其中共刺激/存活信号结构域在两个car之间“拆分”。
[0558]
在这个方面,本发明提供细胞,其在细胞表面共表达第一嵌合抗原受体 (car)和第二car,每个car包含细胞内信号传导结构域,其中第一car 的细胞内信号传导结构域包含共刺激结构域;且第二car的细胞内信号传导 结构域包含tnf受体家族胞内域。
[0559]
第一和第二car可以结合不同的抗原。例如,第一car可以结合cd19 且第二car可以结合cd22;或者第一car可以结合cd22且第二car可以结 合cd19。
[0560]
第一car的细胞内信号传导结构域可以包含共刺激结构域且不包含传 输存活信号的结构域(例如tnf受体家族胞内域)。第二car的细胞内信号 传导结构域可以包含tnf受体家族胞内域且不包含共刺激结构域(例如cd28 胞内域)。
[0561]
共刺激结构域可以是cd28共刺激结构域。cd28共刺激结构域可以具有 如seq id no.41所示的序列。
[0562]
seq id no.41(cd28共刺激胞内域)
[0563]
skrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrs
[0564]
本发明的car可以包含如seq id no.41所示的序列的变体,其具有至少 80、85、90、95、98或99%的序列同一性,条件是该变体序列保留了当抗原 识别时共刺激t细胞的能力,即向t细胞提供信号2。
[0565]
tnf受体家族胞内域可以是ox40或4-1bb胞内域。ox40胞内域可以具 有如seq id no.42所示的序列。4-1bb胞内域可以具有如seq id no.43所示 的序列。
[0566]
seq id no.42(ox40胞内域)
[0567]
rdqrlppdahkppgggsfrtpiqeeqadahstlaki
[0568]
seq id no.43(4-1bb胞内域)
[0569]
krgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel
[0570]
本发明的car可以包含如seq id no.42或43所示的序列的变体,其具有 至少80、85、90、95、98或99%的序列同一性,条件是该变体序列保留了当 抗原识别时向t细胞传输存活信号的能力。
[0571]
第一和/或第二car的细胞内信号传导结构域还可以包含含有itam的 结构域,例如cd3 zeta结构域。cd3 zeta结构域可以具有如seq id no.44所 示的序列。
[0572]
seq id no.44(cd3zeta胞内域)
[0573]
rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggk prrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstat kdtydalhmqalppr
[0574]
本发明的car可以包含如seq id no.44所示的序列的变体,其具有至少 80、85、90、95、98或99%的序列同一性,条件是该变体序列保留了当抗原 识别时诱导t细胞信号传导的能力,即向t细胞提供信号1。
[0575]
第一car可以具有以下结构:
[0576]
agb1-间隔区1-tm1-costim-itam
[0577]
其中:
[0578]
agb1是第一car的抗原结合结构域;
[0579]
间隔区1是第一car的间隔区;
[0580]
tm1是第一car的跨膜结构域;
[0581]
costim是共刺激结构域;和
[0582]
itam是含有itam的胞内域。
[0583]“costim”可以是cd28共刺激结构域。
[0584]“itam”可以是cd3 zeta胞内域。
[0585]
第二car可以具有以下结构:
[0586]
agb2-间隔区2-tm2-tnf-itam
[0587]
其中:
[0588]
agb2是第二car的抗原结合结构域;
[0589]
间隔区2是第二car的间隔区;
[0590]
tm2是第二car的跨膜结构域;
[0591]
tnf是tnf受体胞内域;和
[0592]
itam是含有itam的胞内域。
[0593]“tnf”可以是tnf受体胞内域例如ox40或4-1bb胞内域。
[0594]
还提供编码具有“拆分”胞内域的第一和第二嵌合抗原受体(car)两 者的核酸;和包含两种核酸的试剂盒,一种编码第一car且一种编码第二 car,其包含如上文定义的拆分胞内域。
[0595]
共表达位点
[0596]
本发明的第二个方面涉及核酸,其编码第一和第二car。
[0597]
核酸可以产生蛋白,其包含通过切割位点连接的两个car分子。该切割 位点可以是自切割的,使得当多肽产生时,其立即切割为第一和第二car而 不需要任何外部切割活性。
[0598]
多种自切割切割位点是已知的,包括口蹄疫病毒(fmdv)2a肽和相似 序列(donnelly et al,journal of general virology(2001),82,1027
–
1041),例 如来自thoseaasigna病毒的2a样肽,其具有如seq id no.12所示的序列。
[0599]
seq id no.12
[0600]
raegrgslltcgdveenpgp
[0601]
共表达序列可以是内部核糖体进入序列(ires)。共表达序列可以是内 部启动子。
[0602]
细胞
[0603]
本发明涉及细胞,其在细胞表面共表达第一car和第二car,其中一个 car结合cd19且另一个car结合cd22。
[0604]
细胞可以是能够在细胞表面表达car的任何真核细胞,例如免疫细胞。
[0605]
特别地,细胞可以是免疫效应细胞例如t细胞或自然杀伤(nk)细胞。
[0606]
t细胞或t淋巴细胞是在细胞介导的免疫中发挥中心作用的淋巴细胞类 型。通过细胞表面t细胞受体(tcr)的存在,它们可以与其它淋巴细胞例 如b细胞和自然杀伤细胞(nk细胞)区分。存在多种类型的t细胞,如下文 总结的。
[0607]
辅助性t辅助细胞(th细胞)在免疫学过程中辅助其他白细胞,包括b 细胞成熟为浆细胞和记忆b细胞,以及活化细胞毒性t细胞和巨噬细胞。th 细胞在其表面表达cd4。当它们通过抗原呈递细胞(apc)表面上的mhc ii 类分子呈递肽抗原时,th细胞被激活。这些细胞可以分化成几种亚型之一, 包括th1,th2,th3,th17,th9或tfh,其分泌不同的细胞因子
以促进 不同类型的免疫应答。
[0608]
细胞毒性t细胞(tc细胞或ctl)破坏病毒感染的细胞和肿瘤细胞,并 且也涉及移植排斥。ctl在其表面表达cd8。这些细胞通过与存在于所有有 核细胞表面上的mhc i类相关的抗原结合而识别其靶标。通过调节性t细胞 分泌的il-10,腺苷和其他分子,可以将cd8+细胞失活至无能力状态,其防 止自身免疫疾病,如实验性自身免疫性脑脊髓炎。
[0609]
记忆t细胞是抗原特异性t细胞的子集,其在感染已经解决之后长期持 续。它们在再次暴露于其同源(cognate)抗原后迅速扩增为大量效应t细胞, 从而为免疫系统提供了针对过去感染的“记忆”。记忆t细胞包括三种亚型: 中央记忆t细胞(tcm细胞)和两种类型的效应记忆t细胞(tem细胞和 temra细胞)。记忆细胞可以是cd4+或cd8+。记忆t细胞通常表达细胞表 面蛋白cd45ro。
[0610]
以前称为抑制性t细胞的调节性t细胞(treg细胞)对于维持免疫耐受性 至关重要。它们的主要作用是关闭t细胞介导的免疫以朝向免疫反应的结束, 和抑制逃避胸腺阴性选择过程的自身反应性t细胞。
[0611]
已经描述了两种主要类型的cd4+treg细胞-天然发生的treg细胞和适应 性treg细胞。
[0612]
天然存在的treg细胞(也称为cd4+cd25+foxp3+treg细胞)出现在胸 腺中,并与已经与发育中的t细胞和已经用tslp激活的骨髓(cd11c+)和 浆细胞样(cd123+)树突状细胞之间的相互作用相关。天然存在的treg细 胞可以通过称为foxp3的细胞内分子的存在与其它t细胞区分开来。foxp3 基因的突变可以阻止调节性t细胞发育,导致致命的自身免疫性疾病ipex。
[0613]
适应性treg细胞(也称为tr1细胞或th3细胞)可以在正常免疫应答期间 产生。
[0614]
本发明的t细胞可以是上述任何t细胞类型,特别是ctl。
[0615]
自然杀伤(nk)细胞是形成先天免疫系统一部分的一类细胞溶解性细 胞。nk细胞以不依赖于mhc的方式对来自病毒感染细胞的先天信号提供快 速应答。
[0616]
nk细胞(属于先天性淋巴细胞群)被定义为大颗粒淋巴细胞(lgl), 并构成从产生b和t淋巴细胞的共同淋巴祖细胞分化的第三种细胞。已知nk 细胞在骨髓,淋巴结,脾,扁桃体和胸腺中分化和成熟,然后它们进入循环。
[0617]
本发明的car细胞可以是上述任何细胞类型。
[0618]
表达car的细胞,例如表达car的t细胞或nk细胞可以从患者自己的外 周血(第一方)离体产生,或在来自供体外周血的造血干细胞移植(第二方) 的设置中产生,或来自不相关供体的外周血(第三方)。
[0619]
本发明还提供了包含根据本发明的表达car的t细胞和/或表达car的 nk细胞的细胞组合物。可以通过使用根据本发明的核酸体外转导血液样品 来制备细胞组合物。
[0620]
或者,表达car的细胞可以衍生自诱导型祖细胞或胚胎祖细胞体外分化 为相关细胞类型例如t细胞。或者,可以使用保留其溶解功能并且可以用作 治疗剂的永生化细胞系,例如t细胞系。
[0621]
在所有这些实施方案中,通过包括使用病毒载体转导,使用dna或rna 转染的许多方式之一引入编码car的dna或rna来生成car细胞。
[0622]
本发明的car t细胞可以是来自受试者的离体t细胞。t细胞可以来自外 周血单核
细胞(pbmc)样品。t细胞可以在用编码car的核酸转导之前活 化和/或扩增,例如通过用抗cd3单克隆抗体处理。
[0623]
本发明的car t细胞可以如下制备:
[0624]
(i)从受试者或上文列出的其它来源分离含t细胞的样品;和
[0625]
(ii)用编码第一和第二car的一种或多种核酸序列转导或转染t细胞。
[0626]
然后可以通过纯化,例如基于第一和第二car的共表达来选择t细胞。
[0627]
核酸序列
[0628]
本发明的第二个方面涉及一种或多种核酸序列,其编码如本发明的第一 个方面定义的第一car和第二car。
[0629]
核酸序列可以是例如rna,dna或cdna序列。
[0630]
核酸序列可以编码结合cd19的一种嵌合抗原受体(car)和结合cd22 的另一种car。
[0631]
核酸序列可以具有以下结构:
[0632]
agb1-间隔区1-tm1-coexpr-abb2-间隔区2-tm2
[0633]
其中
[0634]
agb1是编码第一car的抗原结合结构域的核酸序列;
[0635]
间隔区1是编码第一car的间隔区的核酸序列;
[0636]
tm1是编码第一car的跨膜结构域的核酸序列;
[0637]
coexpr是使得能够共表达两种car的核酸序列;
[0638]
agb2是编码第二car的抗原结合结构域的核酸序列;
[0639]
间隔区2是编码第二car的间隔区的核酸序列;
[0640]
tm2是编码第二car的跨膜结构域的核酸序列;
[0641]
该核酸序列,当在t细胞中表达时,编码在切割位点剪切的多肽,使得 第一和第二car在t细胞表面共表达。
[0642]
第一car可以结合cd19且第二car可以结合cd22。或者,第一car可 以结合cd22且第二car可以结合cd19。
[0643]
为了避免同源重组,可以在编码相同或相似的氨基酸序列的序列区域中 使用替代密码子。
[0644]
由于密码子的简并性,有可能使用编码相同氨基酸序列的替代密码子。 例如,密码子“ccg”和“cca”两者都编码氨基酸脯氨酸,因此使用的“ccg
”ꢀ
可以交换为“cca”而不影响翻译的蛋白序列中该位置的氨基酸。
[0645]
可以用于编码每种氨基酸的替代密码子总结于表3中。
[0646]
表3
[0647][0648]
替代密码子可用于编码第一car的间隔区和第二car的间隔区的核酸 序列部分中,特别是如果在第一和第二car中使用相同或相似的间隔区。图 4显示编码间隔区hch2ch3-铰链的两个序列,其中一个已经使用了替代密 码子。
[0649]
替代密码子可用于编码第一car的跨膜结构域和第二car的跨膜的核 酸序列部分中,特别是如果在第一和第二car中使用相同或相似的跨膜结构 域。图4显示编码cd28跨膜结构域的两个序列,其中一个已经使用了替代密 码子。
[0650]
替代密码子可用于编码第一car的胞内域的全部或部分和编码第二 car的胞内域的全部或部分的核酸序列部分中。替代密码子可用于cd3 zeta 胞内域。图4显示了编码cd3 zeta胞内域的两个序列,其中一个已经使用了替 代密码子。
[0651]
替代密码子可以用于一个或多个共刺激结构域中,例如cd28胞内域。
[0652]
替代密码子可用于传输存活信号的一个或多个结构域,例如ox40和 41bb胞内域。
[0653]
可以在编码cd3 zeta胞内域的核酸序列的部分和/或编码一个或多个共 刺激结构域的核酸序列的部分和/或编码传输存活信号的一个或多个结构域 的核酸序列的部分中使用替代密码子。
[0654]
载体
[0655]
本发明还提供载体,或载体的试剂盒,其包含一个或多个编码car的核 酸序列。此类载体可以用于将核酸序列引入宿主细胞中使得其能够表达第一 和第二car。
[0656]
载体可以是比如质粒或病毒载体,例如逆转录病毒载体或慢病毒载体, 或基于载体或合成mrna的转座子。
[0657]
载体可以能够转染或转导t细胞。
[0658]
药物组合物
[0659]
本发明还涉及药物组合物,其含有多种根据本发明的第一个方面的表达 car的细胞,例如t细胞或nk细胞。药物组合物可以另外包含药学上可接受 的载体,稀释剂或赋形剂。药物组合物可以任选地包含一种或多种另外的药 学活性多肽和/或化合物。此类剂型可以是例如以适合用于静脉输注的形式。
[0660]
治疗方法
[0661]
本发明的细胞能够杀伤癌细胞,例如b细胞淋巴瘤细胞。表达car的细 胞,例如表达t细胞,可以从患者自己的外周血(第一方)离体产生,或在 来自供体外周血的造血干细胞移植(第二方)的设置中产生,或来自不相关 供体的外周血(第三方)。或者,car t细胞可以衍生自诱导型祖细胞或胚 胎祖细胞体外分化为t细胞。在这些情况下,通过包括使用病毒载体转导, 使用dna或rna转染的许多方式之一引入编码car的dna或rna来生成 car t细胞。
[0662]
本发明的细胞可以能够杀伤靶细胞,例如癌细胞。靶细胞可以通过cd19 或cd22的表达识别,。
[0663]
表4.淋巴性白血病上淋巴抗原的表达
[0664][0665][0666]
取自campana等人,(immunophenotyping of leukemia.j.immunol. methods 243,59
–
75(2000))。cig μ-胞质免疫球蛋白重链;sig μ-表面免疫球 蛋白重链。
[0667]
普遍研究的淋巴抗原在不同类型的b细胞白血病上的表达与b细胞个体 发生紧密相关(参见图2)。
[0668]
本发明的t细胞可以用于治疗癌症,特别是b细胞恶性肿瘤。
[0669]
表达cd19或cd22的癌症的例子是b细胞淋巴瘤,包括霍奇金淋巴瘤和 非霍奇金淋巴瘤;和b细胞白血病。
[0670]
例如,b细胞淋巴瘤可能是扩散性大b细胞淋巴瘤(dlbcl),滤泡淋巴 瘤,边缘区淋巴瘤(mzl)或粘膜相关淋巴组织淋巴瘤(malt),小细胞 淋巴细胞性淋巴瘤(与慢性淋巴细胞性白血病重叠),mantle细胞淋巴瘤 (mcl),burkitt淋巴瘤,原发性纵膈(胸腺)大b细胞淋巴瘤,淋巴浆细胞 性淋巴瘤(可能表现为巨球蛋白血症),淋巴结边缘区b细胞淋 巴瘤(nmzl),脾边缘区淋巴瘤(smzl),血管内大b细胞淋巴瘤,原发性 渗液淋巴瘤,淋巴瘤样肉芽肿病,t细胞/组织细胞丰富的大b细胞淋巴瘤或 原发性中枢神经系统淋巴瘤。
[0671]
b细胞白血病可能是急性淋巴细胞白血病,b细胞慢性淋巴细胞白血病, b细胞前淋巴细胞白血病,前体b淋巴细胞性白血病或毛细胞白血病。
[0672]
b细胞白血病可能是急性淋巴细胞白血病。
gtctattattgtgcgcgtcatagtggctacggtagtagctacggggttttgtttgcttactggggccaa ggaaccctggtcaccgtctcctcaggtggaggcggttcaggcggaggtggctctggcggtggcggatcg gacatccagatgactcagtctccgtcctccctgtctgcatctgtaggagaccgcgtcaccatcacctgc cgtgcaagtcaggacattagcaattatttaaactggcttcaacagaaaccggggaaagccccgaagctc ctgatttactacacatcaatcttacactcaggagtcccgtcacgcttcagcggcagtggatctgggaca gaattcactctcacaatcagcagcctgcagccggaagattttgcaacttattactgtcaacagggtaat acgcttccgtggacgtttggccaggggaccaaactggaaatcaaacgttcggatccagccgaaccaaag agccccgataagacccacacctgtcccccctgcccagccccagagctgctgggaggccccagcgtgttt ctgtttccacccaagccaaaggataccctgatgattagtagaacacccgaagtgacctgtgtggtggtg gatgtgtctcacgaggaccccgaggtgaaatttaattggtatgttgatggtgttgaagtgcacaacgcc aaaaccaaacccagagaggagcagtacaattctacctatagagtcgtgtctgtgctgacagtgctgcat caggattggctgaacggaaaagaatacaaatgtaaagtgagcaataaggccctgcccgctccaattgag aagacaattagcaaggccaagggccagccaagggagccccaggtgtatacactgccacccagtagagac gaactgacaaagaatcaggtgtctctgacatgtctggtgaagggattttacccatctgatatcgccgtg gaatgggaatctaacggccagcccgagaataactataagacaaccccaccagtgctggatagcgatggc agcttttttctgtattctaagctgacagtggataagtcccggtggcagcagggaaatgtgtttagctgt agtgtcatgcatgaggccctgcacaatcactatacccagaaatctctgagtctgagcccaggcaagaag gaccccaagttctgggtcctggtggtggtgggaggcgtgctggcctgttactctctcctggtgaccgtg gccttcatcatcttttgggtgcgctcccgggtgaagttttctcgctctgccgatgccccagcctatcag cagggccagaatcagctgtacaatgaactgaacctgggcaggcgggaggagtacgacgtgctggataag cggagaggcagagaccccgagatgggcggcaaaccacggcgcaaaaatccccaggagggactctataac gagctgcagaaggacaaaatggccgaggcctattccgagatcggcatgaagggagagagaagacgcgga aagggccacgacggcctgtatcagggattgtccaccgctacaaaagatacatatgatgccctgcacatg caggccctgccacccagatga
[0679]
seq id no:14
[0680]
mslpvtalllplalllhaarpypydvpdyaslsggggsqvqlvqsgaevkkpgasvkvsckasgytfts nwmhwvrqapgqglewmgeidpsdsytnynqkfkgrvtitvdksastaymelsslrsedtavyycargs npyyyamdywgqgtlvtvssggggsggggsggggseivltqspatlslspgeratlscsassgvnymhw yqqkpgqaprrwiydtsklasgvparfsgsgsgtsyslti sslepedfavyychqrgsytfgggtklei krsdptttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdifwvlvvvggvlacysllv tvafiifwvrrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqegly nelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprraegrgslltcgdvee npgpmefglswlflvailkgvqcevqlvesggglvqpggslrlscaasgfafsiydmswvrqvpgkgle wvsyissgggttyypdtvkgrftisrdnsrntldlqmnslrvedtavyycarhsgygssygvlfaywgq gtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqdisnylnwlqqkpgkapkl liyytsilhsgvpsrfsgsgsgteftltisslqpedfatyycqqgntlpwtfgqgtkleikrsdpaepk spdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhna ktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrd eltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfsc svmhealhnhytqkslslspgkkdpkfwvlvvvggvlacysllvtvafiifwvrsrvkfsrsadapayq qgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrg kghdglyqglstatkdtydalhmqalppr
[0681]
为了证明两种car的共表达,使用表位标签(分别为ha或v5)标记每 种car的scfv。此随后的单个可读框克隆到sfg逆转录病毒载体中。使用该 载体转导t细胞且通过使用抗ha和抗v5染色并通过流式细胞术研究表达,可 以在表达该基因盒的t细胞表面检测到两种car。
[0682]
接着,使用靶细胞挑战表达cd19 or cd22 car门的t细胞,所述靶细 胞都不表达两种抗原,表达两种抗原,或表达一种抗原,连同不表达car, 或仅单独表达抗cd19 car,或单独抗cd22 car的对照t细胞。我们发现, or门的car t细胞能够杀伤表达任一种或两种靶抗原的靶细胞(图5)。
[0683]
实施例2-cd19 alab和cd22alab的鉴定和表征
[0684]
鉴定了cd19结合子(cd19 alab),人源化,且鉴定了鼠和人源化igg 和scfv的亲和力并与“金标准“抗cd19结合子fmc63比较。平行地,鉴定了 cd22结合子(cd22alab),人源化,且鉴定了鼠和人源化igg和scfv的亲和 力并与“金标准“抗cd22结合子m971比较。
[0685]
在biacore t200上进行了实验,使用hbs-p作为运行和稀释缓冲液。使用 biaevaluation软件2.0版用于数据处理。对于结合动力学,将小鼠抗人igg/ 山羊抗小鼠igg共价偶联到cm5传感器芯片上。捕获igg或scfv-fc蛋白,并 以30μl/min的流速在流动池上注入各种浓度的相互作用配对蛋白。通过根据 1:1langmuir结合模型的曲线拟合获得动力学速率常数。使用其中捕获抗体 已经固定在与活性表面相同的水平上的空白对照流动池减去体积折射率差 异(bulk refractive index)。使用仅缓冲液进行双参考减法(double referencesubtraction)。
[0686]
结果示于图6至图8。
[0687]
数据显示人源化cd22alab具有与鼠cd22alab对cd22相似的结合亲 和力(图6)和相似的结合动力学。scfv形式的鼠和人源化cd22alab具有 比金标准cd22结合抗体m971显著更高的对cd22的结合亲和力(图6)。
[0688]
尽管发现igg形式的鼠和人源化cd19alab的结合亲和力是相似的(数 据未显示),令人惊讶的是,发现scfv形式的人源化cd19alab的结合亲和 力高于鼠cd19alab(图7)。cd19alab的结合亲和力与金标准抗cd19 ab, fmc63的结合亲和力相当(可能略好)(图8)。
[0689]
实施例3-使用cd19alab/fmc63 car和cd22alab/m971 car进行的比较功能测定
[0690]
car的抗原结合结构域可以影响其功能。在本研究中,创建了包含 cd19alab和cd22alab的car,并且将功能与具有基于fmc63或m971的抗 原结合结构域的等同car进行比较。
[0691]
包含基于fmc63(抗cd19)和m971(抗cd22)的scfv的car可以认为 是金标准抗体,因为两种car处于临床开发中。
[0692]
基于cd19alab,fmc63,cd22alab和m971构建和表达car。它们的 结构如图9所示。car仅在其抗原结合结构域中不同。在所有构建体中,使 用cd8茎部间隔区将结合结构域连接到膜上,并含有来自41bb和cd3-zeta 的细胞内活化基序。
[0693]
通过用编码car,gag/pol和包膜蛋白rd114的质粒瞬时转染293t细胞产 生逆转录病毒。3天后收获上清液,并用于在纤维连接蛋白包被的板上使用 相同滴度的逆转录病毒转导经pha/il2活化的pbmc。转导后6天通过流式细 胞术证实car表达,并将pbmc与cd19+bfp supt1细胞(fmc63和 cd19alab car)或cd22+bfp supt1细胞(m971和cd22alab car)以
1: 1的比例共培养。一天和三天后测定靶细胞杀伤。在一天和三天后,还除去 上清液并通过elisa测定干扰素-γ水平。
[0694]
结果如图10和11所示。
[0695]
如图10所示,具有cd19alab抗原结合结构域的car比具有fmc63结合 结构域的等同car在第1天和第3天给出更多的对cd11+ve靶细胞的杀伤(图 10)。
[0696]
关于cd22,具有cd22alab抗原结合结构域的car在三天后比具有m971结合结构域的等同car给出更多的对cd22+ve靶细胞的杀伤(图11a)。 在同一时间段后,cd22alab car的ifnγ释放显著高于m971 car。
[0697]
因此,具有基于cd19alab和cd22alab的抗原结合结构域的car在靶 细胞杀伤方面相比基于fmc63和m971的等同car具有改善的特性。
[0698]
鉴于如上文所述haso等人(2013年)报道的结果,cd22alab结果是特 别令人惊讶的。在该研究中,制备并测试了不同的抗cd22 car,其具有基 于抗cd22抗体ha22,bl22和m971的结合结构域。ha22和bl22 scfv结合 cd22的ig结构域3,而m971结合cd22的ig结构域5-7内(参见haso等人(2013) 中的图2b)。据报道,m971衍生的car显示出比ha22衍生的car优异的靶 细胞杀伤活性,该发现归因于car靶向的cd22表位的重要性(haso等人 (2013)第1168页,最后一段)。得出结论,靶向cd22的膜近端结构域是开 发高度活性的抗cd22 car的“关键因素”(discussion,最后一段)。与此发 现相反,本文图11所示的数据表明cd22alab,其靶向cd22的ig结构域3中 的表位-与m9712靶向的ig结构域5-7相比的“膜远端”表位-具有比基于m971 的抗cd22 car优异的靶细胞杀伤能力。
[0699]
实施例4-研究具有不同胞内域组合的or门构建体
[0700]
如图13所示开发了四种or门构建体。它们都编码具有相同抗原结合结 构域,间隔区结构域和跨膜结构域的cd19/cd22 or门:构建体之间的仅有 区别是在胞内域中,其如下表所示:
[0701]
构建体cd19 car胞内域cd22 car胞内域a41bb-cd3ζ41bb-cd3ζbox40-cd3ζox40-cd3ζc41bb-cd3ζcd28-cd3ζdox40-cd3ζcd28-cd3ζ
[0702]
如上文所述测定表达每种cd19/cd22 or门的细胞体外杀伤raji细胞的 能力。将表达各种or门组合的转导的pbmc与cd19+/cd22+raji靶细胞以1: 1和1:10的效应细胞:靶细胞比率共培养72小时。
[0703]
结果如图14所示。发现所有四种or门比fmc63和m971 car显著更好地 杀伤靶细胞。使用1:10效应细胞:靶细胞比率,显示“拆分”胞内域or门, 其具有一个car上的4-1bbzeta/ox40 zeta和另一个car上的cd28zeta,具有 最好的杀伤活性。
[0704]
上述说明书中提及的所有出版物通过引用并入本文。在不脱离本发明的 范围和精神的情况下,本发明的所述方法和系统的各种修改和变化对于本领 域技术人员将是显而易见的。虽然已经结合具体的优选实施例描述了本发 明,但是应当理解,所要求保护的本发明不应被不适当地限于这些具体实施 例。实际上,对于分子生物学,细胞生物学或相关领域的技术人员显而易见 的用于实施本发明的所述模式的各种修改意图在所附权利要
求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1