一种可提供细胞内参信号的金刺纳米探针、制备方法及应用
1.本发明属于纳米生物材料合成技术领域,具体涉及一种可提供细胞内参信号的金刺纳米探针、制备方法及应用。
背景技术:
2.sers可以将目标的拉曼信号增强到12个数量级,产生单分子水平的灵敏度和分子指纹特异性。sers在循环肿瘤细胞、循环肿瘤dna/rna等生物标志物的超敏感检测方面已被广泛研究。用于检测rna或dna的经典sers纳米探针是由纳米颗粒、mbs和稳定剂合成的。随着构象的改变,mbs携带的拉曼报告分子会远离纳米颗粒,从而改变拉曼信号,从而实现对靶标的检测。
3.虽然纳米探针替代基于小分子的探针可以显著提高目标分子的检测和成像能力,但仍存在不少重大挑战。传统的光学纳米探针主要依靠“始终开启”或“始终关闭”的信号转导模式来检测目标分子。而这种依赖单一靶标和单一信号强度的纳米探针在检测过程中可能会受到与靶标扥自浓度无关的非特异性干扰的影响。这些非特异性性干扰包括(1)探针递送和洗脱不均匀和洗脱不良;(2)在良性组织和病变组织中探针的渗透性和滞留性的变化;(3)检测环境如检测中光源距离、角度、激光器性能等对检测结果的影响;(4)纳米探针的非特异性脱靶结合。这些非特异性干扰均可以引起与靶标浓度无关的信号变化和误导性的成像,因此传统依赖单一信号的纳米探针可能会产生不准确的检测和成像结果。
4.内标法(is)被认为是校正测量条件和样品干扰引起的信号波动的一种有效的比率策略。许多以往的体内研究表明,比率sers纳米传感器可以提供更高的灵敏度、特异性和可靠性。然而,细胞核酸检测仍然存在与靶标核酸浓度无关的细胞间差异,例如纳米探针的细胞摄取量和检测条件下的细胞数量难以一致等。因此,使用现有的比率sers纳米探针在没有细胞内参信号进行参考下,检测目标核酸在细胞中的相对表达水平仍有困难。
技术实现要素:
5.本发明的目的在于克服现有技术的不足,提供一种可提供细胞内参信号的金刺纳米探针、制备方法及其应用。
6.本发明的第一个目的是提供一种可提供细胞内参信号的金刺纳米探针,该金刺纳米探针由海胆状结构的拉曼增强金刺纳米颗粒内核和复合在拉曼增强金刺纳米颗粒表面的分子信标外壳组成。
7.优选的,所述拉曼增强金刺纳米颗粒通过以下方法制备得到:
8.s21、将甘油和超纯水混合,在95℃下,搅拌10分钟,接着依次加入硝酸银溶液和柠檬酸钠溶液,在90~95℃下搅拌反应1h,反应结束后,冷却至室温,得到银种子纳米颗粒,将银种子纳米颗粒离心、洗涤、超纯水重悬,得到银种子溶液,所述硝酸银和柠檬酸钠的质量比为9:50;
9.s22、将氯金酸与超纯水混合,降温至15℃以下,搅拌反应10min,加入步骤s1得到
的银种子溶液,并加入左旋多巴溶液,于冰浴中搅拌反应10min,反应结束后,得到拉曼增强金刺纳米颗粒。
10.优选的,所述分子信标包括两种可结合单链核酸并发生信号转换的分子信标,两种分子信标分别为可识别肿瘤标志物tk1mrna的tk1分子信标和可识别细胞内参gapdhmrna的gapdh分子信标tk1分子信标的结构为:5’hex
‑
acgacgccagggagaacagaaaccgtcgt
‑3’
sh,gapdh分子信标的结构为:5’fam
‑
cgacggagtccttccacgataccacgtcg
‑3’
sh,tk1分子信标和gapdh分子信标的摩尔比为1~5:5~1。
11.本发明的第二个目的是提供一种上述金刺纳米探针的制备方法,包括以下步骤:
12.s1、拉曼增强金刺纳米颗粒的制备
13.s11、将甘油和超纯水混合,在95℃下,搅拌10分钟,接着依次加入硝酸银溶液和柠檬酸钠溶液,在90~95℃下搅拌反应1h,反应结束后,冷却至室温,得到银种子纳米颗粒,将银种子纳米颗粒离心、洗涤、超纯水重悬,得到银种子溶液,所述硝酸银和柠檬酸钠的质量比为9:50;
14.s12、将氯金酸与超纯水混合,降温至15℃以下,搅拌反应10min,加入步骤s1得到的银种子溶液,并加入左旋多巴溶液,于冰浴中搅拌反应10min,反应结束后,得到拉曼增强金刺纳米颗粒,然后离心、洗涤、重悬,得到拉曼增强金刺纳米颗粒溶液;
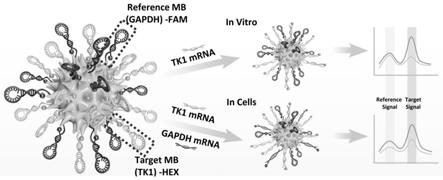
15.s2、金刺纳米探针的制备
16.将步骤s1得到的拉曼增强金刺纳米颗粒溶液和分子信标溶液混合,搅拌4h,接着加入十二烷基硫酸钠溶液和磷酸盐缓冲液,搅拌孵育10小时以上,加入nacl溶液,连续搅拌4小时以上,离心分离1min,然后将甲氧基聚乙二醇巯基添加到悬浮液中,用超纯水重悬,即得到金刺纳米探针。
17.优选的,步骤s2中,所述拉曼增强金刺纳米颗粒溶液中的拉曼增强金刺纳米颗粒与分子信标溶液中的分子信标的摩尔比为1:15。
18.优选的,步骤s2中,所述十二烷基硫酸钠溶液的浓度为0.1%,磷酸盐缓冲液的浓度和ph分别为0.1m和7.4。
19.优选的,步骤s2中,所述拉曼增强金刺纳米颗粒溶液的浓度为10
‑
13
m,分子信标溶液的浓度为10
‑7m。
20.优选的,步骤s2中,所述分子信标溶液通过将分子信标溶解于三(2
‑
羧乙基)膦溶液中制备得到。
21.本发明的第三个目的是提供上述金刺纳米探针在体液中微量核酸检测中的应用。
22.本发明与现有技术相比,其有益效果在于:
23.(1)本发明提供的金刺纳米探针通过在表面拉曼增强基地上加入了检测细胞内参核酸信号的分子信标,能够提供内参拉曼信号,在检测中,内参拉曼信号能够去除检测中的非特异性干扰,如检测时激光器性能、探针密度、环境温度等,提高了检测的精度,同时内参信号的加入还能够通过拉曼信号实现对靶标核酸相对表达量的检测;
24.(2)本发明中通过制备得到的海胆状结构的金刺纳米作为内核,特殊的刺状形貌使颗粒表面存在诸多电磁增强场,从而使刺状纳米相较于传统纳米颗粒能够提供更优良的表面拉曼增强能力;
25.(3)本发明首次构建了一种可提供细胞内参信号的sers纳米探针,可同时检测目
标核酸单链信号及细胞内参信号,将细胞内参信号作为内标对目标核酸检测信号进行归一化处理,可有效去除检测过程中激光工作距离、激光功率、表面粗糙度甚至分子结构等诸多非特异性干扰因素的影响,从而增加检测灵敏度、特异性、可靠性,同时细胞内参信号的加入可有效去除细胞探针摄取量和检测条件下细胞数量等细胞间差异因素对检测结果的影响,并确定靶标核酸在细胞中的相对表达水平。
附图说明
26.图1为本发明实施例提供的可提供细胞内参信号的金刺纳米探针对体液中微量核酸检测的示意图;
27.图2为本发明实施例1中的拉曼增强金刺纳米颗粒的扫描电镜图片;
28.图3为本发明实施例1中的拉曼增强金刺纳米颗粒的电磁场时域有限差分成图;
29.图4为单连接tk1分子信标(au
‑
tk1mb)、单连接gapdh分子信标(au
‑
gapdhmb)和本发明实施例1同时连接两种分子信标的比率探针的拉曼图;
30.图5为本发明实施例1
‑
3和对比例1和2制备得到的au
‑
ismb的拉曼光谱图;
31.其中,图5(a)为不同分子信标投料比制备au
‑
ismb纳米探针的sers信号图;图5(b)为不同投料比下hex和fam的sers强度图;图5(c)为不同投料比下的sers比值图;
32.图6为本发明实施例1
‑
3和对比例1和2制备得到的au
‑
ismb的拉曼信号强度比率化处理图;
33.图7为本发明实施例1
‑
3和对比例1和2制备得到的au
‑
ismb与不同浓度tk1模板链共孵后的sers信号检测图;
34.图8为本发明实施例1制备得到的au
‑
ismb的sers信号和mapping图;
35.其中,图8(a)为au
‑
ismb纳米探针在745cm
‑1(hex)处的sers信号图;图8(b)为单纯依赖hexsers信号的mapping图;图8(c)为au
‑
ismb纳米探针比率化处理后(i745/i645)的sers信号;图8(d)为au
‑
ismb纳米探针比率化处理后的mapping图;
36.图9为本发明实施例1制备得到的au
‑
ismb与梯度浓度靶标模板链共孵后的拉曼光谱、sers信号以及sers比值变化图;
37.其中,图9(a)为au
‑
ismb在不同浓度目标序列存在下的拉曼光谱图;图9(b)为au
‑
mb(745cm
‑1)在存在不同浓度目标序列时的sers信号变化图;图9(c)为au
‑
ismb的sers比值变化图;
38.图10为本发明实施例1制备得到的au
‑
ismb的检测特异性图;
39.图11为本发明实施例1制备得到的au
‑
ismb的耐核酶稳定性图。
具体实施方式
40.下面将参照附图更详细地描述本公开的示例性实施例。虽然附图中显示了本公开的示例性实施例,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施例所限制。相反,提供这些实施例是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。
41.实施例1
42.本发明实施例提供的可提供细胞内参信号的金刺纳米探针,具体由海胆状结构的
拉曼增强金刺纳米颗粒内核和复合在拉曼增强金刺纳米颗粒表面的分子信标外壳组成。
43.拉曼增强金刺纳米颗粒具体通过以下方法制备得到:
44.s21、将70ml甘油和30ml超纯水混合,在95℃下,搅拌10分钟,接着依次加入2ml浓度为9mg/ml的硝酸银溶液和10ml浓度为10mg/ml的柠檬酸钠溶液,在95℃下搅拌反应1h,反应结束后,冷却至室温,得到粒径为30nm的银种子纳米颗粒,将银种子纳米颗粒在12,000rpm的转速下离心12min,超纯水洗涤3次,然后于1ml超纯水中重悬后避光于4℃保存,得到银种子溶液;
45.s22、将7.2ml浓度为10mm的氯金酸溶液与12.8ml的超纯水混合,降温到15℃以下,在300rpm下搅拌反应10min,加入1ml步骤s1得到的银种子溶液,并加入7.2ml浓度为10mm的左旋多巴溶液,于冰浴下,在100转/分的速度下搅拌反应10min,在此过程中,混合物的颜色由浅黄色变为深棕色,反应结束后,得到拉曼增强金刺纳米颗粒。
46.本发明实施例中的分子信标包括两种可结合单链核酸并发生信号转换的分子信标,两种分子信标分别为可识别肿瘤标志物tk1mrna的tk1分子信标和可识别细胞内参gapdhmrna的gapdh分子信标tk1分子信标的结构为:5’hex
‑
acgacgccagggagaacagaaaccgtcgt
‑3’
sh,gapdh分子信标的结构为:5’fam
‑
cgacggagtccttccacgataccacgtcg
‑3’
sh,tk1分子信标和gapdh分子信标的摩尔比为1:1。本发明实施例中对上述所述的两种分子信标的来源没有特别限制,以本领域技术人员熟知的此类所述单链rna分子的制备方法制备即可,或从市场上购买均可。
47.本发明实施例还提供了一种上述金刺纳米探针的制备方法,具体包括以下步骤:
48.s1、拉曼增强金刺纳米颗粒的制备
49.s11、将70ml甘油和30ml超纯水混合,在95℃下,搅拌10分钟,接着依次加入2ml浓度为9mg/ml的硝酸银溶液和10ml浓度为10mg/ml的柠檬酸钠溶液,在95℃下搅拌反应1h,反应结束后,冷却至室温,得到粒径为30nm的银种子纳米颗粒,将银种子纳米颗粒在12,000rpm的转速下离心12min,然后超纯水洗涤3次,然后于1ml超纯水中重悬后避光于4℃保存,得到银种子溶液;
50.s12、将7.2ml浓度为10mm的氯金酸溶液与12.8ml超纯水混合,降温到15℃,在300rpm下搅拌反应10min,加入1ml步骤s1得到的银种子溶液,并加入7.2ml浓度为10mm的左旋多巴溶液,于冰浴下,在100转/分的速度下搅拌反应10min,在此过程中,混合物的颜色由浅黄色变为深棕色,反应结束后,得到拉曼增强金刺纳米颗粒,然后在3500rpm下离心1min,用甲酸、氨水和超纯水洗涤多次,超纯水重悬,并于4℃冰箱中避光保存,得到拉曼增强金刺纳米颗粒溶液,拉曼增强金刺纳米颗粒溶液的浓度为10
‑
13
m;
51.s2、金刺纳米探针的制备
52.将步骤s1得到的拉曼增强金刺纳米颗粒溶液和浓度为10
‑7m的分子信标溶液混合(拉曼增强金刺纳米颗粒与分子信标的摩尔比为1:15),振荡4h,接着加入0.1%的十二烷基硫酸钠溶液和0.1m的磷酸盐缓冲液(ph7.4),使十二烷基硫酸钠溶液和磷酸盐缓冲液的最终浓度分别为0.01%和0.01m,在25℃下搅拌孵育10小时以上,分为10次加入0.1m的nacl溶液,使最终溶液中的na浓度达到0.1mol/l,连续搅拌4小时以上,3500rpm离心分离1min,得到悬浮液,然后将甲氧基聚乙二醇巯基添加到悬浮液中,用超纯水重悬,即得到金刺纳米探针。
53.分子信标溶液通过将摩尔比为1:1的tk1分子信标和gapdh分子信标溶解于三(2
‑
羧乙基)膦溶液中制备得到。
54.实施例2
55.本发明实施例与实施例1的结构和制备方法均相同,区别仅在于tk1分子信标和gapdh分子信标的摩尔比为5:1。
56.实施例3
57.本发明实施例与实施例1的纳米探针结构和制备方法均相同,区别仅在于tk1分子信标和gapdh分子信标的摩尔比为1:5。
58.对比例1
59.该对比例与实施例1的纳米探针制备方法相同,区别仅在于tk1分子信标和gapdh分子信标的摩尔比为10:1。
60.对比例2
61.该对比例与实施例1的纳米探针制备方法相同,区别仅在于tk1分子信标和gapdh分子信标的摩尔比为1:10。
62.如图1所示,本发明实施例1
‑
3提供的金刺纳米探针在金刺纳米表面通过au
‑
s键包被上识别gapdh的带有fam内参分子信标(gapdhmb)并作为拉曼信号报告分子,以及识别目的检测核酸(tk1ssdna/mrna)的靶标分子信标并连接hex作为报告分子(tk1mb)。当探针与靶标单链结合后其拉曼报告分子的拉曼信号将发生下降。在细胞实验,gapdh分子信标的所携带的fam作为内参信号可提供细胞内参信号,去除非特异性干扰提高检测性能。
63.如图2所示,本发明实施例1中的拉曼增强金刺纳米颗粒具有海胆状结构,特殊的刺状形貌使颗粒表面存在诸多电磁增强场,从而使刺状纳米相较于传统纳米颗粒能够提供更优良的表面拉曼增强能力。
64.图3为本发明实施例1中的拉曼增强金刺纳米颗粒的电磁场磁域有限差分成像图,通过图3可以看出,在纳米表面的刺的尖端及刺与刺之间存在强烈的电磁场增强“热点”,表明刺状结构纳米颗粒具有良好的电磁场增强效应,这是颗粒拉曼增强金刺纳米颗粒具有优良表面拉曼增强能力的依据。
65.下面分别对单连接tk1分子信标(au
‑
tk1mb)、单连接gapdh分子信标(au
‑
gapdhmb)和本发明实施例1同时连接两种分子信标的比率探针(au
‑
ismb)在532nm激光器下行拉曼检测,如图4所示,hex拉曼报告信号在745cm
‑1、1295cm
‑1、1501cm
‑1、1632cm
‑1等处有明显的拉曼特征峰,而fam拉曼报告分子在469cm
‑1、645cm
‑1、1171cm
‑1、1309cm
‑1、1431cm
‑1、1510cm
‑1、1638cm
‑1等处可观测到明显地拉曼特征峰,au
‑
ismb可以同时检测到两种拉曼报告分子信号。考虑到745cm
‑1、645cm
‑1两处拉曼峰宽窄、强度高、稳定性好无其他拉曼峰干扰,因此分别选为hex和fam拉曼报告分子的sers标准峰。
66.对本发明实施例1
‑
3和对比例1和2构建的纳米探针在532nm激光器下进行拉曼检测,检测结果如图5所示。通过图5可以看出,随着投料比率的变化,两种拉曼报告分子的特征峰强度也随之发生变化。
67.对本发明实施例1
‑
3和对比例1和2构建的纳米探针sers信号进行比率化处理后,结果如图6所示,通过图6可以看出,随着投料比率的变化,i745/i645比值的大小及变异率(cov)也随之发生变化,其中当投料比为1:1时,比值的变异率最小为0.03%,此时tk1mbs所
携带拉曼报告分子hex的sers强度变异率为17%。
68.将本发明实施例1
‑
3和对比例1和2构建的纳米探针与不同浓度模板tk1mrna序列共孵后在532nm激光下行sers信号检测,并对i745/i645处理后,检测结果如图7所示,通过计算au
‑
ismb对靶标tk1mrna模板的检出极限值(lod),可得投料比分别为1:1、1:5和5:1时,探针对靶标tk1mrna均具有较好的检出能力,而当投料比为1:1时,探针对靶标tk1mrna的检出能力最好,lod达到3.4pm。
69.本发明实施例1制备得到的金刺纳米探针的mapping图如图8所示,通过图8可以看出,经过比率化处理后探针的稳定性提升,变异率降低。
70.为了进一步确定本发明实施例1制备得到的au
‑
ismb的肿瘤tk1mrna检测灵敏度,将au
‑
ismb与梯度浓度tk1模板核酸链(0.1nm、1nm、10nm、100nm、1000nm)共孵,此时ddh2o作为对照组。将反应温度迅速升至95℃后以1分钟1℃的速度缓慢降温至室温后,在532nm激光下对au
‑
ismb行拉曼光谱检测,如图9(a)所示。通过图9(a)可以看出,645cm
‑
1处fam的拉曼信号相对稳定,而745cm
‑
1处hex的拉曼信号强度则随着tk1模板链的浓度提高而逐渐降低。通过9(b)可以看出,745cm
‑
1处hex的拉曼信号强度与靶标浓度的对数存在线性关系,线性相关系数为0.92,加入内参信号后,i745/i645数值与靶标浓度的对数的线性关系更佳,达到了0.99,如图9(c)所示。通过拟合线可以计算出au
‑
ismb对靶标核酸链的检出限,在不经过内参信号处理时,靶标检出限为3nm,在加入内参信号后检出能力提高,检出限达到3.4pm。
71.将本发明实施例1制备得到的au
‑
ismb与单碱基错配序列、靶标序列、ddh2o阴性对照共孵,经退火处理后行拉曼检测,在比率化处理后(i745/i645),数值单碱基错配、阴性对照数值无统计学差异,而au
‑
ismb与靶标共孵后比值明显下降,如图10所示。通过图10的结果表明本发明实施例1制备得到的au
‑
ismb具有良好的检测特异性,可有效识别靶标的单碱基错配序列。
72.将本发明实施例1制备得到的au
‑
ismb与0.02u/ml浓度下的脱氧核酸酶i孵育1小时,对照组以h2o代替,后两组探针分别在离心重悬后行拉曼检测;再将两组探针分别与足量靶标模板链共孵,经过退火处理后再次检测拉曼信号。如图11所示,实验组au
‑
ismb预先与脱氧核酸酶i孵育后拉曼信号与对照组无明显差异,且实验组探针经过核酶处理后仍可以达到与对照组一致的与靶标结合、信号相应的能力,在与靶标共孵后两组信号无明显差异。实验结果证明了au
‑
ismb有良好的耐核酶稳定性,在检测过程中可抵抗自然界和细胞内的核酶降解,保证检测稳定性。
73.综上所述,本发明实施例首次构建了一种可提供细胞内参信号的sers纳米探针,可同时检测目标核酸单链信号及细胞内参信号,将细胞内参信号作为内标对目标核酸检测信号进行归一化处理,可有效去除检测过程中激光工作距离、激光功率、表面粗糙度甚至分子结构等诸多非特异性干扰因素的影响,从而增加检测灵敏度、特异性、可靠性,同时细胞内参信号的加入可有效去除细胞探针摄取量和检测条件下细胞数量等细胞间差异因素对检测结果的影响,并确定靶标核酸在细胞中的相对表达水平。
74.尽管已经示出和描述了本发明的实施例,本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1