一种治疗肝纤维化、肝硬化的Wnt5a敲低的M1型骨髓来源巨噬细胞及其应用
一种治疗肝纤维化、肝硬化的wnt5a敲低的m1型骨髓来源巨噬细胞及其应用
技术领域
1.本发明属细胞生物学和肝病防治领域,具体地说,涉及一种治疗肝纤维化、肝硬化的 wnt5a敲低的m1型骨髓来源巨噬细胞及其应用。
背景技术:
2.肝硬化是各种慢性肝病的晚期阶段,一旦发展至失代偿期,肝移植是公认有效的治疗 手段,但其受制于供体缺乏、费用昂贵等的限制,使其缺乏普适性。因此,促进病态肝脏 自身结构的重建显得尤为紧迫。
3.巨噬细胞具有高度的可塑性,有助于其根据环境信号快速在促炎和抗炎之间进行表型切 换。如受到来自细菌脂多糖(lipopolysaccharide,lps)或损伤、炎症产生的细胞因子等的影 响,巨噬细胞可经历经典活化并分化为m1巨噬细胞,其特征是产生炎性细胞因子,如tnf-α、 白介素-6(interleukin-6,il-6)以及活性氧等,它们的细胞毒性使得m1巨噬细胞在清除病原 体的同时引发炎症反应,尽管这种反应对宿主具有保护作用,但持续的炎症对宿主极为不利。 但也有研究(马鹏飞.回输不同极化类型的巨噬细胞对小鼠肝纤维化的治疗作用和机制的研 究[d].第四军医大学,2014.)发现小鼠肝纤维化模型尾静脉回输骨髓来源巨噬细胞,小鼠肝 脏胶原纤维沉积减少,提示骨髓来源m1型巨噬细胞回输对肝纤维化有较好的治疗效果。而 本课题组的研究(xu ying et al.yiguanjian decoction inhibits macrophage m1 polarization andattenuates hepatic fibrosis induced by ccl4/2-aaf.[j].pharmaceutical biology,2021,59(1): 1150-1160.)发现中药复方一贯煎是通过抑制巨噬细胞m1极化,减轻了ccl4/2-aaf诱导的 肝纤维化。总体来说,目前业界仍然认可“m1型主要参与组织炎症损伤和免疫防御,而m2 型更倾向于正常组织修复”的假说。
[0004]
wnt5a是wnt家族成员之一,主要介导非经典wnt/ca
2+
通路,也可以激活经典wnt通路。 文献(梁利波,王霞,何訸,等.肥胖及超重人群中血清wnt5a水平与肝脏脂肪变和纤维化程 度的相关性研究[j].四川大学学报(医学版),2017,48(001):7-11.)探讨了肥胖及超重人群中血 清wnt5a水平与肝脏脂肪变及纤维化程度的相关性,发现血清wnt5a水平与瞬时肝脏弹性测 量值无显著相关关系,血清wnt5a水平与nafld有关,在肥胖或超重合并nafld的发病 不同阶段可能起着不同的病理生理作用。文献(苗成龙.肝细胞肝癌组织中wnt5a、β-catenin、 gpc-3的表达及意义[d].苏州大学,2014.)报道了在肝细胞肝癌的发生过程中,wnt5a为代 表的非经典wnt信号通路可以抑制以β-catenin为核心的经典wnt信号通路而抑制肝细胞肝 癌的发生。
[0005]
目前未见如本技术利用wnt5a敲低的m1型骨髓来源巨噬细胞治疗肝纤维化、肝硬化的 报道。
技术实现要素:
[0006]
本发明的目的是针对现有技术中的不足,提供一种wnt5a敲低的m1型骨髓来源巨噬 细胞。
[0007]
本发明的再一的目的是,提供所述wnt5a敲低的m1型骨髓来源巨噬细胞的用途。
[0008]
为实现上述目的,本发明采取的技术方案是:
[0009]
一种wnt5a敲低的m1型骨髓来源巨噬细胞,所述wnt5a敲低的m1型骨髓来源巨噬 细胞相比于m1型骨髓来源巨噬细胞,wnt5a基因低表达。
[0010]
所述wnt5a敲低的m1型骨髓来源巨噬细胞是通过慢病毒转染的方法制备的,所述慢 病毒载体中含有seq id no:11所示的序列。
[0011]
所述wnt5a敲低的m1型骨髓来源巨噬细胞,其原始的骨髓来源巨噬细胞来自于哺乳 动物,所述哺乳动物为人、猴、大鼠、小鼠、猪或狗。
[0012]
为实现上述第二个目的,本发明采取的技术方案是:
[0013]
如上任一所述的wnt5a敲低的m1型骨髓来源巨噬细胞在制备治疗肝硬化或肝纤维化 的药物中的应用。
[0014]
所述治疗肝硬化为抑制硬化肝脏的炎症反应或进一步纤维化。
[0015]
所述wnt5a敲低的m1型骨髓来源巨噬细胞用于降低肝脏hyp含量或肝脏col-1表 达。
[0016]
如上任一所述的wnt5a敲低的m1型骨髓来源巨噬细胞在制备研究巨噬细胞与肝硬化 或肝纤维化间关系的实验试剂中的应用。
[0017]
所述wnt5a敲低的m1型骨髓来源巨噬细胞用于抑制硬化肝脏的炎症反应或进一步纤 维化。
[0018]
所述wnt5a敲低的m1型骨髓来源巨噬细胞用于降低肝脏hyp含量或肝脏col-1表 达。
[0019]
本发明优点在于:
[0020]
本发明建立了ccl4/2-aaf大鼠肝硬化模型,发现将非经典wnt信号通路配体wnt5a 基因敲减的m1型骨髓巨噬细胞(bmdm-m1
wnt5a-kd
)经外周静脉注射后可显著提高其抗肝 纤维化效应,主要表现为显著减轻肝脏炎症反应,抑制肝星状细胞活化,抑制肝祖细胞向 胆管上皮细胞分化(胆管反应),抑制进一步肝纤维化,进而抑制肝硬化进展。反之,将 wnt5a基因过表达的bmdm-m1(bmdm-m1
wnt5a-oe
)注射后则显著促进肝硬化的进展。因 此,bmdm-m1的wnt5a基因在肝纤维化、肝硬化治疗中可能发挥关键作用,敲减wnt5a 基因的bmdm-m1可作为肝纤维化、肝硬化的创新生物或化学治疗药物。
附图说明
[0021]
图1是本发明实施例的bmdm-m1的细胞形态、流式细胞鉴定及表面标记物qpcr检 测结果。其中(a)代表bmdm-m1 cd11b/c免疫荧光染色;(b)代表bmdm-m1 cd68免 疫荧光染色;(c)代表bmdm-m1的流式细胞检测结果图;(d)代表bmdm-m1 cd68 mrna 表达水平。
[0022]
图2是本发明实施例的egfp荧光图及慢病毒转染后bmdm-m1 wnt5a基因mrna表 达情况。其中(a)代表慢病毒转染后细胞形态以及绿色荧光表达水平(
×
400);(b)和(c) 代表rt-pcr检测wnt5a mrna的表达。m0代表bmdm-m0组;m1代表bmdm-m1组; bmdm-m1
wnt5a-ncoe
代
表过表达阴性对照组;bmdm-m1
wnt5a-oe
代表bmdm-m1 wnt5a基 因过表达组;bmdm-m1
wnt5a-nckd
代表敲减阴性对照组;bmdm-m2
wnt5a-kd
代表bmdm-m1 wnt5a基因敲减组。**p《0.01。
[0023]
图3是本发明实施例的bmdm-m1
wnt5a-kd
移植可抑制肝脏炎症反应。其中(a)代表 he染色(
×
100);(b)代表cd68的免疫染色(
×
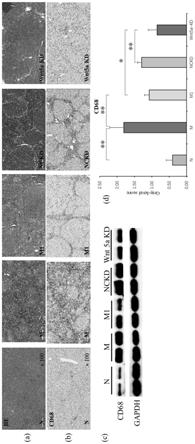
100);(c)代表cd68蛋白印迹图;(d) cd68蛋白印迹灰度积分。n代表正常组;m代表模型组;m1代表bmdm-m1移植组; nckd代表bmdm-m1 wnt5a基因敲减阴性对照移植组;kd代表bmdm-m1 wnt5a基因 敲减移植组。*p《0.05,**p《0.01。
[0024]
图4是本发明实施例的bmdm-m1
wnt5a-kd
移植可抑制肝硬化进展。其中(a)代表天狼 星红染色(
×
100);(b)代表α-sma免疫染色(
×
100);(c)代表天狼星红染色阳性面积 半定量分析结果;(d)代表肝脏羟脯氨酸(hyp)含量水平;(e-f)蛋白印迹结果显示各组 大鼠肝组织α-sma蛋白表达情况。n代表正常组;m代表模型组;m1代表bmdm-m1移 植组;nckd代表bmdm-m1 wnt5a基因敲减阴性对照移植组;kd代表bmdm-m1 wnt5a 基因敲减移植组。*p《0.05,**p《0.01。
[0025]
图5是本发明实施例的bmdm-m1
wnt5a-oe
移植促进肝脏炎症反应。其中(a)代表he 染色(
×
100);(b)代表cd68的免疫染色(
×
100);(c-d)代表cd68 mrna表达水平。n 代表正常组;m代表模型组;m1代表bmdm-m1移植组;ncoe代表bmdm-m1
wnt5a-oe
阴性对照移植组;oe代表bmdm-m1
wnt5a-oe
移植组。*p《0.05,**p《0.01。
[0026]
图6是本发明实施例的bmdm-m1
wnt5a-oe
移植促进肝硬化进展结果。其中(a)代表天 狼星红染色(
×
100);(b)代表α-sma免疫染色(
×
100);(c)代表天狼星红染色阳性面 积半定量分析结果;(d)代表肝脏羟脯氨酸(hyp)含量水平;(e-f)蛋白印迹结果显示各 组大鼠肝组织α-sma蛋白表达情况。n代表正常组;m代表模型组;m1代表bmdm-m1 移植组;ncoe代表bmdm-m1
wnt5a-oe
阴性对照移植组;oe代表bmdm-m1
wnt5a-oe
移植 组。*p《0.05,**p《0.01。
具体实施方式
[0027]
下面结合附图对本发明提供的具体实施方式作详细说明。
[0028]
实施例1
[0029]
运用四氯化碳/2-乙酰氨基芴(ccl4/2-aaf)诱导的大鼠肝硬化模型证实本发明wnt5a 敲低的m1型骨髓来源巨噬细胞在抑制肝硬化的进展中具有重要作用。
[0030]
1.建立大鼠骨髓源性巨噬细胞m1亚型wnt5a敲减或过表达模型
[0031]
1.1材料
[0032]
1.1.1动物
[0033]
sd雄性大鼠5只,清洁级,体重80~100g,用于分离bmscs,购自北京维通利华实验 动物有限公司,许可证号:scxk(沪)2013-0016。
[0034]
1.1.2主要试剂
[0035]
生长因子:gm-csf购于cyagen公司;m-csf购于novus biologicals公司。l929细胞 株购于中国科学院细胞库。兔多克隆抗体抗cd11b/c[alexa](nb110-40766af405)、 小鼠单克隆抗体抗cd68[alexa](nb100-683af488)购于novus biologicals公司; 兔多克隆抗体抗α-平滑肌肌动蛋白(α-sma,ab5694)、兔多克隆抗体抗cd68(ab125212)购自 abcam公司;甘油醛-3-磷酸脱氢酶抗体(gapdh,6000-4-1-1)均购自proteintech公司。qrt-pcr 试剂购自toyobo公司。
[0036]
主要引物列表:
[0037][0038]
1.1.3慢病毒转染相关试剂
[0039]
本研究所用wnt5a基因包装的慢病毒购于上海吉凯基因医学科技股份有限公司。合同编 号:gosl0250585。wnt5a-kd货号:92640-1。shrna的编码序列如seq id no:11所示。
[0040]
1.2方法
[0041]
1.2.1大鼠骨髓源性巨噬细胞(bmdms)分离,培养,m1极化及鉴定
[0042]
(1)bmdms的分离
[0043]
处死wistar大鼠,75%乙醇消毒,分离大鼠股骨与胫骨,剪除双头,无血清1640培养 基冲洗骨髓腔,收集混合液,20℃1500rpm 5min离心,弃上清,重复1次。加入10ml 1
×ꢀ
红细胞悬液吹打混匀,静置3min,使用同体积单一1640培养基吹打混匀终止裂红。20℃ 1500rpm 5min离心,弃上清。bmdm-m0培养加入10ml 1640-gm-csf细胞培养基重悬, bmdm-m2采用1640-l929细胞培养基重悬,使用40μm滤筛过滤后细胞计数,co2培养箱 培养,每3天换液1次。
[0044]
(2)大鼠骨髓源性巨噬细胞的m1极化
[0045]
在37℃5%co2培养条件下,采用10%fbs+50ng/ml gm-csf+1640培养基培养原 代bmdms,72h换液,第6d加入5ng/ml lps培养12h,第7d即可获得成熟的m1-bmdms。
[0046]
(3)m1巨噬细胞的免疫荧光鉴定
[0047]
bmdm-m1的形态学采用免疫荧光鉴定。细胞采用多聚甲醛固定细胞过夜,0.5%tritonx-100孵育透膜。加入一抗:cd11b/c 1:150,cd68 1:500;37℃避光孵育1h,pbs清洗。免疫 荧光标记二抗室温下避光孵育1h,pbs清洗。dapi染核,pbs清洗,封片,olympus fv10i 激光共聚焦显微镜获取图像。
[0048]
(4)m1型巨噬细胞的流式鉴定
[0049]
采用流式细胞术鉴定bmdm-m1细胞中cd45、cd68和cd11b/c阳性细胞的占比。
[0050]
1.2.2慢病毒转染bmdm-m1
[0051]
取培养第4天的bmdm-m1,台盼蓝染色计数,分组如下:
[0052]
①
正常组:bmdm-m1(m1)
[0053]
②
wnt5a基因敲减空载病毒组:bmdm-m1
wnt5a-nckd
(nckd)
[0054]
③
wnt5a基因kd组:bmdm-m1
wnt5a-kd
(wnt5a-kd)
[0055]
④
wnt5a基因过表达空载病毒组:bmdm-m1
wnt5a-ncoe
(ncoe)
[0056]
⑤
wnt5a基因oe组:bmdm-m1
wnt5a-oe
(wnt5a-oe)
[0057]
根据预实验转染结果,选定感染复数(multiplicity of infection,moi)=10进行转染。 转染2h后,细胞形态发生变化后换为正常培养液,48h后荧光倒置图像分析仪拍摄细胞形 态以及egfp绿色荧光阳染情况,72h提取细胞rna,rt-pcr检测wnt5a基因表达情况。
[0058]
1.2.3统计学方法
[0059]
采用spss 24.0统计软件进行实验数据分析,计量资料的数据以均数
±
标准差(x
±
s) 的形式表示,多组之间比较采用单因素方差分析(one-way anova)比较,组间两两比较 采用lsd方法进行分析,p《0.05表示差异具有统计学意义。
[0060]
1.3结果
[0061]
1.3.1 bmdm-m1标记物免疫荧光染色及鉴定
[0062]
培养至第7d时m1-bmdms呈不规则形态特征。免疫荧光染色显示,m1-bmdms高表 达cd11b/c和cd68(图1a,b)。流式细胞计数显示m1-bmdms为cd45
+
(98.6%)、cd68
+ (88.6%)、cd11b/c
+
(97.7%)(图1c)。qrt-pcr检测结果显示,m1-bmdms cd68 mrna 水平显著上调(p《0.01)(图1d)。
[0063]
1.3.2慢病毒转染后egfp荧光表达及wnt5a基因表达
[0064]
与未转染病毒的bmdm-m1比较,病毒转染后的bmdm-m1高表达egfp绿色荧光(图 2a);与nckd组比较,wnt5a-kd组的wnt5a基因水平显著降低(p《0.01);与ncoe组 比较,wnt5a-oe组wnt5a基因水平显著升高(p《0.01)(图2b,c)。
[0065]
2.bmdm-m2
wnt5a-kd
移植抑制2-aaf/ccl4大鼠肝硬化进展
[0066]
2.1动物
[0067]
雄性wistar大鼠28只,spf级,体重(160-180g),购自上海斯莱克实验动物有限公司。 动物实验方案获得上海中医药大学实验动物伦理委员会批准(no:pzshutcm200807008)。
[0068]
2.2肝硬化模型的制备
[0069]
采用30%ccl
4-橄榄油溶液,2ml
·
kg-1
皮下注射,2次/w,建立肝硬化动物模型。第9 周开始在ccl4继续造模的同时,予以2-aaf 10mg/kg灌胃以诱导内源性肝干细胞增殖分化, 并予以腹腔注射ccr2抑制剂以抑制外周骨髓巨噬细胞向肝脏募集。
[0070]
2.3分组与干预
[0071]
模型大鼠随机分为模型组(m,n=8);bmdm-m1注射组(m1,n=8);bmdm-m1 wnt5a 基因敲减阴性对照组(nckd,n=6);bmdm-m1 wnt5a基因敲减组(wnt5a kd,n=8); 于8周末经尾静脉单次注射1
×
106cells,第12周末取材。另设正常组(n,n=6)。
[0072]
2.4统计学方法:同1.2.3。
[0073]
2.5结果
[0074]
2.5.1 bmdm-m1
wnt5a-kd
移植抑制肝脏炎症反应
[0075]
he染色显示,与n组比较,m组大鼠肝小叶排列紊乱,肝细胞桥接样坏死,汇管区 可见大量炎性细胞浸润,纤维组织增生并伴有纤维间隔形成;m1组较m组肝脏炎症反应 明显减轻,纤维间隔较窄;wnt5a kd组大鼠较nckd组炎症反应明显减轻,纤维组织明 显减少(图3a)。
[0076]
免疫染色显示,n组大鼠肝窦内有少量cd68阳性巨噬细胞;与n组比较,m组大鼠 肝
脏cd68阳性表达明显增加;与m组比较,m1组肝脏cd68阳性表达明显减少;与nckd 组比较,wnt5a kd组大鼠肝脏中cd68阳性表达明显减少(图3b)。免疫印迹结果显示, 与n组比较,m组cd68蛋白表达显著增加(p《0.01);与m组比较,m1组cd68蛋白 表达显著降低(p《0.01);与nckd组比较,wnt5a kd组cd68蛋白表达显著降低(p《 0.01),且显著低于m1组(p《0.05)(图3c,d)。
[0077]
2.5.2 bmdm-m1
wnt5a-kd
移植抑制肝硬化进展
[0078]
天狼星红染色显示,n组大鼠肝组织仅在中央静脉与汇管区可见少量胶原纤维;与n 组比较,m组大鼠肝脏胶原纤维自汇管区蔓延至肝实质部分,形成完整的假小叶结构;与 m组比较,m1组胶原沉积明显减轻;与nckd比较,wnt5a kd组胶原沉积明显减轻(图 4a)。天狼星红半定量结果显示相同的趋势(图4c)。
[0079]
肝组织羟脯氨酸(hyp)检测结果显示,与n组比较,m组大鼠肝脏hyp含量显著增 加(p《0.01);与m组比较,m1组肝脏hyp含量显著降低(p《0.05);与nckd组比较, wnt5a kd组大鼠肝脏hyp含量显著降低(p《0.05)(图4d)。
[0080]
免疫染色显示,n组大鼠肝脏血管壁周围有少量α-sma阳性染色;与n组比较,m组 大鼠肝脏α-sma大量表达于纤维间隔;与m组比较,m1组肝脏α-sma阳性表达明显减 少;与nckd组比较,wnt5a kd组大鼠肝脏中α-sma阳性表达明显减少(图4b)。此外, 蛋白印迹结果显示m组大鼠肝组织α-sma蛋白表达显著增加(p《0.01),与m组比较, m1组肝脏α-sma蛋白表达显著降低(p《0.01);与nckd组比较,wnt5a kd组α-sma 蛋白表达显著降低(p《0.01)(图4e,f)。
[0081]
3.bmdm-m1
wnt5a-oe
移植促进2-aaf/ccl4大鼠肝硬化进展
[0082]
3.1动物:同2.1。
[0083]
3.2肝硬化模型的制备:同2.2。
[0084]
3.3分组与干预
[0085]
模型大鼠随机分为模型组(m,n=8);bmdm-m1注射组(m1,n=8);bmdm-m1 wnt5a 基因过表达阴性对照组(ncoe,n=6);bmdm-m1 wnt5a基因过表达组(wnt5a oe,n=8); 于8周末经尾静脉单次注射1
×
106cells,第12周末取材。另设正常组(n,n=6)。
[0086]
3.4统计学方法:同1.2.3。
[0087]
3.5结果
[0088]
3.5.1 bmdm-m1
wnt5a-oe
移植可促进肝脏炎症反应
[0089]
he染色显示,与n组比较,m组大鼠肝小叶排列紊乱,肝细胞变性坏死,汇管区大 量炎性细胞浸润,纤维组织增生并伴有纤维间隔形成;m1组较m组肝脏炎症反应明显减 轻,纤维间隔较窄;wnt5a oe组大鼠肝脏较ncoe组炎症反应明显加重,且纤维间隔明显 增宽(图5a)。
[0090]
免疫组化染色显示,n组大鼠肝脏肝窦中存在少量cd68阳性巨噬细胞;与n组比较, m组大鼠肝脏cd68阳性表达明显增多;与m组比较,m1组肝组织cd68阳性表达明显 减少;与ncoe组比较,wnt5a oe组大鼠肝脏中cd68阳性表达明显增加(图5b)。cd68 的蛋白表达水平与免疫染色趋势一致,m1组显著低于m组(p《0.01),wnt5a oe组显著 高于ncoe组(p《0.05),并显著高于m1组(p《0.01)(图5c,d)。提示bmdm-m1
wnt5a-oe
移植后可促进肝脏固有巨噬细胞的活化及炎症反应。
[0091]
3.5.2 bmdm-m1
wnt5a-oe
移植促进肝硬化进展
[0092]
天狼星红染色显示,n组大鼠肝组织仅在中央静脉与汇管区可见少量胶原纤维;与n 组比较,m组大鼠肝组织中胶原纤维自汇管区延伸至肝实质,形成完整的假小叶结构;与 m组比较,m1组胶原沉积明显减轻;与ncoe组比较,wnt5a oe组胶原沉积明显加重(图 6a)。天狼星红半定量结果显示相同的趋势,且wnt5a oe组显著高于m1组(p《0.05)(图 6c)。
[0093]
hyp结果显示,与n组比较,m组大鼠肝脏hyp含量显著升高(p《0.01);与m组 比较,m1组肝脏hyp含量明显降低(p《0.05);与ncoe比较,wnt5a oe组大鼠肝脏 hyp含量显著升高(p《0.05),且显著高于m1组(p《0.01)(图6d)。
[0094]
免疫染色显示,n组大鼠肝脏血管壁周围有少量α-sma阳性染色;与n组比较,m组 大鼠肝脏α-sma大量表达于纤维间隔;与m组比较,m1组肝脏α-sma阳性表达明显减 少;与ncoe组比较,wnt5a oe组大鼠肝脏中α-sma阳性表达明显增加(图6b)。蛋白 印迹结果显示m组大鼠肝组织α-sma蛋白表达显著增加(p《0.01),与m组比较,m1 组肝脏α-sma蛋白表达显著降低(p《0.05);与ncoe组比较,wnt5a oe组α-sma蛋白 表达显著增加,且显著高于m1组(均p《0.05)(图6e,f)。
[0095]
4.bmdm-m1
wnt5a-kd
移植治疗肝硬化的作用优于bmdm-m1联合wnt5a-kd给药
[0096]
为明确bmdm-m1 wnt5a基因敲减在肝硬化治疗中的重要性,课题组建立ccl4大鼠肝 硬化模型(方法同前),比较了bmdm-m1
wnt5a-kd
经尾静脉注射与bmdm-m1联合 lv-wnt5a-kd经尾静脉注射对肝硬化的干预作用,bmdm-m1
wnt5a-kd
、bmdm-m1经尾静 脉注射方法同前,lv-wnt5a注射量为5.0
×
10
10
v.g/只。结果显示了bmdm-m1
wnt5a-kd
的综 合干预效果显著优于bmdm-m1联合lv-wnt5a-kd尾静脉注射。提示bmdm-m1
wnt5a-kd
可能成为治疗肝硬化的理想细胞。
[0097]
表1肝脏cd68蛋白表达,hyp含量,α-sma表达的比较
[0098][0099]
注:与m组比较,
**
p<0.01;与bmdm-m2联合lv-wnt3a组比较,
#
p<0.05,
##
p<0.01。
[0100]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员, 在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本 发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1