一种吴茱萸碱类化合物及其制备方法和用途
1.本发明属于生物医药技术领域。更具体地,涉及一种吴茱萸碱类化合物及其制备方法和用途。
背景技术:
2.环磷酸鸟苷(cgmp)是重要的第二信使,介导激素、神经传递素、趋化因子、细胞活素等外界信号变化引起的细胞内生物反应,参与调节体内多种生理过程,如平滑肌的收缩、血小板凝聚、脂质及糖质代谢、细胞生长、分化控制等。磷酸二酯酶(pdes)是一类重要的超级酶家族,通过对camp和cgmp的水解,有效控制细胞内的camp和cgmp浓度,从而调节体内第二信使所传导的生化作用。pdes(pde1~pde11)在哺乳动物组织中分布广泛,其多样性致使不同的pde酶在细胞和亚细胞水平有着特定的分布,可选择性调节多种细胞功能,是良好的药物设计与治疗靶点。
3.其中,磷酸二酯酶5型(pde5)作为对cgmp特异性水解的pde家族,最先在老鼠的血小板中被分离并确认,之后在老鼠的肺中也被发现并纯化得到。人体内的pde5a主要分布在主动脉血管平滑肌细胞、心脏、胎盘、骨骼肌细胞、胰腺、血小板,大脑、肝脏、肺部也有极少量分布,其中,男性阴茎海绵体中的pde5含量远高过其他pde家族。研究发现,抑制pde5酶的活性,可以提高细胞内cgmp的浓度,治疗cgmp浓度过低引起的相应病症,pde抑制剂除被fda批准用于治疗勃起功能障碍(ed)、肺动脉高压(pah)和良性前列腺增生(bph)的治疗外,对于治疗阿尔兹海默症、心脏病、雷诺综合症的临床或临床前研究也正在进行,并且其对神经痛、中风、膀胱过动症(oab)、肿瘤和糖尿病等均表现出潜在的药效。
4.目前fda已经批准了四个pde5抑制剂上市,其中西地那非、伐地那非和他达那非经过十余年的临床应用,表现出较显著的临床疗效,但由于其对pde5以外的其它pde同工酶也有一定程度的抑制作用,临床上表现出头痛、面部潮红、消化不良、鼻塞、视觉障碍、听觉障碍或者肌肉酸痛、存在心血管风险等毒副作用,影响了患者用药的顺应性及安全性。除了已经上市的药物,本领域技术人员也在持续研究着新的pde5抑制剂,如发明人前期申请的中国专利申请cn107141288a公开了一类吴茱萸碱类化合物具有显著的pde5抑制作用,并且选择性高,但是在实际应用中发现该类化合物的溶解度、稳定性、口服生物利用度等均较差,成药性不良,极大地限制了其的临床用药。因此,寻找高活性及成药性好的pde5抑制剂是目前新一代pde5抑制剂研发的主要方向,具有重要的社会及经济意义。
技术实现要素:
5.本发明要解决的技术问题是克服现有pde5抑制剂可选择范围较小、成药性差等缺陷和不足,提供多一种活性高、成药性好(代谢稳定性、水溶性及口服生物利用度等均显著提升)的pde5抑制剂可供选择。
6.本发明的目的是提供一种吴茱萸碱类化合物。
7.本发明另一目的是提供所述吴茱萸碱类化合物的制备方法。
8.本发明另一目的是提供所述吴茱萸碱类化合物在制备防治与磷酸二酯酶5型相关疾病的药物中的用途。
9.本发明上述目的通过以下技术方案实现:
10.一种吴茱萸碱类化合物,所述吴茱萸碱类化合物具有式(i)所示结构:
[0011][0012]
其中,r1、r2、r3、r4、r7、r8和r9各自独立地选自氢、卤素、羟基、氨基、硝基、氰基、巯基、肼基、叠氮基、c
1~6
取代或非取代烷基、c
3~7
取代或非取代环烷基、c
1~6
取代或非取代烷氧基、c
1~6
取代或非取代链烯基、c
1~6
取代或非取代烷酰基、c
1~6
取代或非取代酰胺基;
[0013]
r5、r6和r
10
各自独立地选自氢、c
1~6
取代或非取代烷基、c
1~6
取代或非取代链烯基、c
3~7
取代或非取代环烷基、c
1~6
取代或非取代烷酰基、c
1~20
取代或非取代芳基、c
3~7
取代或非取代杂环基;
[0014]r11
为c
1~6
取代或非取代烷基、c
3~7
取代或非取代环烷基、c
1~6
取代或非取代链烯基、c
1~20
取代或非取代芳基、c
3~7
取代或非取代杂环基;
[0015]
其中,取代烷基、取代环烷基、取代烷氧基、取代链烯基、取代烷酰基、取代杂环基、取代芳基的取代基为卤素、羟基、c
1~6
烷基、氨基、硝基、氰基、巯基、羰基、酯基、酰胺基、芳基、c
1~6
烷氧基、c
1~6
烷酰基、中的一种或多种。
[0016]
优选地,所述r1、r2、r3、r4、r7、r8和r9各自独立地选自氢、甲氧基;
[0017]
所述r5、r6和r
10
各自独立地选自氢、甲基。
[0018]
更优选地,所述r
11
为为
[0019]
具体的,所述吴茱萸碱类化合物具有以下任一结构:
[0020]
[0021]
另外的,所述吴茱萸碱类化合物还包括所述吴茱萸碱类化合物在药学上可接受的盐。
[0022]
式(i)所示吴茱萸碱类化合物中存在氨基、叔胺等碱性基团,其可与酸发生成盐反应,得到同样具有生物活性的吴茱萸碱类化合物药学上可接受的盐。
[0023]
进一步地,所述酸为氢氟酸、盐酸、氢溴酸、磷酸、乙酸、草酸、硫酸、甲磺酸、水杨酸、三氟乙酸、三氟甲磺酸、萘磺酸、马来酸、富马酸、柠檬酸、醋酸、酒石酸、琥珀酸、苹果酸或谷氨酸。
[0024]
另外的,本发明还提供了所述吴茱萸碱类化合物的制备方法,由如下合成路线制备得到:
[0025][0026]
具体合成步骤:
[0027]
s1、将化合物ii与化合物iii在碱性环境及催化剂存在条件下混合反应完全,得到化合物iv;
[0028]
s2、将步骤s1所得化合物iv脱保护基,得到化合物v;
[0029]
s3、将步骤s2所得化合物v与反应,即可得到化合物i;
[0030]
其中,x为卤素或羟基;r
1~11
的定义与上述r
1~11
的定义相同。
[0031]
进一步地,步骤s1中,所述反应的温度为-78~50℃。
[0032]
更进一步地,步骤s1中,所述碱性环境通过添加碱性物质得到,所述碱性物质选自二异丙基乙基胺、三乙胺、4-二甲氨基吡啶、哌啶、碳酸氢钠、碳酸钠、碳酸钾、氢氧化钠、氢氧化钾、叔丁醇钾、氢化钠、甲醇钠、乙醇钠中的一种或多种。
[0033]
进一步地,步骤s1中,所述催化剂为常规的有机不对称合成催化剂,选自有机不对称催化剂奎宁、奎宁胺、奎宁衍生物、奎宁胺衍生物中的一种或多种。
[0034]
更进一步地,步骤s2中,所述脱保护基条件为常规的氨基保护基脱保护条件。
[0035]
进一步地,步骤s3中,所述反应的条件为目前常用的胺与酰氯、酰溴或酸的反应条件。
[0036]
更进一步地,制备在有机溶剂存在的条件下进行反应。优选地,所述有机溶剂包含但不限于甲苯、乙醚、乙酸乙酯、氯仿、二氯甲烷、1,2-二氯乙烷、1,4-二氧六环、四氢呋喃、乙腈、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲基亚砜、n-甲基吡咯烷酮、甲醇、乙醇、异丙醇、乙二醇二甲醚、乙二醇单甲醚中的一种或多种。
[0037]
另外的,本发明还提供了所述吴茱萸碱类化合物在制备防治与磷酸二酯酶5型相关疾病的药物中的用途。
[0038]
进一步地,所述与磷酸二酯酶5型相关疾病包括勃起功能障碍、肺动脉高压、肺纤维化、肾纤维化、器官纤维化、雌性的性功能障碍、早产、痛经、良性前列腺增生、肿瘤多药耐药、膀胱出口梗阻、失禁、不稳定的和变异型心绞痛、高血压、充血性心衰、肾衰竭、动脉粥样硬化、中风、周围血管疾病、雷诺氏症、炎症性疾病、支气管炎、慢性哮喘、过敏性哮喘、过敏性鼻炎、青光眼、特征为肠蠕动障碍的疾病。
[0039]
另外的,本发明还提供了一种磷酸二酯酶5型抑制剂,含有所述吴茱萸碱类化合物。
[0040]
进一步地,所述磷酸二酯酶5型抑制剂可以按照常规工艺加入药学上可接受的辅料制成临床应用的剂型,包括但不限于口服型片剂、丸剂、胶囊剂,注射用注射液、粉针剂,经皮或皮下吸收的剂型。
[0041]
本发明具有以下有益效果:
[0042]
本发明提供了一种吴茱萸碱类化合物,经过实验证明,其对pde5具有显著的选择性抑制作用;并且,本发明的吴茱萸碱类化合物具有较好的半衰期、水溶性、稳定性、口服生物利用度等类药性,非常合适应用于制备治疗pde5相关疾病的药物,为治疗pde5相关疾病药物提供可选择范围。
附图说明
[0043]
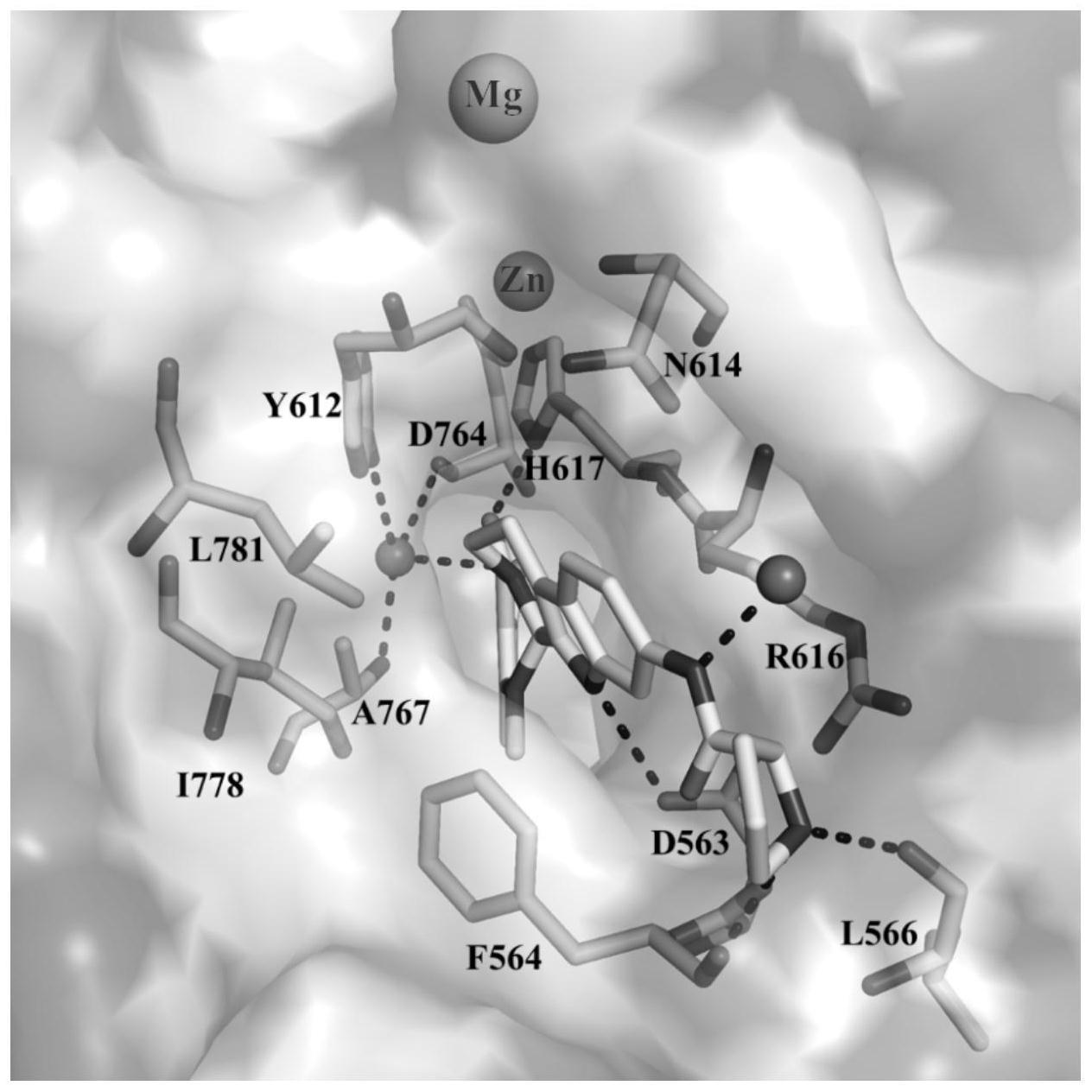
图1为化合物(s)-p4与pde5的共晶结构示意图,其中,红色小球为水分子,黄色部分为化合物(s)-p4。
具体实施方式
[0044]
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0045]
除非特别说明,以下实施例所用试剂和材料均为市购。
[0046]
本发明化合物合成路线如下:
[0047][0048]
其中反应条件:(a)三光气,k2co3,ea,1h;(b)ch3i,k2co3,dmf,12h;(c)(i)dmf,pocl3,0℃ to rt,2h;(ii)4m naoh,80℃,1h;(d)ch3no2,nh4ac,105℃,15min;(e)nabh4,meoh,thf,0℃ to rt,40min;(f)pd/c,h2,meoh,ch3cooh,40℃,24h;(g)甲酸乙酯,ch3cooh,
80℃,48h;(h)cf3cooh,dcm,回流,48h;(i)dcm,overnight;(j)naoh,meoh:thf:h2o=3:3:1,80℃,12h;(k)hatu,dipea,dmf,12h.
[0049]
具体制备步骤如下:
[0050]
实施例1中间体的制备
[0051]
1、中间体m2的合成
[0052][0053]
在冰水浴条件下,将化合物m1(325mg,2.0mmol)的乙酸溶液(2ml)滴入40%二甲胺(402μl,8.0mmol)和37%甲醛(222μl,8.0mmol)的乙酸溶液(1ml),转移至室温搅拌一段时间后,置于50℃油浴锅中反应1.5h。反应结束后冷却至室温,冰水浴条件下用4m naoh溶液调节ph至9,抽滤,得黄色固体m2(360mg,82.1%)。1h nmr(400mhz,dmso)δ11.71(s,1h),8.31(d,j=2.0hz,1h),7.89(dd,j=8.8,1.9hz,1h),7.79(d,j=8.8hz,1h),7.69(s,1h),3.60(s,2h),2.17(s,6h).
[0054]
2、中间体m3的合成
[0055][0056]
将化合物m2(220mg,1.0mmol)溶于四氢呋喃(1ml)、dmf(162μl)和h2o(162μl)的混合溶液中,在ar气环境下,慢慢滴入碘甲烷(0.12ml,2.0mmol)。室温反应16h,再于冰水浴条件下依次滴入1m tbaf in thf(2.0ml)、tmscn(0.2ml)。然后室温反应4h,加入乙酸乙酯和水稀释,分出乙酸乙酯层,用饱和食盐水洗三次,无水硫酸钠干燥,减压浓缩,经柱层析得淡黄色固体m3(109mg,54.0%)。1h nmr(400mhz,dmso)δ11.87(s,1h),8.36(s,1h),7.97(dd,j=8.8,2.1hz,1h),7.82-7.76(m,2h),4.15(s,2h).
[0057]
3、中间体m4的合成
[0058][0059]
将化合物m3(860mg,4.27mmol)溶于无水四氢呋喃(24ml),ar气保护,再在冰水浴条件下慢慢滴加1m bh
3 in thf(13ml),转移至室温反应过夜。反应体系减压浓缩,加入2m hcl溶液,用乙酸乙酯萃取,水层再在冰水浴条件下用4m naoh溶液碱化至无固体析出,抽滤,得产物m4(482mg,55.0%)。1h nmr(400mhz,dmso)δ8.30(d,j=2.0hz,1h),7.87(dd,j=8.8,2.1hz,1h),7.71(d,j=8.8hz,1h),7.61(s,1h),2.85-2.77(m,4h).
[0060]
4、中间体m5的合成
[0061][0062]
往化合物m4(472mg,2.3mmol)的甲醇(10ml)溶液中加入甲酸乙酯(4ml),ar气保护,在80℃油浴锅中反应过夜,冷却至室温后,减压浓缩,经柱层析(dcm/meoh=30:1)得黄色固体m5(460mg,86.0%)。1h nmr(400mhz,dmso)δ11.64(s,1h),8.31(d,j=2.1hz,1h),8.08(s,1h),8.02(s,1h),7.89(dd,j=8.8,2.1hz,1h),7.73(d,j=8.8hz,1h),7.64(d,j=2.3hz,1h),3.43-3.38(m,2h),2.89(t,j=7.2hz,2h).
[0063]
5、中间体m6的合成
[0064][0065]
往化合物m5(80mg,0.34mmol)的甲醇溶液(7ml)中加入10%pd/c(24mg),氢气球换气,室温反应3h。反应结束后,用硅藻土抽滤,取母液减压浓缩,经柱层析(dcm/meoh=10:1)得到产物m6(63mg,91.0%)。1h nmr(400mhz,dmso)δ10.19(s,1h),8.02(s,2h),7.18(d,j=8.3hz,1h),6.80(d,j=1.9hz,1h),6.52(d,j=1.3hz,1h),6.39(dd,j=8.3,1.7hz,1h),4.69(s,2h),3.36(d,j=6.7hz,2h),2.74(t,j=7.4hz,2h).
[0066]
6、中间体m7的合成
[0067][0068]
用thf:dmf=4:1(2.5ml)将化合物m6(63mg,0.31mmol)溶解,加入吡啶(65μl,0.81mmol),再在0℃下滴加苄氧酰氯(107μl,0.74mmol),升至室温反应过夜。tlc监测反应结束后,加入饱和碳酸氢钠中和,用乙酸乙酯萃取,分出有机层,用饱和食盐水洗涤,无水硫酸钠干燥,减压浓缩,经柱层析(dcm/meoh=20:1)得白色固体m7(73mg,70.0%)。1h nmr(400mhz,dmso)δ10.70(s,1h),9.57(s,1h),8.04(s,1h),8.01(d,j=1.5hz,1h),7.65(s,1h),7.47-7.33(m,6h),7.06(d,j=2.1hz,1h),7.01(dd,j=8.5,1.6hz,1h),5.15(s,2h),3.39-3.34(m,2h),2.79(t,j=7.3hz,2h).
[0069]
7、中间体m8的合成
[0070][0071]
将m7(59mg,0.17mmol)溶于二氯甲烷(2ml),在0℃下滴加三氟乙酸(0.5ml),转移至室温反应2h。tlc监测反应结束后,减压浓缩,加入乙酸乙酯稀释,用饱和碳酸氢钠调节ph至中性,分出乙酸乙酯层,用饱和食盐水洗三次,减压浓缩,然后柱层析(dcm:4m nh
3 in meoh=30:1)得产物m8(38mg,68.0%)。1h nmr(400mhz,meod)δ8.28(s,1h),7.76(s,1h),
7.47(d,j=8.7hz,1h),7.44(d,j=7.2hz,2h),7.39(dd,j=9.8,4.7hz,2h),7.35-7.30(m,1h),7.03(dd,j=8.6,1.8hz,1h),5.21(s,2h),3.87-3.79(m,2h),2.88(t,j=8.6hz,2h).
[0072]
8、中间体m10的合成
[0073][0074]
消旋体制备方法:将化合物m8(64mg,0.2mmol)与化合物m9(42mg,0.2mmol)溶于二氯甲烷(2.0ml)中,搅拌过夜。tlc监测反应结束后,再加入二氯甲烷打浆洗涤得化合物m10(41mg,74.0%)。1h nmr(500mhz,cdcl3)δ8.75(s,1h),7.86(s,1h),7.44(s,1h),7.33(dt,j=13.4,7.6hz,6h),7.08(s,1h),6.90(d,j=8.4hz,1h),6.67(m,2h),6.64(d,j=8.4hz,1h),5.59(s,1h),5.18(s,2h),4.62(dt,j=12.7,4.0hz,1h),3.87(s,3h),3.32(m,1h),2.82(dd,j=9.3,4.8hz,2h),2.39(s,3h).
[0075]
不对称合成方法:
[0076][0077]
将奎宁胺(1.521g,4.7mmol)溶于无水四氢呋喃(35ml)中,再加入异硫氰酸酯(1.275g,4.7mmol),避光反应过夜,反应体系减压浓缩,直接经柱层析分离(二氯甲烷:甲醇=20:1)获得手性催化剂(cat.)。1h nmr(400mhz,cdcl3)δ8.55(s,1h),7.99(d,j=9.1hz,1h),7.83(s,2h),7.70(s,2h),7.39(dd,j=9.2,2.3hz,1h),7.13(s,1h),5.86(s,1h),5.72(ddd,j=17.3,10.2,7.3hz,1h),5.09-4.96(m,2h),3.99(s,3h),3.48-3.08(m,3h),2.79(s,2h),2.35(s,1h),1.70(dd,j=12.0,8.2hz,3h),1.42(t,j=11.6hz,1h),0.92(dd,j=11.6,7.5hz,1h).
[0078]
将化合物m8(0.2mmol)溶于乙腈(40ml)中,依次加入手性催化剂(17.8mg,0.03mmol)、三乙胺(4.2μl,0.03mmol)和化合物m9(0.2mmol),然后在25℃下反应4天。tlc监测反应结束后,减压浓缩,经柱层析可得目标产物。
[0079]
9、中间体m11的合成
[0080][0081]
将化合物m10(483mg,1.0mmol)溶于甲醇(10ml)和四氢呋喃(10ml)的混合溶液中,加入10%pd/c(145mg),氢气球换气,40℃下反应过夜。tlc监测反应结束后,用硅藻土抽滤,母液减压浓缩,经柱层析(dcm/meoh=50:1)得到产物m11(316mg,90.7%)。1h nmr(500mhz,cdcl3)δ8.20(s,1h),7.43-7.30(m,2h),6.71(d,j=8.0hz,1h),6.68(d,j=6.6hz,2h),
6.60(d,j=8.0hz,1h),5.64(s,1h),4.64(d,j=12.6hz,1h),3.92(s,3h),3.43-3.33(m,1h),2.86(s,2h),2.45(s,3h).
13
c nmr(126mhz,cdcl3)δ162.97,160.82,153.12,143.03,138.28,132.91,125.57,119.63,119.60,114.35,113.72,113.57,110.62,106.89,96.77,67.46,56.21,38.87,36.12,20.18.hrms(esi-tof)m/z:[m+h]
+
calcd for c
20h20
n4o2,349.1659;found,349.1655.
[0082]
目标化合物的合成:
[0083]
在溶剂中,将化合物m11和化合物在碱性环境作用下,室温中搅拌1~12小时,浓缩除去大部分溶剂,残余物经乙酸乙酯萃取、水与饱和食盐水分别洗涤、无水硫酸钠干燥,浓缩获得的残余液经柱层析分离获得目标化合物。具体如下:
[0084]
实施例2化合物p1的合成
[0085][0086]
将化合物m11(30mg,0.086mmol)溶于n,n-二甲基甲酰胺(1.0ml),再依次加入dipea(45μl,0.25mmol)、hatu(66mg,0.17mmol)和n-苄氧羰基-d-丙氨酸(39mg,0.17mmol),室温反应过夜。加入乙酸乙酯和水稀释,分出有机层,用饱和食盐水洗三次,无水硫酸钠干燥,减压浓缩得到粗产物。加入甲醇(3.0ml)溶解,再加入10%pd/c(10mg),于氢气保护下,在40℃下反应过夜。tlc监测反应结束后,用硅藻土抽滤,母液减压浓缩,经柱层析得到白色固体l11(22mg,61.0%)。
[0087]1h nmr(400mhz,cdcl3)δ9.60(s,1h),8.86(d,j=3.1hz,1h),8.32(s,1h),7.50(d,j=8.4hz,1h),7.39(t,j=8.2hz,1h),6.96(d,j=8.4hz,1h),6.77(d,j=8.0hz,1h),6.72(d,j=8.5hz,1h),5.73(d,j=5.3hz,1h),4.74-4.61(m,1h),3.96(s,3h),3.67(qd,j=7.0,2.4hz,1h),3.49-3.34(m,1h),3.02-2.83(m,2h),2.46(d,j=1.1hz,3h),1.49-1.42(m,3h).
13
c nmr(126mhz,cdcl3)δ173.94(d,j=8.2hz),162.96(d,j=2.5hz),160.89(d,j=3.4hz),153.14(d,j=5.7hz),137.35(d,j=4.2hz),133.31(d,j=3.9hz),132.84(d,j=2.9hz),127.93(d,j=1.7hz),122.85,118.89,114.01,113.35(d,j=20.3hz),113.22(d,j=2.9hz),112.61(d,j=2.3hz),106.60(d,j=18.6hz),102.76,67.39(d,j=6.6hz),56.22(d,j=1.7hz),51.24(d,j=2.4hz),38.82(d,j=2.1hz),36.02(d,j=14.0hz),21.70(d,j=9.2hz),20.19.hrms(esi-tof)m/z:[m+h]
+
calcd for c
23h25
n5o3,420.2030;found,420.2039.
[0088]
实施例3化合物p2的合成
[0089]
[0090]
参考化合物p1的合成方法,不同之处在于,将n-苄氧羰基-d-丙氨酸替换成n-乙酰甘氨酸,且不经过还原步骤,制备得到化合物p2。
[0091]1h nmr(400mhz,dmso-d6)δ11.17(s,1h),9.91(s,1h),8.21(s,1h),7.94(s,1h),7.53-7.30(m,2h),7.09(d,j=6.8hz,1h),6.69(dd,j=26.3,6.9hz,2h),5.80(s,1h),4.45(d,j=9.1hz,1h),3.88(s,2h),3.77(s,3h),3.22(s,1h),2.81(s,2h),2.62(s,3h),1.90(s,3h).
13
c nmr(101mhz,dmso-d6)δ170.24,167.91,162.45,160.90,152.36,137.26,134.39,133.66,129.17,122.49,118.81,112.67,112.26,111.88,111.13,105.81,102.81,68.10,56.20,43.26,36.16,22.95,20.20.hrms(esi-tof)m/z:[m+h]
+
calcd for c
24h25
n5o4,448.1979;found,448.1968.
[0092]
实施例4化合物p3的合成
[0093][0094]
参考化合物p1的合成方法,不同之处在于,将n-苄氧羰基-d-丙氨酸替换成fmoc-甘氨酸,得到fmoc保护的缩合中间体,并将该中间体溶于二氯甲烷,加入哌啶,室温反应2h,加入乙酸乙酯和水稀释,分出有机层,用饱和食盐水洗三次,无水硫酸钠干燥,减压浓缩,经柱层析得到化合物p3。
[0095]1h nmr(400mhz,dmso-d6)δ11.17(s,1h),9.83(s,1h),8.03(s,1h),7.43(d,j=8.4hz,1h),7.38(d,j=8.1hz,1h),7.10(d,j=8.2hz,1h),6.72(d,j=8.0hz,1h),6.66(d,j=8.1hz,1h),5.80(s,1h),4.46(d,j=12.3hz,1h),3.77(s,3h),3.20(s,3h),2.81(s,2h),2.64(s,3h).
13
c nmr(126mhz,dmso-d6)δ171.82,162.47,160.93,152.32,137.31,134.30,133.66,129.16,122.47,118.85,112.54,112.27,111.75,111.03,105.76,102.52,68.16,56.21,45.85,36.16,20.20.hrms(esi-tof)m/z:[m+h]
+
calcd for c
22h23
n5o3,406.1874;found,406.1866.
[0096]
实施例5化合物p4的合成
[0097][0098]
参考化合物p1的合成方法,不同之处在于,将n-苄氧羰基-d-丙氨酸替换成n-苄氧羰基-d-脯氨酸,得到化合物p4。
[0099]1h nmr(400mhz,cdcl3)δ9.85(s,1h),8.80(s,1h),8.36(s,1h),7.48(d,j=8.4hz,1h),7.37(t,j=8.2hz,1h),6.92(dd,j=8.4,1.6hz,1h),6.75(d,j=8.0hz,1h),6.70(d,j=8.3hz,1h),5.74(s,1h),4.73-4.62(m,1h),3.96(s,3h),3.90(dd,j=9.2,5.2hz,1h),3.48-3.36(m,1h),3.12-2.98(m,2h),2.97-2.82(m,2h),2.44(s,3h),2.23-2.12(m,1h),2.06(dt,j=11.4,6.2hz,2h),1.84-1.75(m,2h).
13
c nmr(101mhz,cdcl3)δ173.43(d,j=5.8hz),163.04(d,j=2.4hz),160.88(d,j=4.6hz),153.06(d,j=7.6hz),137.40(d,j=5.6hz),133.17,132.85(d,j=6.8hz),127.90(d,j=4.5hz),122.80,118.81,113.69(d,j
=6.7hz),113.16(d,j=5.0hz),112.95(d,j=10.6hz),112.52(d,j=6.0hz),106.34(d,j=22.6hz),102.75(d,j=4.3hz),67.40(d,j=5.6hz),61.03,56.20(d,j=1.2hz),47.33,38.86,35.88(d,j=16.4hz),30.86(d,j=3.5hz),26.27,20.20.hrms(esi-tof)m/z:[m+h]
+
calcd for c
25h27
n5o3,446.2187;found,446.2179.
[0100]
实施例6化合物p5的合成
[0101][0102]
参考化合物p1的合成方法,不同之处在于,将n-苄氧羰基-d-丙氨酸替换成n-苄氧羰基-l-天冬酰胺,得到化合物p5。
[0103]1h nmr(400mhz,dmso-d6)δ11.17(s,1h),9.93(s,1h),8.00(dd,j=5.6,1.4hz,1h),7.46(s,1h),7.43(d,j=8.5hz,1h),7.39(t,j=8.2hz,1h),7.12(ddd,j=8.5,4.2,1.7hz,1h),6.90(s,1h),6.73(d,j=7.9hz,1h),6.66(d,j=8.3hz,1h),5.80(s,1h),4.50-4.41(m,1h),3.77(s,3h),3.72(dd,j=8.6,4.5hz,1h),3.22-3.17(m,1h),2.88-2.74(m,2h),2.62(s,3h),2.55(dd,j=15.1,4.4hz,1h),2.34(dd,j=15.1,8.7hz,1h).
13
c nmr(101mhz,dmso-d6)δ172.97,172.81,162.42,160.93,152.39,137.30,134.34,133.61,129.13,122.52,118.78,112.72,112.27,111.91,111.22,105.88,102.70,68.08,56.24,53.09,36.12,20.22.hrms(esi-tof)m/z:[m+h]
+
calcd for c
24h26
n6o4,463.2088;found,463.2088.
[0104]
实施例7化合物p6的合成
[0105][0106]
参考化合物p1的合成方法,不同之处在于,将n-苄氧羰基-d-丙氨酸替换成n-苄氧羰基-d-天冬酰胺,得到化合物p6。
[0107]1h nmr(400mhz,dmso-d6)δ11.15(s,1h),9.89(s,1h),8.00(d,j=4.8hz,1h),7.40(dd,j=18.8,8.2hz,3h),7.17-7.08(m,1h),6.87(s,1h),6.74(d,j=8.1hz,1h),6.67(d,j=8.3hz,1h),5.80(s,1h),4.51-4.40(m,1h),3.78(s,3h),3.67(dd,j=8.5,4.4hz,1h),3.28-3.19(m,1h),2.81(d,j=12.7hz,2h),2.62(s,3h),2.54(d,j=4.2hz,1h),2.31(dd,j=15.0,8.7hz,1h).
13
c nmr(101mhz,dmso-d6)δ172.95,172.82,162.41,160.91,152.38,137.28,134.35,133.62,129.14,122.50,118.79,112.69,112.26,111.92,111.19,105.84,102.66,68.07,56.22,53.08,36.13,20.22.hrms(esi-tof)m/z:[m+h]
+
calcd for c
24h26
n6o4,463.2088;found,463.2088.
[0108]
实施例8化合物p7的合成
配成的ph=7.29的缓冲溶液,在37℃摇床中过夜,离心取上层清液,用作标准曲线的色谱条件测试,根据标准曲线和峰面积计算化合物的溶解度。化合物的水溶性研究数据如表1所示。
[0120]
2、化合物大鼠肝微粒体稳定性研究
[0121]
将准确量的大鼠肝微粒体溶于0.1m tris ph=7.4缓冲液,再与辅因子mgcl2、待测化合物和0.005%牛血清白蛋白在37℃下共孵育10min。然后加入nadph开始反应,分别于0、7、17、30和60min取样,加入甲醇(4℃)终止反应。离心后,采用液相色谱串联质谱(lc-ms/ms)进行分析。化合物的大鼠肝微粒体稳定性指标半衰期(t
1/2
)数据如表1所示。
[0122]
其中先导化合物为中国专利申请cn107141288a中获得的活性较好化合物p20,作为对比实验。
[0123]
表1.吴茱萸碱衍生物部分化合物的水溶性和大鼠肝微粒体稳定性测试结果
[0124][0125]
由表可见,先导化合物的溶解度小于10μg/ml,大鼠肝微粒体代谢半衰期仅为6.71min,在体内极易被代谢。本发明中获得的吴茱萸碱类化合物,其水溶性及大鼠肝微粒体稳定性显著提升。并且经过研究结果发现,化合物(s)-p4的水溶性高达896.3mg/l且具有较高的大鼠肝微粒体代谢半衰期(t
1/2
=155.0min);化合物p5和p6的代谢稳定性相近,说明引入天然氨基酸片段和非天然氨基酸片段对代谢稳定性的影响不大。
[0126]
总体来看,本项发明所述吴茱萸碱类化合物的水溶性和稳定性均得到显著性改善,表明该类化合物具有较好的类药性。
[0127]
实施例11吴茱萸碱类化合物对pde5酶的抑制活性研究
[0128]
所需酶浓度的确定:用assay buffer(2.0mm氯化镁,50mm tris 7.5,1.0mm dtt)配制一系列梯度浓度的酶溶液,分别取40μl,加入60μl已稀释底物,阴性对照用40μl assay buffer代替酶溶液,室温反应15min。加入200μl 0.2m硫酸锌溶液和200μl 0.2m氢氧化钡溶液,终止反应。离心(14000rpm)5分钟,取430μl上清液,转移至含2.5ml闪烁液的闪烁管中,振荡混合均匀,用闪烁分析仪测试。取[8-3
h]-cgmp水解率在40%-70%之间的酶浓度作为测定所需酶浓度。
[0129]
待测化合物对酶的抑制活性测定:取2.0μl待测化合物的dmso溶液,加到58μl已稀释底物,混合均匀,阴性对照中加入2.0μl dmso,阳性对照加入2.0μl西地那非的dmso溶液。再加入40μl合适水解范围的酶溶液,阴性对照加入40μl assay buffer代替酶溶液,室温反应15min。终止反应操作同上。分别取上清液430μl,转移至含2.5ml闪烁液的闪烁管中,混合均匀,再用闪烁分析仪测定。化合物对酶的抑制活性用半数抑制浓度(ic
50
)表示,结果参见表2。
[0130]
其中先导化合物为中国专利申请cn107141288a中获得的活性较好化合物p20,作为对比实验。
[0131]
表2.吴茱萸碱类化合物对pde5酶的抑制活性测试结果
[0132]
[0133][0134]
由表可见,本发明中吴茱萸碱骨架吲哚环的6位引入氨基再接上不同的氨基酸片段得到系列新型化合物,均具有较好的pde5酶抑制活性;其中本发明中最先连接丙氨酸的化合物p1对pde5的ic
50
为293
±
24nm,而先导化合物的ic
50
为115
±
4nm,说明这个位点适合进一步结构改造。
[0135]
为了再次验证吴茱萸碱骨架的手性中心对pde5抑制活性的影响,将化合物p4和p6进行不对称合成分别得到相应的两个异构体。由活性测试结果表2可知,(s)-p4和(s)-p6的ic
50
相比于对应的消旋体提高了近1倍、分别为173
±
8nm和80
±
11nm,而(r)-p4和(r)-p6对pde5基本没有抑制作用。
[0136]
需要说明的是,本发明中化合物的结构式是在发明人前期研究的先导化合物基础上进行进一步改进得到的,其靶标作用模式不变,具有相同的对pde5的高选择性。
[0137]
实施例13化合物(s)-p4的药代动力学研究
[0138]
本发明进一步评价了化合物(s)-p4的药代动力学性质,具体实验方法为:选取sd大鼠6只(3只2.5mg/kg静脉注射,3只5.0mg/kg口服给药),给药后不同时间点采集血浆(10个时间点),每次采用都经hplc-ms/ms测定血浆样品中化合物的浓度,然后分析药代动力学参数:半衰期t
1/2
、达峰时间t
max
、最大血药浓度c
max
、药时曲线下面积auc
(0-t)
、清除率cl、稳态分布容积vss及生物利用度f(%)等。部分研究数据与阳性药物西地那非的对比结果见表3。
[0139]
表3.(s)-p4和西地那非在大鼠中的静脉注射药代动力学参数和生物利用度
[0140][0141]
由表可见,在大鼠体内,(s)-p4的半衰期和稳态分布容积均比上市药物西地那非高,特别是半衰期接近西地那非的10倍。此外,西地那非的大鼠口服生物利用度仅为23%(xenobiotica 1999,29,297-310.),其枸橼酸盐在人体中的生物利用度为41%(br.j.clin.pharmacol.2002,53,5s-12s.),而(s)-p4的生物利用度高达63.9%,说明该药物经胃肠道吸收不易被代谢,适合开发成口服药物。其他化合物结构与化合物(s)-p4相近,效果接近。
[0142]
实施例14吴茱萸碱类化合物(s)-p4与靶蛋白pde5的结合模式研究
[0143]
选取化合物(s)-p4与靶蛋白pde5进行共晶培养研究,获得pde5/(s)-p4共晶结构,参见图1。
[0144]
由图可见,(s)-p4进入了pde5蛋白的别构口袋(非催化口袋),不同于现有的传统类型pde5抑制剂。且该类吴茱萸碱类化合物的吲哚6位引入的脯氨酸片段与先导化合物的甲氧基不同,该片段并未进入f564和d563和r616形成的小口袋,而是伸出别构口袋外侧且形成了额外的3根氢键相互作用,分别是酰胺键与附近的水分子、脯氨酸的仲胺与l566及f564。本发明其他化合物结构与化合物(s)-p4结构接近,具有相似的效果。
[0145]
由上述结果可以看出,本发明所述的吴茱萸碱类化合物对磷酸二酯酶5型具有良好的抑制活性、水溶性、大鼠肝微粒体稳定性及口服生物利用度,充分说明本发明中的该类吴茱萸碱类化合物具有较好的类药性;且该类化合物与传统磷酸二酯酶5型抑制剂具有不同的作用模式,其为别构调节抑制剂。可见,本发明所述吴茱萸碱类化合物作为磷酸二酯酶5型抑制剂具有广阔的应用空间。
[0146]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,
均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1