车前草花叶病毒的检测卡、检测引物组合物、GICA-RT-LAMP试剂盒
车前草花叶病毒的检测卡、检测引物组合物、gica
‑
rt
‑
lamp试剂盒
技术领域
1.本发明涉及百合科作物病毒病原检测技术领域,具体而言,涉及车前草花叶病毒的检测卡、检测引物组合物、gica
‑
rt
‑
lamp试剂盒。
背景技术:
2.百合(lilium spp.)是百合科(liliaceae)百合属(lilium)多年生草本球根植物的总称,是一种集观赏、食用、药用价值于一身的重要园艺作物。近年来,国内百合产业发展迅速,遍及大江南北。云南省和辽宁省为国内切花百合的主要生产基地,每年的切花百合种球生产量约为2.3亿粒。兰州百合、宜兴百合和龙牙百合为国内三大食用百合,主要种植于甘肃兰州、江苏宜兴、江西万载、湖南隆回等地。兰州百合是唯一的甜百合,种植面积已超过17万亩,产值达20亿元。宜兴百合,又名卷丹百合,种植于太湖湖畔,种植面积1000亩。龙牙百合主要种植于湖南隆回和江西万载等地,因其鳞茎形如龙爪、色如象牙而得名,每年种植面积约为930万亩。随着百合种植面积的扩大,无性繁殖使病毒广泛传播并积累,导致种源严重退化,其中,由多个病毒引起的俗称植物癌症的病毒病在百合产区普遍发生,感染率高达98%,百合的产量逐年下降,其中兰州百合由每亩1500kg降到600kg甚至更少。病毒病已成制约百合产业发展的重要因素。
3.目前文献报道侵染百合的病毒有十多种,除百合隐症病毒(lily symptomless virus,lsv)、黄瓜花叶病毒(cucumber mosaic virus,cmv)和百合斑驳病毒(lily mottle virus,lmov)三种普遍感染的病毒外,中国科学院西北生态环境资源研究院植物病毒研究组于2019年在甘肃省种植的切花百合上检测到了车前草花叶病毒(plantago asiatica mosaic virus,plamv)。plamv是荷兰新报道,国内偶尔发现、尚未大面积传播的百合病毒,拥有广泛的寄主范围,能侵染16科的作物,除侵染百合、烟草、地黄、南天竹等作物以外,还能够侵染多种杂草,对农业生产造成潜在威胁。感染了plamv的百合,初期的主要症状为花叶和锈斑,发展到后期症状加重,百合生长受到抑制,造成植株矮化。plamv的传播方式主要是机械传播和土壤传播。
4.目前,针对plamv病毒的检测方法主要有酶联免疫吸附法(elisa)、逆转录聚合酶链式反应(rt
‑
pcr)和基因芯片技术(mircoarray)等,但这些方法大多都还停留在研究和实验室阶段,表现在程序复杂,检测费用高、对仪器设备和检测条件要求高,需要长期经验积累和具有专业操作技能的人员才能完成,因此使用范围受到很大的局限,无法满足百合种植现场及田间快速检测的需求。
5.对于以球茎繁殖为主的百合作物,籽球中病毒含量低,现有的elisa及其衍生技术由于受灵敏性的限制易出现假阴性结果。此外,籽球中淀粉含量高,且富含多糖、多酚等物质,rna提取难度大,依赖于核酸提取的rt
‑
pcr及其衍生技术检测的准确性受到影响,急需开发出适用于球茎类作物病毒病害快速、灵敏检测的新技术和新方法。
6.鉴于此,特提出本发明。
技术实现要素:
7.本发明的目的在于提供一种车前草花叶病毒的检测卡、检测引物组合物、gica
‑
rt
‑
lamp试剂盒。
8.车前草花叶病毒(plamv)属于甲型线形病毒科(alphafilexiviridae)马铃薯x病毒属(potexvirus),病毒粒子为弯曲的丝状结构,呈螺旋对称,不含包膜蛋白。病毒粒子长度约为490
‑
530nm,直径大小约为11
‑
13nm。plamv的基因组由一条约6100个核苷酸的正义单链rna构成,从n端到c端负责编码orf1
‑
orf5共5个开放阅读框。rna链的5n端含有一个甲基鸟苷帽子结构,3c端由poly(a)尾巴构成。在rna的5n端,orf1编码复制相关蛋白rep(replication
‑
associated protein),3c端编码病毒结构蛋白cp,处于中间的orf2
‑
orf4共同编码三基因连锁结构(triple gene block proteins,tgbp)。cp作为病毒的结构蛋白,在病毒的移动及侵染中发挥着重要作用。
9.目前,针对plamv的检测存在程序复杂、设备要求高、人员要求高、rna提取难、无法快速检测等问题,发明人特提出了免疫层析法和dna环介导等温扩增技术的联合检测方法和检测试剂盒。
10.免疫层析法(immunochromatographic assay,ica)是将抗原抗体的免疫反应和层析作用相结合的病毒检测方法;其中,胶体金免疫层析技术(colloidal gold immunochromatography assay,gica)是将胶体金标记技术和抗原抗体免疫反应相结合而开发的血清学检测技术,该技术以硝酸纤维素膜为载体,通过液体的渗移,利用抗原抗体的结合,以及胶体金呈现颜色反应来检测抗原或抗体。gica技术以其特异性强、成本低、操作简便、不需任何仪器、适合现场快速检测等优点被广泛应用,已被用于植物、动物等多种病原微生物以及新型冠状病毒(covid
‑
19)等人类疾病病原物的快速检测。作为一种快速筛查的技术手段,gica技术既可节省检测成本,又可用于广大基层单位开展植物病毒的检测和防控工作中,具有重要的经济价值和社会价值。但是作为一种快速筛查的血清学检测技术,该方法的灵敏性普遍低于pcr等核酸检测手段,对于病毒浓度低的样品,如种球等,很容易检测出假阴性结果,造成误检或漏检,给病害防治带来潜在威胁。
11.本发明是这样实现的:
12.本发明提供了一种车前草花叶病毒的检测卡,其包括在衬板上依次设置的样品垫、胶体金结合垫、硝酸纤维素膜和吸收垫,胶体金结合垫上含有胶体金
‑
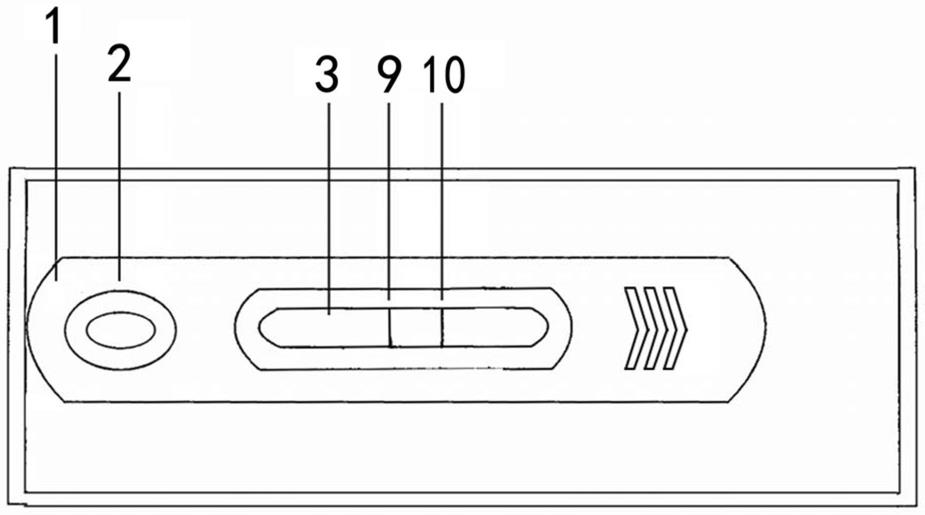
车前草花叶病毒抗体的结合物,硝酸纤维素膜上沿层析方向依次设置有检测t线和质控c线,检测t线包被有plamv的抗体igg,质控c线包被有抗plamv抗体的二抗;检测t线上plamv的抗体igg的包被量为每2mm线宽上包被1.5~2.0μg蛋白;抗plamv抗体的二抗的包被量为每2mm线宽上包被1.5~2.0μg蛋白;
13.胶体金结合垫上的车前草花叶病毒抗体的包被量为每毫升胶体金中含14
‑
16μg的车前草花叶病毒抗体。
14.胶体金结合垫和硝酸纤维素膜上包被的抗体可以选自市售或自制纯化获得。
15.在本发明应用较佳的实施方式中,上述检测卡还包括由下壳体和上壳体组成的卡槽,衬板与下壳体的一个端面固定连接,上壳体与下壳体固定连接,且上壳体与下壳体留有放置衬板的安装腔;
16.优选地,上壳体上间隔设置有加样窗和反应观察窗,加样窗空间上位于样品垫的
上方,反应观察窗空间上位于硝酸纤维素膜的上方;
17.优选地,上壳体与下壳体通过卡扣结构卡接。
18.上述检测卡也可简称为gica速测卡,在检测样品时,在加样窗处加入少量被检样品的待检溶液,对比反应观察窗内检测t线和质控c线的颜色,即可判定被检测样品是否感染车前草花叶病毒plamv。
19.其中将少量待检溶液加入加样窗中,3
‑
5分钟后,当反应观察窗内检测t线和质控c线上均出现棕红色的条带时,则判定被检样品感染了车前草花叶病毒plamv,无需进行后续的反转录rt
‑
lamp检测。
20.若反应观察窗内检测t线没有颜色变化而仅质控c线出现棕红色的条带时,则初步判定被检样品没有感染车前草花叶病毒plamv,或感染车前草花叶病毒plamv的含量低,则需接着进行后续的反转录rt
‑
lamp检测。
21.dna环介导等温扩增技术(loop
‑
mediated isothermal amplification of dna,lamp)是一种新型的核酸等温扩增技术。通过设计特异性内引物fip/bip和外引物f3/b3,靶向目的序列六个特异性区域,利用具有链置换特点的bst dna聚合酶,合成循环模板进行扩增反应。lamp扩增效率高,能在约1h时间内获得109‑
10
10
个拷贝。与常规pcr核酸检测方法相比,lamp技术在恒温水浴中即能完成扩增反应,具有操作简便、特异性强、灵敏度高等优势,在食品安全监测、动植物病原物和医学病原物,包括covid
‑
19等的检测中被应用。
22.本发明提供了一种检测车前草花叶病毒的rt
‑
lamp检测引物组合物,其包括如seq id no.1所示的正向外引物f3、seq id no.2所示的反向外引物b3、seq id no.3所示的正向内引物fip和seq id no.4所示的反向内引物bip。
23.在本发明应用较佳的实施方式中,上述引物组合物还包括seq id no.5所示的正向环引物lf和seq id no.6所示的反向环引物lb。通过设置正向环引物lf和反向环引物lb可以增加dna合成的起点,加快扩增速度,提升反应效率。
24.引物序列具体如下:
25.f3:5
’‑
acagccaccatctctctgg
‑3’
;
26.b3:5
’‑
ccatcgaagaagtcgaagcc
‑3’
;
27.fip:
[0028]5’‑
ggcgtagaagcggcagaactcaaatcgccggggttgtg
‑
3';
[0029]
bip:
[0030]5’‑
aatcatctggaacgcccggcgcggtgttcgaacttgatgt
‑3’
;
[0031]
lf:5
’‑
gcagggtggtggtgacttt
‑3’
;
[0032]
lb:5
’‑
gaaatctcccaccggcaggc
‑3’
。
[0033]
发明人发现,采用上述引物组合能够实现目标样本中车前草花叶病毒的特异性检出,具有极低的检出限,且特异性高。
[0034]
本发明还提供了一种检测车前草花叶病毒的gica
‑
rt
‑
lamp试剂盒,其包括上述的车前草花叶病毒的检测卡和上述的检测车前草花叶病毒的rt
‑
lamp检测引物组合物。
[0035]
发明人提供了gica
‑
rt
‑
lamp试剂盒的检测对象是plamv病毒粒子,通过胶体金免疫层析gica技术快速富集病毒粒子,初步判定待测样品的病毒感染情况;再利用病毒基因组序列的特异性引物进行rt
‑
lamp扩增,通过对扩增产物的分析达到精确检测病原物的目
的。gica
‑
rt
‑
lamp检测方法将血清学方法和核酸检测方法有机地结合起来,具有特异性强、灵敏度高的优势。
[0036]
gica
‑
rt
‑
lamp试剂盒的检测灵敏度达到了0.069pg/ml,比普通gica
‑
rt
‑
pcr灵敏10倍。且在检测过程中免核酸rna提取,无需要专业的仪器设备,简化了操作过程,降低了检测难度,可以通过简单的培训即可指导测试员进行待测样本的测试。该试剂盒的提出还提高了检测效率,具有广阔的应用前景。
[0037]
在本发明应用较佳的实施方式中,上述试剂盒还包括rt
‑
lamp扩增反应试剂,rt
‑
lamp扩增反应试剂包括反转录酶、rnase抑制剂、dntp混合物、thermopol反应缓冲液、mgso4、dna聚合酶和水。优选地,反转录酶选自amv反转录酶或m
‑
mlv反转录酶,dna聚合酶选自bst dna聚合酶。此外,在其他实施方式中,dna聚合酶的类型可以根据需要进行选择。
[0038]
rnase抑制剂可以为depc、异硫氰酸胍或氧钒核糖核苷复合物。
[0039]
在本发明应用较佳的实施方式中,试剂盒还包括磷酸缓冲液(pbs)、磷酸洗涤缓冲液(pbst)、荧光染料检测液、阴性对照品和阳性对照品。
[0040]
在本发明应用较佳的实施方式中,阴性对照品为水,阳性对照品为车前草花叶病毒外壳蛋白cp基因片段标准品。
[0041]
车前草花叶病毒外壳蛋白cp基因片段标准品序列如下:
[0042]
cgatgacttttgccgtctcatccccgtccgtgcccaccgccgcggagctggacacgatcacacgaggcttaacaaccctcggcgtcccagcagaagctctgctcagccacgccctctcggtcgtcaacgcgtgcttcgacgctggctcttccgccttcgtcaccctcagcggccccagccccacagccaccatctctctggcccaaatcgccggggttgtgaaagtcaccaccaccctgcggaagttctgccgcttctacgccaaaatcatctggaacgcccggctttccagaaatctcccaccggcaggcttcgcccgcgccaacatcaagttcgaacaccgctgggccggcttcgacttcttcgatggcctcctcaaccccgcagctctggaacccctcggcggactcacacgcaccccaacccctgacgaagtaactgccaatgagacggcacgatccctaaacctcttcgaggcccgtgccagcacttccaacctagcctcaacctccacccagttcacccgcggccagctctcgagcacggctccgcaaatccagttcctcccct。
[0043]
本发明还提供了一种采用检测车前草花叶病毒gica
‑
rt
‑
lamp试剂盒检测车前草花叶病毒的检测方法,其包括:
[0044]
(1)取待测溶液置于车前草花叶病毒的检测卡的样品垫上,观察检测t线和质控c线的颜色变化,初次判断待测样品中是否含有车前草花叶病毒plamv;
[0045]
(2)若根据步骤(1)无法鉴别待测样品中是否含有车前草花叶病毒plamv,进行反转录rt
‑
lamp扩增:将步骤(1)免疫富集反应后检测卡上的检测t线取下,以取下的检测t线作为模板,利用rt
‑
lamp检测引物组进行rt
‑
lamp扩增;根据rt
‑
lamp扩增反应产物二次判断待测样品中是否含有车前草花叶病毒。
[0046]
需要说明的是,上述无法鉴别的情形包括:检测t线不显色,无法确定待测样本是否是阳性,均需要进行后续的rt
‑
lamp检测。
[0047]
rt
‑
lamp扩增的反应条件为:56
‑
68℃恒温水浴中扩增70
‑
100min,随后80℃变性10min,终止反应。发明人发现,在上述恒温反应温度和时间条件下,可以通过肉眼观察到反应的荧光染料颜色变化,从而判读出样本中是否含有车前草花叶病毒。
[0048]
在本发明应用较佳的实施方式中,根据检测t线和质控c线的颜色变化初次判断待测样品是否含有plamv的具体方法为肉眼观察法;肉眼观察法为:
[0049]
若检测t线和质控c线上均出现棕红色的条带时,说明待测样品中含有车前草花叶病毒plamv,无需进行反转录rt
‑
lamp扩增;
[0050]
若检测t线没有颜色变化而仅质控c线出现棕红色的条带时,则判定被检样品没有感染车前草花叶病毒plamv,或感染车前草花叶病毒plamv的含量低,则需进行反转录rt
‑
lamp扩增。
[0051]
在本发明应用较佳的实施方式中,根据rt
‑
lamp扩增反应产物二次判断待测样品是否含有车前草花叶病毒的具体方法为荧光染料肉眼观察法;荧光染料肉眼观察法为:
[0052]
取荧光染料反应液在反应前加入rt
‑
lamp扩增反应管的管盖上,待lamp扩增反应结束后,使荧光染料检测液与lamp反应液混合,采用肉眼直接观察混合反应液的颜色。
[0053]
由于sybr green i会抑制lamp反应,因此不适合反应前加sybr green i,而反应结束后加入方可显色。
[0054]
在本发明应用较佳的实施方式中,荧光染料反应液为sybr green i,若扩增产物出现绿色荧光,表示待测样品中含有车前草花叶病毒;
[0055]
若扩增产物颜色为橙色则表示待测样品中不含车前草花叶病毒。
[0056]
本发明还提供了一种车前草花叶病毒的检测卡、检测车前草花叶病毒的rt
‑
lamp检测引物组合物或检测车前草花叶病毒的gica
‑
rt
‑
lamp试剂盒在检测车前草花叶病毒中的应用。
[0057]
本发明具有以下有益效果:
[0058]
(1)本发明提供的检测车前草花叶病毒的gica
‑
rt
‑
lamp试剂盒以及其检测方法克服了现有技术中车前草花叶病毒的生物学检测方法繁琐,费时费力,必须依赖酶标仪或热循环仪等昂贵的分子生物学仪器设备,无法快速检测车前草花叶病毒等的缺陷。该试剂盒将血清学和lamp扩增技术有机地结合,充分地发挥了两种检测方法的优势,直接以胶体金免疫层析富集到的plamv病毒粒子作为检测对象进行rt
‑
lamp扩增,避免了rna抽提,极大程度上降低了检测的门槛和难度,操作简单易行。反应操作在同一反应体系中连续进行,反应中途不需添加任何试剂,降低了污染风险。
[0059]
(2)准确性高:本发明首先利用车前草花叶病毒plamv胶体金免疫层析检测卡免疫富集待测样品中的plamv粒子,用其作为模板进行rt
‑
lamp扩增,提高了检测的特异性,减少了假阳性的发生。本发明提供的检测车前草花叶病毒的rt
‑
lamp检测引物组合物具有特异性强,灵敏度高的优势。rt
‑
lamp反应通过f3、b3、fip、bip、lf和lb共6条特异性引物识别plamv cp靶基因的8个序列,特异性强,准确性高。
[0060]
(3)适用性好:本发明提供的检测方法摆脱了现有检测技术对酶标仪或热循环仪器(pcr仪器)的强烈依赖,第一步免疫层析反应无需任何仪器设备,用肉眼观察结果,随后进行的rt
‑
lamp反应在恒温水浴中就能完成,降低了检测难度,扩展了技术的应用范围,反应结束后通过颜色变化用肉眼判断结果,不依赖于仪器或设备,增加了应用价值,非常适合在基层推广应用,前景十分广阔。
[0061]
(4)本发明为百合及植物病毒病检测提供了新的技术平台,既能应用于车前草花叶病毒plamv的快速筛查,也能应用于plamv病毒的精准检测,一举两得,为监控plamv病毒的发生、扩散、流行以及病毒病的防治提供技术支撑。
附图说明
[0062]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
[0063]
图1为本发明实施例gica
‑
rt
‑
lamp检测plamv病毒的胶体金免疫层析检测卡平面结构示意图;
[0064]
图2为本发明实施例gica
‑
rt
‑
lamp检测plamv病毒的胶体金免疫层析检测卡内部结构示意图;
[0065]
图3为本发明实施例gica
‑
rt
‑
lamp检测plamv病毒反应温度的荧光染料肉眼观察图;
[0066]
图4为本发明实施例gica
‑
rt
‑
lamp检测plamv病毒反应时间的荧光染料肉眼观察图;
[0067]
图5为本发明实施例gica
‑
rt
‑
lamp检测plamv病毒特异性的荧光染料肉眼观察图;图中:1:阴性对照;2
‑
12分别对应:健康百合组织;lsv百合感病组织;cmv
‑
li百合感病组织;lmov百合感病组织;armv百合感病组织;jhmv当归感病组织;pvx马铃薯感病组织;lnyv生菜感病组织;lmv生菜感病组织;cmv生菜感病组织;plamv百合感病组织;
[0068]
图6为本发明实施例gica
‑
rt
‑
lamp检测plamv病毒灵敏性的荧光染料肉眼观察图;图中:1:阴性对照;2
‑
11分别对应plamv cp基因标准品浓度:10
‑1(6.9
×
103ng/ml);10
‑2(6.9
×
102ng/ml);10
‑3(6.9
×
101ng/ml);10
‑4(6.9
×
100ng/ml);10
‑5(6.9
×
10
‑1ng/ml);10
‑6(6.9
×
10
‑2ng/ml);10
‑7(6.9
×
10
‑3ng/ml);10
‑8(6.9
×
10
‑4ng/ml);10
‑9(6.9
×
10
‑5ng/ml);10
‑
10
(6.9
×
10
‑6ng/ml);
[0069]
图7为本发明实施例gica
‑
rt
‑
pcr检测plamv病毒灵敏性的电泳分析图;图中:m:600bp marker;1:阴性对照;2
‑
11分别对应plamv cp基因标准品浓度:10
‑1(6.9
×
103ng/ml);10
‑2(6.9
×
102ng/ml);10
‑3(6.9
×
101ng/ml);10
‑4(6.9
×
100ng/ml);10
‑5(6.9
×
10
‑1ng/ml);10
‑6(6.9
×
10
‑2ng/ml);10
‑7(6.9
×
10
‑3ng/ml);10
‑8(6.9
×
10
‑4ng/ml);10
‑9(6.9
×
10
‑5ng/ml);10
‑
10
(6.9
×
10
‑6ng/ml)。
[0070]
附图标记:1
‑
卡槽;2
‑
加样窗;3
‑
反应观察窗;4
‑
样品垫;5
‑
胶体金结合垫;6
‑
硝酸纤维素膜;7
‑
吸收垫;8
‑
衬板;9
‑
检测t线;10
‑
质控c线。
具体实施方式
[0071]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0072]
以下结合实施例对本发明的特征和性能作进一步的详细描述。
[0073]
实施例1
[0074]
参照图1和图2所示,本实施例提供了一种车前草花叶病毒的检测卡,其包括卡槽1。卡槽1由下壳体和上壳体(图中未示出标号)组成,本实施例中设置下壳体和上壳体卡扣
相连。上壳体与下壳体留有放置衬板8的安装腔。衬板8与下壳体的一个端面固定连接。
[0075]
在衬板8上依次设置的样品垫4、胶体金结合垫5、硝酸纤维素膜6和吸收垫7,胶体金结合垫5上含有胶体金
‑
车前草花叶病毒抗体的结合物,硝酸纤维素膜6上沿层析方向依次设置有检测t线9和质控c线10,检测t线9包被有plamv的抗体igg,质控c线10包被有抗plamv抗体的二抗;检测t线9上plamv的抗体igg的包被量为每2mm线宽上包被1.5~2.0μg蛋白;抗plamv抗体的二抗的包被量为每2mm线宽上包被1.5~2.0μg蛋白,本实施例中的抗plamv抗体的二抗为羊抗兔igg;胶体金结合垫5上的车前草花叶病毒抗体的包被量为每毫升胶体金中含14
‑
16μg的车前草花叶病毒抗体。本实施例中,胶体金结合垫5上的车前草花叶病毒抗体为兔抗plamv多克隆抗体。
[0076]
上壳体上间隔设置有加样窗2和反应观察窗3,加样窗2空间上位于样品垫4的上方,反应观察窗3空间上位于硝酸纤维素膜6的上方。
[0077]
上述检测卡的制备方法如下:
[0078]
1.先制备车前草花叶病毒plamv多克隆抗体igg:
[0079]
①
plamv病毒粒子的纯化:取100g冰冻的plamv感病百合叶片(田间自行采集),加200ml 0.1m,ph7.5的含0.2%β
‑
巯基乙醇和0.01m edta的tris
‑
硼酸缓冲液,在冰冻研钵中研磨至匀浆,4层纱布过滤,取滤液;向滤液中加入终浓度为6%的正丁醇,冰上不断搅拌45min;15000g离心10min,保留上清,弃沉淀;向上清液中加入终浓度为8%的peg8000和终浓度为2%的nacl,沉淀上清液,混合物在4℃静置30min;15000g离心10min,保留沉淀,重悬于0.1m,ph7.5的含0.2%β
‑
巯基乙醇和0.01m edta的tris
‑
硼酸缓冲液,4℃过夜;7500g离心5min,离心3次,保留上清;将病毒溶液覆盖在4ml含有30%蔗糖的0.1m,ph 7.5的tris
‑
硼酸缓冲液上,4℃86500g离心3h,沉淀用tris
‑
硼酸缓冲液重新溶解,4℃过夜,7500g离心10min,离心3次,取上清经sds
‑
page电泳以及rt
‑
pcr验证,确定为plamv病毒粒子后用于免疫实验。
[0080]
②
多克隆抗体的制备:用1mg/ml上述纯化的plamv病毒粒子蛋白作为免疫原免疫新西兰大白兔(购于青岛康大生物科技有限公司);初次免疫中,将蛋白抗原与弗氏完全佐剂等体积充分混匀,进行皮下多点注射;初次免疫21d后,将1.0mg/ml的纯化蛋白与等体积的弗氏不完全佐剂混合,充分乳化后,经皮下多点注射作为第一次增强免疫;以后每间隔21d进行一次增强免疫,免疫方式为皮下多点注射。一共进行3次增强免疫,在第4次加强免疫后的5~7d颈动脉采血,静至,离心,收集到的血清加入质量百分比浓度0.02%的叠氮钠,
‑
20℃保存;所得抗血清通过饱和硫酸铵沉淀法,透析至ph 7.8的磷酸缓冲液,然后通过protein a亲和层析的方法对抗血清进行纯化获得兔抗plamv多克隆抗体igg。
[0081]
2.胶体金标记兔抗plamv多克隆抗体的方法如下:
[0082]
分别取粒径为30nm的胶体金5ml及兔抗plamv多克隆抗体78μg,在ph7.5的条件下通过磁力搅拌震荡使其结合,加10%牛血清白蛋白(bsa)和5%peg20000作为稳定剂,使得终浓度分别为0.5%和0.2%,采用低温高速离心法除去未结合的多克隆抗体和未稳定的胶体金颗粒及去凝聚物,在离心管底部的深红色沉淀即为胶体金—抗体结合物。
[0083]
3.胶体金结合垫的制备:
[0084]
用1/10标记前胶体金溶液体积的重悬液悬浮胶体金
‑
抗体结合物,离心,上清液用喷涂设备涂于玻璃纤维素膜上,37℃烘干,制成胶体金结合垫。
[0085]
4.免疫层析膜的包被:
[0086]
检测t线包被的是纯化的兔抗plamv多克隆抗体igg,对照c线包被的是羊抗兔igg抗体,每条线宽2mm,兔抗plamv多克隆抗体合适包被量为1.6μg蛋白,羊抗兔igg纯化抗体合适包被量为1.6μg蛋白。
[0087]
5、胶体金免疫层析gica检测卡的组装。
[0088]
作为支撑载体聚氯乙烯衬板体被固定于检测卡槽下壳体中,样品垫、胶体金结合垫、硝酸纤维素膜和吸水滤纸依次排列连接于聚氯乙烯衬板上表面,再通过卡扣将检测卡槽上壳体与下壳体连接。
[0089]
本实施例还提供了上述检测卡的检测方法:
[0090]
参照图1所示,吸取少量样品的待检测溶液,滴在检测卡槽上壳体加样窗2处,由于毛细效应液体往前移动,若待测液中含有plamv,检测样品经过胶体金结合垫时,plamv与金标垫上的金标多克隆抗体形成复合物,然后继续向所述检测t线方向层析泳动,当接触到检测t线时,与检测t线上的plamv多克隆抗体发生抗原抗体结合反应而被截留下来,形成可见的棕红色条带;未结合的复合物继续向质控c线方向渗移,当接触到质控c线时与固定在质控c线上的羊抗兔igg抗体结合而被截留下来,形成可见的棕红色条带。即当检测t线和质控c线上均出现棕红色的条带时,则判定被检样品感染了车前草花叶病毒plamv。
[0091]
若待测液中不含plamv或plamv含量较低时,检测样品经过胶体金结合垫时,则不能与金标垫上的金标多克隆抗体结合或者结合的复合物量非常少,当接触到所述检测t线时不发生反应,金标多克隆抗体继续向质控c线方向渗移,当接触到质控c线时与固定在质控c线上的羊抗兔igg抗体结合而被截留下来,形成可见的棕红色条带。即当检测线没有颜色变化而仅质控c线出现棕红色的条带时,则判定被检样品没有感染车前草花叶病毒plamv或感染车前草花叶病毒plamv的含量低,需要后续进一步的试验分析。
[0092]
上述实施例可以看出,本发明提供的检测卡可初步对车前草花叶病毒plamv进行快速筛查,田间地头及现场就地检测,无需培训,3~5分钟可初步判断被检样品的病毒感染情况,达到快速、简便、高效检测plamv的目的。
[0093]
实施例2
[0094]
本实施例提供了一种检测车前草花叶病毒的gica
‑
rt
‑
lamp试剂盒。
[0095]
gica
‑
rt
‑
lamp试剂盒由三部分组成,分别为车前草花叶病毒plamv胶体金免疫层析gica检测卡;rt
‑
lamp特异性引物组合物和rt
‑
lamp扩增反应试剂;
[0096]
除此之外,gica
‑
rt
‑
lamp试剂盒还包括磷酸缓冲液(pbs)、磷酸洗涤缓冲液(pbst)、荧光染料检测液、阴性对照品和阳性对照品。
[0097]
其中rt
‑
lamp特异性引物组合物包括如seq id no.1所示的正向外引物f3、seq id no.2所示的反向外引物b3、seq id no.3所示的正向内引物fip、seq id no.4所示的反向内引物bip、seq id no.5所示的正向环引物lf和seq id no.6所示的反向环引物lb。通过设置正向环引物lf和反向环引物lb可以增加dna合成的起点,加快扩增速度,提升反应效率。
[0098]
上述引物组合物中各引物组的序列如下:
[0099]
f3:5
’‑
acagccaccatctctctgg
‑3’
;
[0100]
b3:5
’‑
ccatcgaagaagtcgaagcc
‑3’
;
[0101]
fip:5
’‑
5'
‑
ggcgtagaagcggcagaactcaaatcgccggggttgtg
‑
3';
[0102]
bip:5
’‑
aatcatctggaacgcccggcgcggtgttcgaacttgatgt
‑3’
;
[0103]
lf:5
’‑
gcagggtggtggtgacttt
‑3’
;
[0104]
lb:5
’‑
gaaatctcccaccggcaggc
‑3’
。
[0105]
rt
‑
lamp扩增反应试剂由10u/μl amv反转录酶、40u/μl rnase抑制剂、10mm dntp混合物、10
×
thermopol反应缓冲液、100mm mgso4、8u/μl bst dna polymerase和rna
‑
free h2o组成;
[0106]
磷酸缓冲液(pbs)和磷酸洗涤缓冲液(pbst)的浓度为0.02m,ph值为7.4;
[0107]
荧光染料检测液为1000
×
sybr green i;
[0108]
阴性对照品为rna
‑
free h2o;
[0109]
阳性对照品为百合plamv cp基因标准品。
[0110]
本实施例还提供了百合plamv cp基因标准品的制备方法。具体制备方法如下:
[0111]
1.总rna的提取
[0112]
将50
‑
100mg感染plamv的百合叶片在液氮中研磨,用植物总rna提取试剂盒提取感病组织的总rna;
[0113]
2、引物设计与合成
[0114]
根据本课题组从甘肃切花百合上克隆的plamv基因序列设计并合成了1对cp基因的特异性正向(plamv
‑
f)和反向引物(plamv
‑
r);其中上述引物序列如下:
[0115]
plamv
‑
f:5
’‑
cgatg acttt tgccg tct
‑3’
[0116]
plamv
‑
r:5
’‑
agggg aggaa ctgga ttt
‑3’
;
[0117]
3、阳性对照品的制备。
[0118]
1)rt反应
[0119]
利用上述plamv反向引物plamv
‑
r和m
‑
mlv反转录酶进行rt反应,合成cdna第一链;10μl rt反应体系如下:总rna 2μl,10μm plamv特异性反向引物plamv
‑
r 1μl,rna
‑
free h2o 3μl,70℃变性10min,迅速置冰上急冷2min;再加入5
×
m
‑
mlv buffer 2μl,10mm dntps 1μl,30u/μl rnase抑制剂0.34μl,200u/μl m
‑
mlv反转录酶0.35μl和rna
‑
free 0.31μl;混合后42℃水浴1h,70℃保温15min,置冰上待用;
[0120]
2)pcr反应
[0121]
利用上述cdna第一链为模板,在ex taq dna聚合酶作用下进行plamv cp基因的pcr扩增;
[0122]
pcr反应体系为12.5μl,包括:50ng cdna 0.5μl,5u/μl ex taq dna聚合酶0.1μl,10
×
pcr buffer 1.25μl,2.5mm dntps 1μl,10μm正向引物plamv
‑
f 0.25μl,10μm反向引物plamv
‑
r 0.25μl,ddh2o补足至12.5μl;
[0123]
pcr扩增条件为:94℃预变性4min;94℃变性30s,50℃退火45s,72℃延伸30s,循环扩增35次,最后72℃延伸7min;
[0124]
pcr产物经1.5%琼脂糖凝胶电泳检测后,回收目的片段,利用克隆载体试剂盒将目的片段连接在pmd18
‑
t载体上,转化dh5α感受态细胞,进行蓝白斑平板筛选;随机挑取3个白斑菌落分别接种在氨苄lb培养基上,37℃摇菌12~16h;使用质粒微量抽提试剂盒提取质粒;分别取1μl质粒,在与上述pcr反应体系相同的条件下进行pcr扩增;将pcr检测得到的阳性重组质粒测序;测序证实序列完全正确的阳性质粒,即为阳性对照品,百合plamv cp基因
对应的片段长度分别为570bp;用nanodrop nd
‑
1000核酸/蛋白分析仪测定标准品的质粒浓度;
[0125]
4、阳性对照品的序列
[0126]
经测序,上述阳性对照品与预期完全相符,回收的对照品片段序列如下:
[0127]
百合plamv cp基因片段标准品序列:
[0128]
cgatgacttttgccgtctcatccccgtccgtgcccaccgccgcggagctggacacgatcacacgaggcttaacaaccctcggcgtcccagcagaagctctgctcagccacgccctctcggtcgtcaacgcgtgcttcgacgctggctcttccgccttcgtcaccctcagcggccccagccccacagccaccatctctctggcccaaatcgccggggttgtgaaagtcaccaccaccctgcggaagttctgccgcttctacgccaaaatcatctggaacgcccggctttccagaaatctcccaccggcaggcttcgcccgcgccaacatcaagttcgaacaccgctgggccggcttcgacttcttcgatggcctcctcaaccccgcagctctggaacccctcggcggactcacacgcaccccaacccctgacgaagtaactgccaatgagacggcacgatccctaaacctcttcgaggcccgtgccagcacttccaacctagcctcaacctccacccagttcacccgcggccagctctcgagcacggctccgcaaatccagttcctcccct。
[0129]
实施例3
[0130]
本实施例提供了gica
‑
rt
‑
lamp试剂盒检测plamv的方法。
[0131]
1、胶体金免疫层析gica富集病毒粒子
[0132]
1)取100mg感染plamv的百合样品或其他待检样品放入3ml装有磷酸缓冲液pbs的自封袋中,用研棒轻轻研磨,研磨后的组织液即为待检样品的检测液;
[0133]
2)吸取少量上述样品的检测液,滴在plamv胶体金免疫层析gica检测卡加样窗2处,3
‑
5分钟内在反应观察窗3内观察显色结果。
[0134]
2、初次判断反应结果
[0135]
当上述胶体金免疫层析gica检测卡反应观察窗3内的检测t线9和质控c线10上均出现棕红色的条带时,则判定被检样品感染了车前草花叶病毒plamv,无需进行后续检测;
[0136]
当上述胶体金免疫层析gica检测卡反应观察窗3内的检测t线9没有颜色变化,而质控c线10上出现棕红色的条带时,则判定被检样品没有感染车前草花叶病毒plamv,或者感染plamv的程度轻,则需进行后续的反转录rt
‑
lamp检测;
[0137]
3、rt
‑
lamp反应
[0138]
1)将上述反应结束的plamv胶体金免疫层析检测卡的检测t线切下,用pbst冲洗三次,用消毒刀片小心地刮下t线区域,放入pcr管中;
[0139]
2)在上述含有t线的pcr管中加入40u/μl rnase抑制剂0.15μl、10u/μlamv反转录酶0.3μl、10
×
thermopol缓冲液1.25μl、100mm mgso
4 0.75μl、10mm dntp混合物1.75μl、分别含2.5μm b3和f3,20.0μm fip和bip,以及10.0μm lf和lb的lamp引物组1.0μl、8u/μl bst dna polymerase 1.0μl、rnase free h2o补足至12.5μl;以rna
‑
free h2o作为阴性对照,百合plamv cp基因标准品作为阳性对照;反应体系配置完成后,在pcr管盖内壁加1μl100
×
sybr green i荧光染料工作液,盖紧pcr管盖,进行rt
‑
lamp反应;rt
‑
lamp的反应条件为:56
‑
68℃扩增70
‑
100min,随后80℃变性10min,终止反应。
[0140]
4、二次判断反应结果
[0141]
上述rt
‑
lamp反应结束后,在不开盖的情况下,离心或轻甩pcr管,使pcr管盖内壁上的sybr green i荧光染料与lamp扩增产物混合,上下颠倒混匀,采用肉眼直接观察pcr管
内混合液的颜色变化:
[0142]
若混合液颜色变为绿色,说明sybr green i染料与双链dna结合,则为阳性反应,表示被检样品中含有车前草花叶病毒plamv;
[0143]
若混合液颜色为橙色,则为阴性反应,表示样品中不含车前草花叶病毒plamv。
[0144]
实验例1
[0145]
本实验例提供了实施例2中的gica
‑
rt
‑
lamp试剂盒检测plamv病毒在不同反应温度和反应时间下的荧光染料肉眼观察实验,检测方法参照实施例3所示。
[0146]
分别测试56℃、58℃、60℃、62℃、64℃、66℃、68℃和70℃的rt
‑
lamp扩增温度下扩增80min的扩增结果。图3所示,图中:1:阴性对照;2
‑
9分别对应:56℃、58℃、60℃、62℃、64℃、66℃、68℃和70℃。由图可知,本发明实施例提供的扩增引物组合能在56
‑
68℃条件下实现靶基因的高效扩增。
[0147]
分别测试20min、30min、40min、50min、60min、70min、80min、90min、100min的rt
‑
lamp扩增时间下扩增温度为64℃的扩增结果。图4所示,图中:1:阴性对照;2
‑
10分别对应:20min、30min、40min、50min、60min、70min、80min、90min、100min。由图可知,本发明实施例提供的扩增引物组合能在70
‑
100min条件下实现靶基因的高效扩增。
[0148]
实验例2
[0149]
胶体金免疫层析gica
‑
rt
‑
lamp检测plamv的特异性。
[0150]
为了分析胶体金免疫层析gica
‑
rt
‑
lamp检测百合plamv的特异性,以感染百合、当归、马铃薯、生菜的10个常见病毒:百合隐症病毒lsv、百合黄瓜花叶病毒cmv
‑
li、百合斑驳病毒lmov、百合南芥菜花叶病毒armv、当归日本金鱼藻花叶病毒jhmv
‑
dg、马铃薯x病毒pvx、生菜坏死黄化病毒lnyv、生菜花叶病毒lmv、生菜黄瓜花叶病毒cmv
‑
l、百合车前草花叶病毒plamv的感病叶片(田间自行采集)为样品,分别在装有pbs缓冲液的自封袋中用研棒轻轻研磨,研磨后制成检测液滴加至plamv胶体金免疫层析gica检测卡的加样窗,3
‑
5分钟后观察显色结果;随后,再用上述实施例2和3中的gica
‑
rt
‑
lamp检测体系和检测方法进行rt
‑
lamp扩增,反应程序为64℃扩增80min,扩增结束后显色。以健康百合叶片为阴性对照,每个实验组重复3次。
[0151]
plamv胶体金免疫层析gica检测卡的显色结果显示,只有感染plamv的百合叶片样品的检测t线和质控c线上均出现棕红色的条带,而包括pvx在内的其他样品的检测t线没有颜色变化,而质控c线上出现棕红色的条带。
[0152]
sybr green i荧光染料肉眼观察法结果显示,只有感染plamv的百合叶片的扩增产物出现绿色,包括同属pvx在内的其余感病叶片的扩增产物与健康百合叶片的扩增产物均为橙色(图5);这表明本发明建立的gica
‑
rt
‑
lamp方法对plamv病毒有很高的特异性,与马铃薯x病毒属的其他成员以及其他属的病毒无交叉反应。
[0153]
实验例3
[0154]
胶体金免疫层析gica
‑
rt
‑
lamp检测plamv的灵敏性
[0155]
为了分析胶体金免疫层析gica
‑
rt
‑
lamp检测plamv的灵敏性,以上述实施例2中百合plamv cp基因标准品为样品,经nanodrop nd
‑
1000核酸/蛋白分析仪测定浓度(6.9
×
104ng/ml)后,再用rna
‑
free h2o对上述标准品进行10倍比稀释,
‑
20℃保存作为模板。分别取10倍比稀释后的各稀释液1.0μl作为模板,加入上述实施例中的rt
‑
lamp反应试剂进行
rt
‑
lamp扩增,反应程序为64℃扩增80min。
[0156]
作为对比检测,将上述10倍比稀释后的各稀释液进行pcr扩增。pcr扩增条件为:94℃预变性4min;94℃变性30s,50℃退火45s,72℃延伸30s,循环扩增35次,最后72℃延伸7min。
[0157]
rt
‑
lamp反应结束后,sybr green i荧光染料肉眼观察法观察显色情况,结果显示gica
‑
rt
‑
lamp对百合plamv cp基因标准品的反应灵敏度为6.9
×
10
‑5ng/ml,即0.069pg/ml(图6);pcr反应结束后,取5μl扩增产物上样,琼脂糖凝胶电泳结果显示,gica
‑
rt
‑
pcr对百合plamv cp基因标准品的反应灵敏度为6.9
×
10
‑4ng/ml,即0.69pg/ml(图7),可见胶体金免疫层析gica
‑
rt
‑
lamp检测plamv的灵敏性是gica
‑
rt
‑
pcr的10倍。
[0158]
实验例4
[0159]
胶体金免疫层析gica
‑
rt
‑
lamp检测田间样品。
[0160]
取田间百合叶片样品,用plamv胶体金免疫层析gica检测卡富集病毒粒子,再用上述实施例中的gica
‑
rt
‑
lamp检测体系进行rt
‑
lamp扩增;
[0161]
若gica检测卡的检测t线和质控c线上均出现棕红色的条带,则判定被检样品感染了车前草花叶病毒plamv;
[0162]
若gica检测卡检测t线没有颜色变化,而质控c线上出现棕红色的条带,同时荧光染料肉眼观察法显示绿色,说明样品中含有车前草花叶病毒plamv;
[0163]
若gica检测卡检测t线没有颜色变化,而质控c线上出现棕红色的条带,同时荧光染料肉眼观察法显示橙色,说明样品中不含车前草花叶病毒plamv。
[0164]
以上仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1