一种检测肠杆菌科细菌中是否含有能够介导替加环素耐药的tet(X)基因变异体的方法
一种检测肠杆菌科细菌中是否含有能够介导替加环素耐药的tet(x)基因变异体的方法
技术领域
1.本发明属于生物技术领域,具体涉及一种检测肠杆菌科细菌中是否含有能够介导替加环素耐药的tet(x)基因变异体的方法,tet(x)基因变异体为tet(x4)耐药基因和/或tet(x6)耐药基因。
背景技术:
2.替加环素是首个被美国食品药品监督管理局(fda)批准进行临床使用的甘氨酰环素类药物,是在米诺环素基础上进行改造而获得的新一代四环素类衍生物。因替加环素具有广谱且较强的抗菌活性,在治疗碳青霉烯和黏菌素耐药菌引发的感染时起到十分重要的作用,目前已被who列为治疗临床多重耐药菌感染的重要抗菌药物。然而,随着替加环素在临床上的使用,所引发的替加环素耐药性问题逐渐严峻。尤其是近年来广泛存在于肠杆菌科细菌中的新型可转移且能够介导替加环素高水平耐药的耐药基因tet(x)的变异体tet(x4)和tet(x6)在畜禽养殖业中广泛的流行,对畜牧业的发展及公共卫生安全构成严重威胁。为了更好的防控它们的传播,应当对其流行情况进行广泛监测。进行监测时,这些基因的现场快速检测便成为十分重要的一环。然而,常规pcr和sanger测序等传统核酸检测方法耗时耗力,无法满足现场快速检测的需要。
3.近年来,重组酶介导的扩增技术(raa)因其较短的扩增时间及较高的检测灵敏度,受到研究人员的广泛关注,可与侧流层析试纸条(lfd)检测相结合进行核酸快速检测。然而,在进行耐药基因的核酸检测时通常需要进行细菌dna的提取,传统的试剂盒提取法耗时耗力(至少需要1h),且需要笨重的离心机,不便于进行现场快速操作。
技术实现要素:
4.本发明的目的是检测细菌的替加环素耐药性,从而进行防控。
5.本发明首先保护一种成套试剂,其包括raa上游引物、raa下游引物和raa探针;
6.所述raa上游引物可为seq id no:1所示的单链dna分子;
7.所述raa下游引物可为seq id no:2所示的单链dna分子;
8.所述raa探针从5’至3’依次可包括dna片段甲、四氢呋喃和dna片段乙;
9.所述dna片段甲可为seq id no:3所示的单链dna分子;
10.所述dna片段乙可为seq id no:4所示的单链dna分子;
11.所述成套试剂的用途可为a1)或a2)或a3):
12.a1)检测待测样品是否含有tet(x)变异体;所述tet(x)变异体为tet(x4)耐药基因和/或tet(x6)耐药基因;
13.a2)检测替加环素耐药性;
14.a3)防控具有替加环素耐药性的细菌。
15.所述raa探针从5’至3’具体可由所述dna片段甲、四氢呋喃和所述dna片段乙组成。
16.所述raa下游引物中,5’端可具有生物素标记。
17.所述dna片段甲的5’末端可具有荧光基团fitc修饰。
18.所述dna片段乙的3’末端可具有磷酸化修饰。
19.所述成套试剂具体可由上述任一所述raa上游引物、上述任一所述raa下游引物和上述任一所述raa探针组成。
20.上述任一所述成套试剂还包括chelex-100裂解提取液;
21.所述chelex-100裂解提取液具体可由chelex-100、tritonx-100和te缓冲液组成;chelex-100裂解提取液中,chelex-100、tritonx-100和te缓冲液的比例可为2.5g:500μl:50ml。
22.上述任一所述成套试剂具体可由上述任一所述raa上游引物、上述任一所述raa下游引物、上述任一所述raa探针和上述任一所述chelex-100裂解提取液组成。
23.本发明还保护上述任一所述成套试剂的应用,可为a1)-a6)中的至少一种:
24.a1)检测待测样品是否含有tet(x)变异体;
25.a2)检测替加环素耐药性;
26.a3)防控具有替加环素耐药性的细菌;
27.a4)制备用于检测待测样品是否含有tet(x)变异体的试剂盒;
28.a5)制备用于检测替加环素耐药性的试剂盒;
29.a6)制备用于防控具有替加环素耐药性的细菌的试剂盒;
30.所述tet(x)变异体为tet(x4)耐药基因和/或tet(x6)耐药基因;
31.所述应用用于非疾病的诊断与治疗。
32.本发明还保护含有上述任一所述成套试剂的试剂盒。
33.本发明还保护含有上述任一所述成套试剂的试剂盒的应用,可为a1)-a3)中的至少一种:
34.a1)检测待测样品是否含有tet(x)变异体;
35.a2)检测替加环素耐药性;
36.a3)防控具有替加环素耐药性的细菌;
37.所述tet(x)变异体为tet(x4)耐药基因和/或tet(x6)耐药基因;
38.所述应用用于非疾病的诊断与治疗。
39.本发明还保护一种检测待测样品是否含有或疑似含有tet(x)变异体的方法,可包括如下步骤:
40.(1)向待测样品中加入上述任一所述chelex-100裂解提取液,重悬,90-100℃(如90-95℃、95-100℃、90℃、95℃或100℃)反应5-15min(如5-10min、10-15min、5min、10min或15min),之后过滤除菌,得到待测样品的dna;
41.(2)以步骤(1)得到的待测样品的dna为模板,以上述任一所述raa上游引物、上述任一所述raa下游引物和上述任一所述raa探针进行raa,得到raa扩增产物;然后进行如下评判:如果raa扩增产物可以检测出阳性信号,则待测样品含有或疑似含有tet(x)变异体;如果raa扩增产物不能检测出阳性信号,则待测样品不含有或疑似不含有tet(x)变异体;
42.所述tet(x)变异体为tet(x4)耐药基因和/或tet(x6)耐药基因;
43.如果待测样品含有tet(x)变异体,则待测样品具有或疑似具有替加环素耐药性;
44.如果待测样品不含有tet(x)变异体,则待测样品不具有或疑似不具有替加环素耐药性;
45.所述方法用于具有替加环素耐药性的细菌的防控。
46.上述方法中,所述进行raa的参数可为41℃反应15min。
47.本发明还保护一种检测待测细菌是否具有替加环素耐药性的方法,包括如下步骤:
48.(1)向待测细菌中加入上述任一所述chelex-100裂解提取液,重悬,90-100℃(如90-95℃、95-100℃、90℃、95℃或100℃)反应5-15min(如5-10min、10-15min、5min、10min或15min),之后过滤除菌,得到待测细菌的dna;
49.(2)以步骤(1)得到的待测细菌的dna为模板,以上述任一所述raa上游引物、上述任一所述raa下游引物和上述任一所述raa探针进行raa,得到raa扩增产物;然后进行如下评判:如果raa扩增产物可以检测出阳性信号,则待测细菌具有或疑似具有替加环素耐药性;如果raa扩增产物不能检测出阳性信号,则待测细菌不具有或疑似不具有替加环素耐药性;
50.所述方法用于具有替加环素耐药性的细菌的防控。
51.上述方法中,所述进行raa的参数为41℃反应15min。
52.上述任一所述细菌可为肠杆菌科细菌。
53.上文中,raa扩增产物能否检测出阳性信号的方法可为:在酶标板的小孔内加入150μl pbs缓冲液和1.5μl标记有anti-biotin(hrp conjugate)的金纳米颗粒,使用微量移液器吹打混匀;之后加入25μl raa扩增产物,使用微量移液器吹打混匀,得到待测溶液;将侧流层析试纸条的样品垫末端垂直插入待测溶液,5min后取出侧流层析试纸条,观察检测线和质控线是否出现条带,并进行如下判断:若质控线出现条带且检测线不出现条带,则raa扩增产物不可以检测出阳性信号;若检测线和质控线均出现条带,则raa扩增产物能检测出阳性信号。
54.为达到tet(x4)耐药基因和/或tet(x6)耐药基因快速现场检测的目的,本发明的发明人经过大量实验,基于chelex-100裂解法建立了无需使用离心机的细菌dna提取法,进一步将该细菌dna提取方法、raa和侧流层析试纸条结合构建了tet(x4)耐药基因和/或tet(x6)耐药基因的快速可视化检测方法。该检测方法具有快速、灵敏度高、特异性强和能够进行现场检测的技术优点,适用于临床及畜禽养殖业替加环素tet(x4)耐药基因和/或tet(x6)耐药基因流行情况的监测。本发明具有重要的应用价值。
附图说明
55.图1为实施例2中引物对的筛选结果
56.图2为实施例2中步骤四快速检测待测样品是否含有tet(x4)耐药基因的方法的优化结果。其中,a为反应时间的优化结果,b为反应温度的优化结果。
57.图3为实施例3的特异性检测结果。
58.图4为实施例4的tet(x4)耐药基因阳性对照溶液1—tet(x4)耐药基因阳性对照溶液10的检测结果。
59.图5为实施例4的tet(x6)耐药基因阳性对照溶液a—tet(x6)耐药基因阳性对照溶
液j的检测结果。
具体实施方式
60.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
61.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
62.raa反应试剂盒为杭州众测生物科技有限公司的产品。raa反应单元管、raa扩增反应缓冲液和醋酸镁溶液均为raa反应试剂盒中的组件。
63.实施例1、基于chelex-100裂解法无需使用离心机的细菌dna提取方法的建立
64.一、无需使用离心机的细菌dna提取方法的建立
65.本发明的发明人经过大量实验,基于chelex-100裂解法,建立了一种无需使用离心机的细菌dna提取方法。具体步骤如下:
66.1、使用蓝色接种环将固体培养基上的细菌单克隆菌落刮取至离心管中。
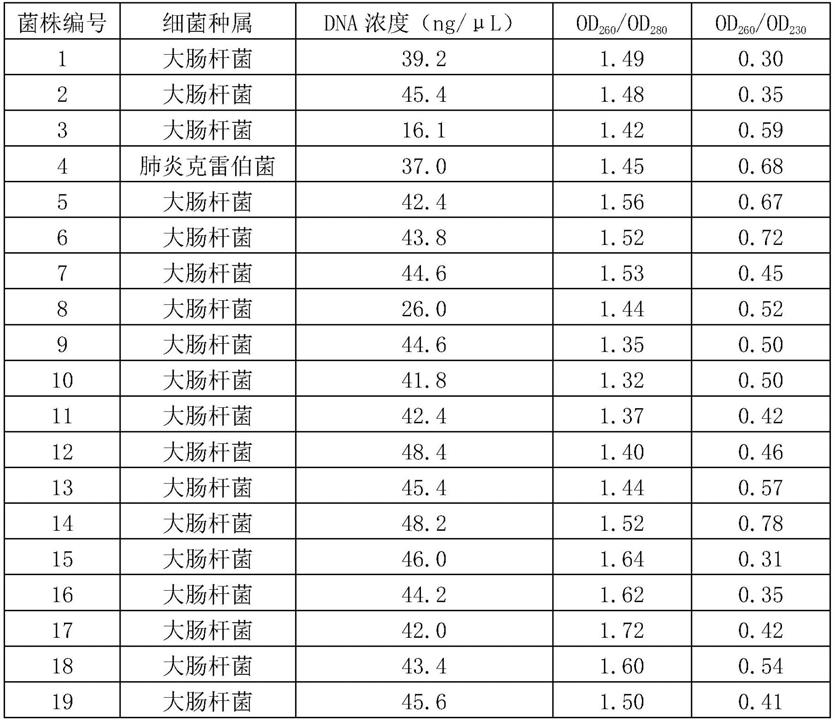
67.2、完成步骤1后,取所述离心管,用微量移液器加入200μl chelex-100裂解提取液,涡旋30s,充分重悬。
68.chelex-100裂解提取液:向50ml te缓冲液中加入2.5g chelex-100和500μl tritonx-100,涡旋混匀,得到chelex-100裂解提取液。
69.3、完成步骤2后,取所述离心管,置于100℃反应10min。
70.4、完成步骤3后,使用1ml注射器抽取离心管内的液体,之后将注射器针头拔掉,插入孔径为0.45μm的过滤膜,缓慢推动注射器活塞将液体过滤至新的离心管中,得到细菌dna。
71.5、完成步骤4后,用nanodrop测定细菌dna的od
260
/od
280
和od
260
/od
230
。
72.6、完成步骤4后,用qubit测定细菌dna浓度。
73.二、采用步骤一建立的方法提取细菌dna
74.采用步骤一建立的方法分别提取95株细菌的dna。
75.95株细菌的种属、dna浓度、od
260
/od
280
和od
260
/od
230
的统计结果见表1。结果表明,使用步骤一建立的方法均能成功提取细菌dna。
76.表1
77.78.[0079][0080]
实施例2、快速检测肠杆菌科细菌中是否含有能够介导替加环素高水平耐药的tet(x4)耐药基因和/或tet(x6)耐药基因的方法
[0081]
本发明的发明人经过大量实验,将实施例1建立的细菌dna提取方法、raa和侧流层析试纸条结合起来,建立了快速检测肠杆菌科细菌中是否含有能够介导替加环素高水平耐药的tet(x4)耐药基因和/或tet(x6)耐药基因的方法。具体步骤如下:
[0082]
一、金纳米颗粒-侧流层析试纸条的构建
[0083]
1、金纳米颗粒的制备
[0084]
采用“柠檬酸三钠还原氯金酸”法制备,制备方法如下:
[0085]
(1)将量筒、磁力搅拌子及圆底烧瓶在酸缸中进行过夜浸泡,然后依次使用清水、蒸馏水清洗三遍,最后使用去离子水清洗三遍。
[0086]
(2)完成步骤(1)后,在清洗干净的圆底烧瓶中加入186ml的去离子水,加入质量浓度为1%的氯金酸溶液2ml,使用磁力搅拌机加热煮沸。
[0087]
(3)完成步骤(2)后,待溶液沸腾后,加入12ml的柠檬酸三钠溶液,继续加热煮沸,当溶液变为酒红色时,再加热10min。
[0088]
(4)完成步骤(3)后,使用冷水将溶液温度快速下降至室温,将烧瓶内的溶液转移至50ml离心管,得到金纳米颗粒,4℃储存备用。
[0089]
2、标记有anti-biotin(hrp conjugate)的金纳米颗粒的制备
[0090]
(1)吸取1ml制备好的金纳米颗粒至1.5ml离心管中,使用0.02m的k2co3溶液调节ph至8.2-8.5。
[0091]
(2)完成步骤(1)后,加入30μl anti-biotin(hrp conjugate)(cell signaling technology,货号:5571s),涡旋混匀。
[0092]
(3)完成步骤(2)后,静置1h后加入200μl 10%bsa溶液,涡旋混匀后静置1h。
[0093]
(4)完成步骤(3)后,4℃、11000rpm离心10min,弃掉上清。
[0094]
(5)完成步骤(4)后,加入100μl浓缩样本稀释液(北京维德维康生物技术有限公司,货号:b-kitw.006.03.01)重悬沉淀,得到标记有anti-biotin(hrp conjugate)的金纳米颗粒,并置于4℃保存。
[0095]
3、侧流层析试纸条的组装与裁剪
[0096]
(1)利用试纸条划线仪(上海金标生物科技有限公司,货号:hm3035)以1μl/cm的速度在硝酸纤维素膜的检测线和质控线位置分别划fitc的抗体(proteintech,货号为80003-1-rr)和羊抗兔igg抗体(jackson immunoresearch,货号为111-005-003),自然晾干。
[0097]
(2)完成步骤(1)后,按照样品垫、硝酸纤维素膜、吸水垫的顺序在pvc背板上进行组装,每部分之间流出2mm的重叠宽度使溶液能够在试纸条上顺畅层析。
[0098]
样品垫、硝酸纤维素膜、吸水垫、pvc背板均购自上海金标生物科技有限公司。
[0099]
(3)完成步骤(2)后,使用可编程切条机(上海金标生物科技有限公司,货号:zq4000)将组装后的侧流层析试纸条切割成3mm宽度的成品。
[0100]
二、能介导替加环素高水平耐药的tet(x)变异体阳性对照菌的构建
[0101]
1、以tet(x4)耐药基因(genebank号为:ng_065852.1)为模板,采用tet(x)通用引物:tet(x)-f:5
′‑
ccgttggactgactatggc-3
′
(seq id no:11)和tet(x)-r:5
′‑
tcaacttgcgtgtcggtaa-3
′
(seq id no:12)组成的引物对进行pcr扩增,得到pcr扩增产物。
[0102]
2、完成步骤1后,取所述pcr扩增产物,用凝胶回收试剂盒进行纯化,得到纯化后的序列。
[0103]
3、完成步骤2后,将纯化后的序列和质粒pacyc184(长沙艾碧维生物科技有限公司,产品目录号为hg-vkn0287)进行连接,得到重组质粒pacyc184-tet(x4)。
[0104]
4、将重组质粒pacyc184-tet(x4)转化大肠杆菌dh5α,得到重组大肠杆菌。
[0105]
5、分别将重组大肠杆菌单克隆接种至1ml lb液体培养基,37℃培养过夜,得到相应的菌液。
[0106]
6、分别以步骤5得到的菌液为模板,使用tet(x)-f和tet(x)-r组成的引物对进行pcr扩增,得到pcr扩增产物;之后将pcr扩增产物进行测序。如果某单克隆的pcr扩增产物的测序结果如seq id no:13所示,则该单克隆鉴定为阳性克隆甲。
[0107]
seq id no:13为
[0108]
ccgttggactgactatggcaaaattattacagcaaaacggcatagacgtttcagtttacgaaagagacaacgaccgagaggcaagaatttttggtggaacccttgacctacacaaaggttcaggtcaggaagcaatgaaaaaagcgggattgttacaaacttattatgacttagccttaccaatgggtgtaaatattgctgatgaaaaaggcaatattttatccacaaaaaatgtaaagcccgaaaatcgatttgacaatcctgaaataaacagaaatgacttaagggctatcttgttgaatagtttagaaaacgacacggttatttgggatagaaaacttgttatgcttgaacctggtaagaagaagtggacactaacttttgagaataaaccgagtgaaacagcagatctggttattattgccaatggtggaatgtctaaagtaagaaaatttgttaccgacacggaagttga
[0109]
按照上述步骤,将tet(x4)耐药基因替换为tet(x6)耐药基因(genebank号为:bk011183.1),其它步骤均不变,得到阳性克隆乙。
[0110]
三、检测能介导替加环素高水平耐药的tet(x)变异体(tet(x4)耐药基因和/或tet(x6)耐药基因)的成套试剂的制备
[0111]
1、raa引物和探针的合成
[0112]
以tet(x4)耐药基因和tet(x6)耐药基因作为靶基因。根据tet(x4)耐药基因及tet(x6)耐药基因的保守区核苷酸序列设计并合成基于raa技术的引物和探针。具体合成了两组。
[0113]
第一组由raa上游引物1、raa下游引物1和raa探针1组成,核苷酸序列如下:
[0114]
raa上游引物1:5
’‑
ccgacaatatcaaggcatccatcaacccgc-3’(seq id no:1)。
[0115]
raa下游引物1:5
’‑
biotin-ctacaaagaactgattcgtgtgacatcatc-3’(seq id no:2)。
[0116]
raa探针1:5
’‑
fitc-gaggcatcaaatgagcagcatctccaatca(seq id no:3)
[0117]
(thf)cgttatgggtaatggacgc(seq id no:4)(c3 spacer)-3’(seq id no:4)。
[0118]
第二组由raa上游引物2、raa下游引物2和raa探针2组成,核苷酸序列如下:
[0119]
raa上游引物2:5
’‑
ctggatgatgaatatcggcttgtatattga-3’(seq id no:5)。
[0120]
raa下游引物2:5
’‑
gcttgaacctggtaagaagaagtggacact-3’(seq id no:6)。
[0121]
raa探针2:5
’‑
fitc-acattccaccattggcaataataaccagat(seq id no:7)
[0122]
(thf)tgctgtttcactcggttta(c3 spacer)-3’(seq id no:8)。
[0123]
上述raa下游引物1和raa下游引物2中,5’端为生物素(biotin)标记。
[0124]
上述raa探针1和raa探针2中,5’端为荧光基团fitc修饰;thf为四氢呋喃残基,是核酸内切酶nfo的识别位点;3’端为磷酸化修饰(c3-spacer),用来阻断dna链的延伸。
[0125]
在tet(x)变异体(tet(x4)耐药基因和/或tet(x6)耐药基因)上,采用raa上游引物
1和raa下游引物1进行扩增,获得的扩增产物1。扩增产物1的核苷酸序列如seq id no:9所示;采用raa上游引物2和raa下游引物2进行扩增,获得的扩增产物2。扩增产物2的核苷酸序列如seq id no:10所示。
[0126]
ccgacaatatcaaggcatccatcaacccgctgtttacgccttgtcctgcaaaaggaggcatcaaatgagcagcatctccaatcatcgttatgggtaatggacgcttacttttccaagacttacctaagggaaatattcgtgtcgctaaccctacaaaagatgatgtcacacgaatcagttctttgtag(seq id no:9)ctggatgatgaatatcggcttgtatattgaaagtacctgtttcttcaacttccgtgtcggtaacaattttcttactttagacattccaccattggcaataataaccagatctgctgtttcactcggtttattctcaaaagttagtgtccacttcttcttaccaggttcaagc(seq id no:10)
[0127]
2、raa引物和探针的筛选
[0128]
(1)制备raa扩增体系1:向raa反应单元管中加入12.5μl raa扩增反应缓冲液(目的为使管内的冻干酶组分溶解),之后在raa反应单元管内一次加入25.4μl无核酸酶水、2μl raa上游引物1水溶液(浓度为250nm)、2μl raa下游引物1水溶液(浓度为250nm)、0.6μlraa探针1(浓度为125nm)和5μl无核酸酶水,在反应单元管的管盖上加入2.5μl醋酸镁溶液(浓度为280mm),盖上反应单元管盖,上下颠倒混匀。之后39℃反应15min(进行raa扩增),得到raa扩增产物1。
[0129]
按照上述步骤,将raa上游引物1替换为raa上游引物2,raa下游引物1替换为raa下游引物2,raa探针1替换为raa探针2,其它步骤均不变,得到raa扩增产物2。
[0130]
(2)完成步骤(1)后,在酶标板的小孔内加入150μl pbs缓冲液和1.5μl标记有anti-biotin(hrp conjugate)的金纳米颗粒,使用微量移液器吹打混匀;之后加入25μl raa扩增产物(raa扩增产物1或raa扩增产物2),使用微量移液器吹打混匀,得到待测溶液;将侧流层析试纸条的样品垫末端垂直插入待测溶液,5min后取出侧流层析试纸条,观察检测线和质控线是否出现条带,并进行如下判断:若质控线出现条带且检测线不出现条带,则raa引物和探针可用于检测tet(x)变异体;若检测线和质控线均出现条带,则raa引物和探针不可用于检测tet(x)变异体。
[0131]
检测结果见图1(从左至右依次命名为1、2、3和4,1和2为第一组的结果,3和4为第二组的结果)。结果表明,由raa上游引物1、raa下游引物1和raa探针1组成的第一组可用于检测tet(x)变异体,即tet(x4)耐药基因和/或tet(x6)耐药基因。
[0132]
3、检测能介导替加环素高水平耐药的tet(x)变异体的成套试剂的制备
[0133]
检测能介导替加环素高水平耐药的tet(x)变异体的成套试剂由raa上游引物1、raa下游引物1和raa探针1组成。引物和探针分别独立包装。
[0134]
四、快速检测待测样品是否含有能介导替加环素高水平耐药的tet(x)变异体的方法的优化
[0135]
1、采用实施例1建立的方法提取构建的阳性克隆甲或阳性克隆乙的细菌dna,得到阳性对照扩增模板。
[0136]
2、制备raa扩增体系。具体步骤如下:向raa反应单元管中加入12.5μl raa扩增反应缓冲液(目的为使管内的冻干酶组分溶解),之后在raa反应单元管内一次加入25.4μl无核酸酶水、2μl raa上游引物1水溶液(浓度为250nm)、2μl raa下游引物1水溶液(浓度为250nm)、0.6μl raa探针1(浓度为125nm)和5μl阳性对照扩增模板,在反应单元管的管盖上
加入2.5μl醋酸镁溶液(浓度为280mm),盖上反应单元管盖,上下颠倒混匀。
[0137]
3、raa反应时间的优化
[0138]
(1)取步骤2制备的raa扩增体系,39℃反应10、15、20、25或30min(进行raa扩增),得到raa扩增产物。
[0139]
(2)完成步骤(1)后,在酶标板的小孔内加入150μl pbs缓冲液和1.5μl标记有anti-biotin(hrp conjugate)的金纳米颗粒,使用微量移液器吹打混匀;之后加入25μl raa扩增产物,使用微量移液器吹打混匀,得到待测溶液;将侧流层析试纸条的样品垫末端垂直插入待测溶液,5min后取出侧流层析试纸条,利用试纸条比色信号检测仪(qiagen,esequantlr3)检测侧流层析试纸条检测线的信号。
[0140]
检测结果见图2中a。结果表明,反应时间为15min时,侧流层析试纸条检测线信号强度最强。因此,进行raa反应的最佳时间为15min。
[0141]
4、raa反应温度的优化
[0142]
(1)取步骤2制备的raa扩增体系,35、37、39、41或43℃反应15min(进行raa扩增),得到raa扩增产物。
[0143]
(2)完成步骤(1)后,在酶标板的小孔内加入150μl pbs缓冲液和1.5μl标记有anti-biotin(hrp conjugate)的金纳米颗粒,使用微量移液器吹打混匀;之后加入25μl raa扩增产物,使用微量移液器吹打混匀,得到待测溶液;将侧流层析试纸条的样品垫末端垂直插入待测溶液,5min后取出侧流层析试纸条,利用试纸条比色信号检测仪检测侧流层析试纸条检测线的信号。
[0144]
检测结果见图2中b。结果表明,反应温度为41℃时,侧流层析试纸条检测线信号强度最强。因此,进行raa反应的最佳温度为41℃。
[0145]
最终,优化得到的raa扩增反应条件为:反应温度41℃,反应时间15min。
[0146]
由于tet(x4)耐药基因和tet(x6)耐药基因检测时使用的是同一套成套试剂,因而检测的最优条件相同。
[0147]
五、快速检测待测样品(待测细菌)是否含有tet(x)变异体的方法的建立
[0148]
本发明的发明人经过大量实验,建立了快速检测待测样品(待测细菌)是否含有tet(x)变异体的方法。具体步骤如下:
[0149]
1、取待测细菌,采用实施例1建立的方法提取待测细菌的dna。
[0150]
2、制备raa扩增体系。具体步骤如下:向raa反应单元管中加入12.5μl raa扩增反应缓冲液,之后在raa反应单元管内一次加入25.4μl无核酸酶水、2μl raa上游引物1水溶液(浓度为250nm)、2μl raa下游引物1水溶液(浓度为250nm)、0.6μl raa探针1(浓度为125nm)和5μl待测细菌的dna在反应单元管的管盖上加入2.5μl醋酸镁溶液(280mm),盖上反应单元管盖,上下颠倒混匀。
[0151]
3、取步骤2制备的raa扩增体系,41℃反应15min,得到raa扩增产物。
[0152]
4、完成步骤3后,在酶标板的小孔内加入150μl pbs缓冲液和1.5μl标记有anti-biotin(hrp conjugate)的金纳米颗粒,使用微量移液器吹打混匀;之后加入25μl raa扩增产物,使用微量移液器吹打混匀,得到待测溶液;将侧流层析试纸条的样品垫末端垂直插入待测溶液,5min后取出侧流层析试纸条,观察检测线和质控线是否出现条带并进行如下判断:
[0153]
如果质控线与检测线均出现条带,则说明待测溶液中存在tet(x)变异体,即待测细菌中存在tet(x)变异体;
[0154]
如果质控线出现条带且检测线不出现条带,则说明待测溶液中不存在tet(x)变异体,即待测细菌中不存在tet(x)变异体;
[0155]
如果质控线不出现条带,则说明侧流层析试纸条失效,需更换侧流层析试纸条进行重新检测。
[0156]
实施例3、实施例2建立的方法的特异性检测
[0157]
采用实施例2中步骤五建立的方法分别检测待测细菌1—待测细菌7是否含有tet(x)变异体。
[0158]
待测细菌1—待测细菌7的细菌种属和含有的耐药基因见表2,待测细菌3-待测细菌7均不含有tet(x)变异体。
[0159]
待测细菌1为实施例2步骤二中构建的阳性克隆甲。
[0160]
待测细菌2为实施例2步骤二中构建的阳性克隆乙。
[0161]
待测细菌3记载于如下文献中:a multiplex sybr green real-time pcr assay for the detection of threecolistin resistance genes from cultured bacteria,feces,and environment samples.在文献中的菌株编号为:dh5a-mcr-1。
[0162]
待测细菌4记载于如下文献中:emerging carriage of ndm-5and mcr-1in escherichia coli from healthy people in multiple regions in china:a cross sectional observational study.在文献中的菌株编号为:e1189。
[0163]
待测细菌5记载于如下文献中:prevalence and mechanisms of fosfomycin resistance among kpc-producing klebsiella pneumoniae clinical isolates in china.在文献中的菌株编号为:kp1。
[0164]
表2
[0165]
菌株编号细菌种属耐药基因1大肠杆菌tet(x4)2大肠杆菌tet(x6)3大肠杆菌mcr-14大肠杆菌bla
ndm
5肺炎克雷伯菌bla
kpc
6大肠杆菌atcc25922-7肺炎克雷伯菌atcc13883-[0166]
注:
“‑”
表示不含有耐药基因。
[0167]
检测结果见图3(从左至右依次为待测细菌1—待测细菌7)。结果表明,只有当待测细菌含有能介导肠杆菌科细菌对替加环素耐药的tet(x)变异体(tet(x4)耐药基因或tet(x6)耐药基因)的时候,侧流层析试纸条的质控线(c)与检测线(t)才均出现条带;其余不含有tet(x4)耐药基因或tet(x6)耐药基因的待测细菌在质控线出现条带且检测线不出现条带。由此可见,实施例2中步骤五建立的方法对能介导肠杆菌科细菌对替加环素耐药的tet(x)变异体的检测具有良好的特异性。
[0168]
实施例4、实施例2建立的方法的灵敏度检测
[0169]
1、采用实施例1建立的方法提取步骤二中阳性克隆甲的dna,得到拷贝数为7.63
×
109copies/μl的tet(x4)耐药基因阳性对照溶液1。采用实施例1建立的方法提取步骤二中阳性克隆乙的dna,得到拷贝数为6.43
×
109copies/μl的tet(x6)耐药基因阳性对照溶液a。
[0170]
2、取tet(x4)耐药基因阳性对照溶液1,用无菌水进行10倍系列稀释,得到拷贝数为7.63
×
108copies/μl的tet(x4)耐药基因阳性对照溶液2、拷贝数为7.63
×
107copies/μl的tet(x4)耐药基因阳性对照溶液3、拷贝数为7.63
×
106copies/μl的tet(x4)耐药基因阳性对照溶液4、拷贝数为7.63
×
105copies/μl的tet(x4)耐药基因阳性对照溶液5、拷贝数为7.63
×
104copies/μl的tet(x4)耐药基因阳性对照溶液6、拷贝数为7.63
×
103copies/μl的tet(x4)耐药基因阳性对照溶液7、拷贝数为763copies/μl的tet(x4)耐药基因阳性对照溶液8、拷贝数为76.3copies/μl的tet(x4)耐药基因阳性对照溶液9和拷贝数为7.63copies/μl的tet(x4)耐药基因阳性对照质粒溶液10。取tet(x6)耐药基因阳性对照溶液a,用无菌水进行10倍系列稀释,得到拷贝数为6.43
×
108copies/μl的tet(x6)耐药基因阳性对照溶液b、拷贝数为6.43
×
107copies/μl的tet(x6)耐药基因阳性对照溶液c、拷贝数为6.43
×
106copies/μl的tet(x6)耐药基因阳性对照溶液d、拷贝数为6.43
×
105copies/μl的tet(x6)耐药基因阳性对照溶液e、拷贝数为6.43
×
104copies/μl的tet(x6)耐药基因阳性对照溶液f、拷贝数为6.43
×
103copies/μl的tet(x6)耐药基因阳性对照溶液g、拷贝数为643copies/μl的tet(x6)耐药基因阳性对照溶液h、拷贝数为64.3copies/μl的tet(x6)耐药基因阳性对照溶液i和拷贝数为6.43copies/μl的tet(x6)耐药基因阳性对照溶液j。
[0171]
3、采用实施例2中步骤五建立的方法分别检测tet(x4)耐药基因阳性对照溶液1—tet(x4)耐药基因阳性对照质粒10是否含有tet(x)变异体(以去离子水作为阴性对照);检测tet(x6)耐药基因阳性对照溶液a—tet(x6)耐药基因阳性对照溶液j是否含有tet(x)变异体(以去离子水作为阴性对照)
[0172]
灵敏度检测结果见图4(1-10依次为tet(x4)耐药基因阳性对照溶液1—tet(x4)耐药基因阳性对照溶液10,11为阴性对照)和图5(从左至右依次为tet(x6)耐药基因阳性对照溶液a—tet(x6)耐药基因阳性对照溶液j和阴性对照)。结果表明,实施例2中步骤五建立的方法检测tet(x4)耐药基因的灵敏度为7.63copies/μl,能够满足检测较低拷贝数的tet(x4)耐药基因的要求;检测tet(x6)耐药基因的灵敏度为6.43copies/μl,能够满足检测较低拷贝数的tet(x6)耐药基因的要求。
[0173]
实施例5、实施例2建立的方法的实际应用
[0174]
待测细菌为95株临床分离的细菌,经常规pcr法检测,这95株细菌中22株存在tet(x4)耐药基因,3株存在tet(x6)耐药基因,70株不存在tet(x)变异体(tet(x4)耐药基因和/或tet(x6)耐药基因)。
[0175]
1、采用实施例2中步骤五建立的方法分别检测95株细菌是否含有tet(x)变异体。
[0176]
检测结果见表3。
[0177]
表3
[0178][0179]
2、按照如下公式计算实施例2中步骤五建立的方法的敏感性与特异性。
[0180]
敏感性=(真阳性数)/(真阳性数+假阴性数)。
[0181]
特异性=(真阴性数)/(真阴性数+假阳性数)。
[0182]
结果表明,实施例2中步骤五建立的方法的敏感性为92%(23/(23+2)),特异性为100%(70/70)。由此可见,实施例2中步骤五建立的方法能够用于能介导肠杆菌科细菌对替加环素高水平耐药的tet(x)变异体的临床检测。
[0183]
上述结果表明,实施例1建立的基于chelex-100裂解法无需使用离心机的细菌dna提取方法操作简便,能够在20min内实现细菌dna的提取,并且提取获得的dna能够用于后续的核酸扩增检测。实施例2中步骤五建立的快速检测待测样品是否含有能介导肠杆菌科细菌对替加环素高水平耐药的tet(x)变异体的方法特异性强、灵敏度高且准确率高,能够在现场实现对能介导肠杆菌科细菌对替加环素高水平耐药的tet(x)变异体的变异体的快速可视化检测,极具应用前景。
[0184]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1