光固化引发剂酰基膦氧化合物的制备方法与流程
1.本发明涉及光引发剂材料技术领域,尤其涉及一种酰基膦氧化合物的制备方法。
背景技术:
2.光刻胶(photoresist)又称光致抗蚀剂,是一种对光敏感的混合液体。其组成包括:光引发剂、光刻胶树脂、单体、溶剂和其他助剂。光刻胶可以通过光化学反应,经曝光、显影等光刻工序将所需要的图形从光罩(掩模版)转移到待加工基片上。
3.光引发剂是光聚合体系中最重要组成部分,光引发剂的研究一直是光聚合反应的热点。在众多类型的引发剂中,酰基膦氧化合物是具有很好的光化学反应活性的高效光敏引发剂,它在一定波长的辐射下可以高效地生成自由基,光分解速度快,光固化速度快,有漂白的作用,有利于厚涂层固化。酰基氧化膦类光引发剂因其独特的光学特点,是工业中适用范围较广的光引发剂品类。
4.然而,目前的酰基氧化膦类光引发剂的制备方法一般是两步法,从醛类化合物和二芳基氧磷,在碱性条件下,相继进行亲核加成、分子内氧化消除反应,制备相应的酰基氧磷化合物。此路线尽管存在一定的优势,比如条件温和,官能团适应范围广等,但是,由于反应分两步进行,中间需要经过一步纯化,操作比较繁琐。特别是,该方法第二步通常需要在活化二氧化锰的作用下发生分子内氧化消除反应,脱除一分子水,才能得到相应的产物,普通的二氧化锰对于这一步效果不明显,甚至检测不到产物的生成,反应条件较为苛刻。
技术实现要素:
5.因此,本发明的目的是提供一种酰基膦氧化合物的制备方法,旨在解决酰基氧化膦类光引发剂通常是在强酸或强碱的条件下制备,并且制备工艺较为复杂的问题。本发明提供的方法采用一步法合成酰基氧磷衍生物。
6.具体地,本发明提供了一种式i所示的酰基膦氧化合物的制备方法,所述制备方法包括:
7.(1)向式ii所示的芳基甲醛衍生物与二芳基磷氧的混合物中加入cu(oac)2、过氧二叔丁基醚(dtbp)和溶剂,密封后在70~90℃下搅拌反应6~24小时得到反应液;
8.(2)将反应液除去溶剂后,用二氯甲烷和水的混合溶剂进行萃取分离,收集下层有机相除去溶剂得到粗产品,将粗产品纯化即得到式i所示的酰基膦氧化合物。
9.10.其中,
11.ar表示芳基,所述芳基包括:苯基;被c
1-3
烷基、c
1-3
烷氧基、卤素和3-6元环烷基中的一种或多种取代的苯基;萘基;以及被c
1-3
烷基、c
1-3
烷氧基、卤素和3-6元环烷基中的一种或多种取代的萘基中的一种或多种;
12.x为c或n;
13.r选自c
1-3
烷基、c
1-3
烷氧基、卤素、3-6元环烷基、3-6元杂环烷基、c
1-3
烷基氨基、苯基氨基和二苯基氨基中的一种或多种,或者r与母环一起形成具有2-4个苯环的稠环,
14.n为0、1、2或3;当n为2或3时,r为相同或不同的基团。
15.根据本发明提供的制备方法,其中,芳基甲醛衍生物与二芳基磷氧的摩尔比可以为1:0.5~2,最优选的比例为1:1.5。优选地,相对于每摩尔芳基甲醛衍生物,cu(oac)2的加入量为0.05~2摩尔;dtbp的加入量为1.5~2.5摩尔。
16.根据本发明提供的制备方法,其中,所述溶剂优选为1,2-二氯乙烷。其他类似的溶剂,比如乙腈,氯仿,均可让反应发生,但效率不高。优选地,相对于每摩尔芳基甲醛衍生物,所述溶剂的加入量为5000~15000毫升。
17.其中,步骤(1)的反应时间可以为6~24小时,优选为8~12小时。
18.根据本发明提供的制备方法,其中,所述二芳基磷氧中的芳基包括:苯基;被c
1-3
烷基、c
1-3
烷氧基、卤素和3-6元环烷基中的一种或多种取代的苯基;萘基;以及被c
1-3
烷基、c
1-3
烷氧基、卤素和3-6元环烷基中的一种或多种取代的萘基中的一种或多种。
19.在本发明优选的反应条件下产物收率相对较高,且反应时长合适。
20.根据本发明提供的制备方法,在步骤(2)所述二氯甲烷和水的混合溶剂中,二氯甲烷与水的体积比可以优选为1:0.5~2。
21.根据本发明提供的制备方法,所述制备方法还可以包括将制得的粗品酰基膦氧化合物通过二氯甲烷和水的溶剂体系进行萃取分离,然后通过硅胶柱层析分离纯化。
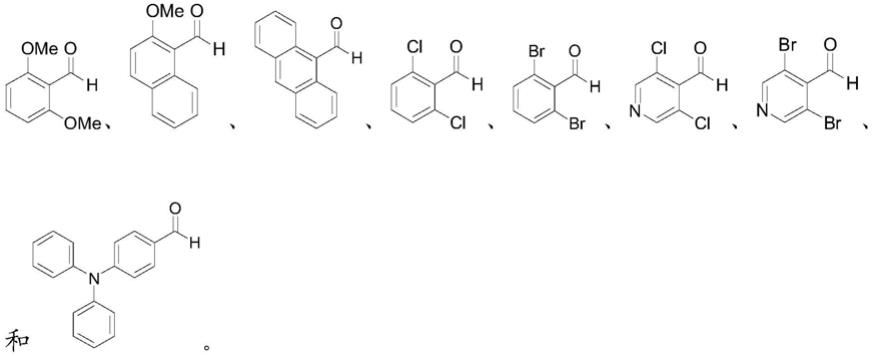
22.在本发明的一些优选的实施方案中,所述芳基甲醛衍生物选自以下结构中的任一种:
[0023][0024]
以上述芳基甲醛衍生物为原料的产率更高。
[0025]
在本发明的最优选实施方案中,所述芳基甲醛衍生物选自以下结构中的任一种:
nmr谱图和
31
p nmr谱图;
[0042]
图11a~图11c为本发明实施例11制得的酰基膦氧化合物i-11的1h nmr谱图、
13
c nmr谱图和
31
p nmr谱图;
[0043]
图12a~图12b为本发明实施例12制得的酰基膦氧化合物i-12的1h nmr谱图和
13
c nmr谱图;
[0044]
图13为本发明实施例12制得的酰基膦氧化合物i-12的
31
p nmr谱图。
具体实施方式
[0045]
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
[0046]
实施例中的酰基膦氧化合物i-1~i-12和芳基甲醛衍生物ii-1~ii-12的结构式如表1所示。
[0047]
表1
[0048]
[0049]
[0050][0051]
实施例1
[0052]
酰基膦氧化合物i-1的制备:
[0053]
(1)将0.1摩尔式ii-1的芳基甲醛衍生物与0.15摩尔二苯基磷氧混合,向混合物中依次加入0.01摩尔的cu(oac)2和0.2摩尔的过氧叔丁基醚(dtbp),再将1000ml的1,2-二氯乙烷加入到体系中去,在80℃下反应12小时;
[0054]
(2)待反应停止后,先蒸除大部分1,2-二氯乙烷并回收,剩余油状混合物采用二氯甲烷和水的体系对产物进行萃取,取下层有机相合并浓缩后,进行硅胶柱层析分离,得到产物i-1,淡黄色液体,产率:90%,相应谱图参见图1a、图1b和图1c,其结构表征数据如下:
[0055]1h nmr(400mhz,cdcl3)δ=8.37
–
7.73(m,4h),7.69
–
7.36(m,6h),6.80(s,2h),2.24(s,3h),2.02(s,6h)(ppm).
13
c nmr(101mhz,cdcl3)δ=220.0(j
c-p
=72.6hz),140.6,136.2(j
c-p
=39.9hz),134.9,132.4(j
c-p
=2.8hz),131.9(j
c-p
=8.8hz),129.6(j
c-p
=93.4hz),128.9,128.8(j
c-p
=11.7hz),21.2,19.7(ppm).
31
p nmr(162mhz,cdcl3)δ=13.21(ppm).uv-vis:λ
max
=394nm(乙腈中).ir:ν=2924,2337,1669(c=o),1437,1202(p=o),1112,697cm-1
.ms(ei):m/z(%)=201.0(c
12h10
op
+
,20),147.1(c
10h11o+
,100),119.1(c9h
11+
,22),77.0(c6h
5+
,14).hrms(esi)(m/z)[c
22h21
o2p+na]
+
,计算值:371.1171,实验值:371.1170。
[0056]
实施例2
[0057]
酰基膦氧化合物i-2的制备:
[0058]
(1)将0.1摩尔式ii-2的芳基甲醛衍生物与0.15摩尔二苯基磷氧混合,向混合物中依次加入0.01摩尔的cu(oac)2和0.2摩尔的过氧叔丁基醚(dtbp),再将1000ml的1,2-二氯乙烷加入到体系中去,在80℃下反应12小时;
[0059]
(2)待反应停止后,先蒸除大部分1,2-二氯乙烷并回收,剩余油状混合物采用二氯甲烷和水的体系对产物进行萃取,取下层有机相合并浓缩后,进行硅胶柱层析分离,得到产物i-2,淡黄色固体,产率:92%,熔点:95~97℃,相应谱图参见图2a、图2b和图2c,其结构表征数据如下:
[0060]1h nmr(400mhz,cdcl3)δ=7.99
–
7.75(m,4h),7.60
–
7.33(m,6h),6.06(s,2h),3.79(s,3h),3.60(s,6h)(ppm).
13
c nmr(101mhz,cdcl3)δ=207.6(j
c-p
=87.3hz),165.4,160.9,131.9(j
c-p
=96.0hz),131.7(j
c-p
=9.0hz),131.6(j
c-p
=2.6hz),128.3(j
c-p
=11.8hz),110.5(j
c-p
=44.1hz),91.1,55.9,55.6(ppm).
31
p nmr(162mhz,cdcl3)δ=17.29(ppm).uv-vis:λ
max
=316nm(乙腈中).ir:ν=2997,2941,2360,1653(c=o),1599,1436,1208(p=o),1127,694cm-1
.ms(ei):m/z(%)=201.1(c
12h10
op
+
,6),195.1(c
10h11o4+
,100),180.1(c9h8o
42+
,5),137.1(c7h5o
33+
,6),77.0(c6h
5+
,8).hrms(esi)(m/z)[c
22h21
o5p+na]
+
计算值:419.1019,实验值:419.1016。
[0061]
实施例3
[0062]
酰基膦氧化合物i-3的制备:
[0063]
(1)将0.1摩尔式ii-3的芳基甲醛衍生物与0.15摩尔二苯基磷氧混合,向混合物中依次加入0.01摩尔的cu(oac)2和0.2摩尔的过氧叔丁基醚(dtbp),再将1000ml的1,2-二氯乙烷加入到体系中去,在80℃下反应12小时;
[0064]
(2)待反应停止后,先蒸除大部分1,2-二氯乙烷并回收,剩余油状混合物采用二氯甲烷和水的体系对产物进行萃取,取下层有机相合并浓缩后,进行硅胶柱层析分离,得到产物i-3,白色固体,产率:90%,熔点:103~105℃,相应谱图参见图3a、图3b和图3c,其结构表征数据如下:
[0065]1h nmr(400mhz,cdcl3)δ=8.17
–
7.79(m,4h),7.74
–
7.38(m,6h),7.19(t,1h),6.98(d,2h),2.04(s,6h)(ppm).
13
c nmr(101mhz,cdcl3)δ=220.1(j
c-p
=72.3hz),139.0(j
c-p
=39.4hz),134.8,132.5(j
c-p
=2.8hz),131.9(j
c-p
=8.8hz),130.4,129.5(j
c-p
=93.6hz),128.8(j
c-p
=11.8hz),128.1,19.7(ppm).
31
p nmr(162mhz,cdcl3)δ=13.28(ppm).uv-vis:λ
max
=394nm(乙腈中).ir:ν=2924.0,1669(c=o),1437,1205(p=o),1111,731,692cm-1
.ms(ei):m/z(%)=201.1(c
12h10
op
+
,44),133.1(c9h9o
+
,100),105.1(c8h
9+
,20),77.1(c6h
5+
,13).ir=(cm-1
).hrms(esi)(m/z)[c
21h19
o2p+na]
+
,计算值:357.1015,实验值:357.1010。
[0066]
实施例4
[0067]
酰基膦氧化合物i-4的制备:
[0068]
(1)将0.1摩尔式ii-4的芳基甲醛衍生物与0.15摩尔二苯基磷氧混合,向混合物中依次加入0.01摩尔的cu(oac)2和0.2摩尔的过氧叔丁基醚(dtbp),再将1000ml的1,2-二氯乙烷加入到体系中去,在80℃下反应12小时;
[0069]
(2)待反应停止后,先蒸除大部分1,2-二氯乙烷并回收,剩余油状混合物采用二氯甲烷和水的体系对产物进行萃取,取下层有机相合并浓缩后,进行硅胶柱层析分离,得到产物i-4,黄色固体,产率:89%,熔点:102~104℃,相应谱图参见图4a、图4b和图4c,其结构表征数据如下:
[0070]1h nmr(400mhz,cdcl3)δ=8.02
–
7.73(m,4h),7.57
–
7.37(m,6h),7.31(t,1h),6.51(d,2h),3.59(s,6h)(ppm).
13
c nmr(101mhz,cdcl3)δ=211.3(j
c-p
=85.5hz),158.6,133.7,131.8(j
c-p
=3.1hz),131.8(j
c-p
=9.0hz),131.2(j
c-p
=96.1hz),128.3(j
c-p
=11.9hz),117.0(j
c-p
=41.7hz),104.4,55.9(ppm).
31
p nmr(162mhz,cdcl3)δ=16.80(ppm).uv-vis:λ
max
=295nm(乙腈中).ir:ν=2941,2359,1675(c=o),1473,1255(p=o),1107.9,692cm-1
.ms(ei):m/z(%)=201.1(c
12h10
op
+
,9),165.1(c9h9o
3+
,100),122.1(c7h6o
22+
,6),107.0(c6h3o
23+
,12),77.1(c6h
5+
,12).hrms(esi)(m/z)[c
21h19
o4p+na]
+
,计算值:389.0913,实验值:389.0910。
[0071]
实施例5-12
[0072]
按照与实施例1相同的方式制备酰基膦氧化合物i-5、i-6、i-7、i-8、i-9、i-10、i-11和i-12,不同之处在于,依次采用式ii-5、ii-6、ii-7、ii-8、ii-9、ii-10、ii-11和ii-12的苯甲醛衍生物为原料,其中原料和产物的结构式如表1所示。
[0073]
产物i-5,黄色固体,产率:81%,mp:135~137℃,相应谱图参见图5a、图5b和图5c,其结构表征数据如下:
[0074]1h nmr(400mhz,cdcl3)δ=7.98
–
7.85(m,5h),7.77(d,1h),7.70(d,1h),7.55
–
7.39(m,6h),7.35(t,1h),7.31
–
7.23(m,1h),7.18(d,1h),3.67(s,3h)(ppm).
13
c nmr(101mhz,cdcl3)δ=212.5(j
c-p
=83.2hz),159.1,135.1,131.7(j
c-p
=2.7hz),131.6,131.4(j
c-p
=8.9hz),130.7,130.3(j
c-p
=3.8hz),129.0,128.4(j
c-p
=23.4hz),128.3(j
c-p
=11.8hz),124.2,122.7,120.2(j
c-p
=41.1hz),112.7,56.3(ppm).
31
p nmr(162mhz,cdcl3)δ=17.02(ppm).uv-vis:λ
max
=358nm(乙腈中).ir:ν=2923,2360,1648(c=o),1512,1436,1256(p=o),1199,697cm-1
.ms(ei):m/z(%)=355.1(c
23h16
o2p
+
,8),201.1(c
12h10
op
+
,4),185.1(c9h9o
3+
,100),170.1(c
11
h6o
22+
,4),142.1(c
10
h6o
22+
,9),77.1(c6h
5+
,4).hrms(esi)(m/z)[c
24h19
o3p+na]
+
,计算值:409.0964,实验值:409.0966。
[0075]
产物i-6,黄色固体,产率:75%,mp:160~162℃,相应谱图参见图6a、图6b和图6c,其结构表征数据如下:
[0076]1h nmr(400mhz,cdcl3)δ=8.52(s,1h),8.15
–
7.89(m,6h),7.58(t,4h),7.54
–
7.47(m,4h),7.41(t,2h),7.32(t,2h)(ppm).
13
c nmr(101mhz,cdcl3)δ=219.8(j
c-p
=73.8hz),132.8(j
c-p
=39.9hz),132.7(j
c-p
=2.8hz),132.2(j c-p
=8.9hz),130.9(j
c-p
=11.3hz),129.5(j
c-p
=94.0hz),128.9,128.8,128.6,127.2,125.7,124.6(ppm).
31
p nmr(162mhz,cdcl3)δ=15.25(ppm).uv-vis:λ
max
=387nm(乙腈中).ir:ν=3054,2360,1653(c=o),1437,1201(p=o),1111,821,692cm-1
.ms(ei):m/z(%)=406.1(m
+
,4),205.1(c
15h19o+
,100),201.1(c
12h10
op
+
,9),177.1(c
14h9+
,44),77.1(c6h
5+
,13).hrms(esi)(m/z)[c
27h19
o2p+na]
+
,计算值:429.1015,实验值:429.1015。
[0077]
产物i-7,白色固体,产率:72%,mp:149~150℃,相应谱图参见图7a、图7b和图7c,其结构表征数据如下:
[0078]1h nmr(400mhz,cdcl3)δ=8.04
–
7.91(m,4h),7.63
–
7.45(m,6h),7.28(m,3h)(ppm).
13
c nmr(101mhz,cdcl3)δ=212.4(j
c-p
=82.5hz),137.1(j
c-p
=39.8hz),132.7(j
c-p
=2.8hz),132.1,132.0,131.4,129.35(j
c-p
=97.5hz),128.8(j
c-p
=12.2hz),128.4(ppm).
31
p nmr(162mhz,cdcl3)δ=15.45(ppm).uv-vis:λ
max
=389nm(乙腈中).ir:ν=2360,1685(c=o),1559,1423,1208(p=o),1097,919,787,691cm-1
.ms(ei):m/z(%)=339.0(c
19h13
clo2p
+
,65),201.1(c
12h10
op
+
,100),173.0(c7h3cl2o
+
,40),145.0(c6h3cl
2+
,20),109.0(c6h3cl
2+
,7),77.0(c6h
5+
,23).hrms(esi)(m/z)[c
19h13
o2pcl2+h]
+
,计算值:375.0103,实验值:375.0095。
[0079]
产物i-8,白色固体,产率:80%,mp:109~111℃,相应谱图参见图8a、图8b和图8c,其结构表征数据如下:
[0080]1h nmr(400mhz,cdcl3)δ=8.12
–
7.94(m,4h),7.60
–
7.39(m,8h),7.15(m,1h)(ppm).
13
c nmr(101mhz,cdcl3)δ=213.1(j
c-p
=81.6hz),140.7(j
c-p
=39.5hz),132.6(j
c-p
=2.6hz),132.5,132.1(j
c-p
=9.0hz),131.9,129.9(j
c-p
=97.2hz),128.8(j
c-p
=12.1hz),119.1(ppm).
31
p nmr(162mhz,cdcl3)δ=12.37(ppm).uv-vis:λ
max
=390nm(乙腈中).ir:ν=2924,2360,1683(c=o),1549,1438,1208(p=o),1111,731,691cm-1
.ms(ei):m/z(%)=385.0(c
19h13
bro2p
+
,38),262.9(c7h3br2o
+
,32),234.9(c6h3br
2+
,7),201.1(c
12h10
op
+
,100),183.1(c7h3bro
2+
,10),77.1(c6h
5+
,76),75.0(c6h
33+
,24).hrms(esi)(m/z)[c
19h13
o2pbr2+h]
+
,计算值:462.9093,实验值:462.9088。
[0081]
产物i-9,白色固体,产率:81%,mp:123~125℃,相应谱图参见图9a、图9b和图9c,其结构表征数据如下:
[0082]1h nmr(400mhz,cdcl3)δ=8.50(s,2h),8.17
–
7.80(m,4h),7.69
–
7.39(m,6h)(ppm).
13
c nmr(101mhz,cdcl3)δ=210.8(j
c-p
=81.4hz),147.9,144.2(j
c-p
=39.7hz),133.1(j
c-p
=2.9hz),132.0(j
c-p
=9.4hz),129.0(j
c-p
=12.3hz),128.0,127.8(ppm).
31
p nmr(162mhz,cdcl3)δ=16.63(ppm).uv-vis:λ
max
=390nm(乙腈中).ir:ν=2851,2360,1669(c=o),1437,1215(p=o),1117,821,692cm-1
.ms(ei):m/z(%)=201.1(c
12h10
op
+
,100),77.0(c6h
5+
,11).hrms(esi)(m/z)[c
18h12
no2pcl2+h]
+
,计算值:376.0056,实验值:376.0053。
[0083]
产物i-10,白色固体,产率:78%,mp:134~136℃,相应谱图参见图10a、图10b和图10c,其结构表征数据如下:
[0084]1h nmr(400mhz,cdcl3)δ=8.63(s,2h),8.22
–
7.87(m,4h),7.87
–
7.38(m,6h)(ppm).
13
c nmr(101mhz,cdcl3)δ=211.3(j=80.5hz),150.4,148.0(j
c-p
=39.6hz),133.1(j
c-p
=2.8hz),132.0(j
c-p
=9.2hz),129.0(j
c-p
=98.5hz),129.0(j
c-p
=12.3hz),116.2(ppm).
31
p nmr(162mhz,cdcl3)δ=13.72(ppm).uv-vis:λ
max
=392nm(乙腈中).ir:ν=2954,2360,1685(c=o),1438,1212(p=o),1122,692cm-1
.ms(ei):m/z(%)=386.0(c
18h12
brno2p
+
,11),201.1(c
12h10
op
+
,100),183.1(c6h2brno
2+
,5),77.1(c6h
5+
,19).hrms(esi)(m/z)[c
18h12
no2pbr2+h]
+
,计算值:463.9045,实验值:463.9046。
[0085]
产物i-11,黄色固体,产率:72%,mp:175~177℃,相应谱图参见图11a、图11b和图11c,其结构表征数据如下:
[0086]1h nmr(400mhz,cdcl3)δ=8.50(d,2h),7.97
–
7.76(m,4h),7.58
–
7.29(m,6h),6.51(d,2h),3.37(s,4h),2.02(s,4h)(ppm).
13
c nmr(101mhz,cdcl3)δ=198.5(j
c-p
=83.1hz),152.3,133.2,132.0(j
c-p
=9.1hz),132.0(j
c-p
=2.9hz),131.0,129.0(j
c-p
=11.9hz),128.5(j
c-p
=11.7hz),126.04(j
c-p
=50.9hz),111.3,47.8,25.4(ppm).
31
p nmr(162mhz,cdcl3)δ=22.08(ppm).uv-vis:λ
max
=386nm(乙腈中).ir:ν=2924,2360,1685(c=o),1571,1264(p=o),1179,694cm-1
.ms(ei):m/z(%)=201.0(c
12h10
op
+
,15),174.1(c
11h12
no
+
,100),146.1(c
10h12n+
,6),77.0(c6h
5+
,7).hrms(esi)(m/z)[c
23h22
no2p+na]
+
,计算值:398.1280,实验值:398.1278。
[0087]
产物i-12,黄色固体,产率:75%,mp:116~118℃,相应谱图参见图12a、图12b和图13,其结构表征数据如下:
[0088]1h nmr(400mhz,cdcl3)δ=8.38(d,2h),8.06
–
7.80(m,4h),7.55
–
7.40(m,6h),7.33
–
7.26(m,4h),7.18
–
7.10(m,6h),6.91(d,2h)(ppm).
13
c nmr(101mhz,cdcl3)δ=200.5(j
c-p
=82.1hz),153.7,145.7,132.3,132.2(j
c-p
=2.7hz),131.9(j
c-p
=9.3hz),129.6,128.6(j
c-p
=11.9hz),128.2(j
c-p
=320.7hz),125.9,125.6,122.2(j
c-p
=445.2hz),118.6(ppm).
31
p nmr(162mhz,cdcl3)δ=22.25(ppm).uv-vis:λ
max
=329nm(乙腈中).ir:ν=2924,2360,1698(c=o),1576,1489,1271(p=o),1175,693cm-1
.ms(ei):m/z(%)=473.2(m
+
,3),272.1(c
19h14
no
+
,100),244.1(c
18h14n+
,10),201.1(c
12h10
op
+
,6),167.1(c
12
h9n
2+
,5),77.0(c6h
5+
,4).hrms(esi)(m/z)[c
31h24
no2p+na]
+
,计算值:496.1437,实验值:496.1432。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1