宫颈癌相关基因甲基化的引物、试剂盒、模型及构建方法与流程
1.本发明涉及分子生物学检测领域,具体涉及一种宫颈癌相关基因甲基化的引物、试剂盒、模型及构建方法。
背景技术:
2.目前宫颈癌的筛查包括宫颈细胞学检测及人类乳头状瘤病毒(hpv)检测。细胞学检测包括巴氏涂片和tct液基细胞压片。tct相较于巴氏涂片更易于发现异常细胞,敏感性较高,但价格相对较高,且诊断水平受医师主观因素影响较大。hpv dna检测相比细胞学检测,能够对高危型和低危型进行分型和定量检测,但是》80%的妇女一生中都会感染hpv,90%以上的感染者体内的病毒在两年内自动清除,hpv dna 检测产生大量的假阳性(特异度低)。宫颈上皮内瘤变(cin)是宫颈癌前病变的阶段,随病变程度加重,癌变几率升高。即使对于同一级别癌前病变个体,癌症风险也存在差别。宫颈上皮内病变(cin)可分为轻度非典型增生(cin1)、中度非典型增生(cin2)与重度非典型增生及原位癌(cin3/cis);cin 的转化性病变(cin2 与cin3)反映一种异质性疾病;表观遗传学研究表明宫颈癌发展过程伴随着局部基因甲基化异常,基因甲基化改变可以区分早期和晚期宫颈cin转化病变,可用于宫颈癌筛查诊断和宫颈癌前病变管理。通过甲基化标记检测宫颈病变时,可由自体细胞基因甲基化程度知道癌症进展的风险,建议是否立即治疗或是跟踪观察。所以,仍需要开发一种新的方法精准评估癌前病变个体风险。
技术实现要素:
3.针对上述现有技术的不足,本发明所要解决的问题是:如何提供一种宫颈癌相关基因甲基化的引物、试剂盒、模型及构建方法,以解决对宫颈癌甲基化水平评估不准确的问题。
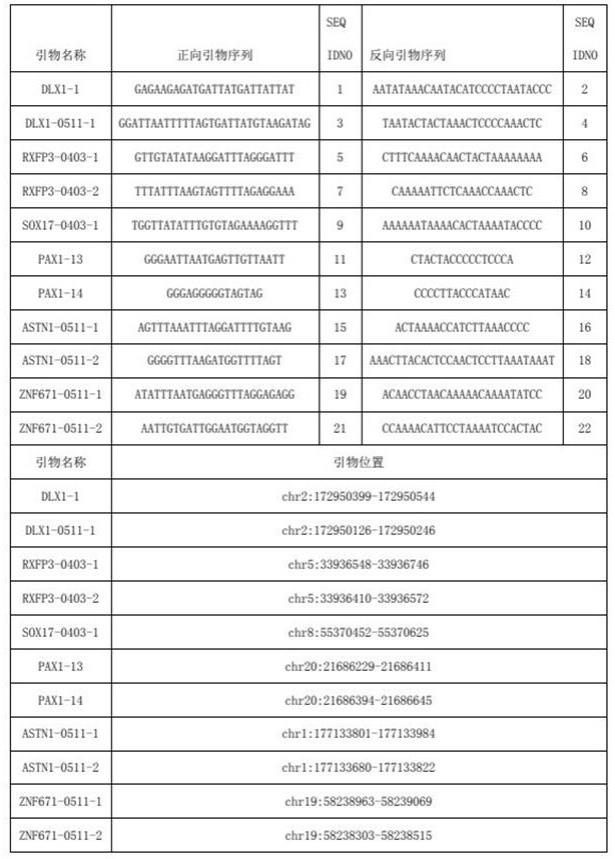
4.为了解决上述问题,本发明采用了如下的技术方案:一种用于评估宫颈癌相关基因甲基化的pcr扩增的甲基化引物,所述甲基化引物包括:如seq id no:1所示核苷酸序列的正向引物和seq id no:2所示核苷酸序列的反向引物;如seq id no:3所示核苷酸序列的正向引物和seq id no:4所示核苷酸序列的反向引物;如seq id no:5所示核苷酸序列的正向引物和seq id no:6所示核苷酸序列的反向引物;如seq id no:7所示核苷酸序列的正向引物和seq id no:8所示核苷酸序列的反向引物;如seq id no:9所示核苷酸序列的正向引物和seq id no:10所示核苷酸序列的反向引物;
如seq id no:11所示核苷酸序列的正向引物和seq id no:12所示核苷酸序列的反向引物;如seq id no:13所示核苷酸序列的正向引物和seq id no:14所示核苷酸序列的反向引物;如seq id no:15所示核苷酸序列的正向引物和seq id no:16所示核苷酸序列的反向引物;如seq id no:17所示核苷酸序列的正向引物和seq id no:18所示核苷酸序列的反向引物;如seq id no:19所示核苷酸序列的正向引物和seq id no:20所示核苷酸序列的反向引物;如seq id no:21所示核苷酸序列的正向引物和seq id no:22所示核苷酸序列的反向引物。
5.具体的,引物位置为:引物位置seqidnochr2:172950399-1729505441/2chr2:172950126-1729502463/4chr5:33936548-339367465/6chr5:33936410-339365727/8chr8:55370452-553706259/10chr20:21686229-2168641111/12chr20:21686394-2168664513/14chr1:177133801-17713398415/16chr1:177133680-17713382217/18chr19:58238963-5823906919/20chr19:58238303-5823851521/22一种用于评估宫颈癌相关基因甲基化的pcr扩增的试剂盒,所述试剂盒包括权利要求1所述甲基化引物。
6.进一步,所述试剂盒包括:25体积份platinum multiplex pcr master mix、3体积份gc enhancer、1体积份权利要求1所述甲基化引物和11体积份无酶水。
7.一种用于宫颈癌相关基因甲基化评估模型的构建方法,包括:1)提取宫颈细胞dna,并对所述宫颈细胞dna进行甲基化处理;2)对所述步骤1)甲基化处理后的宫颈细胞dna利用上述pcr扩增的试剂盒进行第一次pcr扩增并纯化;3)将所述步骤2)处理后的产物进行第二次pcr扩增并纯化,得到文库;4)将所述文库通过二代测序平台进行高通测序后进行生信分析,对每个pcr扩增区域计算一个甲基化分值,基于宫颈癌样本和正常样本,将每个pcr扩增区域计算得到的一个甲基化分值作为自变量,采用逻辑回归方式构建宫颈癌相关基因甲基化评估模型。
8.具体的,根据所述甲基化引物,所述相关基因为6个。
9.具体的,所述步骤4)中对每个pcr扩增区域计算一个甲基化分值采用以下公式进
行计算:,其中,l为候选marker含有的cpg位点,mhi为i个连续cpg位点完全甲基化的比例,p为i个连续cpg位点的片段中,完全甲基片段占比。
10.进一步,所述宫颈细胞dna来源于宫颈刮落细胞、石蜡组织或石蜡切片或新鲜宫颈组织。
11.进一步,所述第一次pcr扩增程序为:95℃、2min,循环一次;95℃、30s,57℃、90s,72℃、1min,循环35次;72℃、10min,循环一次;4℃,保持。
12.进一步,所述第二次pcr扩增体系为:25体积份kapa hifi hotstar readymix、1体积份pe1.0、1体积份生物标签、23体积份所述步骤2)处理后的产物;所述第二次pcr扩增程序为:98℃、2min,循坏1次;98℃、30s,65℃、30s,72℃、20s,循环18次;72℃、5min,循环一次;4℃保持。
13.进一步,所述生信分析包括碱基识别、去除测序接头、删除低质量碱基和比对至人基因组hg19生成bam文件。
14.一种所述用于宫颈癌相关基因甲基化评估模型的构建方法所构建的宫颈癌相关基因甲基化评估模型。
15.一种宫颈癌相关基因甲基化的非疾病诊断的评估方法,利用所述宫颈癌相关基因甲基化评估模型,计算所述待检样本的相关基因的甲基化分值,基于所述待检样本的相关基因的甲基化分值,输入所述宫颈癌相关基因甲基化评估模型进行评估。
16.所述用于评估宫颈癌相关基因甲基化的pcr扩增的甲基化引物或所述用于评估宫颈癌相关基因甲基化的pcr扩增的试剂盒在制备预测宫颈癌试剂、宫颈癌复发检测试剂或宫颈癌治疗评估试剂中的应用。
17.本发明的有益效果在于:1、本发明通过多重pcr甲基化建库,经高通量测序得到样本甲基化状态,测序深度高,时间短,成本低。
18.2、本发明采用多基因的多个位点联合检测及独特的算法模型评价,灵敏度和特异性高于单个基因。
19.3、根据评估的风险程度决定对宫颈癌前病变进行治疗或是观察,可有效减少过度治疗,提高生活质量,同时降低宫颈癌的发病率和死亡率。
具体实施方式
20.下面结合具体实施例对本发明作进一步的详细说明。
21.需要说明的是,这些实施例仅用于说明本发明,而不是对本发明的限制,在本发明的构思前提下本方法的简单改进,都属于本发明要求保护的范围。
22.本发明涉及dna甲基化检测方法主要步骤为:从宫颈细胞获取核酸、甲基化处理、第一步pcr扩增、产物纯化、第二步pcr扩增、产物纯化、文库质检、高通量测序、生信分析。
23.实施例11、宫颈细胞dna提取宫颈刮落细胞dna提取:取300μl保存液保存细胞按照通用型柱式基因组提取试剂盒(康为,cwy004)说明书提取基因组dna后qubit检测浓度。
24.石蜡组织或石蜡切片基因组dna提取:取10μm厚的石蜡块或8-10片石蜡切片样本按照generead dna ffpe kit(qiagen,180134)说明书提取基因组dna后qubit检测浓度。
25.新鲜组织基因组dna提取:取25 mg新鲜组织按照通用型柱式基因组提取试剂盒(康为,cwy004)说明书提取基因组dna后qubit检测浓度。
26.2、甲基化处理使用epitect plus dna plus dna bisufite kit(qiagen,59124)甲基化处理试剂盒按照说明书对宫颈细胞获取dna进行甲基化处理。
27.3、第一步pcr扩增(1)引物合成按照表1中的引物序列在生工生物工程(上海)股份有限公司合成引物,引物合成后用10mm tris-hcl稀释成100μm储存液,11对引物混合形成10μm使用液。
28.表1
ꢀꢀ
甲基化引物
(2)第一步pcr扩增将步骤2经过处理的dna按照表2的体系和表3的pcr程序pcr扩增。
29.表2
ꢀꢀ
第一步pcr扩增体系
表3
ꢀꢀ
第一步pcr程序(3)第一步pcr产物纯化1)在每个样本管中加 1.0倍体积以上的ampure xp磁珠,用移液器吹打或者振荡充分混匀2)放置在室温下孵育5min后,转移到磁力架上室温孵育2min左右。
30.3)待溶液澄清后,吸走并丢弃上清。
31.4)使用200μl 80%乙醇漂洗磁珠30s,然后吸走并丢弃乙醇。再重复用80%乙醇漂洗一次。
32.5)将磁珠在室温下晾干5min至磁珠表面不反光即可。
33.6)移走磁力架,在每个样本管中加入25μl超纯水重悬磁珠,用移液器吹打或者振荡充分混匀,室温孵育5min。
34.7)再将每个样品管放置在磁力架上室温下孵育2分钟,至溶液澄清。
35.8)吸走23μl上清液,并转移到一个新的管中,用于下一步pcr。
36.4、第二步pcr扩增将步骤3的纯化产物按照表4、表5的体系和程序进行第二步pcr扩增。
37.表4 第二步pcr扩增体系
表5 第二步pcr扩增程序pcr反应结束后按照步骤3的纯化步骤纯化后,用qubit检测浓度。
38.5、高通量测序将步骤4得到的靶序列捕获文库通过nextseq500、x ten、novaseq等二代测序平台进行高通量测序,得到测序原始数据进行以下分析。
39.6、生信分析(1)碱基识别使用illumina官方软件bcf2fastq(version 2.15.0.4),根据样本index序列,将illumina测序仪下机二进制bcf格式文件转化并拆分为单个样本可读文件fastq格式。
40.(2)数据质控使用fastp(version 0.20.1)去除测序接头,删除低质量碱基,生成clean reads。
41.(3)数据比对使用甲基化比对专用软件bismark(version 2.2.6)将clean reads比对至人基因组hg19 ,生成bam文件(4)对每个pcr扩增区域计算一个甲基化分值。
42.甲基化分值计算公式为,其中l为候选marker含有的cpg位点,mhi为i个连续cpg位点完全甲基化的比例,p为i个连续cpg位点的片段中,完全甲基片段占
比。
43.(5)甲基化分类模型构建采集35例宫颈癌与16例正常人,表型为宫颈癌样本表型y值编码为1,表型为正常人y值编码为0,基于6个宫颈癌相关基因将自变量设定为6个基因的mhl值。采用逻辑回归的方式构建甲基化分类模型。
44.(6)甲基化新样本预测待检样本检测时,计算上述6个基因的mhl值,将结果输入到步骤5建立的逻辑回归模型中,若得到1则为高甲基化,若为0则为低甲基化。
45.实施例2采用实施例1的方法预测待检样本甲基化状态采集18例病理结果为正常或炎症的宫颈刮落细胞和47例病理结果为宫颈癌的宫颈刮落细胞(均经患者知情同意)样本用实施例1的方法预测待检样本的甲基化状态,检测结果见表6。
46.表6 65例宫颈刮落细胞检测结果其中:临床敏感度(sensitivity)为41/(41+6) =0.87,临床特异度(specificity)为16/(16+2) = 0.89,阴性预测值(npv)为16/(16+6)=0.73,阳性预测值(ppv)为41/(41+2)=0.95。
47.最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管通过参照本发明的优选实施例已经对本发明进行了描述,但本领域的普通技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离所附权利要求书所限定的本发明的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1