分离多聚(A)核酸的方法与流程
分离多聚(a)核酸的方法
1.本技术是申请日为2015年4月28日、申请号为201580023578.1、发明名称为“分离多聚(a)核酸的方法”的发明专利申请的分案申请。
发明领域
2.本发明提供了一种从含有核酸的样品中分离多聚(a)核酸的方法。所述方法有效地富集了多聚(a)核酸例如多聚(a)rna而去除了不需要的非多聚(a)核酸、例如rrna。所述方法特别适合于制备用于下一代测序(ngs)应用的多聚 (a)rna。此外、还提供了适用于执行本发明方法的组合物和试剂盒。
3.发明背景
4.本公开涉及聚腺苷酸化核酸、特别是多聚(a)rna的分离。多聚腺苷酸化通常指的是向生物分子中添加由多个(通常几十到几百个)连续腺嘌呤(a)残基组成的延伸段、其中所述延伸段通常存位于分子的3’末端、通常称为“多聚(a) 尾”。含有各自的多聚(a)延伸段或多聚(a)尾的核酸通常称为“多聚(a)核酸”。在真核生物中、聚腺苷酸化是与用于基因表达(翻译)的成熟信使rna(mrna) 的产生相关的过程。在此、在转录(核聚腺苷酸化)结束时、将多聚(a)尾加入rna 中。在真核生物中、几乎所有的mrna在3’末端具有多聚(a)尾、只有少数例外、如动物复制依赖性组蛋白mrna(参见如lopez等人(rna 14(1):1-10,2007))。此外、除了绝大多数mrna之外、各种真核非编码rna也是多聚腺苷酸化的。这还包括一些小rna、例如微小rna、其在微小rna成熟期间可以具有其中间形式的多聚(a)尾。此外、核酸也可以进行人工聚腺苷酸化从而为它们提供多聚(a) 尾。核酸的多聚(a)尾已经作为从不同样品类型中分离多聚(a)核酸的手段、尤其是用于将多聚(a)核酸与没有多聚(a)尾的核酸分离、在本文中也称为“非多聚(a)核酸”。
5.可以借助于能够与单链多聚(a)延伸段杂交的探针来分离多聚(a)核酸。这样的探针可以通过与多聚(a)延伸段杂交而捕获多聚(a)核酸、下文中也称为捕获探针。通常、采用一种寡核苷酸用于该目的、所述寡核苷酸含有与多聚(a) 核酸的多聚(a)延伸段互补的序列、本文也称为捕获寡核苷酸。为了简化捕获的多聚(a)核酸的分离过程、通常采用的是经捕获探针功能化的固体支持物。用于从总rna中特异性分离多聚(a)rna的标准方式是基于aviv和leder(1972)的方法。这里、将互补dna寡核苷酸(“寡聚dt”,“oligo dt”)的短延伸段固定到不溶性基质、然后通过建立有利于形成rna-dna双链的条件将其用作多聚 (a)rna的选择性固定基质。将总rna样品上样到具有合适的盐缓冲液(最初为含有0.5m kcl的10mm tris、ph7.5)的柱上、促使捕获探针与多聚(a)尾杂交。然后用应用缓冲液(含0.5m kcl)、再用低离子强度溶液(0.1m kcl)彻底对柱进行洗涤、接着用10mm tris(ph7.5)洗脱mrna。
6.对该原始方法的后续修饰保留了与固定化寡聚-dt杂交的基本过程、但是已经改变了例如、从柱到批量程序的形式、以允许更快地进行该程序并且已经使用nacl或licl作为盐。进一步的变化是用塑料或玻璃珠作为固相以代替纤维素、并且采用磁珠作为固体支持物。这种磁性的质量允许这样的磁珠借助于磁体进行批量分离。此外、已经采用生物素-链霉亲和素连接来建立寡聚-dt与固体支持物之间的连接、其中寡核苷酸是经生物素化的、
并且所述固体支持物共价偶联于链霉亲和素。杂交可以在溶液中进行、在后续步骤中将寡聚-dt-mrna 杂交体连接到固体支持物上。该方法倾向于一种在去除rrna的同时选择性分离多聚(a)rna的低效方法。rrna残留水平通常高到足以提供与总rna相同的问题、特别是对于罕见转录物的分析。
7.其他多聚(a)核酸的分离方法旨在通过使用低离子强度(高严格性)洗涤来增强扩展的a:t杂交体中的相互作用、并试图找到更多的“惰性”材料用作支持物。等效稳定剂(isostabilizing agents)、例如、按适合浓度使用时、属于四甲基铵(tma+)和四乙基铵(tea+)离子一类的季铵盐和甘氨酸氨基酸衍生物甜菜碱、可平衡a:t和g:c碱基对的氢键结合强度(jacobs等人、1988;jacobs等人、1985;gitschier等人、1986;melchior等人、1973;rees等人、1993;wood 等人、1985;wozney、1990)。在本领域中使用这种等效稳定剂以促进多聚(a) 分离。us 6,812,341描述了一种富集多聚(a)的方法、其目的在于通过使用等效稳定剂如四甲基铵(tma+)和四乙铵(tea+)离子、优选tmac或teac、从而在分离过程中去除rrna残留。wo 90/12116涉及一种通用方法、其中将包被寡聚-dt的磁性颗粒用于多聚(a)rna的分离。这里、四烷基铵阳离子与离液盐 (chaotropic salt)联合用于稳定多聚(a)核酸的多聚(a)尾部与寡聚(dt)探针之间的 a:t键。
8.此外、各种商业产品可用于多聚(a)核酸分离、例如direct m48 试剂盒、其采用了固定在磁珠上的寡聚(dt)捕获寡核苷酸、或用于分离多聚 (a)rna的mrna试剂盒(凯杰)、其采用了固定于聚苯乙烯-乳胶珠(作为固体支持物)的寡聚(dt)捕获寡核苷酸。
9.对于有效的多聚(a)核酸分离方法(即有效地捕获多聚(a)核酸、同时去除非多聚(a)核酸)仍有大量的需求。这些方法例如、提供适用于采用大规模并行方式进行的下一代测序(ngs)应用的多聚(a)rna需求。ngs技术平台的共同之处在于它们需要制备适合大规模并行测序的测序文库。大多数平台在仪器上“运行”之前都遵循一个通用的库准备程序、而只有少许修改。这个程序包括片段化dna、其可以从cdna获得、随后是dna修复和末端精加工(平端或a突出端)、最后、通常是平台特异性衔接子的连接。此类测序文库的制备和设计描述于例如voelkerding等(clinical chemistry 55:4 641-658,2009)和metzker(naturereviews/genetics volume 11、2010年1月、第31-46页)中。ngs也已经用于转录组测序。使用下一代测序技术对整个转录组的研究提供了转录组详细、高通量的视图。转录组测序也称为rna测序(rna-seq)、并且例如、用于对生物样品中的转录物进行绘制和定量。该技术已经在诸如癌症的疾病研究中被快速采用。
10.从多聚(a)rna制备测序文库具有以下优点:不携带多聚(a)尾的rna种类、例如rrna(为不感兴趣的)在理论上不被回收、因此不被携带到测序反应。因此、从使用多聚(a)rna产生的测序文库中获得的大多数序列对应于编码蛋白质的mrna、其携带多聚(a)尾。然而、在真核细胞中、仅约1至5%的总rna由初级转录物即聚腺苷酸化的mrna组成、而核糖体rna(rrna)构成了本rna种类的约90%。因此、即使当从多聚(a)rna开始时、转录组测序的一个主要问题是干扰rna分子的存在、特别是如果多聚(a)rna起始材料不具有足够的纯度并且含有非多聚(a)污染。如果大量的rrna参与文库构建、测序功能将用于对这些普遍存在的分子进行测序。高丰度的rrna可能在测序读取中占主导地位、从而阻碍低表达基因的研究并浪费宝贵的测序资源。此外、核糖体rna的存在可能导致低的信噪比、其可以导致难以检
测感兴趣的rna种类。因此、在分离多聚(a)rna过程中对去除rrna和/或其它不需要的非多聚(a)rna的改进增加了下游测序的价值、因为可以从测序运行中推导出更多的信息。
11.然而、尽管本领域中有许多方法可用于分离多聚(a)核酸、但是现有技术方法都具有缺点。通常在多聚(a)核酸回收和实现去除不需要的非多聚(a)核酸之间存在折衷。有效去除不需要的非多聚(a)核酸的方法经常遭受差的多聚(a)核酸回收率。其它方法实现了良好的多聚(a)核酸回收率、但非多聚(a)核酸如 rrna的去除不足。事实上、可用的方法通常需要两轮或更多轮的多聚(a)核酸富集以提供多聚(a)核酸样品,其中非多聚(a)核酸的量,例如,rrna足够低以提供用于某些应用的有用样品,例如纯度要求较高的ngs应用。重复整个多聚(a)核酸分离程序的这一要求可导致若干不利的副作用,此外,还延长了进行该程序所需的小时数。各种多聚(a)核酸的代表性分布会一变再变,或者与重复程序相关的难免性损失可以降低通常寻求的低丰度信息的水平超出检测限。这些缺点尤其在诊断设置和ngs应用中造成主要问题,其中简单、有效的非多聚 (a)核酸去除、速度以及可靠性是可行的多聚(a)核酸分离方法,尤其是多聚 (a)rna分离方法的驱动特征。
12.本发明的一个目的是提供一种用于分离多聚(a)核酸,例如特别是多聚 (a)rna的改进方法。具体地,本发明的一个目的是提供一种分离多聚(a)核酸的方法,其有效地富集多聚(a)核酸,同时有效地去除非多聚(a)核酸。此外,一个目的是提供一种用于分离用于下一代测序的多聚(a)核酸的改进方法。此外,提供了适合执行各种方法的产品。
技术实现要素:
13.本发明尤其基于令人惊讶的发现,即,可以使用捕获探针以及涉及使用钠盐与季铵盐组合的杂交条件,能够有效地且特异性地分离含有单链多聚(a)延伸段(以下也称为“多聚(a)核酸”)的核酸。当使用本文所述的杂交条件时,减少了非多聚(a)核酸的污染。如实施例所证明,根据本发明的方法中使用的杂交条件确保有效捕获并借此分离多聚(a)核酸,同时显着降低不需要的非多聚(a)核酸的结合以及所导致的在分离的多聚(a)核酸中的残留。这导致甚至可以在一个分离/富集步骤中就实现高选择性多聚(a)核酸的回收。与需要两个或多个分离循环的现有技术方法相比,这还增加了处理的速度。本发明可以用于从含有核酸的样品中特异且有效地分离多聚(a)rna,同时在分离过程中去除不需要的非多聚(a)rna,例如rrna。该方法特别适用于制备用于下一代测序(ngs)应用(如转录组测序)的多聚(a)rna。对于这样的应用,特别重要的是有效地捕获多聚 (a)rna,同时去除非多聚(a)rna,因为在分离的多聚(a)rna中,不感兴趣的 rna如rrna消除的越多,则从一个测序运行中获得的信息就越多。因此,本文描述的方法对本领域做出重要贡献。
14.此外,经发现,使用钠盐与季铵盐组合的有利杂交条件不仅为多聚(a)核酸提供了严格和选择性的捕获条件,还提供了有利的洗涤条件。因此,本文所述的杂交条件可以有利地用于去除在洗涤期间可能结合于捕获探针和/或捕获的多聚(a)核酸上的非多聚(a)核酸。
15.因此,根据第一方面,提供了从含有核酸的样品中分离具有单链多聚(a) 延伸段的多聚(a)核酸的方法,包括:
16.(a)提供杂交组合物,其包含:
17.i)含有核酸的样品;
18.ii)杂交溶液,其包含:
19.aa.钠盐;
20.bb.季铵盐;
21.其中杂交溶液的组分可以作为单一溶液加入到样品中或者可以以任何顺序分别加入到样品中;
22.iii)能够与多聚(a)核酸的多聚(a)延伸段杂交的捕获探针;
23.和将所述杂交组合物在所述多聚(a)核酸和所述捕获探针之间形成核酸杂交体的条件下进行孵育;
24.(b)将形成的杂交体与剩余的样品分离。
25.根据第二方面,提供了用于对多聚(a)核酸测序的方法,其包括:
26.(a)使用根据第一方面的方法,从含有核酸的样品中分离多聚(a)核酸;
27.(b)对分离的多聚(a)核酸分子进行测序。
28.该方法特别适用于多聚(a)rna的测序。
29.根据第三方面,提供了一种水溶性杂交溶液,其适合于将多聚(a)核酸与能够与多聚(a)核酸的多聚(a)延伸段杂交的捕获探针进行杂交,所述杂交溶液包含:
30.aa.钠盐,浓度≤500mm;
31.bb.季铵盐。
32.第三方面的杂交溶液可以与本发明的第一,第二和第四方面的方法结合使用并用于执行其方法。其特别适合于建立用于将多聚(a)核酸与捕获探针杂交、同时防止非多聚(a)核酸杂交的结合条件。此外,其可用于提供严格的洗涤条件,以在洗涤步骤期间去除结合的非多聚(a)核酸,同时保持多聚(a)核酸与捕获探针的杂交,从而提高分离的多聚(a)核酸的纯度。
33.根据第四方面,提供了用于从含有核酸的样品中分离多聚(a)核酸的试剂盒,包括:
34.(a)根据第三方面的杂交溶液;
35.(b)能够与所述多聚(a)核酸的多聚(a)延伸段杂交的捕获探针。
36.根据第五方面,提供了从含有核酸的样品中分离具有单链多聚(a)延伸段的多聚(a)核酸的方法,包括:
37.(a)将多聚(a)核酸与能够与多聚(a)核酸的多聚(a)延伸段杂交的捕获探针进行杂交,从而在多聚(a)核酸和捕获探针之间形成核酸杂交体;
38.(b)将形成的杂交体与剩余的样品分离;
39.(c)用根据第三方面的杂交溶液洗涤分离的杂交体,其中杂交溶液的组分可以作为单一溶液加入杂交体,或者可以以任何顺序分别加入杂交体以产生用于洗涤的杂交溶液;
40.(d)从洗涤的杂交体中释放多聚(a)核酸。
41.这里,本发明提供的包含钠盐和季铵盐的有益杂交溶液用于分离过程中的洗涤步骤,以在洗涤步骤中减少非多聚(a)核酸的污染。
附图说明
42.图1显示了测试条件的δct值(δct值的计算:在多聚(a)rna富集后测定的平均ct值减去从初始总rna样品测得的平均ct值)。
43.图2a)至d)显示了用测试条件获得的δct值(如上所述计算)。
44.图3a)显示了获得的18s和28s rrna的δct值,图3b)显示了获得的gapdh 和ppia目标mrna的δct值,图3c)显示了gapdh的δδct值,并且图3d)显示了ppia的δδct值。
45.本发明详述
46.本发明尤其基于令人惊讶的发现,采用可以与多聚(a)核酸的多聚(a)延伸段(例如多聚(a)尾)杂交的捕获探针以及涉及使用钠盐与季铵盐组合的杂交条件,可以有效地分离多聚(a)核酸。本文所述的杂交条件确保良好的多聚(a) 核酸回收,同时减少分离的多聚(a)核酸中不需要的非多聚(a)核酸的量。
47.分离多聚(a)核酸的方法
48.在第一方面,提供了从含有核酸的样品中分离具有单链多聚(a)延伸段的多聚(a)核酸的方法,包括:
49.(a)提供杂交组合物,其包含:
50.i)含有核酸的样品;
51.ii)杂交溶液,其包含:
52.aa.钠盐;
53.bb.季铵盐;
54.其中杂交溶液的组分可以作为单一溶液加入到样品中,或者可以以任何顺序分别加入到样品中;
55.iii)能够与多聚(a)核酸的多聚(a)延伸段杂交的捕获探针;和将所述杂交组合物在所述多聚(a)核酸和所述捕获探针之间形成核酸杂交体的条件下进行孵育;
56.(b)将形成的杂交体与剩余的样品分离。
57.主要优点如上所述。随后将描述各个方法的步骤和优选实施例。
58.步骤(a)
59.在步骤(a)中,提供了杂交组合物,其包含i)包含核酸的样品,其中将进行多聚(a)核酸的分离,ii)包含钠盐和季铵盐的杂交溶液,和iii)捕获探针,其能够与所述多聚(a)核酸的多聚(a)延伸段杂交。所述杂交组合物在允许多聚 (a)核酸和捕获探针之间形成核酸-杂交体的条件下进行孵育。
60.分离多聚(a)核酸的含核酸样品可以是经常分离多聚(a)核酸如多聚 (a)rna的任何样品。关于所述含有核酸的样品的细节和非限制性的常见实施例也在下面描述。根据一个实施方式,多聚(a)rna分离自总rna。
61.首先,杂交条件将在随后进行解释,因为它们对于实现多聚(a)核酸与捕获探针的有效结合、而非多聚(a)核酸无法有效结合并因此在分离过程中有效去除而言是决定性的。
62.杂交组合物和杂交溶液
63.随后将解释杂交组合物的组成以及由此的杂交条件。提供杂交组合物包括,向样品中加入杂交溶液。杂交溶液的组分优选作为单一溶液加入样品中。然而,杂交溶液的组分也可以以任何顺序分别加入样品中,例如,使用两种或多种溶液,每种溶液含有至少一种试
剂,例如杂交溶液的钠盐和/或季铵盐,以产生本公开意义上的“杂交溶液”。这种方法还提供“杂交溶液”,因此也包含在本术语中。
64.然后,公开了杂交组合物和适合于建立这些杂交组合物的杂交溶液的合适且优选的实施方式。
65.当描述和定义在本技术说明书和权利要求书中的本发明杂交组合物中“杂交溶液”的组分浓度时,由捕获探针和固体支持物贡献的体积(如果增加体积的固体支持物用于辅助捕获和分离步骤)在确定随后描述的杂交组合物中组分的浓度时不被考虑。也就是说在计算杂交组合物中单个组分的浓度时,忽略捕获探针和用于帮助分离(如果使用)的任何固体支持物或其它结合剂。此外,当描述和定义本发明杂交组合物中“杂交溶液”的组分浓度时,根据一种实施方式,相应的组分例如氯化钠或季铵盐,其不是通过杂交溶液加入但是包含在含有核酸的样品(如果包含在其中)中,则在计算各个组分的浓度时不予考虑。计算以下指定的浓度和浓度范围,忽略含核酸样品的组成,如本文所述,优选为纯化的(也可以是稀释的)核酸样品。然而,根据另一实施方式,在计算中考虑了含核酸样品的各个组分,例如钠盐和/或季铵盐,在该实施方式中,杂交组合物中的盐浓度可以通过添加杂交溶液进行调整从而得出以下说明书给出的杂交组合物中钠盐和季铵盐(由含核酸的样品和杂交溶液提供)的终浓度。
66.根据一实施方式,杂交溶液包含浓缩形式的组分,其允许其用含有核酸的样品和/或稀释溶液稀释,以便与含样品核酸和/或稀释溶液混合时,在杂交组合物中达到适当的终浓度。使用浓缩杂交溶液具有以下优点:使用者相对于含酸样品材料的体积更加灵活,并且待处理的总体积保持较低。例如。可以通过加入稀释溶液如水或其他合适的溶剂将含核酸样品的量调节至一定体积,然后将所述体积与预定体积的杂交溶液混合,以提供杂交组合物的杂交条件。该方法具有优点,因为仅通过向含核酸样品中加入适量的合适稀释溶液,就可以向预定体积的杂交溶液提供相同体积的(可能经稀释的)样品材料。例如,1体积的(可能经稀释的)含核酸样品可以与1-10、1-5、1-3或1-2体积的杂交溶液接触,这取决于杂交溶液的组成。特别优选的比例是1体积的(可能经稀释的)含核酸样品和1体积杂交溶液(1:2稀释),并且也用于几个实施例中。
67.杂交溶液及其杂交组合物包含一(a)钠盐。这还包括使用不同钠盐的混合物作为一(a)钠盐。该钠盐促进多聚(a)核酸与捕获探针的结合。它可以是无机或有机钠盐。根据一个实施方式,钠盐不是离液盐(chaotropic salt,离液序列高的盐),因此,钠盐是非离液钠盐。根据该实施方式,杂交溶液或杂交组合物不含任何离液钠盐。根据一个实施方式,所述钠盐是卤化钠。优选地,所述卤化钠是氯化钠。已经发现,氯化钠是特别合适的,因为当根据本发明的教导使用时,其提供有利的杂交条件。
68.在杂交期间,钠盐必须以足以促进多聚(a)核酸与捕获探针杂交的浓度存在。因此,所述杂交组合物包含一定浓度的杂交溶液钠盐,其有效促进多多聚 (a)核酸与捕获探针的杂交。然而,对需要减少的非多聚(a)核酸污染物,发现降低杂交组合物中钠盐的浓度是有利的。因此,根据一个实施方式,杂交组合物包含浓度≤250mm的杂交溶液钠盐。杂交组合物可以包含选自以下浓度的杂交溶液钠盐:25mm-250mm、35mm-200mm、40mm-175mm、50mm-150mm、55mm-125mm、 60mm-125mm和60mm-100mm。
69.根据一个实施方式,用于在杂交组合物中建立杂交条件的杂交溶液包含浓度≤
500mm的钠盐。杂交溶液可以包含选自以下浓度范围内的钠盐: 50mm-500mm、75mm-400mm、85mm-350mm、100mm-300mm、115mm-250mm、 120mm-225mm和125mm-200mm。根据一个实施方式,所述杂交溶液包含的钠盐浓度位于选自125mm-175mm的范围内。如实施例所证明,当与等体积的样品(或稀释的样品)接触时,这种杂交溶液提供特别好的结果。因此,杂交条件可以在前面段落所描述的杂交组合物中建立。如上所述,氯化钠优选用作钠盐。
70.根据优选的实施方式,所述杂交组合物所含的杂交溶液钠盐的浓度≤ 200mm,≤175mm、≤150mm、≤125mm或≤100mm。所述杂交组合物中,钠盐的这种较低浓度是优选的,因为它们提供用于将多聚(a)核酸特异性杂交到捕获探针的严格条件,而非多聚(a)核酸的非特异性杂交则大大减少。如实施例所示,杂交溶液/杂交组合物中钠盐浓度的降低对非多聚(a)核酸结合具有显着影响。它们的结合显著降低,这导致在分离的多聚(a)核酸中非多聚(a)的污染较少。相对而言,所述盐浓度的降低对多聚(a)核酸与捕获探针杂交的影响较小。因此,相对而言,降低钠盐的浓度对不需要的非多聚(a)核酸的影响比多聚(a) 核酸的影响更严重。然而,降低盐浓度也降低了多聚(a)核酸的产率并因此对其产生不利影响,这并不是所期望的。
71.发明人惊讶地发现,当在杂交溶液及其杂交组合物中另外包含季铵盐时,克服了与杂交组合物中钠盐浓度降低相关的对多聚(a)核酸产量的这种不利影响。因此,这种组合保持了关于在多聚(a)核酸分离过程中去除非多聚(a)核酸的有益效果,同时克服并借此补偿了与钠浓度降低相关的多聚(a)核酸产率的减少。因此,利用钠盐如氯化钠与季铵盐的组合提供了杂交条件,其有利地提供了良好的多聚(a)核酸产量,同时有效地减少了分离的多聚(a)核酸中非多聚 (a)核酸的污染。
72.因此,杂交溶液及其杂交组合物包含一(a)季铵盐。这还包括使用不同季铵盐的混合物作为一(a)季铵盐。根据一个实施方式,所述季铵盐是四烷基铵盐。所述四烷基铵盐可以是四甲基铵盐(tma)或四乙基铵盐(tea)。合适的四烷基铵盐包括但不限于:四乙基氯化铵(teac)、四甲基氯化铵(tmac)、四乙基硝酸铵(tean)、四甲基硝酸铵(tman)、四乙基溴化铵(teab)和四甲基溴化铵 (tmab)。根据一个实施方式,季铵盐不是四甲基硫酸铵。
73.根据优选的实施方式,季铵盐是选自四乙基氯化铵(teac)、四甲基氯化铵 (tmac)、四甲基硝酸铵(tman)、四乙基溴化铵(teab)和四甲基溴化铵(tmab)的四烷基铵盐。优选地,使用四甲基溴化铵作为季铵盐。
74.在杂交过程中,季铵盐以可以与钠盐组合支持多聚(a)核酸与捕获探针结合的浓度存在。根据一个实施方式,所述杂交组合物含有浓度≤3m、≤2.5m、≤2m或≤1.5m的杂交溶液季铵盐。杂交组合物可包含的季铵盐浓度≥100mm、≥125mm、≥250mm或≥375mm。优选地,所述杂交组合物包含的季铵盐浓度选自0.1m-1.75m、0.125m-1.5m、0.25m-1.25m、0.375m-1m和0.375m-0.75m。如上所述,季铵盐优选是四烷基铵盐,合适的实例如上所述。
75.根据一个实施方式,用于在杂交组合物中建立杂交条件的杂交溶液包含的季铵盐浓度≤6m、≤5m、≤4m或≤3m。所述杂交溶液可包含的季铵盐浓度≥ 200mm、≥250mm、≥500mm或≥750mm。优选地,所述杂交溶液包含的季铵盐浓度选自0.2m-3.5m、0.25m-3m、0.5m-2.5m、0.75m-2m和0.75m-1.5m。如实施例所示,当例如采用等体积(或经稀释的)的样品接触时,此类杂交溶液提供了特别好的结果。因此,杂交条件可以在前面段落中所描述的杂交组合物中建立。
76.如实施例所证实,在杂交组合物和/或杂交溶液中的钠盐(优选为氯化钠) 和季铵盐(优选为四烷基铵盐如四甲基溴化铵)的各浓度提供了特别好的结果。合适的浓度也可以由本领域技术人员根据本文提供的教导来确定。
77.杂交溶液和/或杂交组合物可以包含其它组分,随后对非限制性实施方式进行了描述。
78.根据一个实施方式,杂交组合物包含洗涤剂。如实施例所证明,当遵循本发明的教导时,不需要洗涤剂。然而,其可以使用,例如支持多聚(a)核酸中二级结构的变性,从而促使捕获探针与多聚(a)尾杂交。洗涤剂可以选自离子、两性离子和非离子洗涤剂。各种洗涤剂及其在杂交反应中的用途是本领域技术人员公知的。根据一个实施方式,使用了离子型洗涤剂。离子型洗涤剂包括阴离子和阳离子洗涤剂。如实施例所证明,包含阴离子洗涤剂例如sds或lids的杂交组合物提供了良好的结果。杂交组合物中洗涤剂的合适浓度范围包括例如:0.025%-5%,并且可以选自0.05%-3%、0.75%-2.5%、0.1%-2.25%和0.15%-2%。所述洗涤剂优选包含在杂交溶液中并因此随着杂交溶液进行添加。杂交溶液中所述洗涤剂的合适浓度范围包括例如,0.05%-10%、并且可以选自0.1%-7.5%、0.25%-5%、0.5%-3%和0.75%-2%。此外,0.1%-2 %、0.15%-1%和0.2%-0.5%的较低浓度范围也是合适的。然而,所述洗涤剂也可以源自样品的处理,取决于处理的样品类型。例如,如果裂解物作为含有核酸的样品来进行加工,并且使用洗涤剂来裂解样品。然而,洗涤剂并非是必须的。因此,根据一个实施方式,所述杂交组合物不含洗涤剂。
79.此外,杂交组合物可以包含螯合剂。螯合剂包括但不限于:乙二胺四乙酸 (edta)、二乙烯三胺五乙酸(dtpa)、乙二醇四乙酸(egta)和n,n-双(羧甲基) 甘氨酸(nta),以及此外的柠檬酸盐或草酸盐。根据优选的实施方式,使用edta 作为螯合剂。如本文所用,术语“edta”尤其表示edta化合物的edta部分,例如na2edta、k2edta或k3edta。杂交组合物中螯合剂的合适浓度范围包括例如, 0-0.25m、0.5mm-50mm、0.75mm-10mm和1mm-5mm。螯合剂优选包含在杂交溶液中并借此通过杂交溶液添加。根据一个实施方式,杂交溶液包含的螯合剂浓度选自0-0.5m、1mm-100mm、1.5mm-20mm和2mm-10mm。然而,螯合剂也可以源于样品的处理,取决于处理的样品类型。
80.根据一个实施方式,杂交溶液包含缓冲剂,例如tris或其它生物缓冲剂如 mops、hepes、mes或bis-tris。合适的缓冲剂的例子也是本领域技术人员已知的。
81.杂交溶液的ph值可以位于选自6-9的范围内。杂交溶液还可以包含水或其它适合溶解杂交溶液组分的溶剂。
82.此外,如上所述,可以将水或另一种合适的稀释溶液分别加入到样品中以稀释样品,并且为(经稀释的)含核酸样品调节到一定体积,然后将其与一定体积的杂交溶液进行混合。这种稀释也稀释了杂交溶液,从而有助于在杂交组合物中建立杂交条件。如本文所述,相应的稀释具有的优点在于,杂交溶液可以以浓缩形式提供。此外,可以用相同量的杂交溶液容易地处理不同样品体积。为了提供杂交组合物,可以用稀释溶液例如水将特定的样品体积填充至特定体积,然后将与例如等量(或其它预定)体积的杂交溶液进行混合。还可以根据杂交溶液的组成采用其它比例的样品/稀释样品用于杂交。
83.根据一个实施方式,所述杂交溶液不包含离液离子(chaotropic ions)。
84.在根据本发明的方法中使用的杂交条件基于钠盐和季铵盐的平衡组合,其导致多
聚(a)核酸的有效分离,同时防止非多聚(a)残基的残留。因此,除了钠盐和季铵盐以外,杂交溶液和各自杂交组合物都不包含具有将会抵消这些有利效果的浓度的其它杂交促进盐。因此,根据实施方式,杂交溶液和/或杂交组合物不含有具有将抵消通过钠盐和季铵盐的组合获得的有益效果的浓度的杂交促进盐,例如氯化锂或氯化钾或其它非卤化钠,mgcl2和/或离液盐。在实施方式中,所述盐(如果存在的话)的浓度在所述杂交组合物和/或杂交溶液中为 100mm或更小,75mm或更小,50mm或更小或25mm或更小。优选地,所述杂交溶液除了钠盐和季铵盐之外不含任何杂交促进盐。
85.杂交组合物和杂交溶液的,特别是关于含有的钠盐(优选氯化钠)和季铵盐 (优选四烷基铵盐)的,非限制性优选实施方式描述如下。如上所述,当描述杂交组合物中杂交溶液的组分浓度时,由捕获探针和用于辅助分离的装置,特别是固体支持物(如果用于辅助捕获和分离),所贡献的体积在确定杂交组合物中所述组分的浓度时不考虑。此外,如上所述,杂交溶液的组分可以作为单一溶液添加到样品中,或者可以以任何顺序单独添加到样品中,例如,使用两种或两种以上包含至少一种杂交溶液的化学品的溶液以产生杂交溶液。
86.根据一个实施方式,所述杂交组合物包含浓度≤250mm的杂交溶液的钠盐和作为季铵盐的四烷基铵盐。为了确保有效的结合,该浓度应当≥25mm,优选≥35mm,更优选≥50mm。为了提供各自的杂交组合物,可以使用杂交溶液,其包含浓度≤500mm的钠盐和作为季铵盐的四烷基铵盐。根据一个实施方式,所述杂交溶液包含的钠盐浓度≥50mm、优选≥75mm、更优选≥100mm。
87.根据一个实施方式,所述杂交组合物包含杂交溶液的钠盐,浓度选自 25mm-175mm、50mm-150mm、55mm-125mm、60mm-115mm和60mm-100mm,以及作为季铵盐的四烷基铵盐,其浓度选自0.25m-1.25m、0.375m-1m和0.375m-0.75m盐。为了提供相应的杂交组合物,可以使用杂交溶液,其包含的钠盐浓度选自 50mm-350mm、100mm-300mm、115mm-250mm、120mm-225mm和125mm-200mm,以及四烷基铵盐和作为季铵盐,其浓度选自0.5m-2.5m,0.75m-2m和0.75m-1.5m。
88.根据一个实施方式,所述杂交组合物包含杂交溶液的钠盐,浓度选自 37.5mm-125mm、50mm-100mm和55mm-87.5mm以及60mm-100mm,以及作为季铵盐的四烷基铵盐,其浓度选自0.25m-1.25m,0.375m-1m和0.375m-0.75m,其中钠盐是氯化钠。为了提供相应的杂交组合物,可以使用杂交溶液,其包含氯化钠,浓度选自75mm-250mm、100mm-200mm和125mm-175mm,以及选自下组的四烷基铵盐作为季铵盐:四乙基氯化铵(teac)、四甲基氯化铵(tmac)、四甲基硝酸铵 (tman)、四乙基溴化铵(teab)和四甲基溴化铵(tmab),浓度选自0.5m-2.5m, 0.75m-2m,和0.75m-1.5m。如所述,特别优选使用四乙基溴化铵(teab)。
89.如上所述,在杂交组合物中可以额外包含洗涤剂,并且可以通过杂交溶液引入。细节在上面描述并且参考相应的公开内容。
90.捕获探针
91.所述杂交组合物还包含一(a)能够与多聚(a)核酸的单链多聚(a)延伸段杂交的捕获探针。所述捕获探针可以至少与多聚(a)核酸的单链多聚(a)延伸段部分互补,从而使得多聚(a)核酸经由多聚(a)延伸段(例如尤其是它们的多聚(a) 尾)进行杂交,以捕获探针。通常,捕获探针包含可以与多聚(a)核酸的多聚(a) 延伸段杂交的单链序列。它也可以由这样的序列组成。本文所用的包含“一(a)”捕获探针的杂交组合物还涵盖了其杂交组合物包
含两种或多种不同捕获探针的实施方式。
92.优选地,捕获探针是捕获寡核苷酸。设计捕获寡核苷酸序列以提供与多聚 (a)核酸的多聚(a)延伸段的足够互补性,以允许与对于后续分离程序足够强的对多聚(a)段进行的特异性杂交,其中捕获的多聚(a)核酸与非多聚(a)核酸和其他污染物分离。适合于这种目的的捕获寡核苷酸是本领域公知的,因此不需要任何详细描述。即便如此,随后对一些非限制性实施例进行了描述。
93.所述捕获探针可以包含rna、dna、pna(肽核酸)、lna(锁定核酸)和/或其他类似物或可由其组成。特别地,可以使用核碱基t或u的类似物,只要它们能够与a残基杂交。能够与多聚(a)核酸的多聚(a)延伸段杂交(即,如能够与多聚 (a)核酸进行序列特异性结合)的任何捕获探针均认为是“捕获探针”。如上所述,所述捕获探针优选是捕获寡核苷酸,例如合成寡核苷酸。所述捕获寡核苷酸可以包含能够与多聚(a)延伸段(例如多聚(a)核酸的多聚(a)尾或其一部分) 杂交的多嘧啶序列,从而能够通过杂交而捕获多聚(a)核酸。根据实施方式,捕获寡核苷酸包含至少与多聚(a)链延伸段互补的连续单元延伸段,例如核酸碱基或其类似物,所述捕获寡核苷酸的延伸段优选至少为10个、至少为12个、至少为14个、至少为16个、至少为18个、至少为20个、至少为25个、至少为30 个、至少为35个、至少为40个现有技术中已知的单元长度。所述捕获寡核苷酸中还可以使用至少50个或更多个单位的更长延伸段。优选地,所述捕获寡核苷酸至少在与单链多多聚(a)延伸段互补的区域中。整个寡核苷酸也可以是单链和/或分别与多聚(a)延伸段或者多聚(a)尾互补。根据一个实施方式,捕获区和/或整个捕获寡核苷酸的至少60%、至少70%、至少80%、至少90%、至少 95%或至少100%的所有配对单元(例如碱基)能够与多聚(a)核酸的多聚(a)延伸段的至少一部分杂交。根据一个实施方式,当捕获寡核苷酸与多聚(a)核酸的多聚(a)延伸段杂交时,形成不含任何错配的双链核酸杂交体。
94.根据一个实施方式,所述捕获寡核苷酸是多聚(t)或多聚(u)核酸分子。优选地,使用多聚(dt)核酸分子。术语多聚(dt)核酸特别是指包含dna的核酸分子,所述dna具有超过90%的t残基或包含至少10、至少20、至少25、至少30或至少35个连续t残基。各自的捕获寡核苷酸是公知的并且通常用于捕获多聚(a) 核酸例如多聚(a)rna。根据一个实施方式,使用多聚(dt)核酸作为捕获寡核苷酸用于分离多聚(a)rna,例如特别是多聚(a)mrna,其是具有90%以上核酸碱基t的合成分子。如上所述,也可以使用核酸碱基t或u的类似物,只要它们能够与a残基杂交。这样的捕获寡核苷酸也通常被称为寡聚-dt,并且为本领域所熟知。
95.所述捕获探针可以以游离形式存在于杂交组合物中。然后可以在杂交反应期间或之后将结合了多聚(a)核酸的捕获探针固定到固相。寡核苷酸也可以通过与第二化合物反应的化合物进行标记,转而固定于固体支持物上。或者,所述捕获探针以固定化形式提供,其中所述捕获探针连接于固体支持物。优选地,使用经捕获探针官能化的固体支持物,因此其包含在杂交组合物中。可以使用本领域熟知且标准的技术实现固体与固体支持物的固定。在一些实施方式中,使用连接子结构将寡核苷酸连接到固体支持物上。
96.所述固体支持物可以由多种材料提供,包括但不限于:反应容器、微量滴定板、颗粒、磁性颗粒、纤维素、柱、板、膜、滤纸和试纸条,或任何其它可用于分离技术的固体支持物。可采用任何支持物,只要它能够进行液相分离。不同的固体支持物也用于已知的多聚(a)核酸分离方法中。根据一实施例,所述固体支持物由颗粒提供,通常也被称为珠。所用的
颗粒可以由玻璃、二氧化硅、聚合物、聚苯乙烯-乳胶聚合物、纤维素和/或塑料制成。根据一优选的实施例,所述固体支持物由经过捕获探针官能化的颗粒悬浮液提供。优选采用磁性颗粒。当采用磁性颗粒作为固体支持物时,可以有超顺磁性、顺磁性、亚铁磁性或铁磁性特性。各种磁性颗粒可以容易地借助磁场进行分离,例如通过永磁体,因此相对加工而言具有优势。它们与能够处理磁性颗粒的成熟机器人系统兼容。这里,存在可用于处理结合了捕获探针和多聚(a)核酸杂合体的磁性颗粒的不同机器人系统。根据一个实施方式,在反应容器的底部或侧面收集磁性颗粒,并从反应容器中除去剩余的液体样品,留下所收集的结合于杂交体的磁性颗粒。通过倾析或抽吸可以除去剩余的样品。在替代系统中,通常由盖或封套覆盖的磁体浸入反应容器中以收集磁性颗粒。在另一个可选择的系统中,含有磁性颗粒的所述样品可以被吸入移液管尖端,并且所述磁性颗粒可以通过施加到例如移液管尖端侧面的磁体而收集到移液管尖端中。然后可以从移液管尖端释放剩余的样品,而携带结合于杂交体的所收集磁体颗粒由于移液管尖端中的磁体而得以保留。然后可以进一步处理所收集的磁性颗粒。这样的系统在现有技术中也是众所周知的,并且市售可得(例如biorobot ez1,凯杰公司)。其它处理系统也是已知的并且可以使用。
97.颗粒也可以通过过滤、离心或通过使用旋转柱分离,所述旋转柱可以是,例如,装载有本领域技术人员所熟知的颗粒悬浮液。当对固体支持物进行离心时,其可以沉淀或通过离心过滤装置或柱。
98.在一些实施方式中,所述捕获探针可以是生物素化的或以其它方式标记的,以便于促进分离杂交体。该实施例是例如,适用于采用捕获寡核苷酸时。生物素可以使用例如接头而衍生于探针核苷酸,而不减弱捕获寡核苷酸与多聚 (a)核酸杂交的能力。由于生物素与亲和素/链霉亲和素反应,亲和素或链霉亲和素可与生物素化的捕获寡核苷酸联合使用。所述亲和素或链霉亲和素可以连接于固体支持物,例如颗粒或可以结合生物素化捕获寡核苷酸的容器表面。然后可以将固体支持物与样品的其余部分分离,例如通过从剩余的样品中除去固体支持物,反之亦然,从而分离生物素化的捕获寡核苷酸,所述捕获寡核苷酸本身与多聚(a)核酸杂交。还可以使用本领域技术人员公知的多种不同修饰来标记所述捕获探针以进行分离。非限制性替代方法包括采用表位标签标记所述捕获探针,并利用识别该表位的抗体或其结合片段用于捕获,例如,用地高辛标记寡核苷酸,并使用抗地高辛抗体捕获。此外,半抗原可用与例如核苷酸或寡核苷酸偶联。用于后续捕获的常用半抗原包括生物素(生物素-11-dutp),二硝基苯基(二硝基苯基-11-dutp)。这些修饰包括例如荧光修饰。可包含的市售荧光核苷酸类似物包括但不限于:cy3
tm-dctp、cy3
tm-dutp、cy
tm
5-dctp、荧光素
ꢀ‑
12-dutp、等等。荧光素标记也可以用市售的抗荧光素抗体来作为分离的部分。合适的还有采用放射性同位素进行的标记、酶标记和化学发光标记。
99.此外,在捕获探针本身不与固体支持物连接的情况下,可采用固定在固体支持物上的杂交结合剂来促进已形成的杂交体分离,例如抗杂交结合剂,如抗dna/rna抗体或其结合片段。这样的实施方式,例如在捕获探针与多聚(a)核酸杂交时形成rna/dna杂交体的情况下是合适的。根据上述原理,各种杂合结合剂可以同样地固定在固体支持物上。
100.因此,许多已建立的系统是可获得的,其实现了在捕获探针和多聚(a)核酸之间形成的杂交体最终固定在固体支持物上,而促进了杂交体的分离。如上所述,为了易于处理,
优选使用固体支持物,例如用捕获探针功能化的颗粒。
101.孵育条件
102.将所述杂交组合物在条件下孵育足够长的时间从而使多多聚(a)核酸与捕获探针杂交。如上所述,借此,多聚(a)核酸和捕获探针之间形成了核酸杂交体。在孵育时,可以轻轻晃动或搅拌所述杂交组合物。
103.在实施方式中,在于杂交条件下孵育之前,先将所述杂交组合物在约60℃
ꢀ‑
约90℃、优选约65℃-约75℃的温度下加热。各个加热步骤有助于破坏例如多聚(a)核酸的二级结构,从而使多聚(a)延伸段例如多聚(a)尾易于与所述捕获探针杂交。各加热步骤可以进行小于10分钟、小于7分钟,优选小于5分钟。在实施例中,为了进行杂交,将杂交组合物在50℃或更低、45℃或更低、优选40 ℃或更低、更优选室温下的温度中进行孵育,从而使得多聚(a)rna与所述捕获探针杂交。相应的孵育步骤可以进行至少4分钟,优选进行5分钟至30分钟范围内的时间段。本方法的优点是不需要长时间温育,并且杂交步骤,包括变性步骤(如果进行的话),可以在小于30分钟、甚至小于20分钟内完成。然而,如果需要,也可以使用更长的孵育时间。
104.在步骤(a)完成后,在多聚(a)核酸合所述捕获探针之间形成核酸杂交体。
105.步骤(b)
106.在步骤(b)中,将形成的杂交体与剩余的样品分离。由此,从样品中分离出多聚(a)核酸。剩余的样品则去除了与捕获探针结合的多聚(a)核酸。
107.如上所述,杂交体的分离优选通过使用结合有捕获探针和/或形成的杂交体的固体支持物来辅助。结合有杂交体的固体支持物可以容易地与剩余的样品分离。如上所述,根据所使用的固体支持物,所述固体支持物可以从剩余的样品中除去,或者可以回收剩余的样品并留下结合有杂交体的固体支持物。合适的固体支持物以及能够将固体支持物与剩余样品分离的合适的分离程序是众所周知的,并且也在上文中结合捕获探针进行了描述,并参考本文也适用的相应公开内容。合适的分离方法也是公知的并且对于本领域技术人员是可用的。
108.任选的洗涤步骤(c)
109.在任选的步骤(c)中,将分离的杂交体洗涤一次或多次。即使该洗涤步骤 (c)是任选的,但优选进行(该步骤)以支持除去未结合的组分和杂质,它们可能干扰分离的多聚(a)核酸的某些下游应用。
110.因此,根据优选实施方式,在步骤(c)中进行一个或多个洗涤步骤,从而进一步将分离的多聚(a)核酸进行纯化。这可以方便地进行,例如当杂合体固定在优选由颗粒提供的固体支持物上。可使用普通的洗涤溶液,合适的实施方式是本领域技术人员已知的。合适的洗涤溶液去除了杂质,但基本上不从杂交体中释放出多聚(a)核酸而在洗涤期间出现多聚(a)核酸的丢失。
111.可以采用与使用的杂交溶液相比具有相同或更低浓度钠盐和/或具有相同或更低浓度季铵盐的洗涤溶液作为一种或多种洗涤溶液。如果施用一种以上的洗涤缓冲液,则可以在洗涤步骤之间降低盐浓度。
112.当采用颗粒作为固定捕获探针的固体支持物时,可以通过搅拌将所述颗粒重悬,例如,在洗涤期间形成涡流。
113.任选的释放步骤(d)
114.在任选的释放步骤(d)中,多聚(a)核酸从杂交体中释放。这可以方便地进行,例如当杂合体固定在优选由颗粒提供的固体支持物上。为了实现释放,可以进行一个或多个洗脱步骤以洗脱捕获的多聚(a)核酸。
115.这里,基本上可以使用任何能使多聚(a)核酸从杂交体释放并由此使得所结合的多聚(a)核酸从所述固定支持物上洗脱的释放溶液,这种固体支持物优选用于辅助多聚(a)核酸的分离。能将多聚(a)核酸从互补捕获探针上有效洗脱的各种洗脱溶液是本领域技术人员已知的,因此不需要详细描述。非限制性的例子包括水、洗脱缓冲液,如te-缓冲液和低盐溶液,其盐含量为150mm或更低、 100mm或更低、75mm或更低、50mm或更低、25mm或更低、20mm或更低、15mm或更低、10mm或更低或不含盐。洗脱溶液可以包括,例如,缓冲剂,特别是可以包含生物缓冲液,例如tris、mops、hepes、mes、bis-tris、丙烷等。
116.可以通过加热来帮助洗脱,例如至50℃或更高,优选60℃或更高,更优选 65℃或更高。
117.洗脱也可以通过振荡来进行,尤其在使用颗粒状固体支持物时特别可行。
118.此外,重复洗脱步骤也在本发明的范围内,以确保所捕获的多聚(a)核酸被有效释放。
具体实施方式
119.根据第一方面方法的具体优选实施方式再次如下所述:
120.根据一实施方式,所述方法包括:
121.(a)提供杂交组合物,其包含:
122.i)含有核酸的样品;
123.ii)杂交溶液,其包含:
124.aa.浓度≤500mm的钠盐;
125.bb.作为季铵盐的四烷基铵盐;
126.其中杂交溶液的组分可以作为单一溶液加入到样品中或者可以以任何顺序分别加入到样品中;
127.iii)能够与多聚(a)核酸的多聚(a)延伸段杂交的捕获探针;
128.其中所述杂交组合物含有的杂交溶液钠盐的浓度≤250mm,
129.和将所述杂交组合物在所述多聚(a)核酸和所述捕获探针之间形成核酸杂交体的条件下进行孵育;
130.(b)将形成的杂交体与剩余的样品分离;
131.和优选地,还包括:
132.(c)将分离的杂交体进行洗涤和
133.(d)从所述的杂交体释放多聚(a)核酸。
134.根据一实施方式,所述方法包括:
135.(a)提供杂交组合物,其包含:
136.i)含有核酸的样品;
137.ii)杂交溶液,其包含:
138.aa.钠盐,浓度选自50mm-350mm、75mm-300mm、 100mm-250mm和125mm-200mm;
139.bb.作为季铵盐的四烷基铵盐,浓度选自0.2m-2.5m、 0.5m-2m和0.75m-1.5m;
140.其中,所述杂交溶液的组分可以作为单一溶液加入样品或者可以以任何顺序分别加入样品;
141.iii)能够与多聚(a)核酸的多聚(a)延伸段杂交的捕获探针;
142.其中所述杂交组合物含有的杂交溶液钠盐的浓度选自 25mm-175mm、37.5mm-150mm、50mm-125mm和 62.5mm-100mm;且所述的四烷基铵盐的浓度选自0.1m-1.25m, 0.25m-1m和0.375m-0.75m;
143.和将所述杂交组合物在所述多聚(a)核酸和所述捕获探针之间形成核酸杂交体的条件下进行孵育;
144.(b)将形成的杂交体与剩余的样品分离;
145.和优选地,还包括:
146.(c)将分离的杂交体进行洗涤和
147.(d)从所述的杂交体释放多聚(a)核酸。
148.根据一实施方式,所述方法用于将多聚(a)rna从总rna样品中分离,包括:
149.(a)提供杂交组合物,其包含:
150.i)含有核酸的样品;
151.ii)杂交溶液,其包含:
152.aa.作为钠盐的氯化钠,浓度选自75mm-250mm、 100mm-200mm、和125mm-175mm;
153.bb.作为季铵盐的选自下组的四烷基铵盐:四乙基氯化铵 (teac)、四甲基氯化铵(tmac)、四甲基硝酸铵(tman)、四乙基溴化铵(teab)和四甲基溴化铵(tmab),浓度选自 0.25m-2.5m、0.5m-2m和0.75m-1.5m;
154.其中,所述杂交溶液的组分可以作为单一溶液加入样品或者可以以任何顺序分别加入样品;
155.iii)能够与多聚(a)核酸的多聚(a)延伸段杂交的捕获探针,其中所述捕获探针固定于固体支持物上,优选由颗粒提供固体支持物;
156.其中所述杂交组合物含有的杂交溶液钠盐的浓度选自 37.5mm-125mm、50mm-100mm和62.5mm-87.5mm以及 62.5mm-100mm;且所述的四烷基铵盐的浓度选自0.125m-1.25m、0.5m-1m和0.375m-0.75m,
157.和将所述杂交组合物在所述多聚(a)核酸和所述捕获探针之间形成核酸杂交体的条件下进行孵育;
158.(b)将形成的结合于固体支持物的杂交体与剩余的样品分离;
159.和优选地,还包括:
160.(c)将分离的杂交体进行洗涤和
161.(d)从所述的杂交体释放多聚(a)核酸。
162.根据第一方面的方法的应用和用途
163.根据第一方面的方法能有效地从多种样品中分离多聚(a)核酸,而将非多聚(a)核酸在分离的多聚(a)核酸中的残留最小化。
164.如本文所用,术语“核酸”或“多个核酸”,具体指的是一种多聚物,其包括尤其是通
过亚单位之间的磷酸二酯键(有些情况下是硫代磷酸、甲基膦酸酯等等)共价键合的核糖核酸和/或脱氧核糖核酸。所述术语涵盖了天然存在的核酸以及合成核酸。
165.如上所述,术语“多聚(a)核酸”及其相应的术语具体指的是含有连续腺嘌呤碱基(“a”)残基的单链多聚(a)延伸段。这种多聚(a)延伸段通常提供在核酸的3'末端,于是也被称为多聚(a)尾。术语“多聚(a)核酸”特别包括在其3'末端含有多聚(a)尾的任何核酸种类,特别是具有至少10个、至少15个或至少20个a残基的含多聚(a)尾序列。术语多聚(a)核酸是指的是多聚(a)rna以及多聚(a)dna。如本文所述,所述多聚(a)核酸优选是多聚(a)rna,尤其是多聚 (a)mrna。多聚(a)rna是研究和诊断应用中感兴趣的主要聚腺苷酸化核酸。
166.由于采用了有利的杂交条件,非多聚(a)核酸基本上不为本发明的方法所捕获。非多聚(a)核酸,即不具有单链多聚(a)延伸段(如多聚(a)尾)的核酸,其不会被捕获并借此在本发明分离过程中被有效地去除,包括例如非聚腺苷酸化的rna,如rrna、trna、snrna、snorna以及缺少多聚(a)的mrna的未成熟部分。术语非多聚(a)核酸还可以指其他非聚腺苷酸化的核酸,例如非聚腺苷酸化的dna(如果存在于样品中)。
167.术语“含核酸的样品”在本文中以广义使用,并且意欲包括含有核酸的多种来源和组合物。含有核酸的样品可以衍生自生物样品,但是该术语还包括其它的,例如包含多聚(a)核酸(如在体外提供自多聚(a)尾的核酸)的人工样本。特别是指含有从生物样品(例如使用本发明方法分离出多聚(a)核酸的总 rna)中分离的纯化核酸的组合物。然而,所述含有核酸的样品也可以由生物样品、特别是生物样品的裂解物提供。如本领域技术人员所知,可以从样品裂解物中分离多聚(a)核酸,例如多聚(a)rna。
168.示例性的生物样品包括但不限于:细胞样品、环境样品,从身体获得的样品,特别是体液样品,以及人、动物或植物组织样品。非限制性实例包括但不限于:细胞、全血、血液制品、红细胞、白细胞、血沉棕黄层、血浆、血清、拭子、尿、痰、唾液、精液、淋巴液、羊水、脑脊液、腹膜腔积液、胸腔积液、活检样品、囊肿液、滑液、玻璃体液、房水、粘液囊、洗眼液、眼部抽吸液、血浆、血清、肺灌洗液、肺吸出液、动物(尤其是人)或植物组织、包括但不限于肝、脾、肾、肺、肠、脑、心脏、肌肉、胰腺、细胞培养物以及裂解物、提取物或从上述样品获得的材料和部分。优选地,所述样品来源于人、动物或植物的生物样品。所述样品可以选自下组:细胞、组织、肿瘤细胞和体液、例如血液、血液制品例如血沉棕黄层、血浆和血清,尿、体液、痰、粪便、csf 和精子、上皮拭子、活检、骨髓样品和组织样品,优选器官组织样品。术语“样品”还包括经处理的样品,例如经保存的、固定的和/或稳定的样品。如上所述,包含在所述杂交组合物中的含核酸样品优选由从相应样品中纯化的核酸提供,例如总rna。然而,所述含核酸的样品也可以是包含了释放形式的多聚(a)核酸的粗制样品,并且可以由通过相应生物样品获得的裂解物提供。
169.根据优选的实施方式,所述含有核酸的样品是纯化的核酸样品。优选地,所述含有核酸的样品是总rna,并且使用本发明的方法从所述总rna中分离出多聚(a)rna。总rna可以从各种样品中分离,例如使用任何常见的rna纯化方法。合适的方法在现有技术中是公知的,因此,这里不需要详细描述。合适的方法包括但不限于:使用基于酚/氯仿的方法分离rna,使用离液剂、醇和固相(例如特别是含硅固相(例如二氧化硅,玻璃纤维,碳化硅))分离rna、醇沉淀、通过其它有机溶剂、聚合物或阳离子去污剂等进行沉淀。
170.根据一实施方式,分离多聚(a)核酸,优选多聚(a)rna的含核酸样品是加工的生物
样品,例如裂解样品。可以采用与多聚(a)核酸分离相容的任何合适的裂解方法来裂解所述样品。用于裂解生物样品的各种方法是本领域技术人员已知的,并且还取决于待处理的具体样品类型。裂解可以例如,基于或包括化学或机械裂解程序,非限制性的例子包括涉及裂解剂的裂解方法,例如:洗涤剂、蛋白水解酶或离液盐、加热、超声波、机械破碎等。根据一实施方式,采用去除了dna的裂解物作为含有核酸的样品。可以从所述裂解物中除去dna,例如通过进行dnase消化或通过选择性分离并借此从裂解物中去除dna。用于选择性结合并借此去除dna的合适方法如描述于ep 0880537和wo 95/21849中,其通过引用并入本文。例如,如果在不存在短链醇(如乙醇或异丙醇)的情况下,则使用离液剂如离液盐裂解所述样品,可以建立对dna具有选择性的结合条件,尤其是如果使用含硅固相。如果需要,可以进一步使用结合的dna(如经进一步处理的,如经测序的),因此可以例如任选地从核酸结合固相洗涤和洗脱,从而提供基本上不含rna的dna部分。然而,如果感兴趣的不是dna,即如果感兴趣的只有rna,也可以简单地丢弃所结合的dna。此外,可以在从其中分离多聚(a)rna之前清除含有rna的裂解物,以除去如细胞碎片和其他污染物。
171.本发明的方法特别适用于从真核生物样品中分离多聚(a)rna。该方法有效地去除了大量的rrna,如28s rrna、18s rrna、5.8s rrna、5s rrna、线粒体12s rrna和线粒体16s rrna。如所描述的,特别是对于下一代测序应用,这种不需要的rna的有效去除是必要的,否则将浪费了宝贵的测序能力。
172.在使用根据本发明的方法的实验中,去除了99%以上的非多聚(a)rna 如5s rrna、5.8s rrna和28s rrna。因此,根据一个实施方式,非多聚(a)rna 在分离的多聚(a)rna中的量为≤3%、≤2%、≤1.5%、优选≤1%、≤0.75%、≤0.5%、≤0.25%、≤0.15%、≤0.1%、≤0.05%。如上所述,尤其待去除的非多聚(a)rna是rrna。需要有效去除的典型rrna是5s rrna、5.8s rrna、 18s rrna和28s rrna。此外,12mt和16mt rrna也可以用本发明的方法有效地去除。
173.所述方法可用于任何目的的多聚(a)核酸的制备,其常规需要分离多聚 (a)核酸,特别是如多聚(a)rna。非限制性例子包括但不限于从总rna或直接从生物样品例如细胞和组织的裂解物中分离多聚(a)rna,用于cdna合成、 cdna文库构建,基于如反向转录pcr的方法的扩增、消减杂交、多聚腺苷酸化的体外转录物、寡核苷酸或其他核酸的直接分离、体外翻译、sage技术、表达分析、表达阵列和表达芯片分析、微阵列分析、核糖核酸酶和s1核酸酶保护、引物延伸、rna northern、点和狭缝印迹、微注射,此外,用于测序应用,例如,特别是ngs应用。也可以利用它以便在多聚(a)核酸是不需要且应当从样品中去除的情况下从样品中选择性地除去多聚(a)核酸。在这种情况下,即可以淘汰为了进一步纯化分离多聚(a)核酸的洗涤和洗脱步骤。然而,也可能感兴趣的是分析从非多聚(a)核酸分开的经分离和去除的多聚(a)核酸,因此在这种情况下可将它们洗涤和洗脱出来。
174.本发明的方法是特别有利的,因为其是高度有效的,从而借助分离过程而使多聚(a)核酸的损失最小化,对多聚(a)核酸具有高度选择性,从而减少不需要的非多聚(a)核酸在分离的多聚(a)核酸部分中的残留,此外,所需的处置时间最少。在一个分离循环后可以实现有利的结果,其相对于现有技术方法而言是相当大的优点,现有技术经常需要至少两个富集循环以提供足够纯的多聚 (a)核酸。因此,该方法非常适合于在高通量应用中同时处理多个样品。
175.如上所述,根据本发明的方法特别适用于制备下一代测序(ngs)应用(如转录组测序)的多聚(a)rna。对于这样的应用,在分离过程期间有效地捕获多聚(a)rna并从感兴趣的多聚(a)rna中除去非多聚(a)rna(如大量的rrna)是非常重要的,因为非感兴趣rna(如rrna)减少的越多,从一个测序运行中可以获得的信息就越多。本发明提供了这种方法,因此对本领域作出了重要贡献。为此目的,优选采用纯化的总rna作为含有核酸的样品材料。在分离过程之后获得的富含多聚(a)rna的洗脱液可用于构建测序文库。还将结合第二方面的方法对该实施例进一步详细地解释,并且参考相应的公开内容。
176.对多聚(a)核酸进行测序的方法
177.根据第二方面,提供了对多聚(a)核酸、优选多聚(a)rna进行测序的方法,其包括:
178.(a)使用根据第一方面的方法从含有核酸的样品中分离多聚(a)核酸;
179.(b)对分离的多聚(a)核酸分子进行测序。
180.在步骤(a)中,进行根据第一方面的方法以从样品中分离多聚(a)核酸。所述方法和相关优点的细节如上所述,并且我们也参考在此适用的相应公开内容。优选地,分离多聚(a)rna作为多聚(a)核酸。优选根据第一方面的方法步骤(a)和(b)从总rna样品中分离多聚(a)rna,并根据第一方面的上述方法的步骤(c)和(d)进行洗涤和洗脱。
181.然后将纯化的多聚(a)核酸在步骤(b)中进行测序。根据一个实施方式,所述测序包括从分离的多聚(a)核酸中制备测序文库。优选地,所述测序文库适用于大规模并行测序,测序包括对包含在文库中的分子进行并行测序。各个测序文库是本领域已知的。测序文库可以包含多个双链分子,并且优选适合大规模并行测序,因此适用于下一代测序。相应测序文库的制备也是转录组测序中的现行标准。存在于测序文库中的多个双链核酸分子可以是线性或环状的,优选地,所述测序文库中包含的核酸分子是线性的。适合于下一代测序的测序文库可以使用现有技术中已知的方法进行制备。优选地,测序文库中的所述双链分子是dna分子。为了这个目的,在多聚(a)核酸是多聚(a)rna的情况下,可以将多聚(a)rna逆转录成cdna。通常,用于制备适合于下一代测序的测序文库的方法包括获得dna片段、随后任选地进行dna修复和末端精加工,以及最后,通常是ngs平台特异性衔接子连接。根据一实施方式,所获得的cdna可以例如通过剪切(例如超声,水力剪切,超声,雾化或酶促断裂)进行片段化,从而提供适用于后续测序的dna片段。然而,在rna水平上可能发生到所需长度的片段化,因此是在cdna合成之前。例如,可以通过rna的镁催化水解将分离的多聚(a)rna片段化。可以基于后续用于测序的下一代测序平台的测序能力来选择片段的长度。通常,获得的片段具有1500bp或更小、1000bp或更小、 750bp或更小、600bp或更小、优选500bp或更小的长度,因为这对应于大多数当前下一代测序平台的测序能力。片段化的dna可以使用现有技术中已知的方法再进行修复和末端精加工,从而提供如平端或核苷酸突出端,例如a突出端。
182.此外,衔接子可以连接在dna片段的5'和/或3'末端,优选在所获得的片段的两端。衔接子的具体设计取决于待使用的下一代测序平台以及本发明的目的,基本上可以使用用于制备下一代测序文库的任何衔接子。因此,测序文库可以包含或由随机片段化的双链dna分子组成,所述双链dna分子在其3'和5' 末端与衔接子序列相连。衔接子提供了已知的序列,从而提供了用于扩增和/ 或测序引物的已知模板。作为衔接子,可以采用已知序列的双链或部分双链核酸。衔接子可以具有平端、3'或5'突出端的粘性末端,可以由y形衔接子或
茎环形衔接子提供(参见us 2009/0298075)。y形衔接子如(见us 7,741,463)所述。任选地,所述衔接子还可以提供单独的指标,从而能测序之前对两个或多个测序文库进行后续汇集。如所讨论的,测序优选在下一代测序平台上进行。在ngs中,测序通常通过聚合酶介导的核苷酸延伸的重复循环而进行,或者以一种常见形式即通过寡核苷酸连接的迭代循环进行。在使用本发明的方法获得测序文库后,通过体外模板制备反应如乳剂pcr(来自roche 454的焦磷酸测序、来自ion torrent的半导体测序、来自生命技术有限公司-life technologies的经连接的solid测序、来自智能生物系统-intelligent biosystem的经合成的测序)、流动细胞的桥式扩增(例如solexa/illumina)、通过wildfile技术的等温扩增(生命技术有限公司)或通过滚环扩增产生的圆形克隆(rolonies)/纳米球(完整基因组,智能生物系统-complete genomics,intelligent biosystems,polonator)进行单个分子的克隆分离以及后续的扩增。诸如heliscope(helicos)、smrt技术(太平洋生物科学-pacific biosciences)或纳米孔测序(牛津纳米孔-oxfordnanopore)的测序技术能对单个分子进行直接测序而无需先前的克隆扩增。可以使用从分离的多聚(a)rna制备的测序文库在任何相应的平台上进行测序。用于制备测序文库和下一代测序方法的合适方法如metzker,2011,voelkerding, 2009和wo12/003374中所述。
183.采用第一方面的方法制备多聚(a)核酸(如优选步骤(a)中多聚(a)rna)以及相应测序结果的优点如上所述,并且参考相应的公开内容。
184.杂交溶液和试剂盒
185.根据第三方面,提供了一种水性杂交溶液,其包含:
186.aa.浓度≤500mm的钠盐;
187.bb.季铵盐。
188.根据第三方面的杂交溶液可以结合并执行本发明的第一、第二和第四方面的方法,其尤其可以用于建立用于捕获多聚(a)核酸的有利结合条件,或其可以用于提供有助于去除在捕获步骤期间可能已经结合的非多聚(a)核酸的严格洗涤条件,例如没有使用根据本发明的有利杂交条件(即其中联合使用了低浓度的钠盐和季铵盐(如优选四烷基铵盐))。
189.上面结合本发明第一方面的方法详细描述了关于杂交溶液,特别是合适且优选的杂交溶液组分和杂交溶液组分浓度以及与样品(或稀释的样品)的合适且优选的混合比例。参考上面的公开内容,其也在这里适用。随后,将再次对非限制性所选实施例进行简要的描述。
190.所述杂交溶液可以包含的钠盐浓度≤500mm。钠盐优选为卤化钠,更优选为氯化钠。所述杂交溶液可以包含的钠盐浓度选自以下范围:50mm-500mm、 75mm-400mm、85mm-350mm、100mm-300mm、115mm-250mm、120mm
ꢀ‑
225mm和125mm-200mm。根据一实施方式,所述杂交溶液包含的钠盐浓度选自125mm-175mm的范围内。如实施例所证,当与等体积的样品(或稀释的样品)接触时,这种杂交溶液提供了特别好的结果。
191.所述杂交溶液可以包含的季铵盐浓度≤6m、≤5m、≤4m或≤3m。杂交溶液可以包含的季铵盐浓度≥200mm、≥250mm、≥500mm或≥750mm。优选地,所述杂交溶液包含的季铵盐浓度选自0.2m-3.5m、0.25m-3m、0.5m-2.5m、 0.75m-2m和0.75m-1.5m。所述季铵盐优选是四烷基铵盐,如四甲基铵盐(tma) 或四乙基铵盐(tea)。合适的四烷基铵盐包括但不限于:四乙基氯化铵 (teac)、四甲基氯化铵(tmac)、四乙基硝酸铵(tean)、四甲基硝酸铵(tman)、四
乙基溴化铵(teab)和四甲基溴化铵(tmab)。根据一实施方式,所述季铵盐不是四甲基硫酸铵。优选地,所述杂交溶液包含四甲基溴化铵作为季铵盐。
192.根据一实施方式,所述杂交溶液包含一种或多种选自下组的化合物:洗涤剂、螯合剂和缓冲剂。以上结合第一方面对细节进行了描述,并且参考上述公开内容。根据一实施方式,所述杂交溶液不包含离液离子。
193.如上所述,本发明方法中使用的杂交条件基于钠盐和季铵盐的平衡组合,其导致了多聚(a)核酸的有效分离,同时防止了非多聚(a)核酸的残留。因此,除了钠盐和季铵盐以外,杂交溶液不包含将会抵消这些有益效果的浓度的其它杂交促进盐。因此,根据实施方式,杂交溶液不包含杂交促进盐,例如将抵消通过钠盐和季铵盐组合所获得的有益效果的浓度的氯化锂或氯化钾或其它非卤化钠、mgcl2和/或离液盐。在实施方式中,如果存在于杂交溶液中,这些盐的浓度为100mm或更低,75mm或更低,50mm或更低或25mm或更低。优选地,所述杂交溶液除了钠盐和季铵盐之外不含任何杂交促进盐。
194.根据一个实施方式,所述杂交溶液包含浓度≤500mm的钠盐和作为季铵盐的四烷基铵盐。所述杂交溶液可以包含浓度≥50mm,≥75mm或≥100mm的钠盐。所述杂交溶液可包含例如钠盐,其浓度选自50mm-350mm、 100mm-300mm、115mm-250mm、120mm-225mm和125mm-200mm,和作为季铵盐的四烷基铵盐,其浓度选自从0.5m-2.5m、0.75m-2m和0.75m-1.5mg。例如,所述杂交溶液可以包含氯化钠,其浓度选自75mm-250mm、100mm-200mm 和125mm-175mm,和选自四乙基氯化铵(teac)、四甲基氯化铵(tmac)、四乙基氯化铵、四甲基硝酸铵(tman)、四乙基溴化铵(teab)和四甲基溴化铵(tmab)的四烷基铵盐作为季铵盐,浓度选自0.5m-2.5m、0.75m-2m 和0.75m-1.5m。如上所述,特别优选使用四乙基溴化铵(teab)。
195.根据第三方面的杂交溶液可以结合根据第一方面的方法有利地用于上述杂交组合物的制备。参考上面的公开内容,其也在这里适用。此外,其可用于建立严格的洗涤条件,详述如下。
196.根据第四方面,提供了用于从样品中分离多聚(a)核酸的试剂盒,包括:
197.(a)第三方面所述的杂交溶液;
198.(b)能够与所述多聚(a)核酸的多聚(a)延伸段杂交的捕获探针。
199.根据第三方面的杂交溶液如上所述,并且参考上述的公开内容。关于捕获探针的细节和优选实施方式也结合第一方面的方法进行了描述,并且参考公开内容同样适用于此。如上所述,所述捕获探针可以是捕获寡核苷酸,例如优选合成的含寡聚(t)或寡聚(u)的核酸分子或其混合物,或任何其它合适的或可固定于固体支持物的捕获探针。对合适且优选的所述固体支持物的实施方式也结合第一方面的方法进行了描述,并且参考上文公开的内容同样适用于此。如上所述,根据一个实施方式,所述捕获探针结合非磁性或磁性颗粒。
200.所述试剂盒特别适合第一方面所述的方法。此外,所述试剂盒可以含有使用说明书和/或信息。例如,所示试剂盒可以含有说明书和/或信息,其关于采用一定体积的杂交溶液与一定体积的含核酸样品和/或稀释溶液(如水),从而在所述杂交溶液中达到钠盐和季铵盐的有效浓度。根据所用的体积/比例,可在杂交溶液中使用不同的盐浓度。
201.洗涤含多聚(a)核酸杂交体的方法
202.本发明人还发现,采用低浓度钠盐与季铵盐组合的有利杂交条件不仅为多聚(a)核酸提供了高度严格和选择性的捕获条件,还提供了高度严格的洗涤条件。因此,这些杂交
条件可有利地用于在洗涤步骤期间去除非多聚(a)核酸。
203.因此,根据第五方面,提供了从含有核酸的样品中分离具有单链多聚(a) 延伸段的多聚(a)核酸的方法,包括:
204.(a)将多聚(a)核酸与能够与所述多聚(a)核酸的多聚(a)延伸段杂交的捕获探针进行杂交,从而在所述多聚(a)核酸和所述捕获探针之间形成核酸杂交物;
205.(b)将形成的杂交体与剩余的样品分离;
206.(c)采用第三方面的杂交溶液洗涤分离的杂交体,其中所述杂交溶液的组分可以作为单一溶液加入杂交体,或者可以以任何顺序分别加入杂交体以产生用于洗涤的杂交溶液;
207.(d)从经洗涤的杂交体中释放多聚(a)核酸。
208.在步骤(a)中,将多聚(a)核酸与能够与多聚(a)核酸的多聚(a)延伸段杂交的捕获探针杂交,从而形成核酸杂交体。如上所述,可以使用包含与多聚(a) 尾互补的捕获寡核苷酸。在第五方面的方法中,可以使用任何方法及其杂交条件来提供相应的杂交体。因此,也可以使用现有技术的方法。然而,优选上述杂交条件与第一方面的方法的结合也在第五方面方法的步骤(a)中使用。关于多聚(a)核酸和捕获探针的细节结合本发明的第一方面进行描述。相应的公开内容在这里也适用。
209.在步骤(b)中,将形成的杂交体与剩余的样品分离。这里,可以使用任何常见的分离技术。以上结合了第一方面方法的步骤(b)对示例性实施例进行了描述。这里引用同样的公开内容。
210.在步骤(c)中,采用第三方面的杂交溶液洗涤分离的杂交体。相应杂交溶液的细节和优选实施方式如上所述,并且参考相应公开内容且适用于此。所述杂交溶液的组分可以是加入用于洗涤的单一溶液(优选),或者可以以任何顺序单独加入到杂交体中以产生用于洗涤的杂交溶液。所述杂交溶液也可以采用合适的稀释溶液稀释,例如水或优选的其它溶剂。对于杂交溶液:稀释溶液的比例,可以使用与上述第一方面方法中相同的杂交溶液:样品(或稀释样品) 的比例。根据一个实施方式,杂交条件在洗涤期间建立,并因此使用在包含杂交溶液和杂交体的洗涤组合物中,其对应于第一方面方法的杂交组合物的上述杂交条件。参考相应的公开内容,其也适用于此。非限制性实施方式如下文所需:
211.随后,公开了适合于形成这些洗涤条件的洗涤组合物和杂交溶液的合适且优选的实施方式。由于加入了杂交溶液和任选的稀释溶液,洗涤组合物得以形成。
212.当描述和限定洗涤组合物中“杂交溶液”的组分浓度时,在确定洗涤组合物中后续描述的组分浓度时,不考虑捕获探针和固体支持物贡献的体积。根据一个实施方式,所述杂交溶液包含了浓缩形式的组分,其能够采用稀释溶液进行稀释,以便在用于洗涤杂交体的洗涤组合物中达到适当的最终浓度。
213.用于洗涤及洗涤组合物的所述杂交溶液包含一钠盐。这还包括使用不同钠盐的混合物作为“一”钠盐。所述钠盐促进多聚(a)核酸与捕获探针的结合,从而降低了洗涤过程中多聚(a)核酸丢失的风险。它可以是无机或有机钠盐。根据一个实施方式,所述钠盐是卤化钠。根据一个实施方式,钠盐不是离液盐。优选地,所述卤化钠是氯化钠。
214.关于需要降低的非多聚(a)核酸污染物,经发现,降低洗涤组合物中钠盐的浓度是有益的。因此,根据一个实施方式,所述洗涤组合物包含的杂交溶液的钠盐浓度≤250mm。所
述洗涤组合物包含杂交溶液的钠盐浓度选自 25mm-250mm、35mm-200mm、40mm-175mm、50mm-150mm、55mm-125mm、 60mm-115mm和60mm至100mm。
215.根据优选的实施方式,所述洗涤组合物包含杂交溶液的钠盐浓度为≤200mm、≤175mm、≤150mm、≤125mm或≤100mm。所述洗涤组合物中钠盐的这种较低浓度是优选的,因为它们为多聚(a)核酸与捕获探针特异性杂交提供了的严格条件,而非特异性杂交的非多聚(a)核酸则被洗去。
216.所述杂交溶液及其洗涤组合物包含一季铵盐。这还包括使用不同季铵盐的混合物作为“一”季铵盐。根据一个实施方式,所述季铵盐是四烷基铵盐。所述四烷基铵盐可以是四甲基铵盐(tma)或四乙基铵盐(tea)。合适的四烷基铵盐包括但不限于:四乙基氯化铵(teac),四甲基氯化铵(tmac),四乙基硝酸铵(tean),四甲基硝酸铵(tman),四乙基溴化铵(teab) 和四甲基溴化铵(tmab)。根据一个实施方式,所述季铵盐不是四甲基硫酸铵。优选地,采用四甲基溴化铵作为季铵盐。
217.根据一个实施方式,所述洗涤组合物包含杂交溶液的季铵盐浓度≤3m、≤2.5m、≤2m或≤1.5m。所述洗涤组合物可包含杂交溶液中的季铵盐浓度≥ 100mm、≥125mm、≥250mm或≥375mm。优选地,所述洗涤组合物包含的季铵盐浓度选自0.1m-1.75m、0.125m-1.5m、0.25m-1.25m、0.375m-1m和 0.375m-0.75m。如上所述,所述季铵盐优选是四烷基铵盐,并且合适的实例如上所述。
218.根据一个实施方式,用于在洗涤组合物中建立条件的杂交溶液包含的季铵盐浓度≤6m、≤5m、≤4m或≤3m。所述杂交溶液可包含季铵盐浓度≥ 200mm、≥250mm、≥500mm或≥750mm。其可以包含的季铵盐浓度选自 0.2m-3.5m、0.25m-3m、0.5m-2.5m、0.75m-2m和0.75m-1.5m。
219.本领域技术人员可以根据本文提供的教导确定钠盐和季铵盐的合适浓度。
220.所述洗涤组合物、特别是关于所含钠盐(优选为氯化钠)和季铵盐(优选为四烷基铵盐)的非限制性优选实施方式如下文所述。如上所述,当描述洗涤组合物中杂交溶液的组分浓度时,为了确定所述洗涤组合物的所述组分浓度,不考虑由捕获探针和用于辅助分离的装置(如固体支持物(如果用于辅助捕获和分离)))所贡献的体积。此外,如上所述,所述杂交溶液的组分可以作为单一溶液加入到样品中,或者可以以任何顺序单独加入到分离的杂交体中,例如,使用两种或多种含有至少一种杂交溶液化学品的溶液以产生用于洗涤的杂交溶液。
221.根据一个实施方式,所述洗涤组合物包含杂交溶液的钠盐,浓度≤ 250mm,和作为季铵盐的四烷基铵盐。根据一个实施方式,所述洗涤组合物包含杂交溶液中的钠盐,浓度选自25mm-175mm、50mm-150mm、55mm-125mm、 60mm-115mm和60mm-100mm,和作为季铵盐的四烷基铵盐,其浓度选自 0.25m-1.25m、0.375m-1m和0.375m-0.75m。
222.根据一个实施方式,所述洗涤组合物包含杂交溶液中的钠盐,其浓度选自37.5mm-125mm、50mm-100mm和55mm-87.5mm和60mm-100mm,和作为季铵盐的四烷基铵盐,其浓度选自0.25m-1.25m、0.375m-1m和0.375m-0.75m,其中所述钠盐是氯化钠。
223.如上所述,也可用于严格洗涤条件的本发明杂交条件基于钠盐和季铵盐的平衡组合,其导致了多聚(a)核酸的有效分离,同时防止非多聚(a)核酸的残留。因此,除了钠盐和季铵盐以外,所述杂交溶液及其洗涤组合物不包含将抵消这些有益效果的浓度的其它杂交
促进盐。因此,根据实施方式,所述杂交溶液和/或洗涤组合物不含有杂交促进盐,例如将抵消通过钠盐和季铵盐的组合获得的有益效果的浓度的氯化锂或氯化钾或其它非卤化钠、mgcl2和/或离液盐。在实施方式中,这些盐(如果存在的话)的浓度为100mm或更低、75mm或更低、50mm或更低或25mm或更低。优选地,所述杂交溶液除了钠盐和季铵盐之外不含任何杂交促进盐。
224.在步骤(d)中,多聚(a)核酸从经洗涤的杂交体中释放。上面已经结合第一方面的方法描述了关于释放步骤(d)的细节。参考上面的公开内容,其也适用于此。
225.多聚(a)核酸分离程序中至少一个洗涤步骤中使用本公开的洗涤条件具有以下优点:在杂交步骤(a)中结合的非多聚(a)核酸(例如未使用本发明的杂交条件)可随后被洗去。此外,可以进行一个或多个额外的洗涤步骤。这也是优选的,以便提高多聚(a)核酸的纯度并去除可能潜在干扰下游应用的杂交溶液组分。
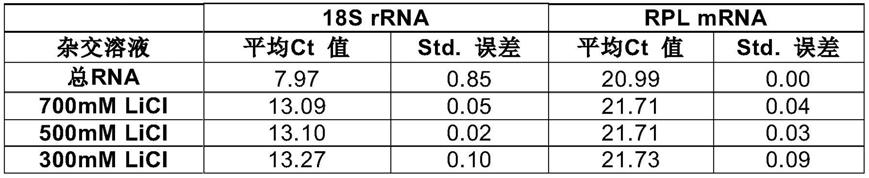
226.如上所述,所述多聚(a)核酸优选是多聚(a)rna。参考结合第一方面的方法进行的上述公开,也适用于此。
227.本发明不受本文公开的示例性方法和材料限制,并且与本文所述的那些类似或等同的任何方法和材料可以用于本发明实施例的实践或测试。数字范围包括定义范围内的数字。本文提供的标题不是对本发明的各个方面或实施例的限制,其可以通过参考整个说明书来读取。
228.如在本说明书和权利要求书中所用,除非上下文另行清楚说明,单数形式“一”,“一个”和“该”包括复数方面。因此,例如,提及“一钠盐”包括单一类型的钠盐,以及两种或多种的钠盐。同样,提及一“季铵盐”、一“捕获探针”、“洗涤剂”、一“缓冲剂”等,包括单一个体和两个或多个这样的个体的组合。提及“本公开”和“本发明”等,包括本文教导的单个或多个方面;等等。本文教导的方面包含在了术语“发明”中。
229.本文所用的术语“溶液”特别是指液体组合物,优选水性组合物。它可以是仅有单相的均质混合物,但是所述溶液包含固体组分,例如沉淀,也在本发明的范围内。
230.根据一个实施方式,本文描述的主题,在方法的情况下包括某些步骤,或在组合物、溶液和/或缓冲剂的情况下包含某些成分,指的是由相应步骤或成分组成的主题。优选地,将本文所述的优选实施例进行选择和组合,而从优选实施例的相应组合所产生的具体主题也属于本公开。
231.实施例
232.实施例仅用于说明目的而不应被解读为对本发明进行的任何形式的限制
233.材料和方法
234.多聚(a)核酸的分离
235.本实验中,采用分离自jurkat细胞的总rna作为分离多聚(a)rna的含核酸样品。作为捕获探针,采用了共价偶联于聚苯乙烯胶乳颗粒(oligotex悬浮液;凯杰公司)表面(非磁性)的dc
10
t
30
捕获寡核苷酸或共价偶联于磁性颗粒 (seradyn磁珠)表面的dt
14
捕获寡核苷酸。
236.基本方案
237.所进行的多聚(a)核酸分离方案是基于手册方案(凯杰)。“基本方案”的主要步骤大致如下:
[0238]-将含有核酸的样品(总rna)加入无rna酶的反应管中,并用不含rna酶的水调节体积至250μl。
[0239]-加入250μl杂交溶液。
[0240]-加入固定于固体支持物的捕获寡核苷酸(若无另行说明,是15μl的 oligotex悬浮液(凯杰)或25μl功能化seradyn磁珠)。
[0241]-将内容物混合并在70℃下孵育3分钟以使rna变性。
[0242]-在20℃-30℃下孵育10分钟,以使多聚(a)rna与捕获寡核苷酸杂交。
[0243]-从剩余样品中分离所形成的杂交体。所述分离过程取决于使用的固体支持物的类型。在oligotex颗粒的情况下,将样品进行离心以沉淀oligotex/多聚(a)rna复合物,并弃去上清液(剩余样品)。在磁性颗粒的情况下,借助于磁场使磁性颗粒/多聚(a)rna复合物沉淀,并弃去上清液(剩余样品)。或者,也可以使用离心柱进行分离。
[0244]-通过涡流将沉淀的复合物在400μl洗涤缓冲液(10mm tris-cl,ph 7.5; 150mm nacl;1mm edta)中重悬。在oligotex颗粒的情况下,将重悬的样品加入到离心柱中并离心。在磁性颗粒的情况下,借助于磁场使磁性颗粒沉淀并弃去上清液。或者,也可以使用离心柱进行分离。
[0245]-向离心柱中加入400μl洗涤缓冲液(见上)并离心(oligotex颗粒)或加入400μl洗涤缓冲液(见上)到沉淀的复合物中并通过涡流重悬,然后进行磁性分离(磁性颗粒)(或者,分离也可以使用离心柱进行)。
[0246]-通过加入50μl洗脱缓冲液(5mm tris-cl,ph 7.5)(70℃)从洗涤的杂交体中释放多聚(a)rna,并通过上下吹吸3-4次进行重悬。
[0247]-通过离心(oligotex颗粒)或磁性分离(磁性颗粒)将含有洗脱液的多聚(a)从固体支持物上分离,并回收洗脱液(oligotex颗粒的情况为穿流,磁性颗粒的情况下为上清液;当然,也可采用磁性颗粒离心柱)。
[0248]
磁性方案
[0249]
或者,还可接着进行进一步的磁性颗粒多聚(a)核酸分离方案(磁性方案)。简而言之,将总rna(未稀释的)与370μl的杂交溶液和50μl的磁性颗粒(见上) 进行接触。在室温下杂交5分钟。在磁性颗粒与所结合的多聚(a)核酸进行磁性分离后,对所述颗粒洗涤数次并用低盐缓冲液对多聚(a)核酸进行洗脱。
[0250]
实时rt-pcr分析
[0251]
采用基于实时定量rt-pcr分析的sybr绿色报告染色剂进行rna的测定。测定了以下目标rna:18s rrna(非多聚(a)污染物),28s rrna(非多聚(a)污染物)以及其它rrnas(非多聚(a)污染物)和rpl(60s核糖体蛋白l12基因) mrna,ppia(肽基脯氨酰异构酶a基因)mrna、cdh2(钙黏蛋白-2基因)mrna和/ 或gapdh(甘油醛3-磷酸脱氢酶基因)mrna。
[0252]
经测试的杂交条件
[0253]
1.对比例实施例1
[0254]
实施例1表明,用于杂交的盐的性质是很重要的。采用含有licl、mgcl2和 kcl的杂交溶液所进行的杂交研究表明,若按不同浓度使用这些盐,对非多聚 (a)的回收仅有很小或没有影响(通过对洗脱液中rrna含量分析进行的测定)。
[0255]
对不同的设置进行了测试:
[0256]
a)在杂交溶液中降低licl浓度的影响
[0257]
通过分析在多聚(a)富集后获得的洗脱液中的18s rrna和rpl转录水平,对在杂交溶液中降低licl浓度(700mm、500mm、300mm)对去除rrna和富集多聚 (a)mrna的效果进行了测定。初始总rna样品中18s rrna和rpl转录水平作为参考对照进行了平行分析。
[0258]
取5μg来自于jurkat细胞的总rna作为起始材料,根据磁性方案进行多聚 (a)rna的分离过程。所测试的杂交溶液含有tris-缓冲液(ph7.5)、阴离子洗涤剂(lids)和不同浓度的licl(300mm、500mm或700mm)。
[0259]
采用了两种洗涤缓冲液,即洗涤缓冲液1(150mm licl、lids)和2(150mmlicl)。
[0260]
简而言之,对多聚(a)rna进行了手动分离如下:
[0261]-将7.4μl的总rna(680ng/μl)吸入无rna酶的试管中。加入370μl 的杂交溶液。
[0262]-添加具有固定寡聚d(t)捕获寡核苷酸的50μl磁珠,并通过轻轻晃动试管以将内容物进行混合。
[0263]-在室温下孵育5分钟,从而使多聚(a)rna与捕获寡核苷酸杂交。
[0264]-施加磁场1分钟以从剩余样品中分离磁珠:多聚(a)rna复合物。
[0265]-洗涤
×
2:对于每个洗涤步骤,向磁珠:多聚(a)rna沉淀中加入300μl 洗涤缓冲液1,通过涡流重悬;施加磁场1分钟;弃去上清液。
[0266]-洗涤
×
3:对于每个洗涤步骤,向磁珠:mrna沉淀中加入300μl洗涤缓冲液2,通过涡旋重悬;施加磁场并孵育1分钟;弃去上清液。
[0267]-加入50μl洗脱溶液(低盐溶液,中性ph);在65℃孵育2分钟;施加磁场并孵育1分钟。
[0268]-回收含有经洗脱的多聚(a)rna的上清液,并转移到另一个不含rna酶的试管中。
[0269]
将获得的洗脱液以1:280稀释(2μl洗脱液+558μlh2o)用于检测18s rrna 和rpl mrna靶标的实时rt-pcr测定。初始总rna(680ng/μl)以1:1838,27稀释从而达到0.37ng/μl的浓度。在实时rt-pcr分析中,采用5μl经稀释的多多聚(a)rna洗脱液或稀释的总rna。每种条件下对所有途径进行分析,一式两份。
[0270]
结果
[0271]
从每种途径的平行两次重复中计算获得平均ct值。所述ct值,是循环阈值 (cycle threshold)的简写,对应于sybr绿色报告染料荧光首先在背景值(阈值)以上指数级上升的pcr循环数。ct值越低,cdna模板越多,因此洗脱液中存在的初始转录物越多。转录物ct值的增加表明在多聚(a)rna富集期间有一些转录物丢失。结果如表1所示。
[0272]
表1:显示了通过实时rt-pcr分析测定的18s rrna和rpl mrna的平均ct值,其采用杂交溶液低浓度licl获得。
[0273][0274]
所有测试的杂交溶液均去除了18s rrna的转录物水平,这从与初始总rna 样品获得的ct值相比显著增加的平均ct值上可以看出。洗脱液中的18s rrna和 rpl mrna水平在
所测试的不同杂交溶液中是相当的。因此,通过降低杂交溶液中的licl盐浓度增加了杂交严格性,因此杂交组合物对去除rrna或mrna富集没有影响。
[0275]
b)降低杂交溶液中kcl或mgcl2浓度的影响
[0276]
此外,测试了降低杂交溶液中kcl或mgcl2的浓度时,对去除rrna(基于18s rrna)和多聚(a)mrna富集(基于ppia和cdh2转录物水平)的影响。杂交溶液除了水和不同浓度的kcl或mgcl2(对于每种盐:1m、500mm或100mm)之外,还含有20mm的tris、2%sds和2.5mm的edta;用hcl或naoh将ph值调节至7.5。对包含1m nacl代替kcl或mgcl2的相应杂交溶液进行了测试,作为参考标准。
[0277]
从jurkat细胞纯化的5μg总rna作为起始材料。对于多聚(a)rna分离,使用上述材料和方法下的基本方案,使用作为捕获寡核苷酸官能化固体支持物, oligotex悬浮液和离心柱以帮助分离。
[0278]
将所获得的洗脱液按1:200稀释用于实时rt-pcr分析。将初始总rna (1351ng/μl)稀释为3.7μg/46.3μl的不含rna酶的水;从该初始稀释液获得1:200的稀释液。在实时rt-pcr分析中采用5μl的稀释多聚(a)rna洗脱液或稀释总rna。
[0279]
结果
[0280]
测定平均ct值,结果如表2所示。
[0281]
表2:显示了通过实时rt-pcr分析测定的18s rrna和ppia以及cdh2 mrna的平均ct值,其采用杂交溶液中低浓度的kcl或mgcl2或1m nacl获得。
[0282] 18s rrnappia mrnacdh2 mrna杂交溶液平均ct值平均ct值平均ct值总rna7.0118.7825.511m nacl14.9121.5327.811m kcl15.9122.6228.85500mm kcl15.4822.4528.95100mm kcl16.8123.8430.451m mgcl217.5528.2534.57500mm mgcl215.6626.1733.70100mm mgcl214.4921.6128.08
[0283]
所有测试的杂交溶液均去除了18s rrna的转录物水平,这从与初始总rna 样品获得的ct值相比增加的平均ct值上可以看出。杂交溶液中的kcl盐浓度的降低导致了对去除rrna的潜在改进并没有明确的结果。与1m kcl的途径相比,在杂交溶液中将kcl盐从1m降至500mm造成了更低的rrna去除效率,而含有 100mm kcl的杂交溶液比含有1m kcl的杂交缓冲液去除了更多的rrna。杂交溶液中mgcl2浓度的降低与18s rrna的去除呈负相关。1m的mgcl2在杂交溶液中实现了最佳的rrna去除,但是与靶mrna的显著丢失相关。测试最低浓度的mgcl
2 (1 00mm)仅显示出与含有1m nacl的杂交溶液相似的良好rrna去除和mrna富集效率。
[0284]
2.对比实施例2
[0285]
分析了降低杂交溶液中nacl的浓度对rrna去除(基于18s和28s rrna)和多聚(a)mrna富集(基于gpdh和ppia mrna)的作用。杂交溶液除了水和不同浓度的nacl(1m、400mm、
300mm、200mm、100mm或50mm)之外,还含有20mm的 tris(ph7.5)、2%sds和2.5mm edta(ph8)。
[0286]
按上所述材料和方法下的基本方案对多聚(a)rna进行了分离,采用捕获寡核苷酸官能化的固体支持物,ol igotex悬浮液和离心柱帮助分离。从jurkat细胞纯化的5μg总rna作为起始材料。
[0287]
将所获得的洗脱液按1:1000进行稀释,用于对rrna和mrna靶标进行的实时 pcr测定。向46.06μl不含核糖核酸酶的水中加入3.94μl的rna,从而稀释初始总rna(1.27μg/μl)。5μl稀释的多聚(a)rna洗脱液或稀释的总rna用于实时rt-pcr分析。
[0288]
结果
[0289]
测定平均ct值,结果如表3所示。图1显示了测试条件的δct值(δct值的计算:在多聚(a)rna富集后测定的平均ct值减去从初始总rna样品测得的平均 ct值)。所有测试的杂交溶液在多聚(a)富集期间去除了18s rrna,这从与初始总rna样品获得的平均ct值相比显著增加的平均ct值上可以看出。
[0290]
表3:显示了通过实时rt-pcr分析测定的18s rrna、28s rrna和gapdh和ppiamrna的平均ct值,其通过杂交溶液中低浓度的nacl获得。
[0291][0292][0293]
所有测试的杂交溶液均去除了18s rrna的转录物水平,这从与初始总rna 样品获得的ct值相比显著增加的平均ct值上可以看出。可以观察到,rrna水平以一种浓度依赖的方式有着大幅的减少。杂交溶液中nacl的浓度越低,则洗脱液中rrna污染的量也相应越少,rrna去除的效率也就越高。从显著增加的ct值可以看出,最大的rrna减少是在杂交溶液nacl浓度低于200mm时达到的。然而,杂交溶液中nacl浓度的降低对mrna回收的剧烈影响则较少。因此,相对而言,由于杂交条件更严格,rrna去除的越多,而目标mrna的丢失越少。可见,降低杂交溶液中nacl的浓度对18s和28s rrna的回收具有惊人的作用,而对mrna的回收则只有一些作用。这种趋势也由图1所示的结果所证明。然而,即使非多聚(a)rna的回收受到了巨大的影响,将nacl的浓度降低到200mm仍然导致了这些杂交条件中mrna的丢失,这从mrna靶标ct值的增加上可以看出。
[0294]
此外,在另外的实验中,改变了sds的量(0%、0.2%和2%)。这种改变对杂交(如rrna的去除和mrna的回收仍维持大约相同(数据未示出))没有作用。
[0295]
3.实施例3
[0296]
在实施例3中,对杂交溶液中采用低离子强度nacl盐浓度(150mm)联合不同季铵盐对rrna去除和多聚(a)mrna富集的作用进行了分析。该测试杂交溶液具有以下组成:20mm tris、150mm nacl、0.2%sds、edta、水和1m的测试季铵盐。作为季铵盐,对四烷基铵盐的四
甲基氯化铵(tmac)、四甲基硝酸铵(tma 硝酸盐)、四甲基溴化铵(tma溴化物)或四乙基溴化铵(tea溴化物)进行了测试。采用上述材料和方法下的基本方案进行多聚(a)分离程序,采用捕获寡核苷酸功能化的固体支持物seradyn磁珠。
[0297]
来源于jurkart细胞的总rna(0.5μg和2μg)作为起始材料。基于18s rrna 和28s rrna水平对rrna去除进行测试,并基于ppia和gapdh转录物对多聚(a)rna 的富集进行测试。
[0298]
将获得的洗脱液以1:200进行稀释用于实时rt-pcr对rrna和mrna靶标进行的测试。向43.63μl不含rna酶的水中加入6.37μl,从而稀释初始总rna (785.5ng/μl)。从该初始稀释液获得1:200稀释液。在实时rt-pcr分析中采用5μl的稀释多聚(a)rna洗脱液或稀释的总rna。使用0.5μg或2μg总rna作为起始材料,每个条件下18s rrna和28s rrna以及gapdh mrna和ppia mrna的平均ct值经两个平行实验进行计算。
[0299]
结果
[0300]
图2a)至d)显示了用测试条件获得的δct值(如上所述计算)。可以看出,当使用0.5μg或2.0μg总rna作为多聚(a)rna分离的起始材料时,对rrna 去除和mrna回收的作用是相当的。与1m nacl参考杂交溶液相比,含有150mmnacl和季铵盐的所有测试杂交溶液得到的18s rrna(图2a)和28s rrna(图2b) 去除率明显更高。此外,从图2c)和d)可以看出,与含150mm nacl的杂交溶液相比,使用150mm nacl与四烷基铵盐组合的杂交溶液显示,多聚(a)rna不需要的丢失明显更少,这基于目标mrna ppia和gapdh所确定。因此,与不含四烷基铵盐的杂交溶液相比,mrna丢失可显着降低。
[0301]
因此,将杂交溶液(及其杂交组合物)中低浓度的nacl与添加季铵盐的组合形成了有利的杂交条件,其中不需要的rrna被有效地去除,而所需的多聚 (a)rna有效地杂交到捕获寡核苷酸并借此富集。因此,本发明所教导的杂交条件(其中较低浓度的钠盐如氯化钠与季铵盐组合使用)为非多聚(a)的去除和多聚(a)rna的回收之间提供了的有利平衡。
[0302]
4.实施例4
[0303]
在此,使用了杂交溶液中不同浓度的tma溴化物,并对rrna去除和多聚 (a)mrna富集的影响进行了分析。所测试的杂交溶液具有以下组成:20mm tris、 150mm nacl、0.2%sds和edta、水和0.5m、1m、1.5m或2m tmab。作为参考,对包含1m或150mm nacl但不含季铵盐的相应杂交溶液进行了平行测试。
[0304]
采用上述材料和方法下的基本方案进行多聚(a)rna的分离程序,使用作为捕获寡核苷酸官能化的固体支持物seradyn磁珠。从jurkart细胞分离的2μg总 rna作为起始材料。基于18s rrna和28s rrna水平对rrna的去除进行测试,并基于ppia和gapdh mrna对多聚(a)rna的富集进行测试。
[0305]
对于针对rrna和mrna靶标的实时rt-pcr测定,所获得的洗脱液以1:200稀释。通过向47.95μl不含rna酶的水中加入2.06μl来稀释初始总rna(0.97μ g/μl)。从该初始稀释液获得1:200稀释液。在实时rt-pcr分析中采用5μl的稀释多聚(a)rna洗脱液或稀释的总rna。
[0306]
结果
[0307]
图3a)至3d)显示的结果:
[0308]
图3a)显示了获得的18s和28s rrna的δct值。可以看出,与1m nacl参考杂交溶液相比,rrna的去除结果得到改善。图3b)显示了获得的gapdh和ppia 目标mrna的δct值。可
以看出,与在所有测试条件下的150mm和1m nacl参考杂交溶液相比,本发明的杂交溶液获得的结果得到了改善。
[0309]
图3c)显示了gapdh的δδct值,图3d)ppia的δδct值。根据以下公式从δct值(根据相应的初始总rna对照归一化的条件下的平均ct值)计算δδ ct值:各条件下18s rrna或28s rrna的δct值减去各条件下gapdh mrna水平或 ppia mrna水平的δct值。δδct值较高是有利的,因为其显示了高的rrna去除率。可以看出,与含有1m nacl的杂交溶液相比,结果得到了改善。此外,与含有150mm nacl的杂交溶液相比,本发明的杂交溶液获得了相似或更好的δδct值。因此,与含有150mm盐的杂交溶液相比,δδct结果得到了维持或甚至改善,并且重要的是,利用本发明的杂交溶液显著改善了mrna的回收,如图 3a)和b)所示。
[0310]
因此,实施例4清楚地证明了本发明的杂交溶液和杂交组合物的益处,并且显示可以以不同浓度使用四烷基铵盐。这些结果也在其它实验中得到证实,其中测试了含有0.2m tmab的相应杂交溶液。因此,季铵盐以高和低浓度工作。
[0311]
5.实施例5
[0312]
采用上述材料和方法下的基本方案进行多聚(a)rna的分离程序,使用作为捕获寡核苷酸官能化的固体支持物seradyn磁珠。所示杂交溶液含有20mm tris、 150mm nacl、0.2%sds水和1m tmab。从jurkart细胞分离的5μg总rna作为起始材料。基于实时rt-pcr分析,在分离的多聚(a)rna洗脱液中测定不同rrna(5s rrna、5.8s rrna、12s rrna、16s rrna、18s rrna和28s rrna)的残留量。对7个样品进行评价。将所得洗脱液以1:1000稀释。将初始总rna稀释至5.1μ g/50μl。从该初始稀释液获得1:1000稀释液。然后制备另外的1:10稀释物。在实时rt-pcr分析中采用5μl稀释的多聚(a)rna洗脱液或稀释的总rna。
[0313]
结果表4:在多聚(a)rna分离后的洗脱液中的残留rrna
[0314]
[0315]
可见,不同种类的rrna均被有效地去除了,通常≥99%甚至是100%。这表明,采用本发明杂交条件能够达到出色的去除效果。
[0316]
6.对比实施例6
[0317]
在实施例6中,对含有500mm licl的杂交溶液中加入不同物质(dmso、甲酰胺、tmac、甜菜碱)的作用进行了测试。从jurkart细胞分离的5μg总rna作为起始材料,用于利用上述磁性方案进行的多聚(a)核酸的富集。将4.20μl总 rna、370μl杂交溶液和50μl的用捕获寡核苷酸功能化的磁性颗粒进行混合,从而制得杂交组合物。
[0318]
参考licl缓冲液:(tris ph:7.5,500mm licl,1%阴离子去污剂)
[0319]
licl-dmso:作为参考组合物的licl缓冲液+dmso(最终:5%)
[0320]
licl-甲酰胺:作为参考组合物的licl缓冲液+甲酰胺(最终:2%)
[0321]
licl-tmac:作为参考组合物的licl缓冲液+tmac(最终:100nm)
[0322]
licl-甜菜碱:作为参考组合物的licl缓冲剂+甜菜碱(最终:1m)
[0323]
结果
[0324]
表5显示了实时定量rt-pcr分析的结果。测定18s和28s rrna的δct值对非
ꢀ‑
多聚(a)的去除进行分析,测定gapdh和cdh2的δct值对mrna的富集进行分析。
[0325]
表5:18s rrna和28s rrna的以及gapdh和cdh2 mrna的δct值如下所示:
[0326][0327]
此外,向参照杂交缓冲液(见上)补充加入不同浓度的tmac(见下表6),从而分析更高浓度的tmac是否会对结果有所改善。然而,与licl的组合未见到对 mrna回收或rrna去除的作用。将该实施例在不同杂交温度(40℃、50℃和60℃) 下进行了重复,并没有任何作用。
[0328]
表6:18s rrna和28s rrna的以及gapdh和cdh2 mrna的ct值如下所示:
[0329][0330]
将先前的实验一起考虑,该结果证明了杂交溶液中将nacl浓度与季铵盐联合才能达到在富集聚合(rna)之后还能显著去除非多聚(a)rna,并保留了结合在寡核苷酸捕获探针上的mrna从而确保多聚(a)rna的有效且选择性的回收。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1